Trasduzione del Segnale da Recettori di Superfice
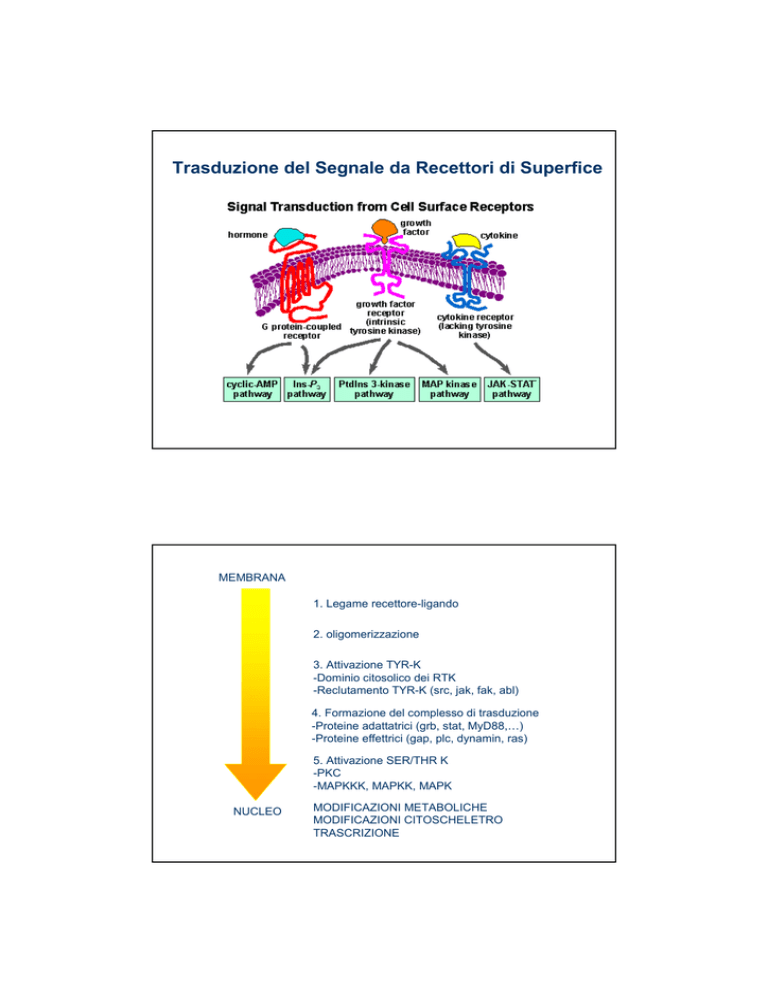
MEMBRANA
1. Legame recettore-ligando
2. oligomerizzazione
3. Attivazione TYR-K
-Dominio citosolico dei RTK
-Reclutamento TYR-K (src, jak, fak, abl)
4. Formazione del complesso di trasduzione
-Proteine adattatrici (grb, stat, MyD88,…)
-Proteine effettrici (gap, plc, dynamin, ras)
5. Attivazione SER/THR K
-PKC
-MAPKKK, MAPKK, MAPK
NUCLEO
MODIFICAZIONI METABOLICHE
MODIFICAZIONI CITOSCHELETRO
TRASCRIZIONE
recettori
1. RECETTORI
LIGANDO
Recettore
nucleare
Recettore
di membrana
LIGANDO
canali
1TM
N
7TM
N
RECETTORI 1 TM
CYTOKINE RECEPTOR FAMILY
Class I (4 cys consecutive e motivo TRP-SER-X-TRP-SER in prossimità della membrana
-GH receptor subfamily (GH, EpoR, G-CSF R) omodimeri
-IL-3 receptor subfamily (IL-3R, IL-5R, GM-CSF) complessi con subunità beta comune
-IL-6 receptor subfamily (IL-6R, IL-11R, LIFR) complessi con subunità comune gp130
-IL-2 receptor subfamily (IL-2Ralfa e beta, IL-4R, IL-7R) complessi con IL-2Rgamma
Class II (4 cys consecutive)
IFNsR,
IFNsR, IL-10R
IFN REC
IL-6 REC
recettori
recettori
Ig superfamily
Uno molti loop dati da ponti disolfuro omologhi alle Ig
(IL-6R, IL-1R, MCSFR, PDGFR)
TNF RECEPTOR FAMILY
Formano trimeri, cys ripetute
TNFR-1, CD40, Fas, Cd27, CD30
recettori
recettori
☼ Cross-talk: il segnale tramite un recettore
può agire attraverso l’attivazione di un secondo recettore
☼ Il recettore lega in modo specifico un ligando
In cellule diverse e/o in momenti diversi la risposta cellulare al ligando cambia
CAMBIA IL MECCANISMO DI TRASDUZIONE DEL SEGNALE
1 CHECK POINT DI REGOLAZIONE
Regolazione del segnale via recettore
-espressione sulla S
-distacco ad opera di enzimi (shedding)
recettori
oligomerizzazione
2. OLIGOMERIZZAZIONE
Riguarda i 1TM R
I complessi Rec-Lig non sono isolati ma si raggruppano
1.
2.
3.
4.
Ligando dimero/trimero (es.TNF)
Ligando con più siti di legame (es EGF)
Un ligando induce il recettore a legarne un’altro
Il recettore è associato a CSK e Ligando/Rec oligomerizzazione del CSK
(es TGFbeta)
5. Combinazione di1-4
Questa oligomerizzazione consente:
Avvicinare i domini citosolici dei rec per trans-fosforilazione
Crea un microambiente inaccessibile agli inibitori
Superamento della soglia
Equilibrio inibitori/attivatori
→regolazione del segnale
oligomerizzazione
OLIGOMERIZZAZIONE FUNZIONALE dei RECETTORI a 1TM
U
U
U
U
U
U
3. ATTIVAZIONE DELLA VIA CITOSOLICA
TYR-CHINASI
A. TYR-K fanno parte del dominio citosolico del Rec
B. TYR-K devono essere reclutate dal citosol (famiglia delle JAK, FAK 125)
2 domini caratterizzanti
- uno con cui legano il dominio citosolico dl Rec (modificato dopo l’interazione col
ligando)
- uno per trans-fosforilazione di substrati
Esistono 4 tipi di JAK che si associano in varie combinazioni ai rec dando risposte
diverse
Fosforilazione di TYR in proteine bersaglio che vengono reclutate a formare un
complesso
-Amplifica il segnale iniziale
→Complessità
Complessità della trasduzione
-Può essere modulato
→regolazione del segnale
Alle TYR-P si legano in modo specifico i domini SH2 (Src Homology) contenuti in
alcune proteine che si assemblano a formare un complesso
Due classi di proteine si associano ai RTKs attivati
Tirosina chinasi non recettoriale
Fosfo lipasi
PI-3 Chinasi
Protein-fosfatasi
4. FORMAZIONE DEL
COMPLESSO DI TRASDUZIONE
La formazione di un complesso proteico consente una più efficiente modulazione della
risposta cellulare.
→regolazione del segnale
→Complessità
Complessità della trasduzione
Reclutamento di proteine è dato dall’interazione tra le stesse proteine
-Proteine adattatrici
-Proteine effettrici
SH2 (Src Homology 2) circa 100 AA, motivo FLVR riconosce la fosfoTYR
SH3 60AA riconosce sequenze ricche in prolina
PH (plecstrin Homology) riconosce l’inositolo fosforilato
I domini SH2 si legano a regioni di molecole bersaglio contenenti residui di
fosfotirosina
La struttura fondamentale e’ quella di un foglietto β antiparallelo affiancato da due α
eliche. Il foglietto β comprende tre lunghi filamenti β antiparalleli βB-βD oltre a due brevi
filamenti, βA e βG legati con legami idrogeno in modo parallelo a βB. Questi elementi di
struttura secondaria sono collegati da loop relativamente brevi eccetto il loop tra βD e αB
che comprende un piccolo foglietto β antiparallelo. Core idrofobi sono formati
dall’impaccamento delle due α eliche contro ognuna delle due superfici del foglietto β.
Il peptide si lega a una superficie relativamente piatta creata dalle due eliche e dal
margine del foglietto β. I peptidi contenenti fosfotirosina usano la sequenza pTyr-GluGlu-Ile che rappresenta il motivo per il legame a Src. La porzione di fosfotirosina e’
saldamente ancorata a SH2 attraverso residui carichi positivamente: 2 Arg provenienti
da αA e βB e una lisina proveniente da βD. I due residui di Glu del peptide
contraggono deboli ma specifiche interazioni con catene laterali polari di SH2, ma il
residuo di Ile e’ legato strettamente a SH2 all’interno di una tasca idrofoba.
I domini SH3 legano regioni ricche di residui di prolina in molecole bersaglio
E’ costituito da una struttura β a 5 filamenti antiparalleli ruotata a formare una botte
comprendente due foglietti β antiparalleli impaccati l’uno sull’altro. Il filamento β2
appartiene a entrambi i foglietti. Questo ripiegamento e’ presente in tutti i tipi di SH3
mentre le regioni loop differiscono e in certi domini SH3 contengono piccole regioni
di struttura secondaria. Il sito di legame per il peptide e’ un solco idrofobo
fiancheggiato da un loop RT tra β1 e β2 e dalloop tra β3 e β4 (n-Src). Il solco e’
orlato da residui aromatici conservati. Nel dominio SH3 di Src, sono state trovate 2
classi di motivi consenso: RXLPPLPXX (classe I), XXXPPLPXR (classe II).
X=qualsiasi residuo, R=Arg, L=Leu, P=Pro.
Gli elementi leganti il dominio SH3 nelle molecole bersaglio consistono di sequenze
peptidiche ricche di residui di prolina. In seguito al legame, questi segmenti peptidici
assumono una struttura secondaria ad elica della poliprolina di tipo II sinistrorsa con tre
residui per giro. Il ligando peptidico possiede 3 creste, due delle quali entrano in
contatto col dominio SH3. La polarita’ di legame e’ determinata da interazioni
aggiuntiva a un’estremita’ del solco. Nel caso del dominio di SH3 di Src, una tasca
carica negativamente contribuisce a selezionare l’orientamento del peptide legato
ricevendo un residuo di Arg presente a una delle due estremita’ del segmento ricco di
proline.
TYR chinasi II ordine
RTK
CKR
INTEGRINE
FAK 125
JAK
7TMD
G-PROTEIN
SRC
family
TYR-K II ordine (Src K)
Vicine alla membrana, attivate si inseriscono nella m.pl con code miristilate
Inattive per opera della chinasi Csk, attivate da fosfatasi (PTP, CD45)
Formano il complesso
→Complessità
Complessità della trasduzione
Molti membri la cui combinazione dà effetti finali diversi
Favoriscono il superamento della soglia
→ regolazione del segnale
Agiscono su substrati comuni o specifici
Promuovono il ciclo cellulare agendo su Myc o attivando Ras
Hanno azioni spcifiche e comuni con JAK e RTK
Si attivano e fosforilano PLC gamma
Potenziano la funzione delle TYR-K I ordine
Attivano le SER/THRSER/THR-K
Recettori senza attivita’ enzimatica intrinseca accoppiati alla tirosin
cinasi
Questi recettori sono privi di attivita’ catalitica intrinseca, ma il legame
del ligando induce la formazione di un recettore dimerico che interagisce
ed attiva una o piu’ tirosina cinasi citosolica.
TYR chinasi II ordine
L’attività chinasica di Src è repressa nello stato inattivo
Il legame di ligandi ai domini SH2/SH3, la defosforilazione di Tyr 527 tramite PTPs o la
fosforilazione di Tyr 416 attivano src
Src inattiva
Src attiva
Le tirosine cinasi della famiglia Src contengono domini SH2 e SH3 oltre al
dominio cinasico
La catena polipeptidica della tirosin cinasi Src, come quelle dei membri appartenenti alla
stessa famiglia di cinasi, comprende una regione N-terminale che dirige i rapporti con la
membrana, seguita da un dominio SH3, da un dominio SH2, e dai 2 lobi responsabili
dell’attivita’ tirosin cinasica. Sono due i residui di Tyr che vengono fosforilati, uno nel “loop
di attivazione” del dominio cinasico (Tyr 416 in c-Src) e l’altro in una breve coda Cterminale (Tyr 527 in c-Src). La fosforilazione di Tyr 416 attiva la funzione cinasica mentre
la fosforilazione di Tyr 527 la inibisce.
Stato inattivo della cinasi: e’ un insieme compatto dei 4 domini. SH2 e SH3
giacciono, rispettivamente, accanto al domino maggiore e minore responsabili
dell’attivita’ cinasica, al lato opposto della fessura catalitica. La coda C-terminale
fosforilata si estende dalla base del dominio catalitico maggiore della cinasi nel
dominio SH2, dove il residuo di fosfotirosina si lega nel relativo sito di legame. La
regione linker, estesa tra il dominio SH2 e il dominio N-terminale della cinasi,
interagisce con il solco del dominio SH3. In questa interazione, i residui 249-253 del
linker assumono struttura ad elica della poliprolina II anche quando la sequenza attorno
a questa regione, -Pro-Gln-Thr-Gln-Gly-Leu-, e’ diversa dalla sequenza consenso di
riconoscimento da parte di SH3,-P-X-X-P-X-P. I contatti tra SH2 e SH3 sono limitati.
Nello stato inattivo, i 2 domini della cinasi sono distanziati. Nella forma attiva, i domini
sono spostati uno verso l’altro e si trovano in una conformazione chiusa. L’elica αC si
trova in una posizione e orientamento in cui il residuo di Glu, cataliticamente
importante, e’ volto in direzione opposta al sito attivo. Il segmento di attivazione ha una
conformazione che, attraverso contatti sterici, blocca il posizionamento cataliticamente
competente dell’ elica αC. Il passaggio da una conformazione all’altra si accompagna
allo spostamento e rotazione dell’ α elica αC nel dominio N-terminale.
Forma attiva: la regione linker e’ rilasciata dal dominio SH3 e il segmento di
attivazione cambia la propria struttura forzando l’elica αC a spostarsi in modo da
portare il residuo di Glu nel sito attivo, a contatto con un residuo di Lys. Nel segmento
di attivazione, un residuo di Arg lega la fosfotirosina mentre un altro residuo di Arg
lega il fosfato γ dell’ATP e un residuo di Asp si lega all’atomo di Mg nel sito attivo. Il
dominio SH3 che lega le regioni linker tra SH2 e il lobo N-terminale della cinasi puo’
modificare la conformazione di αC. La defosforilazione del residuo Tyr 527 o il
reclutamento del dominio SH2 o SH3 in seguito a forte legame con molecole bersaglio
abolisce l’interazione intermolecolare della regione linker e presumibilmente porta
l’elica αC e il segmento di attivazione a spostarsi nelle loro conformazioni attive.










