Gentile Paziente,
con il presente modulo La invitiamo a partecipare allo studio clinico descritto di seguito. Gli studi
clinici sono necessari per acquisire o approfondire conoscenze sulla sicurezza, l'idoneità e l'efficacia
di prodotti medicinali. Come prescrive la legge, lo studio clinico qui illustrato è stato valutato ed
approvato da una commissione etica. Questo studio clinico verrà
condotto in circa 60 centri europei e coinvolgerà in totale circa 2.980 partecipanti. Lo studio
sarà predisposto, coordinato e sponsorizzato dal Centro …
La Sua partecipazione a questa sperimentazione clinica è totalmente volontaria. Pertanto Lei
sarà arruolato nello studio soltanto se esprimerà il Suo consenso per iscritto. Il Suo rifiuto a
partecipare allo studio clinico o la Sua decisione di ritirarsi in un secondo tempo non
comporterà alcuno svantaggio o perdita di benefici. Il Suo arruolamento, tuttavia, non avviene
automaticamente con la sottoscrizione di questo modulo di consenso informato. Per poter
partecipare allo studio, Lei dovrà soddisfare i criteri di inclusione. Se dopo che avrà espresso il
Suo consenso verrà stabilito che Lei non risponde ai criteri di inclusione ne sarà adeguatamente
informato.
Lo studio in programma Le è già stato illustrato. Quanto segue ha lo scopo di chiarire i suoi
obiettivi e le fasi di svolgimento. Successivamente Lei riceverà ogni ulteriore ragguaglio da
uno dei ricercatori dello studio. Non abbia timore ad affrontare tutti i punti che non Le sono
chiari. In seguito Lei avrà a disposizione tempo sufficiente per decidere se partecipare o meno
allo studio.
Introduzione
Le è stata diagnosticata una coronaropatia, ovvero il restringimento di una o più arterie coronarie
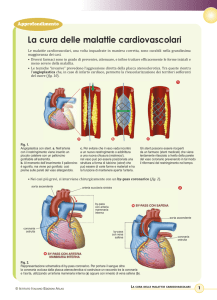
che portano il sangue al cuore. L'angioplastica a palloncino è una delle metodiche standard per
trattare il restringimento delle arterie. Nel corso di questo intervento, un palloncino estensibile
fissato su un sottile tubicino flessibile (il cosiddetto catetere a palloncino), viene spinto nel
restringimento (stenosi) dell'arteria coronaria attraverso un catetere guida precedentemente
collocato in sede. Dopo averlo posizionato correttamente in corrispondenza della stenosi, il
palloncino viene disteso e dilatato per aprire l'arteria e ripristinare il flusso circolatorio.
Talvolta, dopo l'angioplastica a palloncino, in corrispondenza della stenosi viene collocato uno
stent.
Gli stent vengono impiegati con successo nella pratica clinica da molti anni, e costituiscono una
misura efficace per trattare le coronaropatie. Alcuni stent, i cosiddetti "stent a rilascio di farmaci" o
DES, sono rivestiti con un farmaco che, rilasciato in piccole quantità, rallenta la formazione di
nuove cellule, impedendo in questo modo un nuovo restringimento dell'arteria coronaria e
aumentando l'efficacia dello stent impiantato. Il suo medico curante ha deciso di impiantarLe degli
stent a rilascio di farmaci e Le ha proposto di partecipare allo studio clinico.
Informazioni su questo studio
L'obiettivo di questo studio è valutare la sicurezza e l'efficacia del nuovo sistema di stent
coronarici RRR nella rivascolarizzazione coronarica rispetto al prodotto di controllo
XXX. Entrambi i sistemi di stent sono certificati CE, sono già commercializzati e valutati in
numerosi studi clinici, e sono rivestiti con uno strato del medicinale Everolimus.
Everolimus è un farmaco che contrasta il rigetto dopo un trapianto di reni, cuore, polmoni o
fegato.
I soggetti trapiantati assumono Everolimus sotto forma di compresse. Lo stent coronarico che
Le verrà impiantato nell'ambito di questo studio rilascerà il principio attivo Everolimus
direttamente nella parete dell'arteria coronaria. Everolimus nel tessuto arterioso circostante per un
periodo di tre mesi circa. Tuttavia è altamente improbabile che a una settimana di distanza
1
dall'impianto dello stent le concentrazioni di Everolimus nel sangue siano rilevabili o che il farmaco
possa avere effetto su organi diversi dal cuore.
Randomizzazione
Lei soddisfa i criteri di inclusione principali di questo studio se, a seguito di indagine
angiografica, il diametro dell'arteria coronaria ammalata risulta essere compreso tra 2,25 mm
e 4,25 mm e la lunghezza della lesione non supera i 24 mm.
Se parteciperà allo studio, le verrà impiantato uno stent. Per decidere quale dei due sistemi di stent
le sarà applicato nel caso lei partecipi allo studio si ricorrerà a una procedura statistica, simile al
lancio di una moneta: questa procedura viene detta randomizzazione.
Non Le sarà comunicato a quale gruppo è stato assegnato, quindi Lei non saprà quale dei due
stent Le verrà impiantato. Questa cosiddetta "cecità" è finalizzata ad impedire che il risultato
dello studio sia influenzato da pretese o aspettative del partecipante. Il suo medico ricercatore
e gli specialisti che prenderanno parte all'intervento sapranno invece di quale gruppo Lei farà
parte (studio in singolo cieco). Il tipo di stent impiantato Le verrà comunicato quando tutti i
partecipanti avranno concluso il ciclo di visite di follow-up richieste nel quadro di questo
studio randomizzato controllato.
Svolgimento dello studio
Se Lei sarà arruolato in questo studio sarà sottoposto alle medesime cure ospedaliere, ovvero
esami preliminari, impianto dello stent e visite di follow-up, che le sarebbero riservate se si
sottoponesse ad angioplastica con impianto di stent al di fuori dello studio.
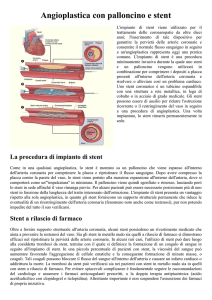
Impianto dello stent
L'impianto dello stent avverrà in anestesia locale. L'intervento potrà durare fino a 3 ore. Prima
di posizionare lo stent Lei sarà sottoposto ad angiografia. A questo scopo, dopo aver punto
un'arteria dell'inguine o del braccio le verrà inserito un tubo flessibile lungo e sottile
(catetere). L'estremità del catetere verrà spinta fino alla sede desiderata nel cuore. In seguito il
medico inietterà il mezzo di contrasto attraverso il catetere, allo scopo di rendere
radioscopicamente ben visibile il restringimento della coronaria. Quindi verranno generate
delle immagini delle coronarie ristrette, i cosiddetti angiogrammi.
Sulla base degli angiogrammi il suo medico ricercatore deciderà se Lei soddisfa o meno i
criteri di inclusione. Per effettuare l'angioplastica a palloncino, utilizzando il catetere guida
precedentemente introdotto, verrà inserito un catetere alla cui estremità è fissato un palloncino
estensibile. Il palloncino verrà spinto fino alla stenosi nell'arteria coronaria. Dopo essere stato
correttamente posizionato, il palloncino verrà disteso e dilatato per allargare la stenosi
dell'arteria coronaria e consentire una migliore circolazione del sangue. Una buona dilatazione
con l'angioplastica a palloncino è essenziale perché Lei possa continuare a essere incluso nello
studio.
Dopo aver dilatato l'arteria o le arterie il palloncino viene sfilato. Un altro catetere a
palloncino sul quale è montato lo stent viene inserito fino a raggiungere la stenosi dell'arteria
coronaria. Appena il palloncino e lo stent sono posizionati correttamente il palloncino viene
dilatato. In questo modo il palloncino espande lo stent applicato al suo esterno contro la parete
dell'arteria coronaria. Se occorre, il palloncino può essere dilatato più volte, fino a quando lo
stent è completamente disteso e ancorato. Quando il risultato è soddisfacente il palloncino
viene sgonfiato e il catetere sfilato. Se posizionato correttamente, lo stent non potrà più essere
rimosso dall'arteria coronaria.
Durante e dopo l'impianto dello stent e fino alle Sue dimissioni dall'ospedale le Sue condizioni
cliniche saranno strettamente monitorate. Questo monitoraggio fa parte della terapia standard
prevista per l'impianto di uno stent coronarico. Lei sarà sottoposto a un ulteriore ECG. Dopo
2
l'impianto dello stent eseguiremo fino a tre prelievi di sangue (ogni volta circa due cucchiai)
per analizzare i suoi enzimi cardiaci. Se il suo medico ricercatore lo riterrà necessario o se i
suoi valori ematici risulteranno anormali, seguiranno ulteriori prelievi.
Terapia farmacologica
La terapia farmacologica prevista dallo studio è identica a quella di qualsiasi impianto
di stent: per prevenire la formazione di trombi, l'occlusione dello stent e quindi il rischio di
un infarto cardiaco, d'ora in avanti Lei dovrà assumere i seguenti farmaci: acido acetilsalicilico
(aspirina) e Clopidogrel (Plavix®1) o Prasugrel. Questi antiaggreganti piastrinici vengono
anche comunemente chiamati fluidificanti del sangue. In caso di accertata sensibilità al
Clopidogrel Lei assumerà Ticlopidin (Ticlid®2) o Prasugrel. La terapia farmacologica avrà
inizio, secondo consiglio del medico, poco prima o subito dopo l'impianto dello stent.
L'assunzione di Clopidogrel o Ticlopidin o Prasugrel avverrà secondo le linee guida della
Società europea di Cardiologia e il piano terapeutico nazionale. Secondo tali linee guida, è
necessario assumere 75 mg di Clopidogrel o 10 mg di Prasugrel una volta al giorno o 250 mg
di Ticlopidin (Ticlid) due volte al giorno per un periodo di almeno 6-12 mesi. L'aspirina dovrà
essere assunta per tutta la vita ad un dosaggio compreso tra 75 e 325 mg al giorno.
Follow-up
Se parteciperà a questo studio, 30 giorni dopo l'impianto dello stent dovrà chiamare il suo
medico ricercatore o uno dei suoi collaboratori per una conversazione telefonica di
follow-up. 12 mesi dopo l'impianto dovrà presentarsi presso la struttura ospedaliera per
una visita di follow-up. 2 anni dopo l'impianto dello stent avrà luogo un'altra
conversazione telefonica o un'altra visita di follow-up presso la struttura. Durante la
telefonata e la visita saranno valutate le Sue condizioni cliniche e di salute. Il suo medico
ricercatore documenterà la Sua terapia farmacologica a base di antiaggreganti piastrinici ed i
problemi clinici eventualmente insorti. Durante la visita sarà sottoposto a ECG per
determinare la frequenza e il ritmo cardiaco. Informi il suo medico ricercatore o uno dei suoi
collaboratori in merito ad eventuali dolori al torace, a qualsiasi modifica nella terapia a base
di antiaggreganti piastrinici ed eventualmente ad eventi clinici verificatisi durante il periodo
di follow-up che abbiano richiesto il suo ricovero in ospedale. La conversazione telefonica
richiederà circa 5-10 minuti di tempo. Tutte le informazioni delle visite condotte prima e dopo
l'impianto dello stent, al momento delle sue dimissioni dall'ospedale e a due anni dall'impianto,
verranno trascritte su moduli speciali. Durante le visite di follow-up appena descritte prenderà
contatto con specialisti ai quali potrebbe essere noto il tipo di stent che Le è stato impiantato
nell'ambito di questo studio randomizzato e controllato. Questi specialisti non le diranno comunque
quale tipo di stent Le è stato applicato.
Quali vantaggi potrà avere partecipando allo studio?
L'angioplastica a palloncino e l'impianto di stent sono metodiche sicure ed efficaci per il
trattamento delle coronaropatie. Dopo l'impianto dello stent le Sue condizioni di salute
dovrebbero migliorare. Precedenti studi clinici hanno dimostrato che il posizionamento di uno
stent riduce il rischio di stenosi recidiva dell'arteria coronaria.
Se deciderà di prendere parte allo studio potrà avere dei benefici dal punto di vista clinico,
sebbene non sia possibile fornire alcuna garanzia assoluta. Tra i possibili vantaggi rientrano
un trattamento efficace della stenosi coronarica e un miglioramento dei sintomi legati alla
malattia.
Partecipando allo studio Lei potrà forse beneficiare di un monitoraggio di follow-up più
intensivo e di una più precisa individuazione degli eventi indesiderati rispetto ad un intervento
di impianto condotto al di fuori dello studio.
I risultati ottenuti dallo studio potranno contribuire a migliorare la terapia delle coronaropatie,
3
portando benefici anche a lei.
Quali rischi potrà correre partecipando allo studio?
Il suo medico di reparto o il suo medico ricercatore Le hanno già illustrato i rischi legati
all'angioplastica a palloncino, all'impianto di stent rivestiti con Everolimus e all'assunzione di
antiaggreganti piastrinici.
Partecipando allo studio non correrà altri rischi oltre a quelli correlati ad un intervento di
angioplastica a palloncino e impianto di stent rivestito con Everolimus condotto fuori dallo
studio.
Gli effetti del farmaco Everolimus rilasciato dallo stent su feti od embrioni al momento non
sono noti. Pertanto, anche considerando che durante l'angiografia viene fatto uso di raggi X, la
partecipazione allo studio durante la gravidanza e l'allattamento è esclusa. Lei sarà esclusa
dallo studio anche se intende pianificare una gravidanza nei 12 mesi successivi all'impianto
dello stent. Se Lei è in età fertile, prima del Suo arruolamento dovrà sottoporsi a un test di
gravidanza che dovrà risultare negativo. Per tutta la durata dello studio dovrà adottare metodi
contraccettivi sicuri ed efficaci. La invitiamo a discutere il metodo anticoncezionale a Lei più
adatto con il suo medico curante o con il ginecologo. Se nel corso dello studio dovesse
instaurarsi una gravidanza, ne dovrà immediatamente informare il medico ricercatore.
Quali altri impegni comporta la partecipazione allo studio?
Oltre alle due telefonate menzionate in precedenza ed alla visita ambulatoriale presso il centro
per valutare il decorso non esistono per i pazienti che partecipano allo studio altri impegni
particolari che esulino dalla routine clinica.
Possibilità terapeutiche fuori dallo studio
La Sua coronaropatia può essere curata con metodiche sperimentate e di comprovata efficacia
anche fuori da questo studio. Tra queste rientrano l'angioplastica a palloncino senza impianto
di stent, l'impianto di uno stent di altro tipo o marca oppure l'intervento di bypass coronarico a
cielo aperto, nel corso del quale la Sua coronaria ostruita o del tutto chiusa viene aggirata
(bypassata) con un segmento di vaso sanguigno detto bypass. Il suo medico ricercatore potrà
illustrarle queste metodiche con i loro vantaggi e rischi.
Ritiro dallo studio
In qualsiasi momento, adducendo fondate ragioni, Lei potrà ritirarsi dallo studio senza per
questo subire alcuno svantaggio in termini di trattamento medico. Se deciderà di ritirarsi dallo
studio a seguito di eventi indesiderati è importante che informi il suo medico ricercatore.
In determinate circostanze è anche possibile che il medico ricercatore o lo sponsor decidano di
interrompere anticipatamente la sua partecipazione allo studio, senza che lei abbia alcuna
influenza su questa decisione. Lei può essere estromesso anticipatamente dallo studio ad esempio
perché:
La sua partecipazione allo studio non è più sostenibile da un punto di vista medico.
Lo studio clinico viene interrotto.
Assicurazione
Lo Sponsor dello studio Centro ha stipulato una polizza assicurativa a copertura di eventuali danni
che dovessero derivare dalla partecipazione a questo studio.
Informazioni supplementari
4
Le verrà fornita ogni nuova informazione che possa influire sulla sua disponibilità a partecipare allo
studio.
Altre informazioni
Per qualsiasi domanda relativa allo studio, ai suoi vantaggi o rischi e alle opportunità di
trattamento al di fuori di esso si rivolga al medico ricercatore. Se durante lo studio dovesse
subire lesioni, danni o ricoveri in ospedale ne informi immediatamente il medico ricercatore,
a prescindere dalle cause legate a questi eventi.
Recapiti:
Medici ricercatori: Responsabile dello studio
Nome 1 Telefono:
Modulo di consenso informato
Titolo dello studio
Ho letto (o mi sono fatto leggere) le informazioni contenute nel Foglio informativo per il paziente e
ne ho compreso il significato Mi è anche stata data una copia del documento da tenere.
Ho posto ai Medici dello studio tutte domande e dubbi relativi allo studio. I Medici dello studio hanno
risposto in modo soddisfacente a tutti i miei quesiti. concordo Acconsento quindi a partecipare a
questo studio.
PARTECIPAZIONE ALLO STUDIO
- Dichiaro di aver letto e compreso il Foglio informativo per il paziente. Ho avuto la
possibilità di studiare le informazioni fornitemi, di chiedere domande e di ricevere
risposte soddisfacenti
- Concedo/non concedo il permesso al mio medico di famiglia di essere informato in
merito alla mia partecipazione a questo studio {apporre un cerchio attorno a
“Concedo” o a “Non concedo”}.
- Concordo di partecipare allo studio summenzionato, di attenermi scrupolosamente alle
sue procedure e di rispettarne tutti i requisiti di follow-up.
Do il mio libero consenso a partecipare allo studio
SI NO
TRATTAMENTO DEI MIEI DATI PERSONALI E SENSIBILI
Sottoscrivendo questo modulo acconsento al trattamento dei miei dati personali ed alla
consultazione della mia cartella clinica (cartella medica, cartella infermieristica, referti
specialistici e diagnostici, relazioni sanitarie, altri documenti sanitari in essa contenuti)
da parte dei soggetti di cui al punto c., che saranno comunque tenuti al segreto
professionale sui dati conosciuti, ai fini della presente sperimentazione.
Acconsento inoltre espressamente al trasferimento dei miei dati personali per gli scopi
della ricerca nei limiti e con le modalità indicate nell’informativa.
Acconsento al trattamento dei miei dati come sopra previsto
SI NO
Firmo volontariamente questo modulo di consenso per partecipare allo studio clinico indicato
sopra.
_______________________ _____________________ __________
Nome completo del partecipante Firma del partecipante Data
5