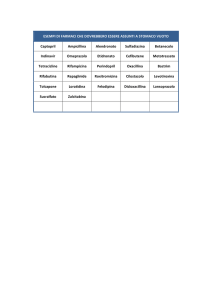
ALLEGATO I
ELENCO DEI NOMI DEI MEDICINALI, DELLA FORMA FARMACEUTICA, DEI
DOSAGGI, DELLA VIA DI SOMMINISTRAZIONE, DEI TITOLARI
DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO NEGLI STATI
MEMBRI
1
Stato membro
UE/SEE
Francia
Titolare dell’autorizzazione
Nome di fantasia
Dosaggio
all’immissione in commercio
Forma
Via di somministrazione
farmaceutica
Otsuka Pharmaceutical Europe Ltd.
PLETAL 100 mg,
Hunton House Highbridge Estate
comprimé
100 mg
compressa
uso orale
PLETAL 50 mg, comprimé 50 mg
compressa
uso orale
Pletal 50 mg Tabletten
50 mg
compressa
uso orale
Pletal 100 mg Tabletten
100 mg
compressa
uso orale
PLETAL
50 mg
compressa
uso orale
Oxford Road Uxbridge
GB-UB8 1LX MIDDLESEX
United Kingdom
Francia
Otsuka Pharmaceutical Europe Ltd.
Hunton House Highbridge Estate
Oxford Road Uxbridge
GB-UB8 1LX MIDDLESEX
United Kingdom
Germania
Otsuka Pharmaceutical Europe Ltd.
Hunton House Highbridge Estate
Oxford Road Uxbridge
GB-UB8 1LX MIDDLESEX
United Kingdom
Germania
Otsuka Pharmaceutical Europe Ltd.
Hunton House Highbridge Estate
Oxford Road Uxbridge
GB-UB8 1LX MIDDLESEX
United Kingdom
Italia
Otsuka Pharmaceutical Europe Ltd.
Hunton House Highbridge Estate
Oxford Road Uxbridge
GB-UB8 1LX MIDDLESEX
United Kingdom
2
Stato membro
UE/SEE
Italia
Titolare dell’autorizzazione
Nome di fantasia
Dosaggio
all’immissione in commercio
Otsuka Pharmaceutical Europe Ltd.
Forma
Via di somministrazione
farmaceutica
PLETAL
100 mg
compressa
uso orale
Otsuka Pharmaceutical Europe Ltd.
PLETAL 50 mg
50 mg
compressa
uso orale
Hunton House Highbridge Estate
comprimidos
100 mg
compressa
uso orale
50 mg
compressa
uso orale
100 mg
compressa
uso orale
Hunton House Highbridge Estate
Oxford Road Uxbridge
GB-UB8 1LX MIDDLESEX
United Kingdom
Spagna
Oxford Road Uxbridge
GB-UB8 1LX MIDDLESEX
United Kingdom
Spagna
Otsuka Pharmaceutical Europe Ltd.
PLETAL 100 mg
Hunton House Highbridge Estate
comprimidos
Oxford Road Uxbridge
GB-UB8 1LX MIDDLESEX
United Kingdom
Spagna
LACER S.A.
EKISTOL 50 mg
Sardenya, 350
comprimidos
08025 Barcelona
Spain
Spagna
LACER S.A.
EKISTOL 100 mg
Sardenya, 350
comprimidos
08025 Barcelona
Spain
3
Stato membro
UE/SEE
Svezia
Titolare dell’autorizzazione
Nome di fantasia
Dosaggio
all’immissione in commercio
Otsuka Pharmaceutical Europe Ltd.
Forma
Via di somministrazione
farmaceutica
PLETAL 50 mg tabletten
50 mg
compressa
uso orale
PLETAL 100 mg tabletten
100 mg
compressa
uso orale
Pletal 50mg Tablets
50 mg
compressa
uso orale
Pletal 100mg Tablets
100 mg
compressa
uso orale
Hunton House Highbridge Estate
Oxford Road Uxbridge
GB-UB8 1LX MIDDLESEX
United Kingdom
Svezia
Otsuka Pharmaceutical Europe Ltd.
Hunton House Highbridge Estate
Oxford Road Uxbridge
GB-UB8 1LX MIDDLESEX
United Kingdom
Regno Unito
Otsuka Pharmaceutical Europe Ltd.
Hunton House Highbridge Estate
Oxford Road Uxbridge
GB-UB8 1LX MIDDLESEX
United Kingdom
Regno Unito
Otsuka Pharmaceutical Europe Ltd.
Hunton House Highbridge Estate
Oxford Road Uxbridge
GB-UB8 1LX MIDDLESEX
United Kingdom
4
Allegato II
Conclusioni scientifiche e motivi della variazione dei termini
dell’autorizzazione all’immissione in commercio
5
Conclusioni scientifiche
Sintesi generale
(vedere Allegato I)
della valutazione
scientifica di
medicinali
contenenti
cilostazolo
Il cilostazolo è un derivato diidro-chinolinolico che appartiene alla categoria farmacoterapeutica
degli agenti antitrombotici, inibitori dell’aggregazione piastrinica eparina esclusa. Il cilostazolo è un
derivato diidro-chinolinolico che inibisce l’adenosina monofosfato ciclico (cAMP) fosfodiesterasi,
sopprimendo la degradazione del cAMP ed aumentando pertanto i livelli di cAMP nelle piastrine e
nei vasi sanguigni. Questo porta all’inibizione dell’attivazione ed aggregazione piastrinica e
previene il rilascio di sostanze infiammatorie e vasoattive protrombotiche. Gli effetti vasodilatatori
del cilostazolo possono anche essere mediati da un aumento del cAMP. Il cilostazolo inibisce anche
la proliferazione delle cellule muscolari lisce dei vasi, abbassa il livello dei trigliceridi ed aumenta i
livelli di colesterolo HDL.
L’indicazione terapeutica che è stata approvata per i prodotti a base di cilostazolo in Europa è
l’aumento della distanza massima percorsa senza dolore da pazienti affetti da claudicatio
intermittens (IC), che non hanno dolore a riposo né prove di necrosi tissutale periferica (malattia
arteriosa periferica (PAD) in stadio II di Fontaine).
Questo deferimento ai sensi dell’articolo 31 è stato avviato dalla Spagna dopo la revisione dei
rapporti sulla sicurezza ricevuti per il cilostazolo durante i primi 18 mesi di commercializzazione (il
cilostazolo è stato autorizzato in Spagna nel 2008). Le principali preoccupazioni dell’autorità
spagnola riguardavano le segnalazioni ricevute in merito a reazioni cardiovascolari (compresi casi
fatali di IM, angina pectoris ed aritmie), a reazioni emorragiche e ad interazioni tra farmaci. Uno
studio sull’uso del medicinale condotto in una regione della Spagna ha riscontrato che i pazienti che
assumevano cilostazolo erano più anziani ed usavano più medicinali concomitanti rispetto a quelli
delle sperimentazioni cliniche. La Spagna ha pertanto deferito il cilostazolo al CHMP/EMA,
richiedendo che esprimesse un parere ai sensi dell’articolo 31 della direttiva 2001/83/EC in merito
all’opportunità di mantenere, modificare, sospendere o ritirare le autorizzazioni all’immissione in
commercio per i medicinali contenenti cilostazolo.
Efficacia clinica
L’efficacia del cilostazolo è stata valutata in 14 sperimentazioni cliniche su più di 4 000 pazienti
affetti da claudicatio intermittens (IC). Queste comprendevano otto sperimentazioni di fase III in
doppio cieco controllate, due delle quali hanno posto a confronto l’efficacia del cilostazolo con un
comparatore attivo (pentossifillina) e con placebo per 24 settimane. Inoltre, è stato condotto uno
studio di efficacia (studio PACE) di fase IV in doppio cieco controllato verso placebo, in cui la
pentossifillina è stata utilizzata come comparatore attivo. In totale sono stati randomizzati 3 122
pazienti che hanno assunto almeno una dose del prodotto sperimentale nelle nove sperimentazioni
sull’efficacia. L’endpoint primario nelle nove sperimentazioni sull’efficacia (denominate
sperimentazioni a medio termine) era la distanza massima percorsa (distanza di claudicatio
assoluta, ACD), misurata mediante test su tapis roulant. Gli endpoint secondari di efficacia
includevano la distanza percorsa senza dolore (distanza di claudicatio iniziale, ICD) misurata
mediante esercizio su tapis roulant e valutazioni sulla qualità della vita.
L’analisi primaria, pre-ordinata nei protocolli, ha evidenziato per il gruppo dei pazienti che
assumevano cilostazolo 100 mg bid una distanza percorsa maggiore in misura statisticamente
significativa rispetto al placebo. I punti valutati in tutte e nove le sperimentazioni hanno mostrato
un vantaggio del cilostazolo 100 mg bid rispetto al placebo. Inoltre, l’analisi ha mostrato la
superiorità statistica del cilostazolo rispetto al placebo in sei delle nove sperimentazioni.
Una meta-analisi raggruppata di queste sperimentazioni, sulla base del rapporto delle medie
geometriche per LOG (ACD all’ultima visita/ACD al basale) per il cilostazolo rispetto al placebo, ha
dimostrato un effetto del trattamento di 1,15 (95% CI: 1,11 – 1,19) per l’ACD.
In tutte le sperimentazioni sull’efficacia il cilostazolo ha mostrato un miglioramento in percentuale
dell’ACD maggiore rispetto al placebo e statisticamente significativo in 6 delle 9 sperimentazioni.
L’intervallo di miglioramento era compreso tra +28% e +100% per il cilostazolo e tra -10% e
+42% per il placebo nelle singole sperimentazioni. L’aumento della distanza percorsa rispetto alla
distanza percorsa al basale con il trattamento a base di cilostazolo era maggiore del 35% rispetto
al placebo. I risultati per gli endpoint di efficacia secondaria erano coerenti con i risultati sull’ACD.
L’effetto del cilostazolo sulle distanze assolute percorse sul tapis roulant, espresse come aumento
assoluto rispetto alla distanza percorsa al basale, oscillava tra +23 m e +109 m, rispetto a -2 m e
+65 m del placebo. La meta-analisi della differenza media ponderata (WMD) nelle nove
sperimentazioni ha anche mostrato un’efficacia costante del cilostazolo nell’insieme delle
sperimentazioni. La WMD stima un miglioramento medio della distanza percorsa dal basale di 87,4
6
m per il cilostazolo 100 mg bid e di 43,7 m per il placebo (p<0,0001) con una distanza percorsa
media al basale di 133 m (66% di miglioramento con cilostazolo). Il CHMP ha rilevato che
l’aumento della distanza percorsa su terreno piano è probabilmente maggiore dell’aumento
misurato su tapis roulant, che è impostato su un piano inclinato.
I dati relativi alle valutazioni sulla qualità di vita e le analisi dei pazienti “responder” sono stati
considerati nella valutazione, poiché forniscono approfondimenti sulla questione della rilevanza
clinica dell’effetto del trattamento, complicata dal fatto che i pazienti facilmente hanno differenti
livelli di beneficio a seconda della gravità dei sintomi di claudicatio intermittens (IC). I risultati delle
meta-analisi raggruppate degli esiti riportati dai pazienti nel questionario sullo stato di salute in
forma breve (SF-36) e nel questionario sulla compromissione dell’andatura (WIQ) hanno
evidenziato effetti significativi del cilostazolo rispetto al placebo sul funzionamento fisico e sul
punteggio della componente fisica di SF-36, oltre a miglioramenti significativi nei punteggi di
velocità e distanza nel WIQ. Una maggiore percentuale di pazienti che hanno completato lo studio
con cilostazolo è stata classificata come “responder” rispetto ai pazienti trattati con placebo (39,6%
a fronte di 26,3%), essendo i pazienti “responder” definiti come quei pazienti la cui distanza
percorsa era migliorata del 50% o più rispetto al basale.
Il CHMP ha pertanto espresso il parere che il cilostazolo ha un effetto statisticamente significativo,
quantunque moderato, sulle distanze percorse da pazienti con IC, e che alcuni pazienti possono
trarne beneficio in misura clinicamente rilevante.
Sicurezza clinica
In questa revisione sono stati considerati i dati sulla sicurezza del cilostazolo resi disponibili dalle
sperimentazioni sull’efficacia (sperimentazioni a medio termine), dalla sperimentazione sulla
sicurezza a lungo termine CASTLE e dagli studi sulla prevenzione dell’ictus, oltre alle segnalazioni di
casi da fonti spontanee e da studi osservazionali.
Le sperimentazioni cliniche non hanno individuato timori importanti in termini di sicurezza. Gli
eventi avversi più comuni includevano mal di testa, diarrea, feci anomale, vertigini, palpitazioni e
tachicardia, già elencati nelle informazioni sul prodotto. Non è stato osservato alcun segnale di un
aumento della mortalità nelle sperimentazioni cliniche, incluso lo studio CASTLE.
L’obiettivo principale della sperimentazione CASTLE era valutare l’effetto a lungo termine del
cilostazolo sulla mortalità per qualsiasi causa. Lo studio CASTLE includeva pazienti che sono stati in
trattamento fino a tre anni. Lo studio è stato prematuramente terminato a causa di una
percentuale di eventi inferiore e di una percentuale di abbandoni superiore alle attese. Il rapporto
di rischio per la mortalità (cilostazolo rispetto a placebo) era di 0,94 (95% CI 0,63-1,39).
Dai risultati delle sperimentazioni cliniche non sono emersi segnali di aritmie cardiache gravi;
tuttavia un numero limitato di eventi gravi (tachicardia ventricolare, prolungamento del QT (inclusa
la torsione di punta)) è stato segnalato da fonti spontanee/studi osservazionali, ed alcuni di essi
sono stati considerati compatibili con gli effetti cronotropici del cilostazolo. Il CHMP ha ritenuto
difficile valutare la causalità in questi rapporti, in particolare visto il livello di confusione dovuto alle
condizioni di base di questi pazienti. Nondimeno, è stato notato che l’attività del cilostazolo come
inibitore dell’enzima fosfodiestereasi (PDE-3) pone problemi potenziali in termini di sicurezza per le
aritmie cardiache che possono scaturire dall’aumento della frequenza cardiaca a riposo (è stato
dimostrato che il cilostazolo aumenta la frequenza cardiaca di ~5,1 e ~7,4 battiti al minuto alle
dosi autorizzate). Palpitazioni e tachicardia sono state ben documentate nelle sperimentazioni
cliniche. In considerazione di questi elementi, il CHMP ha ritenuto che il cilostazolo debba essere
controindicato nei pazienti con anamnesi di grave tachiaritmia e che debbano essere introdotte
particolari avvertenze nel foglio illustrativo.
Sono stati individuati anche altri eventi avversi di interesse, come ischemia del miocardio (infarto
del miocardio, angina pectoris, arteriopatia coronarica), insufficienza cardiaca congestizia e
ipotensione, durante le sperimentazioni cliniche sull’efficacia a medio termine, con una maggiore
incidenza nel gruppo trattato con il cilostazolo rispetto al placebo. Tuttavia, questi squilibri hanno
riguardato un numero modesto di eventi. Ѐ stato notato un piccolo eccesso di casi di insufficienza
cardiaca (cilostazolo: 2,9% rispetto a placebo: 2,4%) e di ipotensione (cilostazolo: 0,7% rispetto a
placebo: 0,1%) nello studio CASTLE. Pertanto, il CHMP ha ritenuto che il cilostazolo debba essere
controindicato in pazienti con angina pectoris instabile, infarto del miocardio sopravvenuto negli
ultimi sei mesi o intervento coronarico effettuato negli ultimi sei mesi, e che debbano essere
incluse particolari avvertenze nel foglio illustrativo.
L’attività anti-piastrinica del cilostazolo ha anche suscitato timori in merito ad eventi emorragici.
Nella sperimentazione CASTLE è stata osservata una frequenza minore di eventi di sanguinamento
nel gruppo con cilostazolo rispetto al gruppo con placebo, e l’uso contemporaneo dell’aspirina non
ha aumentato la frequenza di sanguinamento nel sotto-gruppo trattato con cilostazolo. Tuttavia, il
7
trattamento contemporaneo con aspirina e clopidogrel ha aumentato il rischio di sanguinamento
nel gruppo con cilostazolo in confronto ai pazienti con placebo. In considerazione di questi
elementi, il CHMP ha ritenuto che i pazienti trattati contemporaneamente con due o più agenti
antipiastrinici o anticoagulanti (ad esempio, acido acetilsalicilico o aspirina, clopidogrel, eparina,
warfarin, acenocumarolo, dabigatran, rivaroxaban o apixaban) non vadano trattati con prodotti
contenenti cilostazolo.
Il cilostazolo viene metabolizzato principalmente da CYP3A4 e CYP2C19 e ha due principali
metaboliti attivi, OPC-13015 (deidrocilostazolo, 3-7 volte più potente del cilostazolo) e OPC-13213
(trans-idrossi-cilostazolo, 2–5 volte meno potente del cilostazolo). In considerazione dell’aumento
dell’esposizione al cilostazolo che consegue all’uso concomitante di inibitori di CYP3A4 e CYP2C19
(come l’eritromicina, il ketoconazolo e l’omeprazolo), il CHMP ha ritenuto che esista un alto
potenziale di interazioni con altri medicinali che potrebbe aumentare i rischi associati al cilostazolo
ed ha pertanto ritenuto che debba essere rafforzata la formulazione dell’RPC nella sezione 4.5. Il
CHMP ha anche raccomandato una riduzione della dose a 50 mg bid di cilostazolo in caso di uso
concomitante con tali medicinali. Questa dose ridotta ha mostrato di essere clinicamente efficace in
sperimentazioni cliniche su pazienti che usano inibitori di CYP3A4 o CYP2C19.
Conclusione generale
Il cilostazolo è associato ad un moderato ma statisticamente significativo aumento della distanza
percorsa rispetto al placebo in pazienti con IC, e questo è stato dimostrato anche usando
misurazioni della qualità della vita. In termini di sicurezza, i dati delle sperimentazioni cliniche
hanno mostrato che gli eventi avversi più comunemente riportati sono mal di testa, diarrea,
vertigini, palpitazioni, edema periferico e tachicardia, che erano elencati nelle informazioni sul
prodotto. Tuttavia, gli effetti farmacologici del cilostazolo suggeriscono che esso possa provocare in
alcuni pazienti un aggravamento delle aritmie cardiache. Inoltre, in considerazione della sua
attività anti-piastrinica, ci si aspetta che il cilostazolo aumenti il rischio di sanguinamento.
Nondimeno, risulta difficile quantificare la causalità e l’importanza di tale rischio, vista la mancanza
di un chiaro segnale nelle sperimentazioni cliniche e dato il livello di confusione generata
dall’utilizzo contemporaneo di medicinali di base adottati da questi pazienti. In considerazione dei
timori associati alle interazioni con altri medicinali (in particolare con gli inibitori di CYP3A4 e
CYP2C19) e la possibilità di un aumento del rischio di effetti avversi è stato raccomandato di
ridurre la dose a 50 mg bid nei pazienti che assumono contemporaneamente medicinali che
inibiscono tali enzimi.
Dati i benefici moderati del cilostazolo e i timori sulla sicurezza, il comitato è del parere che l’uso
del cilostazolo debba essere limitato a quei pazienti che possano trarre il massimo vantaggio dal
trattamento, cioè i pazienti ai quali variazioni dello stile di vita (sospensione del fumo e programmi
di esercizio fisico) ed altri interventi appropriati non hanno procurato un beneficio sufficiente.
L’idoneità del trattamento con cilostazolo deve essere accuratamente considerata, insieme ad altre
opzioni di trattamento come la rivascolarizzazione.
Su richiesta del CHMP, è stata convocata nel febbraio 2013 la riunione di un gruppo consultivo di
esperti ad hoc. Agli esperti è stato chiesto di esaminare prima di tutto l’attuale approccio standard
per la gestione clinica dell’arteriopatia occlusiva periferica (PAOD), le caratteristiche dei pazienti
trattati con cilostazolo e la rilevanza clinica dei benefici del cilostazolo. Gli esperti hanno stabilito
che il cilostazolo ha un effetto benefico su pazienti con claudicatio intermittens limitata che non
riescono a mettere in atto un programma di esercizi fisici, in quanto fornisce a tali pazienti il modo
di superare “il primo ostacolo”, il che consente loro di continuare in seguito a migliorare la distanza
percorsa attraverso gli esercizi. Ѐ stato riconosciuto dagli esperti che il beneficio dei prodotti
contenenti cilostazolo era lieve ma clinicamente significativo e sufficiente a consentire il recupero
dell’autosufficienza per alcuni pazienti e permettere loro di iniziare il programma di riabilitazione.
Tutti sono stati concordi in merito alla necessità di rivalutare la risposta dei pazienti al trattamento
dopo tre mesi e di continuare il trattamento solo se la risposta risulta positiva. Gli esperti hanno
riconosciuto che sono stati frequentemente riscontrati in alcuni pazienti eventi avversi minori, ma
nessuno degli esperti ha rilevato effetti indesiderati importanti. Il gruppo di esperti ha preso nota
delle segnalazioni spontanee di emorragia in caso di uso concomitante di uno o due farmaci
antipiastrinici, ma è stato rassicurato dall’assenza di prove negli studi pubblicati controllati verso
placebo. Tuttavia, gli esperti hanno riconosciuto che esiste un rischio di sanguinamento con la tripla
terapia e che quest’ultima deve essere evitata (cilostazolo e due farmaci antipiastrinici). Gli esperti
sono stati concordi nel ritenere che lo studio CASTLE avesse alcuni limiti (inclusa l’interruzione
precoce e l’alta percentuale di abbandoni, la restrizione ad alcuni gruppi di pazienti, l’esclusione di
pazienti ad alto rischio e la rivalutazione dei pazienti da parte dei loro medici nell’arco di sei mesi),
ma hanno giudicato alcuni di essi inevitabili per uno studio di fase IV a lungo termine di questo
tipo. Ѐ stato rilevato che gli eventi avversi segnalati erano inferiori alle attese. Gli esperti hanno
considerato che i pazienti inclusi rappresentavano in modo ragionevole la vita reale e che era
8
difficile dimostrare che lo studio non fosse rassicurante. Inoltre, sono stati concordi nell’asserire
che il cilostazolo ha mostrato una tendenza coerente a essere altrettanto sicuro del placebo in
termini di esiti cardiovascolari importanti. Sebbene come analisi post-hoc, la dimostrazione che i
MACE CV attualmente accettati negli studi dei nuovi farmaci (morte CV, IM non fatale e ictus)
erano inferiori in modo statisticamente significativo nel gruppo di trattamento è stata ritenuta una
buona garanzia quanto alla CV. Il gruppo ha considerato che in pratica era possibile escludere i
pazienti con alto rischio cardiovascolare, il che limiterebbe anche il rischio di interazioni del
farmaco con agenti antipiastrinici (poiché la maggior parte dei pazienti di questi gruppi
assumerebbe una terapia antipiastrinica doppia). La proposta dei titolari dell’autorizzazione
all’immissione in commercio di raccomandare una riduzione a 50 mg bid in alcuni sotto-gruppi di
pazienti è stata accettata dal gruppo. Nell’insieme, il gruppo era del parere che questo farmaco
possa essere utile per un piccolo gruppo di pazienti con basso rischio di co-morbilità
cardiovascolare, con claudicatio intermittens limitata, non in grado di gestire gli iniziali esercizi di
riabilitazione o non idonei alla rivascolarizzazione.
In considerazione di tutti i dati disponibili sulla sicurezza e l’efficacia del cilostazolo così come delle
conclusioni della riunione del gruppo di esperti ad hoc, il CHMP ha concordato una serie di misure,
fra cui la restrizione dell’indicazione a “uso di seconda linea, in pazienti nei quali le modifiche dello
stile di vita (inclusi la sospensione del fumo ed i programmi di esercizi [supervisionati]) ed altri
interventi appropriati non siano riusciti a migliorare sufficientemente i sintomi di claudicatio
intermittens” e l’introduzione di tre nuove controindicazioni in pazienti con anamnesi di tachiaritmia
grave, in pazienti trattati in modo concomitante con due o più ulteriori agenti antipiastrinici/anticoagulanti ed in pazienti con angina pectoris instabile, infarto del miocardio
sopravvenuto negli ultimi sei mesi o intervento coronarico effettuato negli ultimi sei mesi.
Ora si raccomanda un monitoraggio più attento dell’esito del trattamento dopo tre mesi invece che
dopo sei mesi, con l’intento di sospendere il cilostazolo laddove l’effetto del trattamento sia
considerato inadeguato. Inoltre, la terapia con cilostazolo deve essere avviata solo da medici che
abbiano esperienza in merito alla gestione della claudicatio intermittens dopo avere preso
accuratamente in considerazione l’idoneità al trattamento con cilostazolo, insieme ad altre
possibilità di trattamento come la rivascolarizzazione.
Per ridurre al minimo il rischio d’interazione con il metabolismo del farmaco, sono state introdotte
avvertenze nell’RPC, e viene ora raccomandata una riduzione della dose a 50 mg bid nei pazienti
che assumono medicinali che inibiscono CYP3A4 o CYP2C19.
Le misure di farmacovigilanza devono essere rafforzate con la presentazione, ogni sei mesi, di
PSUR con rapporti sulla sicurezza incentrati sugli eventi avversi cardiovascolari, sugli eventi avversi
emorragici e sull’uso al di fuori delle indicazioni approvate.
Per garantire che gli operatori sanitari siano informati in merito alla corretta indicazione sull’uso del
prodotto, il titolare dell’autorizzazione all’immissione in commercio ha introdotto le seguenti
misure: comunicazione proattiva ai medici sul sito web Otsuka Europe, nuova formazione per i
gruppi d’informazione medica e le forze vendita nei Paesi dove il cilostazolo è commercializzato. Il
CHMP ha approvato una comunicazione, diretta agli operatori sanitari (DHPC), per informare
rapidamente sull’esito della presente revisione.
Al fine di monitorare l’efficacia delle misure precedenti, il CHMP ha approvato due studi sull’uso del
medicinale (DUS). Il primo DUS otterrà dati al basale con l’obiettivo di descrivere le caratteristiche
dei nuovi utilizzatori di cilostazolo, la durata dell’uso di cilostazolo ed i profili di sospensione. Lo
studio avrà anche lo scopo di quantificare l’uso al di fuori delle indicazioni approvate, descrivere i
profili di dosaggio e identificare le specializzazioni dei medici che prescrivono il cilostazolo. Il
secondo DUS sarà inteso a valutare l’efficacia delle variazioni proposte all’RPC, le iniziative
formative e le altre misure attuate per la minimizzazione dei rischi in termini di mitigazione dell’uso
al di fuori delle indicazioni approvate e di aderenza dei prescrittori all’RPC, rispetto ai dati al basale.
Il protocollo degli studi è stato concordato dal CHMP.
Inoltre, il titolare dell’autorizzazione all’immissione in commercio ha convenuto di effettuare uno
studio meccanicistico per fornire ulteriori approfondimenti sugli effetti sull’aggregazione piastrinica
del cilostazolo con aspirina o clopidogrel e sulle conseguenze sul tempo di sanguinamento. Saranno
valutati gli eccessi del tempo di sanguinamento durante il trattamento con cilostazolo al di fuori di
un intervallo preordinato definito nel protocollo e saranno proposte appropriate misure per la
minimizzazione dei rischi quando sarà disponibile il rapporto finale dello studio.
9
Rapporto rischi/benefici
Il comitato ha concluso che il rapporto rischi/benefici dei prodotti contenenti cilostazolo per il
miglioramento della distanza massima percorsa e della distanza massima percorsa senza dolore in
pazienti con claudicatio intermittens (IC) che non presentano dolore a riposo né prove di necrosi
tissutale periferica (malattia arteriosa periferica in stadio II di Fontaine) rimane positivo in
condizioni di uso normali, subordinatamente alle restrizioni, le avvertenze, le modifiche alle
informazioni sul prodotto e le misure concordate per la minimizzazione dei rischi.
Motivi della variazione ai termini dell’autorizzazione all’immissione in commercio
Considerato che
•
il comitato ha tenuto conto della procedura ai sensi dell’articolo 31 della direttiva 2001/83/EC
sui medicinali contenenti cilostazolo;
•
il comitato ha riesaminato tutti i dati forniti per iscritto e nella spiegazione orale dai titolari
dell’autorizzazione in commercio e l’esito della riunione del gruppo consultivo di esperti ad hoc;
•
il comitato ha riesaminato tutti i dati sulle reazioni avverse al farmaco ed i dati delle
sperimentazioni cliniche associati al cilostazolo, in particolare con riguardo agli eventi
cardiovascolari e alle reazioni di sanguinamento. Sebbene i dati delle sperimentazioni cliniche
non abbiano comprovato i timori per la sicurezza sollevati dalle segnalazioni spontanee di ADR,
il CHMP ha concluso che il rischio di sanguinamento e di alcuni eventi cardiovascolari, incluse le
tachiaritmie, non può essere escluso nei pazienti a rischio. Il CHMP ha inoltre concluso che il
rischio di sanguinamento era più alto nei pazienti trattati in modo concomitante con due o più
ulteriori agenti antipiastrinici o anticoagulanti. In considerazione del metabolismo del
cilostazolo, il comitato è del parere che esista il potenziale per interazioni che possono
aumentare i rischi associati al cilostazolo;
•
in considerazione dei timori sulla sicurezza precedenti, il comitato ha concordato una serie di
misure per la minimizzazione dei rischi, fra cui modifiche alle informazioni sul prodotto per
rafforzare la formulazione del foglio illustrativo al fine di ridurre il rischio di eventi emorragici,
di eventi cardiaci e di potenziali interazioni farmaco-farmaco (controindicazione nei pazienti a
rischio, raccomandazione di aggiustamento della dose, potenziamento delle avvertenze per
garantire l’idoneità del trattamento con cilostazolo). Il CHMP ha anche concordato
l’introduzione di misure per garantire che gli operatori sanitari siano informati in merito alle
condizioni d’uso del prodotto. Infine, il comitato ha approvato studi sull’uso del medicinale per
descrivere le caratteristiche dei nuovi utilizzatori di cilostazolo, la durata dell’uso del cilostazolo
ed i profili di sospensione, e quindi valutare l’efficacia delle misure di minimizzazione dei rischi
attuate;
•
il comitato considera il beneficio del cilostazolo moderato ma rileva l’aumento statisticamente
significativo della distanza percorsa rispetto al placebo in pazienti con claudicatio intermittens;
•
il comitato è del parere che alcuni pazienti possano trarre beneficio dal trattamento con
cilostazolo in misura clinicamente rilevante; tuttavia, in considerazione dei timori sulla
sicurezza esistenti, il comitato ha ritenuto appropriato restringere l’uso ai pazienti che non
hanno risposto alle variazioni dello stile di vita e raccomandare che il trattamento sia
prolungato solo nei pazienti che abbiano mostrato una risposta migliorativa entro i primi tre
mesi;
•
il comitato ha pertanto concluso che il rapporto rischi/benefici dei medicinali contenenti
cilostazolo sia positivo in condizioni d’uso normali solo per l’uso in seconda linea, nei pazienti in
cui le modifiche dello stile di vita ed altri interventi appropriati non siano stati sufficienti per
ottenere un miglioramento dei sintomi di claudicatio intermittens, subordinatamente alle
misure di minimizzazione dei rischi concordate, incluse le modifiche alle informazioni sul
prodotto.
Il CHMP ha quindi raccomandato la variazione dei termini delle autorizzazioni all’immissione in
commercio per i medicinali contenenti cilostazolo a cui si fa riferimento nell’Allegato I, in
conformità con le modifiche del riassunto delle caratteristiche del prodotto, dell’etichettatura e del
foglio illustrativo stabilite nell’Allegato III, subordinatamente alle condizioni stabilite nell’Allegato
IV.
10
ALLEGATO III
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
ETICHETTATURA E FOGLIO ILLUSTRATIVO
11
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
12
1.
DENOMINAZIONE DEL MEDICINALE
Medicinale contenente cilostazolo (vedere allegato I) 50 mg compresse
Medicinale contenente cilostazolo (vedere allegato I) 100 mg compresse
[Vedere allegato I – completare con i dati nazionali]
2.
COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Una compressa contiene 50 mg di cilostazolo.
Una compressa contiene 100 mg di cilostazolo.
Per l’elenco completo degli eccipienti, vedere paragrafo 6.1.
3.
FORMA FARMACEUTICA
Compressa
Compresse bianche, rotonde, piatte, recanti la dicitura “OG31” su un lato.
Compresse bianche, rotonde, piatte, recanti la dicitura “OG30” su un lato.
4.
4.1
INFORMAZIONI CLINICHE
Indicazioni terapeutiche
Pletal è indicato per aumentare la distanza percorsa a piedi senza dolore e la distanza massima in
pazienti con claudicatio intermittens, senza dolore a riposo e senza necrosi dei tessuti periferici
(arteriopatia periferica – classe Fontaine II).
Pletal è indicato in seconda linea, in pazienti nei quali modifiche dello stile di vita (compreso smettere
di fumare e programmi di attività fisica [con supervisione]) e altri interventi appropriati non hanno
migliorato in modo sufficiente i sintomi della claudicatio intermittens.
4.2
Posologia e modo di somministrazione
Posologia
La dose raccomandata di cilostazolo è 100 mg due volte al giorno. Il cilostazolo deve essere assunto
30 minuti prima della prima colazione e della cena. L'assunzione di cilostazolo con il cibo ha
evidenziato un aumento delle concentrazioni massime (C max ) di cilostazolo nel plasma, che può essere
associato con un'aumentata frequenza di reazioni avverse.
Il trattamento con cilostazolo deve essere avviato da medici esperti nella gestione della claudicatio
intermittens (vedere anche paragrafo 4.4).
Il medico deve riesaminare il paziente dopo 3 mesi di trattamento, per l’eventuale sospensione del
cilostazolo laddove si osserva un effetto inadeguato o i sintomi non sono migliorati.
I pazienti in terapia con cilostazolo devono proseguire le modifiche apportate allo stile di vita
(smettere di fumare e svolgimento di attività fisica) e gli interventi farmacologici (ad esempio terapia
ipolipemizzante e antiaggregante piastrinica) per ridurre il rischio di eventi cardiovascolari. Il
cilostazolo non è un sostituto di tali terapie farmacologiche.
La riduzione della dose a 50 mg due volte al giorno è raccomandata nei pazienti che ricevono farmaci
forti inibitori del CYP3A4, come taluni macrolidi, antifungini azolici, inibitori delle proteasi, oppure
farmaci che inibiscono marcatamente il CYP2C19, come omeprazolo (vedere paragrafi 4.4 e 4.5).
13
Anziani
Non vi sono particolari requisiti posologici per gli anziani.
Popolazione pediatrica
La sicurezza e l’efficacia di <Medicinale contenente cilostazolo> nei bambini non sono state stabilite.
Insufficienza renale
Non è necessario aggiustare la dose in pazienti con clearance della creatinina > 25 ml/min.
Cilostazolo è controindicato nei pazienti con clearance della creatinina ≤ 25 ml/min.
Insufficienza epatica
Non è necessario aggiustare la dose in pazienti con lieve insufficienza epatica. Non ci sono dati
disponibili in pazienti con insufficienza epatica moderata o grave. Poiché il cilostazolo è
metabolizzato estesamente dagli enzimi epatici, è controindicato nei pazienti con insufficienza epatica
moderata o grave.
4.3
Controindicazioni
•
•
•
•
•
•
Ipersensibilità accertata al cilostazolo o ad uno qualsiasi degli eccipienti
Insufficienza renale grave: clearance della creatinina ≤ 25 ml/min
Insufficienza epatica moderata o grave
Scompenso cardiaco congestizio
Gravidanza
Pazienti con accertata predisposizione emorragica (per esempio ulcerazione peptica attiva,
recente ictus emorragico [negli ultimi sei mesi], retinopatia diabetica proliferativa, ipertensione
scarsamente controllata)
Pazienti con anamnesi di tachicardia ventricolare, fibrillazione ventricolare o di ectopie
ventricolari multifocali, trattate adeguatamente o meno, e in pazienti con prolungamento
dell'intervallo QTc
Pazienti con anamnesi di grave tachiaritmia
Pazienti trattati contemporaneamente con due o più antiaggreganti piastrinici o anticoagulanti
supplementari (ad esempio acido acetilsalicilico, clopidogrel, eparina, warfarin,
acenocumarolo, dabigatran, rivaroxaban o apixaban)
Pazienti con angina pectoris instabile, infarto del miocardio negli ultimi 6 mesi, o sottoposti a
intervento coronarico negli ultimi 6 mesi.
•
•
•
•
4.4
Avvertenze speciali e precauzioni d’impiego
L’opportunità del trattamento con cilostazolo deve essere attentamente considerata assieme ad altre
opzioni terapeutiche, come la rivascolarizzazione.
In base al suo meccanismo d’azione, il cilostazolo può indurre tachicardia, palpitazioni, tachiaritmia
e/o ipotensione. L’aumento della frequenza cardiaca associato con il cilostazolo va da 5 a 7 battiti al
minuto circa; di conseguenza, nei pazienti a rischio questo può indurre angina pectoris.
I pazienti possibilmente a maggior rischio di eventi avversi cardiaci gravi per via dell’aumentata
frequenza cardiaca, per esempio pazienti con coronaropatia stabile, devono essere attentamente
monitorati durante il trattamento con cilostazolo, mentre l’uso del cilostazolo è controindicato in
pazienti con angina pectoris instabile, o con infarto del miocardio/intervento coronarico negli ultimi 6
mesi, oppure con storia di grave tachiaritmia (vedere paragrafo 4.3).
14
Deve essere prestata cautela al momento di prescrivere il cilostazolo a pazienti con ectopia atriale o
ventricolare e a pazienti con fibrillazione o flutter atriale.
I pazienti devono essere informati della necessità di riferire qualsiasi episodio emorragico o di facile
comparsa di ecchimosi nel corso della terapia. L'assunzione del cilostazolo deve essere interrotta in
caso di emorragia retinica. Per ulteriori informazioni in merito ai rischi emorragici, vedere paragrafi
4.3 e 4.5.
A causa dell'effetto inibitorio del cilostazolo sull'aggregazione piastrinica, è possibile che si verifichi
un aumentato rischio emorragico in concomitanza con procedure chirurgiche (compresi interventi
invasivi minori, come l’estrazione dentaria). Se un paziente deve sottoporsi ad un intervento
chirurgico elettivo che non richiede un effetto antiaggregante piastrinico, la somministrazione di
cilostazolo deve essere interrotta 5 giorni prima dell’intervento.
Vi sono state segnalazioni rare o molto rare di anomalie ematologiche, incluse trombocitopenia,
leucopenia, agranulocitosi, pancitopenia e anemia aplastica (vedere paragrafo 4.8). Gran parte dei
pazienti è guarita a seguito dell’interruzione di cilostazolo. Tuttavia, alcuni casi di pancitopenia e di
anemia aplastica hanno avuto esito fatale.
Oltre a segnalare gli episodi emorragici e di facile comparsa di ecchimosi, i pazienti devono essere
informati della necessità di riferire tempestivamente qualunque altro segno che possa suggerire
l'esordio precoce di discrasia ematica, come piressia e mal di gola. Un esame emocromocitometrico
completo deve essere eseguito nei casi di sospetta infezione, o in presenza di altre evidenze cliniche di
discrasia ematica. Il trattamento con cilostazolo deve essere interrotto tempestivamente se insorgono
prove cliniche o di laboratorio di anomalie ematologiche.
Nel caso di pazienti in terapia con forti inibitori del CYP3A4 o del CYP2C19, i livelli di cilostazolo
nel plasma hanno evidenziato un aumento. In tali casi si raccomanda una dose di cilostazolo pari a
50 mg due volte al giorno (per ulteriori informazioni, vedere paragrafo 4.5).
È necessaria cautela nella co-somministrazione del cilostazolo e qualunque altro agente con
potenziale effetto ipotensivo, per via della possibilità di effetti ipotensivi additivi con una tachicardia
riflessa. Vedere anche paragrafo 4.8.
Deve essere prestata attenzione alla co-somministrazione di cilostazolo e qualunque altro
antiaggregante piastrinico. Vedere paragrafi 4.3 e 4.5.
4.5
Interazioni con altri medicinali ed altre forme di interazione
Antiaggreganti piastrinici
Cilostazolo è un inibitore della fosfodiesterasi (PDE) III con attività antiaggregante piastrinica. In uno
studio clinico su soggetti sani, la somministrazione di cilostazolo 150 mg due volte al giorno per
cinque giorni non ha portato al prolungamento del tempo di sanguinamento.
Acido acetilsalicilico (ASA)
La co-somministrazione a breve termine (≤4 giorni) di ASA e cilostazolo ha suggerito un aumento di
23-25% dell'inibizione dell'aggregazione piastrinica indotta da adenosina difosfato (ADP) ex vivo,
rispetto al solo ASA.
Non sono emersi trend apparenti verso una maggiore frequenza di eventi avversi emorragici nei
pazienti in terapia con cilostazolo e ASA, a confronto con i pazienti che assumevano placebo e dosi
equivalenti di ASA.
Clopidogrel e altri antiaggreganti piastrinici
15
La somministrazione concomitante di cilostazolo e clopidogrel non ha avuto effetti su conta
piastrinica, tempo di protrombina (PT) o tempo di tromboplastina parziale attivata (aPTT). In tutti i
soggetti sani dello studio si è avuto un prolungamento dei tempi di sanguinamento con il solo
clopidogrel e la somministrazione concomitante con il cilostazolo non ha portato ad effetti aggiuntivi
di rilievo sui tempi di sanguinamento. Si consiglia cautela al momento di co-somministrare il
cilostazolo e qualunque altro antiaggregante piastrinico. L’opportunità di un monitoraggio periodico
dei tempi di sanguinamento deve essere presa in considerazione. Il trattamento con cilostazolo è
controindicato nei pazienti in terapia con due o più antiaggreganti piastrinici/anticoagulanti
supplementari (vedere paragrafo 4.3).
Una percentuale maggiore di emorragia è stata osservata con l’uso concomitante di clopidogrel, ASA
e cilostazolo nello studio CASTLE.
Anticoagulanti orali come warfarin
All'interno di uno studio clinico con singola dose, non è stato possibile osservare inibizione del
metabolismo di warfarin né alcun effetto sui parametri di coagulazione (PT, aPTT, tempo di
sanguinamento). Tuttavia, si consiglia cautela per i pazienti che ricevono sia il cilostazolo che un
anticoagulante, ed è necessario un frequente monitoraggio per ridurre il rischio emorragico.
Il trattamento con cilostazolo è controindicato nei pazienti in terapia con due o più antiaggreganti
piastrinici/anticoagulanti supplementari (vedere paragrafo 4.3).
Inibitori degli enzimi del citocromo P-450 (CYP)
Cilostazolo è metabolizzato estesamente dagli enzimi del CYP, in particolare CYP3A4 e CYP2C19, e
in misura minore CYP1A2. Il metabolita deidro, la cui potenza è maggiore di 4 - 7 volte rispetto a
quella di cilostazolo nell'inibire l'aggregazione piastrinica, sembra essere formato principalmente
tramite il CYP3A4. Il metabolita 4`-trans-idrossi, con potenza pari a un quinto di quella di cilostazolo,
sembra essere formato prevalentemente tramite il CYP2C19. Di conseguenza, i farmaci inibitori del
CYP3A4 (ad esempio alcuni macrolidi, antifungini azolici, inibitori delle proteasi) o del CYP2C19
(come gli inibitori della pompa protonica [PPI]) accrescono l'attività farmacologica totale e
potrebbero potenziare gli effetti indesiderati di cilostazolo. Di conseguenza, per pazienti che
assumono contemporaneamente forti inibitori del CYP3A4 o del CYP2C19 la dose raccomandata è
50 mg due volte al giorno (vedere paragrafo 4.2).
La somministrazione di cilostazolo con eritromicina (un inibitore del CYP3A4) ha portato a un
aumento di 72% nella AUC del cilostazolo, accompagnato da un aumento di 6% nella AUC del
metabolita deidro e da un aumento di 119% della AUC del metabolita 4`-trans-idrossi.
In base alla AUC, la complessiva attività farmacologica di cilostazolo aumenta di 34% con la cosomministrazione con eritromicina. Sulla base di tali dati, la dose raccomandata di cilostazolo è 50 mg
due volte al giorno in presenza di eritromicina e di agenti analoghi (ad esempio claritromicina).
La co-somministrazione di ketoconazolo (un inibitore del CYP3A4) con cilostazolo ha portato a un
aumento di 117% della AUC per il cilostazolo, accompagnato da una riduzione di 15% della AUC per
il metabolita deidro, e un aumento di 87% della AUC per il metabolita 4`-trans-idrossi. In base alla
AUC, la complessiva attività farmacologica di cilostazolo aumenta di 35% con la cosomministrazione con ketoconazolo. Sulla base di tali dati, la dose raccomandata di cilostazolo è
50 mg due volte al giorno in presenza di ketoconazolo e agenti analoghi (ad esempio itraconazolo).
La somministrazione di cilostazolo con diltiazem (un debole inibitore del CYP3A4) ha portato a un
aumento di 44% nella AUC per il cilostazolo, accompagnato da un aumento di 4% della AUC del
metabolita deidro e da un aumento di 43% della AUC del metabolita 4`-trans-idrossi. In base alla
AUC, la complessiva attività farmacologica del cilostazolo aumenta di 19% con la cosomministrazione con diltiazem. Sulla base di tali dati, non è necessario alcun aggiustamento della
dose.
16
La somministrazione di una singola dose di 100 mg di cilostazolo con 240 ml di succo di pompelmo
(un inibitore del CYP3A4 intestinale) non ha avuto effetti di rilievo sulla farmacocinetica del
cilostazolo. Sulla base di tali dati, non è necessario alcun aggiustamento della dose. Un effetto
rilevante dal punto di vista clinico su cilostazolo è comunque possibile con quantità maggiori di succo
di pompelmo.
La somministrazione di cilostazolo con omeprazolo (un inibitore del CYP2C19) ha aumentato di 22%
la AUC per il cilostazolo, con un aumento di 68% della AUC per il metabolita deidro, e una riduzione
di 36% della AUC per il metabolita 4`-trans-idrossi. In base alla AUC, la complessiva attività
farmacologica aumenta di 47% con la co-somministrazione con omeprazolo. Sulla base di tali dati, la
dose raccomandata di cilostazolo è 50 mg due volte al giorno in presenza di omeprazolo.
Substrati degli enzimi del citocromo P-450
È stato dimostrato che il cilostazolo aumenta la AUC della lovastatina (un substrato sensibile per il
CYP3A4) e il suo acido β-idrossi nella misura del 70%. Si consiglia cautela nel co-somministrare il
cilostazolo con substrati del CYP3A4 con stretto indice terapeutico (come cisapride, alofantrina,
pimozide, derivati di segale cornuta). Si raccomanda attenzione nella co-somministrazione con statine
metabolizzate dal CYP3A4, per esempio simvastatina, atorvastatina e lovastatina.
Induttori degli enzimi del citocromo P-450
Non è stato valutato l'effetto degli induttori del CYP3A4 e del CYP2C19 (come carbamazepina,
fenitoina, rifampicina ed Erba di S. Giovanni) sulla farmacocinetica di cilostazolo. L'effetto
antiaggregante piastrinico può venire teoricamente alterato e deve essere attentamente monitorato in
caso di co-somministrazione di cilostazolo e di induttori del CYP3A4 e CYP2C19.
Negli studi clinici, il fumo di sigaretta (che induce il CYP1A2) ha ridotto di 18% le concentrazioni
plasmatiche di cilostazolo.
Altre potenziali interazioni
È necessaria cautela nel co-somministrare cilostazolo con qualunque altro agente in grado di ridurre la
pressione arteriosa, a causa della possibilità di un effetto ipotensivo aggiuntivo con tachicardia
riflessa.
4.6
Fertilità, gravidanza e allattamento
Gravidanza
Non vi sono dati adeguati riguardanti l’uso di cilostazolo in donne in gravidanza. Gli studi sugli
animali hanno mostrato una tossicità riproduttiva (vedere paragrafo 5.3). Il rischio potenziale per gli
esseri umani non è noto. <Medicinale contenente cilostazolo> non deve essere usato durante la
gravidanza (vedere paragrafo 4.3).
Allattamento
L'escrezione di cilostazolo nel latte materno è stata riportata in studi sugli animali. L’escrezione di
cilostazolo nel latte materno umano non è nota. A causa del potenziale effetto dannoso per il neonato
allattato con latte materno da una madre in trattamento, l'uso di <Medicinale contenente cilostazolo>
non è raccomandato durante l'allattamento.
Fertilità
Cilostazolo non ha alterato la fertilità negli studi sugli animali.
4.7
Effetti sulla capacità di guidare veicoli e sull'uso di macchinari
17
Cilostazolo può causare capogiri e i pazienti devono essere informati della necessità di procedere con
cautela prima di guidare veicoli o di usare macchinari.
4.8
Effetti indesiderati
Le reazioni avverse riportate più comunemente negli studi clinici sono state cefalea (in > 30%),
diarrea e feci anomale (ciascuna in > 15%). Tali reazioni sono state solitamente di intensità da lieve a
moderata e talvolta sono state alleviate riducendo la dose.
Le reazioni avverse riportate negli studi clinici e successivamente all'immissione in commercio sono
incluse nella tabella che segue.
Le frequenze corrispondono a:
Molto comune
Comune
Non comune
Raro
Molto raro
(≥1/10)
(≥1/100, <1/10)
(≥1/1.000, <1/100)
(≥1/10.000, <1/1.000)
(<1/10.000), non nota (la frequenza non può essere
definita sulla base dei dati disponibili)
Le frequenze delle reazioni osservate nel periodo successivo all'immissione in commercio sono
considerate non note (la frequenza non può essere definita sulla base dei dati disponibili).
Patologie del sistema
emolinfopoietico
Comune
Ecchimosi
Non comune
Anemia
Raro
Prolungamento del tempo di sanguinamento,
trombocitemia
Non nota
Tendenza emorragica, trombocitopenia,
granulocitopenia, agranulocitosi, leucopenia,
pancitopenia, anemia aplastica
Disturbi del sistema
immunitario
Non comune
Reazione allergica
Disturbi del metabolismo e
della nutrizione
Comune
Edema (periferico, facciale), anoressia
Non comune
Iperglicemia, diabete mellito
Disturbi psichiatrici
Non comune
Ansietà
Patologie del sistema nervoso
Molto comune
Cefalea
Comune
Capogiri
Non comune
Insonnia, turbe oniriche
Non nota
Paresi, ipoestesia
Patologie dell’occhio
Non nota
Congiuntivite
Patologie dell’orecchio e del
labirinto
Non nota
Tinnito
18
Patologie cardiache
Comune
Palpitazioni, tachicardia, angina pectoris,
aritmia, extrasistoli ventricolari
Non comune
Infarto del miocardio, fibrillazione atriale,
scompenso cardiaco congestizio, tachicardia
sopraventricolare, tachicardia ventricolare,
sincope
Non comune
Emorragia oculare, epistassi, emorragia
gastrointestinale, emorragia non specificata,
ipotensione ortostatica
Non nota
Vampate, ipertensione, ipotensione, emorragia
cerebrale, emorragia polmonare, emorragia
muscolare, emorragia del tratto respiratorio,
emorragia sottocutanea
Comune
Rinite, faringite
Non comune
Dispnea, polmonite, tosse
Non nota
Polmonite interstiziale
Molto comune
Diarrea, feci anomale
Comune
Nausea e vomito, dispepsia, flatulenza, dolore
addominale
Non comune
Gastrite
Patologie epatobiliari
Non nota
Epatite, anomalie della funzionalità epatica,
ittero
Patologie della cute e del
tessuto sottocutaneo
Comune
Rash, prurito
Non nota
Eczema, eruzioni cutanee, sindrome di StevensJohnson, necrolisi epidermica tossica, orticaria
Patologie del sistema
muscoloscheletrico e del
tessuto connettivo
Non comune
Mialgia
Patologie renali e urinarie
Raro
Insufficienza renale, compromissione renale
Non nota
Ematuria, pollachiuria
Comune
Dolore toracico, astenia
Non comune
Brividi, malessere
Non nota
Piressia, dolore
Non nota
Aumento dei livelli di acido urico, aumento
dell'azotemia, aumento della creatinina ematica
Patologie vascolari
Patologie respiratorie,
toraciche e mediastiniche
Patologie gastrointestinali
Patologie sistemiche e
condizioni relative alla sede di
somministrazione
Esami diagnostici
19
È stato osservato un aumento della frequenza di palpitazioni e di edema periferico somministrando
cilostazolo contemporaneamente con altri vasodilatatori che causano tachicardia riflessa, come i
calcio-antagonisti derivati dalla diidropiridina.
Il solo evento avverso che ha portato all'interruzione della terapia in ≥ 3% dei pazienti trattati con
cilostazolo è stata la cefalea. Altre cause frequenti di interruzione includevano palpitazioni e diarrea
(ciascuna in 1,1%).
Di per sé cilostazolo può comportare un aumentato rischio emorragico, a sua volta potenziato dalla
co-somministrazione di qualunque altro agente caratterizzato da tale effetto.
Il rischio di emorragia intraoculare può essere superiore nei pazienti diabetici.
Un aumento della frequenza di diarrea e palpitazioni è stato riscontrato in pazienti di età superiore a
70 anni.
4.9
Sovradosaggio
Le informazioni sul sovradosaggio acuto nell'uomo sono limitate. I segni e i sintomi prevedibili sono
forte cefalea, diarrea, tachicardia e, possibilmente, aritmia cardiaca.
I pazienti devono essere posti sotto osservazione, istituendo le terapie di supporto del caso. Procedere
all'evacuazione gastrica inducendo il vomito o con lavanda gastrica, come pertinente.
5.
PROPRIETÀ FARMACOLOGICHE
5.1
Proprietà farmacodinamiche
Categoria farmacoterapeutica: Agenti antitrombotici, antiaggreganti piastrinici esclusa eparina.
Codice ATC: B01A C
Dai dati generati in nove studi controllati verso placebo (in cui 1.634 pazienti sono stati esposti a
cilostazolo), è stato dimostrato che cilostazolo migliora la capacità di fare moto variando la Distanza
di claudicatio assoluta (ACD, o distanza massimale di deambulazione) e la Distanza di claudicatio
iniziale (ICD, o distanza di deambulazione senza dolore), come attestato dalle prove con “treadmill
test”. Dopo 24 settimane di trattamento, la somministrazione di cilostazolo 100 mg due volte al giorno
ha portato ad aumenti della ACD media fra 60,4 e 129,1 metri, e inoltre ad aumenti medi della ICD
fra 47,3 e 93,6 metri.
Una meta-analisi basata sulle differenze medie ponderate fra i nove studi ha indicato un significativo
aumento globale assoluto post-basale di 42 m nella distanza massimale di deambulazione (ACD) per
cilostazolo 100 mg due volte al giorno rispetto al miglioramento riscontrato con il placebo. Questo
corrisponde a un miglioramento relativo di 100% a confronto con il placebo. Tale effetto appariva
inferiore nei soggetti diabetici, rispetto ai pazienti non affetti da diabete.
Studi sugli animali hanno dimostrato effetti vasodilatatori da parte di cilostazolo, attestati in piccoli
studi sull'uomo, in cui il flusso ematico alla caviglia veniva misurato con pletismografia a straingauge. Il cilostazolo inibisce anche la proliferazione delle cellule muscolari lisce nel ratto e delle
cellule muscolari umane in vitro; inibisce inoltre la reazione di rilascio piastrinico del fattore della
crescita piastrino-derivato e del PF-4 nelle piastrine umane.
Studi sugli animali e sull'uomo (in vivo ed ex vivo) hanno evidenziato un'inibizione reversibile
dell'aggregazione piastrinica da parte del cilostazolo. L'inibizione è efficace contro svariati aggreganti
(compresi sforzo di taglio, acido arachidonico, collagene, ADP e adrenalina); nell'uomo, tale
inibizione dura fino a 12 ore e dietro cessazione della somministrazione del cilostazolo, si è avuto il
20
ripristino dell'aggregazione entro 48-96 ore, senza iperaggregabilità di rebound. Gli effetti sui lipidi
plasmatici in circolo sono stati esaminati nei pazienti in trattamento con <Medicinale contenente
cilostazolo>. Dopo 12 settimane, in confronto con il placebo, <Medicinale contenente cilostazolo>
100 mg due volte al giorno ha prodotto una riduzione dei trigliceridi di 0,33 mmol/l (15%) e un
aumento del colesterolo HDL di 0,10 mmol/l (10%).
Uno studio di Fase IV randomizzato, in doppio cieco, controllato verso placebo è stato condotto al
fine di valutare gli effetti a lungo termine del cilostazolo, particolarmente in termini di mortalità e di
sicurezza. In totale, 1.439 pazienti con claudicazione intermittente e non cardioscompensati hanno
ricevuto terapia con il cilostazolo o con il placebo per un massimo di tre anni. Per quanto concerne la
mortalità, la percentuale di eventi di Kaplan-Meier a 36 mesi per i decessi durante la terapia con il
farmaco dello studio, con un tempo mediano di 18 mesi di assunzione del farmaco dello studio, è stata
5,6% (CI 95% fra 2,8 e 8,4%) per il cilostazolo, e 6,8% (CI 95% fra 1,9 e 11,5%) per il placebo. Dal
trattamento a lungo termine con il cilostazolo non sono emerse riserve in merito alla sicurezza.
5.2
Proprietà farmacocinetiche
In seguito a dosi multiple di cilostazolo 100 mg due volte al giorno, in pazienti con malattia vascolare
periferica, lo steady-state viene raggiunto entro 4 giorni.
La C max di cilostazolo e dei suoi principali metaboliti in circolo aumenta in modo meno che
proporzionale rispetto all'incremento delle dosi. Tuttavia, la AUC per cilostazolo e i suoi metaboliti
cresce in modo pressoché proporzionale alla dose.
L’emivita di eliminazione apparente per il cilostazolo è di 10,5 ore. I principali metaboliti sono due:
un deidro-cilostazolo e un 4’-trans-idrossi cilostazolo, entrambi con emivite apparenti analoghe. Il
metabolita deidro è 4 - 7 volte più attivo come antiaggregante piastrinico rispetto al composto
progenitore, mentre nel caso del metabolita 4’-trans-idrossi tale attività è pari a un quinto. Le
concentrazioni plasmatiche (misurate mediante la AUC) dei metaboliti deidro e 4’-trans-idrossi sono
~41% e ~12% delle concentrazioni di cilostazolo.
Cilostazolo è eliminato principalmente per metabolismo e successiva escrezione urinaria dei
metaboliti. I principali isoenzimi coinvolti nella sua biotrasformazione sono il citocromo P-450
CYP3A4, in misura minore il CYP2C19, e ancor meno il CYP1A2.
La via primaria di eliminazione è quella urinaria (74%) con il restante volume escreto nelle feci.
Nessuna quantità misurabile di cilostazolo viene escreta immodificata nelle urine, e meno di 2% della
dose viene escreto sotto forma di metabolita deidro di cilostazolo. Circa 30% della dose è escreta
nelle urine sotto forma di metabolita 4’-trans-idrossi. Il resto è escreto come metaboliti, nessuno dei
quali supera il 5% del totale escreto.
Cilostazolo si lega per 95-98% alle proteine, in primis all'albumina. Il metabolita deidro e il
metabolita 4’-trans-idrossi presentano un legame proteico rispettivamente di 97,4% e 66%.
Non vi sono evidenze dell'induzione di enzimi microsomiali epatici da parte di cilostazolo.
La farmacocinetica del cilostazolo e dei suoi metaboliti non ha risentito in maniera significativa
dell'età o del sesso in soggetti sani la cui età rientra fra 50 e 80 anni.
In soggetti con grave insufficienza renale, la frazione libera del cilostazolo è stata superiore del 27%,
e sia la C max che la AUC erano inferiori rispettivamente di 29% e 39% rispetto ai soggetti con
funzionalità renale nella norma. La C max e la AUC del metabolita deidro erano inferiori
rispettivamente di 41% e 47% nei soggetti con grave insufficienza renale, a rapporto con i soggetti
con funzionalità renale nella norma. La C max e la AUC del metabolita 4’-trans-idrossi erano superiori
rispettivamente di 173% e 209% nei soggetti con grave insufficienza renale. Cilostazolo non deve
essere somministrato a pazienti con clearance della creatinina < 25 ml/min (vedere paragrafo 4.3).
21
Non ci sono dati in pazienti con insufficienza epatica da moderata a grave, e poiché cilostazolo viene
metabolizzato estesamente da enzimi epatici, il medicinale non deve essere usato in tali pazienti
(vedere paragrafo 4.3).
5.3
Dati preclinici di sicurezza
Cilostazolo e molti dei suoi metaboliti sono inibitori della fosfodiesterasi (PDE) III che sopprimono la
degradazione dell'AMP ciclico, con il risultato di un aumento del cAMP in varie tipologie tissutali,
comprese piastrine e vasi ematici. Come per altri inotropi positivi e vasodilatatori, cilostazolo ha
prodotto lesioni cardiovascolari nei cani. Tali lesioni non sono emerse nei ratti e nelle scimmie e sono
considerate specifiche per la specie canina. L'esame del QTc nei cani e nelle scimmie non ha
evidenziato prolungamento dopo la somministrazione del cilostazolo o dei suoi metaboliti.
Gli studi di mutagenicità sono stati negativi in termini di mutazione dei geni batterici, riparazione del
DNA batterico, mutazione genetica delle cellule mammarie e aberrazione cromosomica midollare
murina in vivo. Nei test in vitro su cellule di ovaio di criceto cinese, cilostazolo ha prodotto un
aumento debole ma significativo nella frequenza delle aberrazioni cromosomiche. Non sono stati
osservati esiti neoplastici inconsueti in stufi di carcinogenicità della durata di due anni nei ratti, con
dosi orali (dietetiche) fino a 500 mg/kg/die, e nei topi a dosi massime di 1.000 mg/kg/die.
Nei ratti trattati durante la gravidanza, i pesi fetali risultavano inferiori. Con posologie elevate è stato
inoltre riscontrato un aumento dei feti con malformazioni esterne, viscerali e scheletriche. Con dosi
inferiori, sono stati osservati ritardi nell'ossificazione. L'esposizione a stadi avanzati della gestazione
ha causato maggiore frequenza di natimortalità e di progenie di peso ridotto. Un'aumentata frequenza
di ritardo nell'ossificazione dello sterno è emersa nei conigli.
6.
INFORMAZIONI FARMACEUTICHE
6.1
Elenco degli eccipienti
Amido di mais, cellulosa microcristallina, calcio carmelloso, ipromellosa e magnesio stearato.
[Completare con i dati nazionali]
6.2
Incompatibilità
Non pertinente.
[Completare con i dati nazionali]
6.3
Periodo di validità
3 anni.
[Completare con i dati nazionali]
6.4
Precauzioni particolari per la conservazione
Questo medicinale non richiede alcuna condizione particolare di conservazione.
[Completare con i dati nazionali]
6.5
Natura e contenuto del contenitore
Confezioni contenenti 14, 20, 28, 30, 50, 56, 98, 100, 112 e 168 compresse, e confezioni ospedaliere
con 70 (5x14) compresse, in blister di PVC/Alluminio.
È possibile che non tutte le confezioni siano commercializzate.
[Completare con i dati nazionali]
22
6.6
Precauzioni particolari per lo smaltimento <e la manipolazione>
Nessuna istruzione particolare.
7.
TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
[Vedere allegato I – completare con I dati nazionali]
8.
NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
[Completare con i dati nazionali]
9.
DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL'AUTORIZZAZIONE
[Completare con i dati nazionali]
10.
DATA DI REVISIONE DEL TESTO
[Completare con i dati nazionali]
23
ETICHETTATURA
24
INFORMAZIONI DA APPORRE SUL CONFEZIONAMENTO SECONDARIO
Confezione
1.
DENOMINAZIONE DEL MEDICINALE
Medicinali contenenti cilostazolo (vedere allegato I) 50 mg compresse
Medicinali contenenti cilostazolo (vedere allegato I) 100 mg compresse
[Completare con i dati nazionali]
Cilostazolo
2.
COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI
PRINCIPIO(I) ATTIVO(I)
Una compressa contiene 50 mg di cilostazolo.
Una compressa contiene 100 mg di cilostazolo.
[Completare con i dati nazionali]
3.
ELENCO DEGLI ECCIPIENTI
{Non pertinente.}
[Completare con i dati nazionali]
4.
FORMA FARMACEUTICA E CONTENUTO
20 compresse
28 compresse
30 compresse
50 compresse
56 compresse
100 compresse
112 compresse
168 compresse
[Completare con i dati nazionali]
5.
MODO E VIA(E) DI SOMMINISTRAZIONE
Per uso orale
Leggere il foglio illustrativo prima dell’uso.
6.
AVVERTENZA PARTICOLARE CHE PRESCRIVA DI TENERE IL MEDICINALE
FUORI DALLA VISTA E DALLA PORTATA DEI BAMBINI
25
Tenere fuori dalla vista e dalla portata dei bambini.
7.
ALTRA(E) AVVERTENZA(E) PARTICOLARE(I), SE NECESSARIO
{Non pertinente.}
8.
DATA DI SCADENZA
Scad.
9.
PRECAUZIONI PARTICOLARI PER LA CONSERVAZIONE
{Non pertinente.}
[Completare con i dati personali]
10. PRECAUZIONI PARTICOLARI PER LO SMALTIMENTO DEL MEDICINALE NON
UTILIZZATO O DEI RIFIUTI DERIVATI DA TALE MEDICINALE, SE NECESSARIO
{Non pertinente.}
11.
NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE
ALL’IMMISSIONE IN COMMERCIO
[Completare con i dati nazionali]
[Vedere allegato I – completare con i dati nazionali]
12.
NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
[Completare con i dati nazionali]
13.
NUMERO DI LOTTO
Lotto
14.
CONDIZIONE GENERALE DI FORNITURA
Medicinale soggetto a prescrizione medica.
[Completare con i dati nazionali]
15.
ISTRUZIONI PER L’USO
{Non pertinente}
26
16.
INFORMAZIONI IN BRAILLE
<Medicinale contenente cilostazolo> 50 mg
<Medicinale contenente cilostazolo> 100 mg
[Completare con i dati nazionali]
27
INFORMAZIONI MINIME DA APPORRE SU BLISTER O STRIP
{Blister}
1.
DENOMINAZIONE DEL MEDICINALE
Medicinali contenenti cilostazolo (vedere allegato I) 50 mg compresse
Medicinali contenenti cilostazolo (vedere allegato I) 100 mg compresse
[Vedere allegato I – completare con i dati nazionali]
Cilostazolo
2.
NOME DEL TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN
COMMERCIO
OTSUKA
[Vedere allegato I – completare con i dati nazionali]
3.
DATA DI SCADENZA
Scad.
4.
NUMERO DI LOTTO
Lotto
5.
ALTRO
{Non pertinente}
28
FOGLIO ILLUSTRATIVO
29
Foglio illustrativo: informazioni per l'utilizzatore
Medicinali contenenti cilostazolo (vedere allegato I) 50 mg compresse
Medicinali contenenti cilostazolo (vedere allegato I) 100 mg compresse
Cilostazolo
[Vedere allegato I – completare con i dati nazionali]
Cilostazolo
Legga attentamente questo foglio prima di prendere questo medicinale perché contiene
importanti informazioni per lei.
Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
Se ha qualsiasi dubbio, si rivolga al medico o al farmacista.
Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i
sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio,,
si rivolga al medico o al farmacista.
Contenuto di questo foglio:
1.
Che cos’è <Medicinale contenente cilostazolo> e a cosa serve
2.
Cosa deve sapere prima di prendere <Medicinale contenente cilostazolo>
3.
Come prendere <Medicinale contenente cilostazolo>
4.
Possibili effetti indesiderati
5.
Come conservare <Medicinale contenente cilostazolo>
6.
Contenuto della confezione e altre informazioni
1.
Che cos’è <Medicinale contenente cilostazolo> e a cosa serve
<Medicinale contenente cilostazolo> appartiene a un gruppo di medicinali chiamati inibitori della
fosfodiesterasi di tipo 3.
Agisce in vari modi, tra cui dilatando alcuni vasi sanguigni e riducendo l'attività di coagulazione di
alcune cellule del sangue chiamate piastrine all'interno dei vasi sanguigni.
<Medicinale contenente cilostazolo> le è stato prescritto per la "claudicazione intermittente". La
claudicazione intermittente è il dolore, simile a un crampo, che avverte alle gambe quando cammina,
ed è causata da un apporto insufficiente di sangue alle gambe. <Medicinale contenente cilostazolo>
migliorando la circolazione del sangue nelle gambe le permette di camminare senza avvertire dolore
per una distanza maggiore.
<Medicinale contenente cilostazolo> è raccomandato unicamente per i pazienti i cui sintomi non sono
migliorati a sufficienza dopo aver modificato lo stile di vita (ad esempio smettere di fumare e fare più
attività fisica) e dopo aver intrapreso altre misure. È importante che lei continui a seguire le modifiche
che ha apportato al suo stile di vita mentre prende <Medicinale contenente cilostazolo>.
2.
Cosa deve sapere prima di prendere <Medicinale contenente cilostazolo>
Non prenda <Medicinale contenente cilostazolo>
se è allergico al cilostazolo o ad uno qualsiasi degli altri componenti di questo medicinale
(elencati al paragrafo 6).
se soffre di un disturbo chiamato "insufficienza cardiaca".
se avverte dolore persistente al petto quanto è a riposo, o se ha avuto un “attacco cardiaco” o
qualsiasi intervento chirurgico al cuore negli ultimi sei mesi.
se soffre o ha sofferto in passato di svenimenti causati da una malattia al cuore, o di gravi
disturbi del battito cardiaco.
30
-
-
se sa di avere un disturbo che accresce il rischio di emorragie o della comparsa di lividi, ad
esempio:
- una o più ulcere attive allo stomaco.
- un ictus verificatosi negli ultimi sei mesi.
- problemi agli occhi se soffre di diabete.
- se la sua pressione sanguigna non è ben controllata.
- se sta prendendo sia acido acetilsalicilico sia clopidogrel, o qualsiasi associazione di due o
più medicine che possono aumentare il rischio di emorragie [se ha dubbi consulti il medico
o il farmacista]
se ha una grave malattia ai reni o una grave o moderata malattia al fegato.
se è in gravidanza.
Avvertenze e precauzioni
Prima di prendere <Medicinale contenente cilostazolo>, si assicuri di informare il medico:
se ha un grave problema al cuore, o qualsiasi problema con il battito cardiaco.
se ha problemi di pressione sanguigna.
Durante il trattamento con <Medicinale contenente cilostazolo> si assicuri:
se deve sottoporsi a un intervento chirurgico, compresa l'estrazione di un dente, di informare il
medico o il dentista del fatto che sta prendendo <Medicinale contenente cilostazolo>.
se soffre facilmente di comparsa di lividi o di emorragie, di smettere di prendere <Medicinale
contenente cilostazolo> e di informare il medico.
Altri medicinali e <Medicinale contenente cilostazolo>
Informi il medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe assumere
qualsiasi altro medicinale.
Informi il medico in modo specificose sta assumendo alcune medicine usate abitualmente per disturbi
dolorosi e/o infiammatori a carico dei muscoli o delle articolazioni, oppure se sta assumendo
medicine che riducono la coagulazione. Queste medicine includono:
acido acetilsalicilico
clopidogrel
anticoagulanti (ad esempio warfarin, dabigatran, rivaroxaban, apixaban o eparine a basso peso
molecolare).
Se sta assumendo questi medicinali assieme a <Medicinale contenente cilostazolo>, il medico potrà
sottoporla ad alcuni esami del sangue di routine.
Alcuni farmaci possono interferire con l'effetto di <Medicinale contenente cilostazolo> se vengono
assunti contemporaneamente. Possono accrescere gli effetti indesiderati di <Medicinale contenente
cilostazolo>, oppure ridurre l'efficacia di <Medicinale contenente cilostazolo>. <Medicinale
contenente cilostazolo> può fare altrettanto nei confronti di altri farmaci. Prima di iniziare a prendere
<Medicinale contenente cilostazolo>, informi il medico se sta assumendo:
eritromicina, claritromicina o rifampicina (antibiotici)
ketoconazolo (per il trattamento di infezioni fungine)
omeprazolo (per il trattamento di un'eccessiva acidità di stomaco)
diltiazem (per la pressione alta o per dolore al torace)
cisapride (per il trattamento di disturbi allo stomaco)
lovastatina, simvastatina o atorvastatina (per livelli eccessivi di colesterolo nel sangue)
alofantrina (per il trattamento della malaria)
pimozide (per il trattamento di malattie mentali)
derivati di segale cornuta (per l'emicrania, ad esempio ergotamina, diidroergotamina)
carbamazepina o fenitoina (per il trattamento delle convulsioni)
Erba di S. Giovanni (medicinale a base di pianta medicinale)
31
Se ha dei dubbi sulla validità di quanto sopra per le medicine che sta prendendo, si rivolga al medico
o al farmacista.
Prima di prendere <Medicinale contenente cilostazolo>, informi il medico se sta assumendo medicine
per la pressione alta (ipertensione), poiché <Medicinale contenente cilostazolo> può potenziare
l'effetto di riduzione della pressione sanguigna. Se la pressione scende a livelli troppo bassi, il suo
battito cardiaco potrebbe aumentare. Queste medicine includono:
diuretici (ad esempio idroclorotiazide, furosemide)
calcio-antagonisti (ad esempio verapamil, amlodipina)
ACE-inibitori (ad esempio captopril, lisinopril)
antagonisti dei recettori dell’angiotensina II (ad esempio valsartan, candesartan)
beta-bloccanti (ad esempio labetalolo, carvedilolo);
Potrebbe essere comunque possibile prendere i farmaci elencati sopra assieme a <Medicinale
contenente cilostazolo> e il medico potrà decidere cosa è idoneo nel suo caso.
<Medicinale contenente cilostazolo> con cibi e bevande
Le compresse di <Medicinale contenente cilostazolo> devono essere prese 30 minuti prima della
prima colazione e della cena.
Prenda sempre le compresse con dell’acqua.
Gravidanza e allattamento
<Medicinale contenente cilostazolo> NON DEVE essere usato durante la gravidanza.
Per le donne che allattano con latte materno, l'uso di <Medicinale contenente cilostazolo> NON È
RACCOMANDATO.
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando con
latte materno chieda consiglio al medico o al farmacista prima di prendere questo medicinale.
Guida di veicoli e utilizzo di macchinari
<Medicinale contenente cilostazolo> può causare capogiri. Se avverte capogiri dopo aver preso le
compresse di <Medicinale contenente cilostazolo>, NON guidi veicoli e non usi attrezzi o
macchinari, e informi il medico o il farmacista.
3.
Come prendere <Medicinale contenente cilostazolo>
-
Prenda questo medicinale seguendo sempre esattamente le istruzioni del medico. Se ha dubbi
consulti il medico o il farmacista.
La dose abituale è due compresse da 50 mg due volte al giorno (mattino e sera). Questa dose
non richiede modifiche per le persone anziane. Tuttavia, il medico potrebbe prescrivere una
dose inferiore se lei sta prendendo altre medicine che possono interferire con l’effetto di
<Medicinale contenente cilostazolo>.
La dose abituale è una compressa da 100 mg due volte al giorno (mattino e sera). Questa dose
non richiede modifiche per le persone anziane. Tuttavia, il medico potrebbe prescrivere una
dose inferiore se lei sta prendendo altre medicine che possono interferire con l’effetto di
<Medicinale contenente cilostazolo>.
Le compresse di <Medicinale contenente cilostazolo> devono essere prese 30 minuti prima
della prima colazione e della cena. Prenda sempre le compresse con dell’acqua.
-
-
-
Potrebbe avvertire i benefici dell'assunzione di <Medicinale contenente cilostazolo> entro 4-12
settimane di trattamento. Il medico valuterà i suoi progressi dopo 3 mesi di trattamento e potrebbe
raccomandarle di smettere di prendere il <Medicinale contenente cilostazolo> se l’effetto del
trattamento è insufficiente.
<Medicinale contenente cilostazolo> non è adatto per i bambini.
32
Se prende più <Medicinale contenente cilostazolo> di quanto deve
Se per qualunque motivo ha preso più compresse di <Medicinale contenente cilostazolo> di quanto
avrebbe dovuto, potrebbe avere segni e sintomi come forte mal di testa, diarrea, calo della pressione
sanguigna e battito cardiaco irregolare.
Se ha preso più compresse della sua dose prescritta, contatti immediatamente il medico o
l’ospedale più vicino. Si ricordi di portare con sé la confezione della medicina, affinché sia
chiaro quello che ha preso.
Se dimentica di prendere <Medicinale contenente cilostazolo>
Se salta una dose, non si preoccupi; attenda fino al momento della dose successiva e prenda la
prossima compressa, poi continui normalmente. NON prenda una dose doppia per compensare la
dimenticanza della compressa.
Se interrompe il trattamento con <Medicinale contenente cilostazolo>
Se smette di prendere <Medicinale contenente cilostazolo>, il dolore alle gambe potrebbe tornare o
aggravarsi. Pertanto, smetta di prendere <Medicinale contenente cilostazolo> solo se nota effetti
indesiderati che richiedono cure mediche urgenti (vedere paragrafo 4), oppure se è il medico a
dirglielo.
4.
Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le
persone li manifestino.
Se si manifesta uno degli effetti indesiderati seguenti, potrebbe richiedere urgentemente cure
mediche. Smetta di prendere <Medicinale contenente cilostazolo> e contatti immediatamente un
medico o si rechi all'ospedale più vicino.
ictus
infarto
problemi di cuore che possono causare affanno respiratorio o gonfiore delle caviglie
irregolarità del battito cardiaco (nuova o in peggioramento)
sanguinamento evidente
facile comparsa di lividi
grave malattia con comparsa di vesciche sulla pelle, nella bocca, occhi e genitali
ingiallimento della pelle o della parte bianca degli occhi, per via di problemi al fegato o nel
sangue (ittero)
Informi immediatamente il medico anche se ha la febbre o mal di gola. Potrebbero essere necessari
alcuni esami del sangue e il medico deciderà come proseguire il trattamento.
I seguenti effetti sono stati riferiti per <Medicinale contenente cilostazolo>. Informi non appena
possibile il medico nei seguenti casi:
Effetti indesiderati molto comuni (interessano più di 1 persona su 10)
mal di testa
feci anomale
diarrea
Effetti indesiderati comuni (interessano meno di 1 persona su 10, ma più di 1 persona su 100)
battiti cardiaci rapidi
battiti cardiaci forti (palpitazioni)
dolore al petto
capogiri
33
-
mal di gola
naso che cola (rinite)
dolore addominale
senso di fastidio addominale (indigestione)
nausea o vomito
perdita di appetito (anoressia)
eccessiva eruttazione o flatulenza
gonfiore delle caviglie, dei piedi o del viso
eruzione cutanea (rash) o alterazione dell'aspetto della pelle
prurito della pelle
sanguinamento a chiazze sotto la pelle
senso di debolezza generalizzata
Effetti indesiderati non comuni (interessano meno di 1 persona su 100, ma più di 1 persona su
1.000)
attacco cardiaco
irregolarità del battito cardiaco (nuove o che peggiorano)
problemi di cuore che possono causare affanno respiratorio o gonfiore delle caviglie
polmonite
tosse
brividi
sanguinamento inesplicato
propensione ad emorragie (per esempio di stomaco, occhi o muscoli, sangue dal naso e
presenza di sangue nella saliva o nelle urine)
riduzione del numero di globuli rossi nel sangue
capogiri quando ci si alza in piedi
svenimento
senso di ansia
insonnia
sogni inconsueti
reazione allergica
dolori generalizzati
diabete e aumento degli zuccheri nel sangue
mal di stomaco (gastrite)
malessere
Nelle persone diabetiche, il rischio di sanguinamento nell'interno dell'occhio potrebbe aumentare.
Effetti indesiderati rari (interessano meno di 1 persona su 1.000, ma più di 1 persona su 10.000)
tendenza a sanguinare più a lungo del solito
aumento del numero di piastrine nel sangue
problemi ai reni
I seguenti effetti indesiderati sono stati riportati durante l'uso di <Medicinale contenente
cilostazolo>, ma la loro frequenza non è nota:
alterazioni della pressione sanguigna
riduzione del numero di globuli rossi, globuli bianchi e piastrine nel sangue
difficoltà respiratorie
difficoltà motorie
febbre
vampate
eczema e altre eruzioni cutanee (rash)
ridotta sensibilità della pelle
occhi lacrimanti o viscosi (congiuntivite)
ronzio alle orecchie (tinnito)
problemi al fegato, compresa epatite
34
-
alterazioni delle urine
Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si
rivolga al medico o al farmacista.
5.
Come conservare <Medicinale contenente cilostazolo>
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sulla confezione e sul blister dopo
‘Scad.’. La data di scadenza si riferisce all’ultimo giorno di quel mese.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6.
Contenuto della confezione e altre informazioni
Cosa contiene <Medicinale contenente cilostazolo>
-
Il principio attivo è il cilostazolo. Una compressa contiene 50 mg di cilostazolo.
Il principio attivo è il cilostazolo. Una compressa contiene 100 mg di cilostazolo.
Gli altri componenti sono amido di mais, cellulosa microcristallina, calcio carmelloso,
ipromellosa e magnesio stearato.
[Completare con i dati nazionali]
Descrizione dell’aspetto di <Medicinale contenente cilostazolo> e contenuto della confezione
La compressa di <Medicinale contenente cilostazolo> da 50 mg è una compressa bianca, rotonda e
piatta, recante la dicitura “OG31” su un lato.
La compressa di <Medicinale contenente cilostazolo> da 100 mg è una compressa bianca, rotonda e
piatta, recante la dicitura “OG30” su un lato.
Il medicinale è disponibile in confezioni da 14, 20, 28, 30, 50, 56, 98, 100, 112 o 168 compresse, o in
confezioni ospedaliere da 70 (5x14) compresse.
È possibile che non tutte le confezioni siano commercializzate.
[Completare con i dati nazionali]
Titolare dell’autorizzazione all’immissione in commercio e produttore
Titolare dell’autorizzazione all’immissione in commercio
[Vedere allegato I – completare con I dati nazionali]
Produttore
[Completare con i dati nazionali]
Questo medicinale è autorizzato negli Stati Membri dello Spazio Economico Europeo con le
seguenti denominazioni:
Francia
comprimé - médicament contenant du cilostazol 50 mg
Germania
Cilostazol-haltiges Arzneimittel 50 mg Tabletten
Italia
<Medicinale contenente ciclostazolo> 50 mg compresse
Spagna
Medicamento que contiene cilostazol 50 mg comprimidos
Svezia
läkemedel som innehåller cilostazol 50 mg tabletter
Regno Unito
Cilostazol containing medicinal product 50 mg tablets
Francia
comprimé - médicament contenant du cilostazol 100 mg
35
Germania
Italia
Spagna
Svezia
Regno Unito
Cilostazol-haltiges Arzneimittel 100 mg Tabletten
<Medicinale contenente cilostazolo> 100 mg compresse
Medicamento que contiene cilostazol 100 mg comprimidos
läkemedel som innehåller cilostazol 100 mg tabletter
Cilostazol containing medicinal product 100 mg tablets
[Vedere allegato I – completare con i dati nazionali]
Questo foglio illustrativo è stato aggiornato il {MM/AAAA}.
[Completare con i dati nazionali]
36
Allegato IV
Condizioni per l’autorizzazione all’immissione in commercio
37
Condizioni per l’autorizzazione all’immissione in commercio
Le autorità nazionali competenti (NCA) dello Stato(i) membro(i) o dello Stato(i) membro(i) di
riferimento (RMS) quando applicabile garantiranno che le seguenti condizioni siano soddisfatte
dal(i) titolare(i) dell’autorizzazione all’immissione in commercio:
I titolari dell’autorizzazione all’immissione in commercio sottoporranno un piano di gestione dei
rischi dell’UE per i prodotti secondo le buone pratiche di vigilanza dell’UE, incluse le seguenti
misure:
• Riduzione del ciclo degli PSUR da tre anni a sei mesi fino al 2016. I rapporti di sicurezza sugli
eventi avversi cardiovascolari, sugli eventi avversi emorragici e sull’uso al di fuori delle
indicazioni approvate devono essere presentati insieme agli PSUR semestrali.
Primo Data Lock Point (DLP) = 30 agosto 2013
• Conduzione di uno studio sull’uso del medicinale per descrivere le caratteristiche dei nuovi
utilizzatori di cilostazolo, la durata dell’uso di cilostazolo ed i profili di sospensione. Lo
studio sarà anche utile per quantificare l’uso al di fuori delle indicazioni approvate,
descrivere i profili di dosaggio e individuare le specializzazioni dei medici che prescrivono il
cilostazolo.
Data di scadenza per la presentazione del rapporto finale dello studio: 30 giugno 2014.
• Il titolare dell’autorizzazione all’immissione in commercio deve condurre uno studio sull’uso
del medicinale per valutare l’efficacia delle misure di minimizzazione dei rischi attuate in
termini di mitigazione dell’uso fuori dalle indicazioni approvate ed aderenza dei prescrittori
all’RPC.
Data di scadenza per la presentazione dei rapporti finali dello studio: 31 dicembre 2016.
38