Liceo Scientifico Statale “Galileo Galilei”
Programma di Scienze.
Classe 4 L
anno scolastico 2014/2015
Prof. Paolo Camporese
Biologia
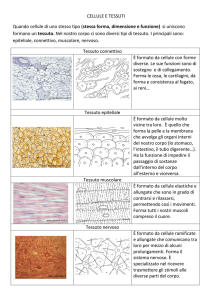
I tessuti del corpo umano: tessuto epiteliale descrizione e funzioni (la pelle o cute), tessuto
connettivo descrizione e principali funzioni. Tessuto muscolare descrizione del t.m. striato, t.m.
liscio e t.m. cardiaco. Il tessuto nervoso: descrizione della cellula nervosa. L’impulso nervoso
dentro e fuori la cellula.
Il sistema digerente: struttura e morfologia del tratto ingestorio e digestorio. Le ghiandole annesse:
fegato e pancreas struttura e funzioni. Fisiologia della digestione. Cenni di corretta alimentazione.
Il sistema respiratorio: la pressione atmosferica, la composizione dell’aria, la pressione parziale
dell’ossigeno. Le prime vie respiratorie: naso, faringe, trachea. Bronchi e polmoni. Cenni sul
trasporto e lo scambio dei gas (flusso di massa e diffusione). La fisiologia della respirazione: il
ruolo delle pleure, del diaframma e dei muscoli costali. I danni provocati dal fumo.
Il sistema circolatorio: cuore e vasi sanguigni, circolazione polmonare e sistemica. Il sangue:
plasma e parte corpuscolata. Il midollo osseo e l’emopoiesi. La coagulazione del sangue. Il cuore
descrizione, la circolazione doppia e completa. La regolazione del battito cardiaco. La pressione
sanguigna e la sua misura. Le malattie cardiovascolari e colesterolo.
Il sistema nervoso: la struttura del sistema nervoso. Il s.n. centrale encefalo e midollo spinale, s.n.
periferico l’arco riflesso. S.n. periferico somatico e autonomo differenze e compiti. S. n. autonomo:
simpatico e parasimpatico. La trasmissione dell’impulso nervoso, le sinapsi e i neurotrasmettitori.
Cenni sulla struttura del cervello.
Il sistema escretore: anatomia del sistema escretore, le funzioni dei reni, la formazione dell’urina,
la conservazione dell’acqua. La regolazione della funzione renale il ruolo degli ormoni.
Il sistema immunitario: immunità innata e acquisita. Il sistema linfatico le sedi del s. immunitario
(tonsille, adenoidi, milza, timo, midollo osseo). Immunità acquisita umorale e cellulo mediata. Gli
anticorpi descrizione e cenni sul processo di selezione, i linfociti B, plasmacellule e cellule
memoria. I linfociti T citotossici e helper. Il complesso di maggiore istocompatibilità. Schema
generale di azione del s. immunitario. Il virus dell’AIDS, modalità di trasmissione e azione sul s.
immunitario, prevenzione.
Il sistema riproduttore: anatomia del sistema riproduttore maschile femminile. La produzione
degli spermatozoi e degli ovuli: descrizione dei testicoli e delle ovaie. Il ciclo mestruale. I principali
mezzi di contraccezione naturali, meccanici e ormonali. Le malattie sessualmente trasmissibili:
gonorrea, sifilide e papilloma virus.
Chimica
Le reazioni chimiche: regole per il bilanciamento di una reazione chimica, i calcoli stechiometrici,
reagente limitante ed in eccesso. I vari tipi di reazionie: sintesi, decomposizione, scambio semplice
e doppio.
Cinetica chimica: la velocità di una reazione. Dinamica delle reazioni: teoria degli urti e energia di
attivazione, i profili di reazione (eso ed endotermica). I fattori che influenzano la velocità di
reazione: natura dei reagenti, concentrazione dei reagenti, temperatura, stato di suddivisione dei
reagenti e presenza di un catalizzatore. Le reazioni reversibili: l’equilibrio chimico. La costante di
equilibrio e la legge di azione di massa. La costante di equilibrio Kp. Le applicazioni della costante
di equilibrio. Il principio di Le Chatelier, effetto della concentrazione di uno dei componenti della
reazione, effetto della pressione in una reazione omogenea (solo gas), effetto della temperatura.
Gli elettroliti forti e deboli, concetto di dissociazione ionica. Gli acidi e le basi, la dissociazione
ionica dell’acqua. La teoria di Arrehenius, la teoria di Bronsted e Lowry, le coppie coniugate acidobase. La protolisi in soluzione acquosa e in assenza di solvente. I composti anfoteri, acidi forti e
deboli la costante di dissociazione acida; basi forti e deboli, la costante di dissociazione basica. La
teoria di Lewis. Le soluzioni acide basiche e neutre, il pH e il pOH . Calcolo del pH in una
soluzione di un acido o di una base forte. Calcolo del pH in una soluzione di un acido o di una base
deboli.
Caselle di Selvazzano, 7 giugno 2015
I rappresentanti di classe
Il Professore