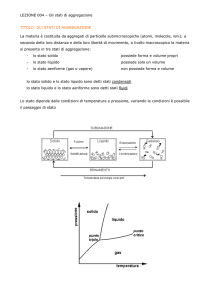
TEORIA CINETICA DEI GAS
Calcolo della pressione
Consideriamo un gas ideale in un recipiente rigido isotermo Trascuriamo la forza peso.
Le molecole si muovono in linea retta.
Consideriamo una parete perpendicolare all’asse x
Supponiamo per semplicità che una molecola di massa m subisca una collisione elastica
nel piano xz.
Le componenti lungo x e z di v e v’ (velocità prima e dopo l’urto) sono:
vx' = −vx e vz' = vz
la variazione di velocità è :
− 2v x e la quella della quantità di moto − 2mvx
!
La pressione esercitata sulla parete è uguale al valor medio della forza F esercitata
sull’unità di area a causa degli urti delle molecola. Per la legge di Newton si ha:
! d ( mv! )
F'=
dt
!
dove F ' è il valor medio della forza esercitata dalla parete sulla molecola.
Il numero di molecole che colpisce l’area dS in un secondo sarà:
"
! v)vx dS
n(
"
! v) è il numero di molecole per unità di volume aventi velocità v .
dove n(
La variazione totale di quantità di moto sarà:
"
! v)dS
!2mv 2x n(
E sommando su tutte le velocità v si ottiene la forza esercitata dalla superficie dS:
"
! v)dS
Ftot ' = !2" mv 2x n(
v
e quindi
p=
"
Ftot
F '
! v)
= ! tot = 2" mv 2x n(
dS
dS
v
Se si osserva che:
2
a)
"
! v n(! v)
x
dove n! è il numero di molecole per unità di volume
n!
b) solo la metà delle molecole (quelle che si muovono in direzione della parete)
urtano realmente
v 2x =
v
si ha quindi:
! 2x
p = nmv
Poiché il moto delle molecole è casuale si ha:
v x2 = v 2y = v 2z
e quindi, essendo
v 2 = v x2 + v 2y + v 2z ,
v x2 =
v2
3
da cui
1
! 2
p = nmv
3
Se NA è il numero di Avogadro e V il volume occupato da una mole si ha:
pV =
NA
mv 2
3
Identifichiamo il gas ideale con un gas perfetto per il quale vale l’equazione pV=RT,
poiché il secondo membro dipende dall’energia cinetica media delle molecole che è
funzione della temperatura T , come si osserva p.e. nel moto browniano.
RT =
da cui si ha:
NA
mv 2
3
v2 =
3RT 3RT 3kT
=
=
N Am
M
m
dove NAm=M è la massa di una mole del gas e k=R/NA=1.38 10-23 J/K è la costante di
Boltzmann.
Introducendo la velocità quadratica media vqm = v 2
vqm =
3RT
3pV
3p
=
=
M
M
!
La temperatura di un gas perfetto può essere espressa come:
T=
M 2 M 2
v =
vqm
3R
3R
Significato statistico della temperatura assoluta T in un gas perfetto.
E’ la misura del quadrato della velocità quadratica media delle molecole.