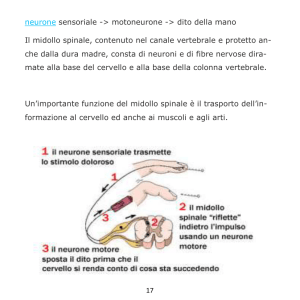
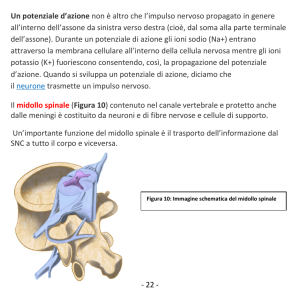
(Notizie dalle Aziende)
SLA, ok Fda a studio di fase II su cellule staminali neurali
17 aprile 2013
La biotech americana Neuralstem ha annunciato di aver ricevuto l’approvazione da parte dell’Fda per iniziare uno studio di fase II
sulle cellule staminali neurali derivate dal midollo spinale, denominate NSI-566, per il trattamento della sclerosi laterale amiotrofica
(Sla).
Lo studio, che valuterà diverse dosi di NSI-566 e la loro sicurezza, verrà condotto presso l’Emory University Hospital di Atlanta, in
Georgia, dove è stata recentemente completata la fase I, e presso la ALS Clinic dello University of Michigan Health System, di Ann
Arbor, in Michigan. Il trial prevede l’arruolamento di 15 pazienti, che verranno trattati con cinque diverse dosi di cellule staminali.
I primi 12 pazienti verranno sottoposti a iniezioni di NSI-566 effettuate in corrispondenza della regione cervicale del midollo spinale
dove le cellule staminali potrebbero essere di aiuto nel migliorare la funzione respiratoria. Gli ultimi tre pazienti riceveranno
iniezioni in corrispondenza sia della regione cervicale, che di quella lombare.
Lo scopo dello studio è quello di stabilire la dose massima tollerabile di cellule staminali neuronali utilizzando la stessa via di
somministrazione della fase I, ovvero attraverso iniezioni nella sostanza grigia del midollo spinale.
Nella fase I gli esperti hanno trattato i pazienti con un massimo di 15 iniezioni da 100mila cellule ciascuna. In base ai risultati positivi
di sicurezza derivati dalla fase I, nella sperimentazione di fase II gli esperti tratteranno i pazienti con un massimo di 40 iniezioni da
400mila cellule ciascuna. Nella fase I le cellule sono state generalmente ben tollerate e sono sopravvissute per lungo periodo. Inoltre,
gli esperti hanno affermato che le cellule sembravano interrompere la progressione della malattia in un sottogruppo di pazaienti per
un periodo di tempo prolungato.
La tecnologia di Neuralstem è in grado di produrre cellule staminali neurali derivate dal cervello e dal midollo spinale umano e di
controllare la loro differenziazione in neuroni maturi e cellule gliali.
Lo scorso febbraio è stata completata la fase I in pazienti con SLA. Le cellule hanno ricevuto la designazione di farmaco orfano
dall’Agenzia americana per la terapia cellulare della SLA.
Oltre alla SLA, le cellule verranno valutate in altre patologie del sistema nervoso centrale incluse le lesioni del midollo spinale, lo
stroke ischemico e il glioblastoma. Lo scorso gennaio, l’Fda ha approvato uno studio di fase I sull’uso delle NSI-566 in pazienti con
lesioni del midollo spinale croniche.
Le cellule staminali neurali (CSN) danno origine, nello sviluppo embrionale, a neuroni e glia, i tipi cellulari specializzati (cellule
differenziate) che formano il cervello. Piccoli numeri di CSN persistono nel cervello adulto, e continuano a fabbricare almeno alcuni
tipi di neuroni, durante tutta la vita umana. Questa scoperta ha indotto a ipotizzare di poter riparare danni al cervello adulto tramite
“riattivazione” delle CSN residenti. Le CSN possono essere anche coltivate in vitro; esponendole agli stimoli che normalmente le
programmano durante l’embriogenesi, si sono ottenuti neuroni potenzialmente utilizzabili in terapie di trapianto.