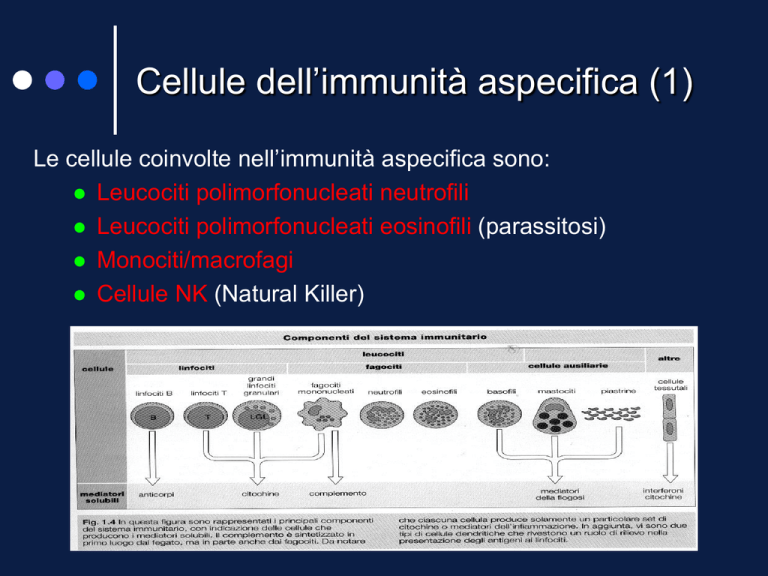
Cellule dell’immunità aspecifica (1)
Le cellule coinvolte nell’immunità aspecifica sono:
Leucociti polimorfonucleati neutrofili
Leucociti polimorfonucleati eosinofili (parassitosi)
Monociti/macrofagi
Cellule NK (Natural Killer)
Cellule dell’immunità aspecifica (2)
Polimorfonucleati e Monociti/Macrofagi – presenti nel sangue,
sono attivati da specifiche citochine ed esplicano la loro
azione attraverso
Fagocitosi
Uccisione dei microrganismi
Interconnessione con l’immunità specifica
Produzione di citochine
Cellule Natural Killer (NK) – sono linfociti a grandi granuli che,
stimolati da alcune citochine (IFN-a, IFN-b, IFN-g, IL-2 e IL12), sono capaci di riconoscere e uccidere cellule infettate da
virus e cellule neoplastiche. Esse agiscono sulle cellule
bersaglio attraverso molecole da esse secrete quali il TNF
(tumor necrosis factor) e le perforine.
Interferoni
Sono citochine sintetizzate e secrete, principalmente ma non
esclusivamente, da cellule infettate da virus e coinvolte nella
risposta immunitaria.
Si conoscono 3 IFN (a,b, g):
Gli IFN agiscono con meccanismo autocrino e paracrino sulle
cellule infettate da un virus inducendo la produzione di
molecole che bloccano la replicazione del virus.
Gli IFN agiscono inoltre come attivatori delle cellule NK e dei
macrofagi.
Sono inoltre prodotti dai linfociti B e T e favoriscono la risposta
immune di tipo specifico.
Il Sistema del Complemento
Il sistema del complemento insieme agli altri fattori umorali descritti (citochine)
completa la componente umorale dell’immunità aspecifica.
E’ costituito da una serie di fattori proteici, presenti nel sangue e attivati, con un
meccanismo a cascata (cascata enzimatica), attraverso 3 vie:
via classica – attivata da complessi antigene-anticorpo (immunità
specifica)
via alternativa – attivata dal contatto
polisaccaridica (endotossine batteriche)
via della lectina - attivata dal legame della lectina plasmatica legante il
mannosio a carboidrati presenti sui microrganismi.
con
sostanze
di
natura
Il risultato finale è la formazione del complesso di attacco sulla superficie del
microrganismo (ma anche su cellule dello stesso organismo) che induce la lisi
cellulare.
I fattori liberatisi nel corso dell’attivazione del sistema del complemento agiscono
anche da fattori stimolanti la reazione infiammatoria.
Fattori della Immunità Specifica
Rappresentano il terzo livello di difesa dell’organismo e si caratterizzano
per la maggiore specificità di azione in quanto diretti alla distruzione di uno
specifico microrganismo.
Caratteristico è il rafforzamento della risposta ad un determinato agente
patogeno nel caso di una seconda infezione che esprime l’esistenza di una
memoria immunologica.
Anche nel caso della risposta immune specifica intervengono fattori
Cellulari – principalmente rappresentati dai linfociti
Umorali – principalmente rappresentati dagli anticorpi
Di fatto la risposta umorale e cellulo-mediata concorrono a determinare in
maniera sinergica l’efficacia della risposta immunologica.
Antigeni
Il termine antigene (Ag) è stato introdotto per indicare quelle sostanze in
grado di indurre la sintesi di anticorpi (antibody generator) da parte dei
linfociti B.
Attualmente questo termine è utilizzato per definire tutte le molecole (di
natura proteica, polipeptidica o polisaccaridica), che possono essere
riconosciute dagli elementi del sistema immunitario responsabili
dell’immunità acquisita.
Gli antigeni di una certa complessità possono presentare più
epitopi o determinanti antigenici.
L’epitopo è la porzione dell’antigene che direttamente lega l’anticorpo e i
recettori per l’antigene che intervengono nell’attivazione delle cellule
coinvolte nella risposta immune specifica.
L’antigene è di fatto l’elemento attivante la complessa serie di eventi che
caratterizza la risposta immune specifica: eliminato l’antigene, cessa
l’azione del sistema immune
Organi linfoidi primari e secondari
Gli organi linfoidi primari, in cui avviene la formazione e/o
maturazione dei linfociti sono (nell’uomo):
Midollo osseo
Timo
I linfociti si originano nel midollo osseo da cellule staminali
pluripotenti emopoietiche da cui si originano gli elementi della serie
bianca del sangue e quindi anche i linfociti B e T.
Gli organi linfoidi secondari o periferici (linfonodi, milza, tonsille,
agglomerati linfoidi delle mucose dell’app. respiratorio e digerente)
sono distribuiti in diversi distretti dell’organismo e contengono oltre
ai macrofagi, linfociti B e T che qui stazionano temporaneamente.
Linfonodo
Negli org. Linfoidi secondari avviene il riconoscimento e l’attivazione dei linfociti ad opera degli
antigeni.
I linfonodi svolgono un ruolo di filtro per gli antigeni estranei e per molti patogeni.
C’è un continuo ricircolo di Linfociti B e T che dai capillari sanguigni raggiungono aree distinte
(corticale e paracorticale).
Sono presenti cellule accessorie (macrofagi e cellule dendritiche) che mediano il riconoscimento
dell’antigene da parte dei linfociti T.
L’attivazione e proliferazione dei linfociti determina un ingrossamento del linfonodo (attivazione
dei centri germinativi).
Linfociti B
Si formano e maturano nel midollo osseo da cui passano nel
sangue e negli organi linfoidi secondari.
Costituiscono circa il 10% dei linfociti del sangue periferico.
I linfociti B sono le uniche cellule in grado di produrre anticorpi
(Ab) e quindi mediano l’immunità umorale.
Essi esprimono sulla loro superficie recettori per l’antigene (B
cell receptor – BCR), costituiti da una Ig di classe M (IgM) e da
2 molecole accessorie Iga e Igb che concorrono alla
trasduzione del segnale, determinando l’attivazione del linfocita
che si trasforma in plasmacellula capace di produrre
attivamente e secernere, liberandoli nel sangue anticorpi
specifici per quel determinato antigene.
Linfociti T
Si formano nel midollo osseo e, ancora indifferenziati (preT) raggiungono il
Timo dove completano il loro processo maturativo.
Sono Liberati nel sangue e raggiungono gli organi linfoidi secondari.
Costituisono circa il 60-70% dei linfociti del sangue periferico ed intervengono
nell’immunità cellulare.
Essi esprimono sulla loro superficie recettori per l’antigene (T cell receptor –
TCR), formato da 2 catene a e b (più raramente g e d) a cui si assoccia un
morcatore comune CD3 che fa parte del complesso recettoriale.
Si distinguono in due sottopopolazioni principali:
• Linfociti T helper (TH) – caratterizzati dalla presenza sulla loro superficie
della molecola CD4 (quindi CD4+) e che presiedono alla regolazione della
risposta immune attraverso una serie di citochine da essi prodotte e che
agiscono su altre cellule coinvolte nella risposta immune.
• Linfociti T citotossici (CTL) – caratterizzati dalla presenza sulla loro
superficie della molecola CD8 (quindi CD8+) e che presiedono alla risposta
immune specifica cellulo-mediata, esercitando una azione tossica sulle
cellule con cui interagiscono.
Le molecole CD (Cluster Designation) sono molecole di superficie espresse dai
linfociti che sono state nel tempo caratterizzate in numero sempre crescente e
che consentono di tipizzare le numerose sottopopolazioni linfocitarie
caratterizzate.
Riconoscimento dell’antigene
Il nostro repertorio immunologico si stima sia pari a circa 109-1011 specificità
diverse.
Le molecole in grado di legare l’antigene presenti sui linfociti sono:
Anticorpi o immunoglobuline, che legati in superficie costituiscono il BCR
Il recettore per l’antigene dei linfociti T (TCR)
Molecole del complesso maggiore di istocompatibilità (MHC) che legano
peptidi antigenici da presentare ai linfociti T
I domini globulinici delle catene pesanti e leggere degli Ab e del TCR sono
formati da domini variabili (V) e domini costanti (C)
Domini V – responsabili della specificità di legame all’antigene
Domini C – responsabili della risposta effettrice
Vengono prodotti durante la maturazione linfocitaria attraverso un meccanismo
di riarrangiamento genico (ricombinazione somatica).
Alcune ricombinasi specifiche dei linfociti (Rag1 e Rag2) intervengono in
questo processo.
Attivazione dei Linfociti B
I linfociti B sono attivati dall’antigene, proliferano e si espandono clonalmente e
si differenziano in plasmacellule secernenti Ab capaci di eliminare l’antigene
estraneo.
I linfociti B maturi che non hanno ancora incontrato l’antigene si dicono “vergini”
(naive).
I linfociti B sono in grado di riconoscere antigeni nativi, cioè non modificati da
altre cellule (processamento dell’antigene per i linfociti T)
L’attivazione del linfocita B si traduce nella sua attivazione funzionale:
Ingresso in G1 ed espansione clonale
Differenziazione in plasmacellule secernenti Ab con la stessa specificità per
l’antigene.
Risposta primaria con produzione di IgM, successivamente con produzione
di IgG (scambio idiotipico)
Eliminato l’antigene alcuni linfociti B (linfociti di lunga vita) continuano a
produrre Ab, altri si differenziano in cellule della memoria.
Le Immunoglobuline (1)
Le immunoglobuline (Ig) sono glicoproteine costituite da due catene
pesanti (H) e due catene leggere (L) tenute insieme da ponti disolfuro. In
esse si riconosce una porzione che interagisce con l’antigene (frammento
Fab fragment antigen binding) e una porzione (frammento Fc
c=cristallizzabile) che interagisce con specifici recettori presenti su cellule
coinvolte nella risposta immune e nell’infiammazione.
Le Ig sono suddivise in 5 classi sulla base della struttura delle catene
pesanti di cui esistono 5 tipi fondamentali (a, d, e, g, m):
IgA – il 10-15% di tutte le immunoglobuline, si localizzano
preferenzialmente sulle mucose dove esercitano la loro azione
antinfettiva.
IgD – sono meno dell’1% delle Ig totali, sono presenti sulla superficie
dei linfociti B (come recettori per l’antigene).
IgE – concentrazione molto bassa nel siero; esse intervengono nelle
infestioni da elminti e sono responsabili di reazioni di ipersensibilità di
tipo I (allergia, shock anafilattico).
Le Immunoglobuline (2)
IgG – sono le più numerose (75-80%) con distribuzione intraed extra-vasale. Hanno un ruolo essenziale nella risposta
secondaria e sono le uniche con funzione di antitossina. Le
IgG materne conferiscono immunità ai neonati nei primi mesi
di vita.
IgM – sono circa il 10% e localizzazione prevalente intravasale. Costituiscono il BCR. Rappresentano le Ig precoci
prevalenti nelle risposte immunitarie conseguenti al primo
contatto con microrganismi antigenicamente complessi.
Le Ig sono molto efficaci, da sole o attraverso l’attivazione del
complemento nel determinare la lisi dei microrganismi o
nell’inattivare esotossine. Legandosi ad antigeni di superficie o ad
antigeni virali esposti sulla superficie delle cellule infettate inducono
il fenomeno dell’opsonizzazione favorendo l’intervento di fagociti e
linfociti T citotossici.
Attivazione dei linfociti T
Il recettore per l’antigene TCR è in grado di riconoscere solo
antigeni proteici legati a molecole MHC di classe I (Linfociti T
CD8+) e II (linfociti T CD4+) localizzate sulla superficie di cellule
APC (antigen presenting cells) che processano l’antigene
riducendolo a brevi sequenze peptidiche.
Complesso maggiore di
Istocompatibilità (MHC)
Un insieme di geni che codificano per glicoproteine espresse sulla superficie cellulare.
Il loro ruolo è quello di legare frammenti peptidici di antigeni estranei e presentarli ai
linfociti T.
Nell’uomo si parla di geni dell’HLA (Human Leukocyte Antigen) localizzati a 6p21.3:
Il locus HLA include due classi di geni altamente polimorfi:
Classe I – include i loci HLA-A, HLAB, HLA-C
Classe II – include i loci HLA-DP, HLA-DQ, HLA-DR
Esistono circa 9000 alleli diversi per i loci HLA
I geni di classe I e II sono espressi in maniera codominante.
L’aplotipo HLA è di fatto specifico di ciascun individuo.
Molecole MHC (1)
Le MHC di classe I sono espresse su
tutte le cellule nucleate e le piastrine.
Sono eterodimeri costituita da una
catena
pesante
a
altamente
polimorfica ed una catena leggera b2microglobulina (non codificata da geni
MHC).
Riconoscono
peptidi
di
origine
endogena (es. cellule infettate da
virus)
Presentano un domini di interazione
con il CD8 presente sui linfociti T
citotossici (CTL)
Molecole MHC (2)
Le MHC di classe II sono eterodimeri
costituiti da 2 catene transmembrana
a e b altamente polimorfe.
Riconoscono peptidi di circa 30 aa.
Che derivano da antigeni esogeni in
grado di indurre una specifica risposta
immunitaria solo se processati da
cellule APC
Presentano un dominio (b2) di
interazione con il CD4 presente sui
linfociti T helper.
Cellule presentanti l’antigene (APC)
Per l’attivazione dei linfociti T vergini è necessario che l’antigene sia
trasportato agli org. linfoidi secondari e opportunamente processato
da cellule APC.
Le cellule dendritiche sono APC specializzate ma altre cellule
(macrofagi e linfociti B) possono svolgere la stessa funzione.
Macrofagi che hanno fagocitato il patogeno ed esprimono MHCII
possono presentare l’antigene a linfociti T CD4+
Linfociti B attivati possono internalizzare e processare l’antigene
associato a molecole MHC II, stimolando l’attività di linfociti T
CD4+
Tutte le cellule nucleate possono processare e presentare peptidi
endogeni associati a molecole MHC I, attivando linfociti T CD8+
Linfociti T helper CD4+
Svolgono un ruolo essenziale nell’attivazione di tutti i linfociti,
producendo un’ampia varietà di citochine che regolano la risposta
immunitaria.
Il principale fattore di crescita, sopravvivenza e differenziamento dei
linfociti T è IL-2 (la ciclosporina inibisce la sintesi di IL-2 prevenendo
il rigetto nei trapianti).
Si differenziano 2 principali sottopopolazioni TH1 e TH2 che
differiscono per citochine prodotte e funzioni.
La differenziazione in TH1 è indotta da IL-12 e INFg prodotti da
cellule dendritiche, macrofagi e cellule NK in risposta a patogeni
intracellulari e virus. Promuovono la fagocitosi e l’eliminazione
dell’antigene.
La differenziazione in TH2 è indotta da IL-4 prodotta da mastociti
ed altri leucociti in risposta ad elminti o allergeni.
Linfociti T citotossici CD8+
Intervengono nell’eliminazione di
cellule
bersaglio
presentanti
l’antigene.
Si differenziano a seguito di un
doppio stimolo:
Riconoscimento
specifico
dell’antigene
complessato
a
molecole MHC I
Costimolazione
da parte di
citochine prodotte dai linfociti T
helper CD4+ (TH1).
L’attività citotossica è dipendente
dall’azione di sostanze (perforine,
granzini) accumulate in granuli
all’interno della cellula.
Tolleranza Immunologica
La tolleranza immunologica è espressione della distruzione/inattivazione
programmata dei linfociti capaci di riconoscere i costituenti propri
dell’organismo (antigeni self), rendendo possibile la distinzione tra self e
non-self.
Questa selezione si realizza nel corso del processo di maturazione dei
linfociti T e B.
Organi linfoidi primari – per il linfociti B e T immaturi (Tolleranza centrale)
E’ un processo di selezione negativa o delezione clonale dei linfociti
reattivi per antigeni self .
Organi Linfoidi periferici – per i linfociti maturi (Tolleranza periferica)
I linfociti autoreattivi che sfuggono ai processi di delezione timica e
midollare sono controllati a livello periferico:
• Delezione clonale
• Anergia
• Soppressione funzionale
Infiammazione
L’infiammazione (o flogosi) è l’insieme delle modificazioni che si verificano
in un distretto dell’organismo colpito da un danno.
Il danno può essere causato da:
agenti fisici (traumi, calore etc.)
agenti chimici (acidi, basi, sostanze tossiche)
agenti biologici (batteri, virus, parassiti)
La risposta al danno si sviluppa apparentemente sempre con le stesse
modalità.
L’infiammazione è intesa principalmente come un fenomeno locale, tuttavia
diverse molecole prodotte da cellule che partecipano alla flogosi possono,
attraverso il sangue, agire a distanza:
il fegato (epatocita) è stimolato a produrre altre molecole che
intervengono nella risposta di fase acuta
febbre
leucocitosi
L’infiammazione è finalizzata a circoscrivere, neutralizzare, distruggere ed
eliminare agenti o prodotti del danno tissutale, ripristinando la condizione
preesistente.
Sintomi dell’infiammazione
I segni più importanti sono (Auro Cornelio Celso, 30a.C.-38d.C.):
Calor – Aumento della temperatura locale
Tumor – Gonfiore locale
Rubor – Arrossamento locale
Dolor – Indolenzimento locale
Functio lesa – compromissione della funzione (Galeno 130-200d.C.)
Essi dipendono principalmente da cambiamenti che coinvolgono il sistema
dei capillari e le cellule ematiche, indotti da una serie di molecole
(mediatori chimici della flogosi) liberate da diversi tipi di cellule.
Si possono distinguere:
Infiammazione acuta (o angioflogosi) – con prevalenza di fenomeni
vasculo-ematici;
Infiammazione cronica (o istoflogosi) – con prevalenza di fenomeni
tissutali dipendenti dalla migrazioni di cellule (monociti e linfociti), dal
sangue al focolaio infiammatorio.
Infiammazione acuta (angioflogosi)
E’ caratterizzata da fenomeni che interessano principalmente
il microcircolo.
Il microcircolo è la porzione più periferica del sistema
circolatorio in cui le arteriole si sfioccano nei capillari da cui si
originano poi le venule.
Quando lo stimolo flogogeno interessa una qualsiasi area
dell’organismo, alcune cellule muoiono o sono danneggiate, I
detriti amplificano l’effetto flogogeno e, in risposta ad esso, si
attivano una serie di eventi che costituiscono le fasi del
processo infiammatorio acuto.
Infiammazione acuta: modificazioni
del microcircolo (1)
Sequenzialmente si osserva:
Vasocostrizione – (10-20 secondi) è mediata dal simpatico (s.n. vegetativo) e
può anche non presentarsi. Non è essenziale nel processo infiammatorio.
Vasodilatazione – provocata dal rilassamento delle fibrocellule muscolari lisce
della parete delle arteriole.
Iperemia attiva – determinata da:
• Dilatazione delle arteriole con maggior afflusso di sangue nel microcircolo.
• Cedimento degli sfinteri precapillari.
Iperemia Passiva – indotta dal rallentamento del flusso di sangue nel
microcircolo per:
• Aumento della superficie del letto circolatorio per cedimento degli sfinteri
precapillari.
• Aumento della viscosità del sangue (aggregazione dei globuli rossi e perdita
di liquido attraverso le giunzioni tra le cellule endoteliali).
• Marginazione dei leucociti (aderiscono alla parete endoteliale per azione di
mediatori chimici e molecole di adesione espresse sulla superficie delle
cellule endoteliali).
Infiammazione acuta: modificazioni
del microcircolo (2)
Diapedesi dei leucociti – le cellule migrano dal sangue nel distretto
extravasale richiamate da fattori chemiotattici sintetizzati o liberati dalle
cellule o dai microrganismi, o anche presenti nel sangue (componenti
del sistema del complemento).
Formazione dell’essudato – la componente liquida del sangue tende a
passare in sede extravasale a causa dell’insufficiente flusso ematico e
per la presenza di una ridotta concentrazione di proteine plasmatiche
che si accumulano nel tessuto richiamando altri liquidi dal sangue
(gradiente oncotico). Si ha quindi l’edema.
Fagocitosi – diversi elementi cellulari intervengono per eliminare i
detriti dei microrganismi o delle cellule morte presenti nel focolaio
infiammatorio.
L’evoluzione sarà
infiammatorio.
la
risoluzione
o
cronicizzazione
del
processo












