ANALISI
CITOFLUORIMETRICA
E SUE APPLICAZIONI IN
AMBITO BIOMEDICO
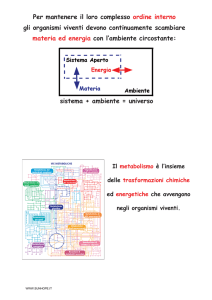
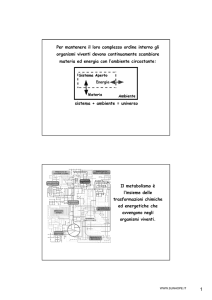
Cos’è la CITOMETRIA A FLUSSO?
• Citometria si riferisce alla misura di caratteristiche chimico-fisiche di cellule o
di altre particelle biologiche.
• Citometria a flusso è una tecnica di misurazione multiparametrica di
caratteristiche fisiche e/o chimiche condotta su cellule in sospensione
all’interno di un fluido di trasporto.
• FACS - Fluorescence Activated Cell Sorting
È la citometria a flusso con la capacità aggiuntiva di separare e raccogliere le
cellule con una serie di caratteristiche meccaniche ed elettriche.
WWW.SUNHOPE.IT
1
Definizione
CITOFLUORIMETRIA o CITOMETRIA A FLUSSO
Metodica di laboratorio che permette un’analisi automatica di
sospensioni cellulari monodisperse
misurando le caratteristiche citologiche e/o biochimiche
all’interno di un flusso laminare
che interseca una sorgente luminosa, acquisendo e memorizzando piu’
parametri (volume, granulosita’, fluorescenza) per ogni cellula acquisita
WWW.SUNHOPE.IT
2
Un po’ di storia
La comparsa della citofluorimetria a flusso (CFM) avviene intorno
agli anni 70, determinando un veloce ed intenso sviluppo delle
tecniche istologiche e citochimiche. Inizialmente era limitata alla
misura di 1-2 parametri: uno per le misure fisiche e l’altro per la
fluorescenza.
La CFM porto’ grande impulso allo studio del sistema immunitario,
grazie all’utilizzo di anticorpi monoclonali marcati con fluoresceina
(FITC). La grande complessita’ del sistema immunitario e la presenza
di diverse subpopolazioni che reagivano con lo stesso anticorpo
stimolarono:
lo sviluppo di MoAb sempre piu’ specifici;
la ricerca di nuovi coloranti fluorescenti da coniugare agli anticorpi;
la creazione di citofluorimetri a flusso multiparametrici
I PRIMI PROBLEMI…..
• trovare coloranti che potevano essere coniugati agli Ab senza
modificare la loro capacita’ di legame all’antigene;
• selezionare fluorocromi con spettri distinti di emissione.
E LE SOLUZIONI!!!
un punto di svolta nella CFM fu lo sviluppo di coloranti come le
ficobiliproteine, fluorocromi naturali solubili in acqua, fluorescenti a
pH neutro, facilmente coniugabili con MoAb, con elevate rese
quantiche.
Ficoeritrina (PE): viene eccitata dalla stessa lunghezza d’onda del
FITC (488 nm), quindi possono essere usati insieme per realizzare un
sistema di rilevazione molto sensibile in doppia marcatura.
WWW.SUNHOPE.IT
3
Citofluorimetria a flusso oggi
Negli ultimi anni la CFM ha raggiunto una notevole diffusione, sia in
laboratori clinici che in laboratori di ricerca.
Fattori che hanno contribuito a questo notevole sviluppo:
la possibilita’ di utilizzare piu’ laser di emissione, che permette di
effettuare analisi multiparametriche a 4 e piu’ colori;
la disponibilita’ di MoAb marcati con un’ampia gamma di
fluorocromi e diretti contro una larghissima varieta’ di Ag di
membrana e/o intracellulari;
la riduzione dei costi e della complessita’ nell’utilizzo dello
strumento.
APPLICAZIONI
Permette di analizzare un elevato numero di cellule in breve tempo (50.000
cellule in pochi secondi), quantificando numerosi parametri per ogni singola
cellula.
Permette ad es. di determinare il contenuto di DNA, i diversi sottotipi
cellulari, gli organelli intracellulari, l’attivita’ di alcuni enzimi.
Studio della ploidia e della proliferazione cellulare;
Analisi del ciclo cellulare;
Analisi immunofenotipica multiparametrica;
Risposta del sistema immunitario alla somministrazione di vaccini (cellule
antigene specifiche, produzione di citochine, ecc);
Livelli di apoptosi in patologie associate a deplezione cellulare (es AIDS)
o accumulo cellulare (tumori);
ecc ecc!!!!!
WWW.SUNHOPE.IT
4
COME FUNZIONA UN CITOFLUORIMETRO?
1) Le cellule di una popolazione eterogenea
vengono aspirate dalla provetta e immesse in un
sistema fluidico il quale tende, in opportune
condizioni idrodinamiche, a trasportare le cellule
in maniera separata e ordinata fino al punto di
misura.
2) Ogni singola cellula viene poi attraversata da un
fascio di luce che eccita i fluorocromi e determina
l’emissione di un segnale fluorescente
3) Il segnale passando attraverso un sistema lenti,
specchi e filtri ottici, viene inviato ai sensori
(fotodiodi e fotomoltiplicatori) che ne misurano
l’intensita’.
4) I segnali elettrici provenienti da ogni
sensore,opportunamente
amplificati
vengono
quindi processati e digitalizzati, sono inviati ad un
analizzatore, che elabora il dato e lo visualizza
tramite un grafico.
5) Attraverso piastre di deflessione le cellule
analizzate possono essere raccolte separatamente
tramite un processo definito “sorting”.
Componenti di un citofluorimetro a flusso
• Sistema fluidico (focalizzazione idrodinamica)
• Sistema ottico (laser Argon 488nm)
• Sistema elettronico (software CellQuest)
WWW.SUNHOPE.IT
5
Sistema Fluidico
Il sistema di dispersione del
campione liquido fornisce un
efficiente mezzo in grado di
presentare individualmente le
cellule del campione alla stazione
di misura, dove intersecano il
raggio di luce emesso dal laser. E’
importante evitare la formazione
di aggregati cellulari.
La velocita’ di efflusso delle cellule
viene valutata come numero di
eventi al secondo: numero di
particelle che hanno incontrato il
raggio di luce nell’unita’ di tempo.
La sospensione cellulare viene spinta con pressione all’interno della camera di
flusso, dove le cellule vengono messe in fila una dietro l’altra, grazie alla
differenza di pressione tra il campione e il fluido di trasporto. Si realizza così un
flusso
laminare
concentrico
di
liquidi
(FOCALIZZAZIONE
IDRODINAMICA) in cui il più esterno (liquido di trascinamento) trasporta
all’interno una sottile vena fluida di campione. Le cellule sono così forzate ad
allinearsi ed attraversare individualmente un punto di misura interagendo con il
fascio di luce del sistema di eccitazione. La pressione di spinta e la diluizione del
campione consentono di contare fino a qualche migliaia di cellule al secondo.
WWW.SUNHOPE.IT
6
Le cellule così disposte passano davanti al raggio laser di forma ellittica,
focalizzato in modo da colpire le cellule al centro del canale di conta
formato dal liquido di trasporto.
Sistema Ottico
Sorgenti luminose
Nella grande maggioranza dei citofluorimetri si utilizza una sorgente
luminosa a ioni Argon centrata su una lunghezza d’onda di 488 nm (blu).
Tale luce consente una efficace misura dei parametri fisici, inoltre permette
la contemporanea eccitazione di diversi fluorocromi.
Se e’ necessario utilizzare altre lunghezze d’onda bisogna utilizzare altri tipi
di laser (es Kripton, Elio Neon, ecc)
I laser hanno costi molto elevati!!!
Un’alternativa piu’ economica e’ costituita dall’uso dei citometri a lampada,
che hanno come fonte di eccitazione una lampada a vapori di Mercurio o
Xenon che non richiede particolari sistemi di raffreddamento. Sono utili per
le applicazioni che riguardano particolari fluorocromi (es quelli utilizzati per
la marcatura del DNA).
LIMITI: bassa potenza erogata, scarsa stabilita’ della luce di emissione,
rapido decadimento
WWW.SUNHOPE.IT
7
Proprietà del Laser
Radiazione coerente a discrete lunghezze d’onda.
Sorgenti più comuni:
Ione Argon.
•UV 350/364 nm
•Visible 458 465 472 488 496 502 515 nm
Ione Krypton.
•UV 350/356 nm
•Visible 468 476 482 520 530 568 647 676 nm
Helium/Neon 633 nm
[email protected]
Dall’interazione delle cellule con il raggio luminoso del sistema di
eccitazione, vengono generati dei segnali dipendenti dalle caratteristiche
fisiche e dalla presenza di marcatori fluorescenti sulla superficie, nel
citoplasma o nel nucleo della cellula.
Light scattering :
I due segnali che permettono di identificare le caratteristiche fisiche
delle popolazioni cellulari sono correlabili alle dimensioni delle
cellule. Se si osserva una cellula in controluce, si misura un segnale
legato alla diffrazione (scatter) che è in relazione al diametro cellulare
(FORWARD SCATTER O SCATTER LINEARE = FSC)
Rifrazione & Riflessione:
proporzionale alla
granularità cellulare e
alla complessità rilevate a
90° rispetto la luce
incidente
Diffrazione:
proporzionale all’area
della cellula rilevata
lungo l’asse della luce
incidente 0°
Se ci si pone ortogonalmente al fascio, si misura un segnale legato
sostanzialmente alla riflessione e alla rifrazione (SIDE SCATTER O
SCATTER A 90 = SSC) dovute alla granulosità cellulare, al rapporto n/c e alla
irregolarità della superficie cellulare.
WWW.SUNHOPE.IT
8
RICAPITOLANDO:
Il Forward scatter distingue le cellule sulla base del volume
ed è anche in grado di distinguere cellule vive da morte.
Il Side scatter tende ad essere più sensibile rispetto alle
inclusioni all’interno della cellula e può essere usato per
distinguere le cellule granulate dalle non-granulate.
FSC e SSC rappresentano i parametri fisici.
Raggruppandoli in un unico grafico se ne ottiene uno
biparametrico, il Citogramma:
diagramma bidimensionale ottenuto dalla combinazione di questi due tipi
di segnale. Permette di discriminare tra diverse popolazioni cellulari
basandosi solamente sulle loro caratteristiche fisiche.
Grafici monoparametrici
(istogrammi)
Citogramma
WWW.SUNHOPE.IT
9
Componenti di un citofluorimetro a flusso
Segnali di fluorescenza: in citofluorimetria vengono rilevati segnali
fluorescenti generati:
• dall’utilizzo di MoAb marcati con fluorocromi (FITC, PE, PerCp, APC, ecc)
specifici per antigeni presenti sulla membrana, nel citoplasma, nel nucleo;
• da fluorocromi che si legano in maniera stechiometrica a determinate
sostanze come il DNA e l’RNA.
Ogni fluorocromo presenta una caratteristica lunghezza d’onda per
l’eccitazione e l’emissione.
Limiti alla scelta di fluorocromi da utilizzare in combinazione:
• La lunghezza d’onda di eccitazione
• Le bande di emissione devono essere sufficientemente separate da
permettere la loro appropriata misurazione.
FLUOROCROMI
La fluorescenza e’ il fenomeno per cui una molecola colpita da una
radiazione luminosa di definita ne emette un’altra a maggiore (effetto
Bohr).
Ogni fluorocromo presenta una caratteristica per l’eccitazione e per
l’emissione.
Se utilizziamo piu’ fluorocromi nello stesso protocollo sperimentale, le loro
emissioni devono essere sufficientemente distanti per poter essere selezionate
in modo distinto, ciascuna da un Fotomoltiplicatore.
L’intensita’ della fluorescenza emessa è proporzionale al numero di siti di
legame.
WWW.SUNHOPE.IT
10
Con l’utilizzo degli anticorpi coniugati a Fluorocromi (e. Isotiocianato di
fluoresceina: FITC, FICOERITRINA (PE), etc:) ed il Citofluorimetro,
sono stati identificati numerosi determinanti antigenici di superficie che
permettono di differenziare sia i vari tipi di cellule che il loro stadio di
maturazione
Come lavorano i fluorocromi?
• Un laser eccita il fluorocromo
• il fluorocromo eccitato sale nel livello successivo della nuvola elettronica
• il fluorocromo ritorna al livello originale e rilascia l’energia in eccesso come
fotone
• i fotoni emettono a lunghezze d’onda maggiori rispetto a quelle a cui
vengono eccitati
Fluorocromi diversi hanno lunghezze d’onda diverse
L’eccitazione proviene dal laser. Ci sono 4 diverse opzioni: 488nm Blue, 633nm
Red, 405nm violet, 350nm UV.
Usando filtri e specchi è possibile separare le diverse lunghezze d’onda ed
inviarle a diversi detectors
WWW.SUNHOPE.IT
11
In caso di impiego di più di una sostanza fluorescente, le diverse emissioni
di colore vengono separate attraverso un sistema di filtri ottici, in modo
da poter analizzare separatamente tutte le diverse fluorescenze (FL1,
FL2, FL3, FL4).
I segnali emessi vengono raccolti da un sistema di lenti, specchi e filtri ottici ed
inviati ai relativi sensori (fotodiodi e Fotomoltiplicatori) che trasformano i
segnali luminosi in impulsi elettrici direttamente proporzionali alla luce raccolta
(ampiezza del segnale). Vengono poi digitalizzati ed inviati ad un elaboratore che
provvede alla loro definizione statistica.
Sistema Elettronico
Sistema di conversione ed elaborazione digitale
Ogni singolo valore proveniente dai sensori,
viene amplificato e convertito, costituendo cosi’ il
“quanto citometrico” o evento. Tutti gli eventi
relativi all’insieme dei dati misurati si
accumulano nei canali che ne rappresentano la
distribuzione dei valori.
Il modo piu’ semplice di rappresentare una
correlazione tra due parametri è il diagramma
di dispersione a due punti (dot plot),nel quale
ogni punto rappresenta un singolo evento o un
insieme di eventi dotati di un definito valore per
ciascuno dei due parametri considerati.
WWW.SUNHOPE.IT
12
Elementi fotoelettronici di base di un FACS
Fotomoltiplicatori FSC
trasformano il
segnale in voltaggi
SSC
Amplificazione e linear linear
trasformazione log
se richiesta
Digitalizzati su una
scala discreta
FL1
log
FL2
log
FL3
linear
0-255 (un byte) per la maggior parte
0-1023 per risoluzioni superiori (i.e. DNA).
Elencate e visualizzate ‘Header’ contiene informazioni riguardanti
come Flow Cytometry l’esperimento ed il settaggio del citometro.
Standard ( FCS )
I dati correlati sono registrati per singola cellula
Files
elencata per tutti I parametri selezionati.
[email protected]
File Size
header+cells x
(parameters x bytes).
Rappresentazione dei dati
Esistono diversi modi per rappresentare un dato citofluorimetico. La
rappresentazione piu’ semplice e’ costituita dall’istogramma dove
l’ascissa riporta l’intensita’ di fluorescenza e l’ordinata il numero di
cellule che esprimono o meno l’antigene (diagramma di distribuzione).
L’analisi
statistica
si
basa
sull’impostazione di cursori che
delimitano le aree di interesse, e
sulla quantificazione degli eventi
cellulari che rientrano in tali aree
(la % di cellule è determinata con
una funzione integrale- area sottesa
dalla curva). Per ogni picco e’
possibile calcolare dati statistici
(valore medio, deviazione standard,
coefficiente di variazione, ecc)
WWW.SUNHOPE.IT
13
Rappresentazione bidimensionale
Oltre all’istogramma, e’ possibile utilizzare una serie di
rappresentazioni bidimensionali, che permettono di mettere in
correlazione due parametri tra di loro.
Dot-plot:
ogni singolo punto rappresenta un evento
Contour-plot:
Visualizzano aree aventi la stessa densita’
mediante linee concentriche
CD8-/CD4+
CD8+/CD4-
CD8-/CD4-
Si possono utlizzare altre rappresentazioni dove l’intensita’ del
colore e’ proporzionale alla densita’ degli eventi
WWW.SUNHOPE.IT
14
Campione : cellule ematiche periferiche dopo lisi emzie.
Dati raccolti su 10000 cellule.
Dot
Density
Contour
Horizontal : low angle scatter. Vertical : high angle scatter.
[email protected]
VANTAGGI dell’ANALISI
citofluorimetrica :
• multiparametricità
• possibilità di mettere in relazione più caratteristiche
della stessa cellula
• analisi di grandi quantità di cellule
• riproducibilità ed affidabilità statistica delle
acquisizioni
• grande sensibilità
• rapidità di analisi
• possibilità di ulteriori analisi a posteriori
WWW.SUNHOPE.IT
15
Limitazioni dell’ANALISI
citofluorimetrica :
• nella necessita’ di impiegare sospensioni monocellulari,
• nei costi,
• nella relativa complessità della strumentazione che
richiede un addestramento estensivo del personale ed
accurata manutenzione.
• Nessun citofluorimetro a flusso potrà dare buoni
risultati da cattivi campioni, e questo fondamentale
aspetto preanalitico dipende dallo scrupolo
dell’operatore e dalla sua capacità di valutare anche
visivamente la qualità di un preparato cellulare o di una
marcatura.
Applicazioni
1. determinazione
dei
marcatori
di
differenziamento cellulare, di superficie,
intracitoplasmatici e intranucleari
2. valutazione del contenuto cellulare di DNA
3. discriminazione tra cellule vive, cellule
apoptotiche e necrotiche
4. predisposizione per la separazione cellulare
5. Macchina per l’emocromo-> un citofluorimetro
a basso costo predisposto alla lettura degli
elementi corpuscolati del sangue.
WWW.SUNHOPE.IT
16
Una delle principali applicazioni cliniche e sperimentali
della Citofluorimetria riguarda l’immunofenotipizzazione
linfocitaria che consiste nell’utilizzazione di anticorpi
specifici diretti verso i vari marcatori di membrana CD
(Cluster Of Differentiation) al fine di differenziare,
all’interno di un pool di linfociti, le diverse
sottopopolazioni.
I linfociti infatti, morfologicamente indistinguibili tra
loro, sono costituiti da diverse sottopolazioni con ruoli
specifici nella risposta immunitaria, le quali hanno pero’
diverse espressioni antigeniche.
Nelle patologie coinvolgenti il sistema immunitario,
ritroviamo caratteristiche alterazioni dei rapporti tra le
sottopolazioni linfocitarie, che possono essere riconosciute
grazie alla loro Tipizzazione citofluorimetrica.
Tipi di cellule
• Immunofluorescenza
• Antigene specifico
• Reporters genetici
– FACS Gal
– FISH
– GFP
WWW.SUNHOPE.IT
17
• Immunofluorescence
• Antigene specifico
• Reporters genetici
– FACS Gal
– FISH
– GFP
• Immunofluorescence
• Specific antigen
• Genetic reporters
– FACS Gal
– FISH
– GFP
WWW.SUNHOPE.IT
18
Stadi: Quiescenza, Attività,
Apoptosi
•
•
•
•
•
•
DNA Totale: ciclo cellulare
Sintesi di RNA
Mitocondri
Ca++ Intracellulare
pH Intracellulare
Esposizione di fosfatidilserina
G0/1
S G2/M
Apoptosi: Annexin-V + PI
Dead Cells
Viable Cells
Late
Apoptosis
Early
Apoptosis
Ref: Beckman Coulter Inc: http://www.beckman.com
WWW.SUNHOPE.IT
19
The Pre-Apoptotic Sequence
WWW.SUNHOPE.IT
20