FISICA MODERNA
LA STRUTTURA ELETTRONICA DEGLI ATOMI
1. LA NATURA ELETTRICA DELLA MATERIA
I primi indizi fondamentali sulla natura dell’elettricit• e sulla struttura elettrica dell’atomo si
possono far risalire ai risultati ottenuti da Michael Faraday riguardo i suoi esperimenti
sull’elettrolisi (1833).
Le sue scoperte furono sintetizzate nelle due leggi che regolano il fenomeno:
1. Il peso di una data sostanza depositata ad uno
degli elettrodi da una data quantit• di
elettricit• ‚ sempre lo stesso
2. I pesi di varie sostanze depositate, sviluppate o
disciolte ad un elettrodo da una quantit• fissa
di
elettricit•
sono
proporzionali
ai
pesi
equivalenti di queste sostanze.
La seconda legge ‚ particolarmente rilevante poichƒ il peso equivalente di qualunque sostanza
contiene lo stesso numero di molecole o un multiplo intero di esso.
Faraday non comprese completamente ci„ che aveva trovato nei suoi studi (le leggi dell’elettrolisi
sono analoghe alle leggi delle combinazioni chimiche che portarono a supporre l’esistenza degli
atomi). Se un numero fisso di atomi reagisce solo con una quantit• fissa di elettricit•, sembra
evidente (e logico) supporre che l’elettricit• sia formata da particelle) ma intu… che “ . . . .la forza che
domina (governa) l’elettrodecomposizione e le normali attrazioni chimiche sia la stessa . . “.
Nel 1874, l'irlandese G. J. Stoney riprese il fenomeno dell'elettrolisi al pari del fisico tedesco H.
Helmholtz (1881).
Sia Stoney che Helmholtz, mostrarono che se la materia e l'elettricit• sono
considerate discontinue (formate cio‚ da tante piccole particelle) allora gli esperimenti di Faraday
sono semplici da spiegare.
La struttura elettronica degli atomi
1
prof. Teugi Pirozzi
Se ciascun atomo di materia, nel passare attraverso la soluzione, porta con sƒ una quantit• di
carica definita e ben determinata, allora la quantit• di materia depositata su di un elettrodo sar•
direttamente proporzionale a questa quantit• di carica. Ora, un grammo-atomo di materia contiene
un numero di atomi pari al numero N di Avogadro e quindi ciascun atomo trasporta una carica pari a
z.(96.522/N) coulomb con z numero intero. Cos… la carica che ogni ione elettrolitico, di qualsiasi tipo
esso sia, trasporta ‚ sempre multipla di 96.522/N, che risulta quindi essere la carica elementare. A
questa carica elementare Stoney, nel 1891, dette il nome di elettrone (agli inizi Stoney con la parola
elettrone indicava la carica elettrica associata ad uno ione monovalente).
1.1 I raggi catodici
Al raggiungimento di questi risultati (parziali ma decisivi) contribuirono le esperienze sulla
conducibilit• dei gas a bassa pressione (rarefatti). Tali esperimenti evidenziarono che in certe
condizioni (pressione minore di 10-4 , differenza di potenziale di 5000-10000 volt), il recipiente di
vetro che conteneva il gas diventava luminescente (fluorescente).
Nel 1869, J.W. Hittorf rilev„ per la prima volta quelli che saranno poi chiamati raggi catodici.
Sulla natura di questi raggi osservati erano state proposte ipotesi contrastanti: per i fisici tedeschi
(Hertz, Goldstein ed altri), non erano particelle ma radiazioni elettromagnetiche mentre per quelli
inglesi (Crookes, Thomson e Lord Kelvin) erano particelle cariche elettricamente.
H. Hertz, unitamente al suo assistente P. Lenard, realizz„ una serie di esperienze con i gas
rarefatti. In particolare osserv„ (1892) che i raggi catodici erano in grado di attraversare sottili lamine
metalliche. Da ci„ egli concluse che non poteva trattarsi di fenomeni corpuscolari e che, al contrario,
i raggi catodici non erano altro che delle vibrazioni dell'etere.
Nel 1879 W. Crookes, impegnato anch’egli nello studio della scarica elettrica in gas rarefatti,
rilev„ l'esistenza dei raggi emessi dal catodo, costituiti, secondo la sua teoria, da molecole elettrizzate
espulse dal catodo stesso (raggi catodici).
La diatriba fu risolta dal fisico francese J. Perrin, nel 1895, il quale fece il passo decisivo essendo
riuscito ad ottenere un vuoto adeguato. Egli raccolse i raggi catodici in una gabbia di Faraday e
dimostr„ cos… che essi trasportavano carica elettrica, verificando ulteriormente che potevano essere
deflessi e guidati da un campo magnetico.
La struttura elettronica degli atomi
2
prof. Teugi Pirozzi
1.2 L’effetto Zeeman
Partendo da una delle fervide idee di Faraday, alla
continua ricerca di relazioni tra “le forze della natura”,
riguardo la possibilit• di influenzare la luce con il campo
magnetico, P. Zeeman ripet‚ gli esperimenti infruttuosi che
il suo predecessore port„ a termine nel 1862 nel tentativo
di alterare la frequenza della luce emessa dal vapore di
sodio. Disponendo di apparecchiature spettrali ben superiori (basate sui reticoli di diffrazione e non
sugli obsoleti prismi di vetro), Zeeman pot‚ osservare un allargamento delle righe spettrali.
Raffinando successivamente la tecnica rilev„ un tripletto o un doppietto secondo l’orientazione
relativa della direzione di osservazione e del campo magnetico. (vedi figura)
Comunic„ i risultati degli esperimenti a H.A. Lorentz, di cui era stato allievo, il quale trov„ una
spiegazione al fenomeno.
Le idee fondamentali erano che la luce fosse emessa a causa del moto delle particelle cariche e
che questo moto fosse influenzato dal campo magnetico.
Dall’alterazione delle frequenze, Lorentz e Zeeman determinarono il rapporto e/m, la carica
specifica e il suo segno negativo.
1.3 Le esperienze di J. J. Thomson
Indipendentemente da Zeeman e Lorentz, J. J. Thomson misur„, nel 1897, il rapporto e/m per
mezzo di una serie di esperimenti sui raggi catodici.
Egli dimostr„ che quando questi raggi vengono deviati
sull’elettrodo di un elettrometro, lo strumento acquista una
carica negativa. Inoltre, fu il primo ad indicare come fosse
possibile deflettere i raggi catodici applicando un campo
elettrico che li faceva allontanare dall’elettrodo negativo.
Thomson sintetizz„ cos… i risultati ottenuti:
“ Dato che i raggi catodici trasportano una carica di elettricit•, vengono deviati da una forza
elettrostatica come se fossero elettrizzati negativamente e sono influenzati da una forza magnetica
allo stesso modo in cui questa forza agirebbe su di un corpo elettrizzato negativamente che si
La struttura elettronica degli atomi
3
prof. Teugi Pirozzi
muovesse nella stessa direzione dei raggi: non possono quindi sfuggire alla conclusione che essi siano
cariche di elettricit• negativa trasportata da particelle materiali”
Qual’era la natura di queste particelle? Il fatto che esse furono osservate indipendentemente dal
gas utilizzato e/o dai materiali usati per costruire il tubo di scarica, sugger… l’ipotesi che esse non
costituivano un particolare tipo di atomo elettrizzato ma piuttosto un frammento universale presente
in tutti gli atomi.
Il rapporto tra carica e la massa di vari ioni era stato ricavato da esperienze sull’elettrolisi e
Thomson riconobbe che una determinazione del rapporto carica/massa delle particelle dei raggi
catodici avrebbe aiutato ad identificarle o come uno ione o come qualche altro frammento carico. Di
conseguenza, egli determin„ il rapporto carica/massa (e/m) con due diversi metodi.
Nella sua prima determinazione, Thomson bombarda un elettrodo con raggi catodici e misura sia
la corrente fornita all’elettrodo, sia l’aumento della temperatura prodotta dal bombardamento.
Dall’aumento di temperatura e dalla capacit• termica dell’elettrodo egli calcola l’energia, E,
fornita dalle particelle dei raggi catodici considerandola uguale alla loro energia cinetica:
E
N Ämv 2
2
con N numero di particelle di massa m e di velocit• v che arrivano all’elettrodo durante
l’esperimento. Poich‚ mv2/2 ‚ l’energia cinetica di una particella, Nmv2/2 ‚ l’energia cinetica totale
delle particelle che colpiscono l’elettrodo.
La carica totale Q, raccolta all’elettrodo durante l’esperimento ‚ legata ad N e ad e, la carica di
ogni particella, dalla relazione:
Q N Äe
Combinando queste due equazioni, si ottiene:
Q 2 e
E v2 m
(1)
Thomson poteva misurare Q ed E; per calcolare e/m aveva bisogno soltanto di misurare la
velocit• delle particelle, ottenendola dalla loro deviazione per mezzo di un campo magnetico di
intensit• nota H.
Considerato che In un campo magnetico, particelle di carica e e massa m che si muovono con
velocit• v percorrono una traiettoria circolare di raggio r, si pu„ ricavare v dalla relazione:
La struttura elettronica degli atomi
4
prof. Teugi Pirozzi
v
erH
m
Combinando questa equazione con la (1) si ha:
e
2E
2 2
m r H Q
Tutte le quantit• a destra di questa relazione possono essere misurate, dato che il raggio di
curvatura r, dovuto al campo magnetico noto H, pu„ essere determinato dalla fluorescenza prodotta
dal fascio di particelle.
Il valore e/m cos… ottenuto, pari a 6.6 ˆ 1017 ues/g. ‚ in buono accordo con le migliori
determinazioni moderne (5.272764 • 1017 ues/g).
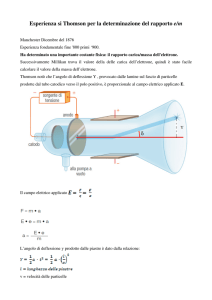
Figura 1. Rappresentazione schematica dell’apparecchio di Thomson per la misura di e/m
Il secondo metodo utilizzato da Thomson per la misura di e/m comport„ l’uso dell’apparecchio
schematizzato in figura 1.
Un fascio di particelle tipiche dei raggi catodici passa in una regione in cui esse possono essere
sottoposte all’azione di campi elettrici e magnetici. Ognuno dei campi applicati pu„ deflettere
autonomamente il raggio della sua traiettoria orizzontale; la direzione della deflessione magnetica ‚
per„ opposta a quella prodotta dal campo elettrico.
In tal modo, se il campo elettrico viene applicato e mantenuto costante, il valore del campo
magnetico ‚ in grado di deflettere il raggio verso la sua traiettoria orizzontale originale.
In questa condizione, la forza esercitata sulle particelle dal campo magnetico, Hev, ‚ uguale alla
forza dovuta al campo elettrico, eE, cio‚:
La struttura elettronica degli atomi
5
prof. Teugi Pirozzi
Hev eE
da cui
v
E
H
(2)
Il secondo passo dell’esperienza consiste nel togliere il campo magnetico e nel misurare la
deflessione del raggio prodotta dal campo elettrico. Al passare delle particelle attraverso le lamine, la
forza elettrica eE produce una deflessione s che, come mostra la figura 1, pu„ essere calcolata dallo
spostamento osservato all’estremit• del tubo. La forza elettrica eE, per la seconda legge di Newton,
produce un’accelerazione a:
eE = ma
da cui si ricava
a
eE
m
(3)
La deflessione s pu„ essere collegata ad a e t, tempo che le particelle trascorrono tra le due
lamine, mediante la relazione:
s
at 2
2
(4)
che ‚ un risultato ben noto della meccanica elementare. Infine t pu„ essere espresso in termini della
lunghezza delle lamine l e la velocit• delle particelle v:
t
l
v
(5)
Se si combinano ora le equazioni (3), (4) e (5), si ottiene:
1 eE l
s
2 m v
2
Da quest’ultima espressione si pu„ isolare il rapporto e/m e sostituendo a v il valore ottenuto
nella (2), esso pu„ essere calcolato utilizzando la relazione
e 2s E
m l2 H 2
Successivamente, nel 1899, Thomson misur„ anche la carica e separatamente da m, servendosi di
tecniche sviluppate dal suo ex allievo C.T.R Wilson.
Quest’ultimo aveva osservato che in condizioni opportune, cariche elettriche negative servivano
come nuclei di condensazione nella formazione della nebbia da un vapore soprasaturo.
La struttura elettronica degli atomi
6
prof. Teugi Pirozzi
Il diametro o il volume delle goccioline che formavano la nebbia si poteva ricavare dalla
sovrasaturazione iniziale. Da questi due dati si otteneva immediatamente il numero delle goccioline
raccolte.
La quantit• di elettricit• da esse trasportata poteva essere misurata direttamente e di
conseguenza si poteva calcolare la carica media di una singola goccia, identificata con quella
dell’elettrone.
Queste esperienze furono effettuate nei laboratori del Cavendish Laboratory e si trov„ per la
carica dell’elettrrone un valore pari a 3 ˆ 10-10 unit• elettrostatiche assolute.
L’importanza di e/m per i raggi catodici, divenne evidente quando il suo valore venne confrontato
con i rapporti carica/massa degli ioni ottenuti dagli esperimenti di elettrolisi. Il rapporto carica/massa
dei raggi catodici era oltre 1000 volte maggiore di quello di qualunque altro ione. Inoltre, mentre il
rapporto carica/massa di vari ioni era diverso, quello dei raggi catodici era una costante indipendente
dai gas usati nel tubo di scarica. Questi fatti portarono Thomson a concludere che i raggi catodici
non erano atomi elettrizzati ma frammenti corpuscolari di atomi; nella terminologia moderna,
elettroni.
1.4 Il contributo di Millikan
La dimostrazione definitiva della natura corpuscolare dell’elettricit• deriv„ dalla famosa
esperienza di R. A. Millikan sulle gocce d’olio. Usando l’apparecchio illustrato dalla figura 2, Millikan
prov„ che tutte le cariche elettriche sono multipli di una unit• elementare definita il cui valore ‚ pari
a 1,6 • 10-19 coulomb.
Figura 2. Diagramma schematico dell’apparecchio utilizzato da Millikan
La struttura elettronica degli atomi
7
prof. Teugi Pirozzi
Per eseguire l’esperimento, si introducono gocce d’olio sferiche dall’atomizzatore alla camera di
osservazione, nella quale esse si caricano per collisione con ioni gassosi prodotti dall’azione di radio o
dei raggi X sull’aria. Una goccia d’olio carica si riconosce dalla sua risposta a un campo elettrico e dal
suo movimento osservato attraverso il microscopio. Quando il campo elettrico ‚ zero, la goccia ‚
soggetta soltanto alla forza di gravit• e cade: a causa della resistenza dell’aria, la goccia non accelera
di continuo, ma raggiunge una velocit• costante data da
v
mg
6r
dove g ‚ l’accelerazione di gravit•, m e r sono la massa e il raggio della goccia e ‚ la viscosit•
dell’aria.
Questa equazione, congiuntamente con l’espressione
m
4 3
r
3
(che mette in rapporto la densit• nota della goccia d’olio con la sua massa e il suo raggio) permette
di calcolare r e m dalla velocit• misurata e dalla densit•.
Se la stessa goccia possiede una carica q ed ‚ sottoposta a un campo E, la forza elettrica che
provoca un movimento verso l’alto della goccia ‚ qE. A causa dell’azione della gravit•, la forza
effettiva esercitata sulla goccia ‚ qE - mg e la sua velocit• relativa al moto verso l’alto, ‚
v'
qE mg
6r
Poich‚ v’ e E sono misurabili, e m, g, sono note, si pu„ calcolare q.
Millikan trov„ che q era sempre un multiplo intero di 1,6 ˆ 10-19 C. Questo risultato mostra che
l’elettricit• ‚ particellare e che l’unit• fondamentale di carica ‚ 1,6 ˆ 10-19 C. Ipotizzando che questa
unit• fondamentale rappresenti la carica trasportata dall’elettrone e potendo misurare il rapporto
e/m, ‚ possibile ricavare il valore della massa dell’elettrone pari a 9,1 • 10-31 kg.
La struttura elettronica degli atomi
8
prof. Teugi Pirozzi
2. LA STRUTTURA DELL’ATOMO
2.1 Il modello atomico di J.J. Thomson
Mentre si stava stabilendo la natura dell’elettricit•, gli scienziati cominciarono a formulare una
definizione particolareggiata dell’atomo. Non era difficile valutare la grandezza dell’atomo, poich‚ il
volume molare di un solido espresso in cm3/mole, diviso per il numero di Avogadro, d• per il volume
atomico un valore approssimativo di 10-24 cm3. Estraendo la radice cubica del volume, si ricava il
raggio di un atomo pari a circa 10-8 cm.
Gli esperimenti di Thomson avevano per„ dimostrato che per quanto un atomo fosse piccolo,
esso conteneva particelle ancora pi‰ piccole di elettricit• negativa. Poich‚ gli atomi risultavano
elettricamente neutri, era fin troppo evidente che essi dovevano contenere anche elettricit• positiva.
Inoltre, poich‚ gli elettroni erano cos… leggeri, sembr„ logico e coerente associare la maggior parte
della massa di un atomo alla sua elettricit• positiva.
Se l’elettricit• positiva corrispondeva a gran parte della massa atomica,
era logico che essa dovesse occupare la maggior parte del volume atomico.
Di conseguenza Thomson nel 1903, rielaborando l’idea di W. Thomson
(Lord Kelvin), propose un modello nel quale l’atomo veniva immaginato
come una sfera uniforme di elettricit• positiva di circa 10-8 cm di raggio,
con gli elettroni annegati in questa sfera in modo da dare la pi‰ stabile disposizione elettrostatica.
Prov„ inoltre a mettere in relazione le stabilit• relative di vari numeri di carica atomica con le
propriet• chimiche periodiche degli elementi e formul„ anche una teoria del legame chimico.
Per quanto questo semplice modello fosse attraente e avesse avuto occasionali successi, esso fu
abbandonato nel 1911 quando E. R. Rutherford dimostr„ che era in completo disaccordo con le sue
osservazioni sulla dispersione delle particelle α da parte di sottili fogli metallici.
2.2 Il modello atomico di Nagaoka
Nel 1904, il fisico giapponese H. Nagaoka, a seguito degli esperimenti effettuati per trovare una
spiegazione agli spettri di emissione di alcune sostanze, pubblic„ sulla rivista britannica Nature un
articolo nel quale proponeva un modello alternativo dell’atomo, rigettando quello di Thomson, sulla
base del fatto che cariche elettriche opposte sono impenetrabili.
La struttura elettronica degli atomi
9
prof. Teugi Pirozzi
Nagaoka immaginava un atomo costituto da una sfera carica positivamente, di grande massa,
circondata da particelle cariche negativamente (elettroni) disposte su traiettorie circolari equidistanti.
Egli giustificava la stabilit• atomica del suo modello in analogia con la stabilit• di Saturno e dei
suoi anelli, pensando che gli elettroni ruotassero attorno al nucleo legati dalla forza elettrostatica
cos… come le particelle degli anelli ruotavano attorno al pianeta legati dalla forza gravitazionale.
Il modello atomico saturniano di Nagaoka si rivel„ presto incapace di spiegare fenomeni
spettroscopici, quali la formazione delle linee spettrali, e la radioattivit•.
Le critiche pi‰ pesanti riguardavano per„ la stabilit• atomica in quanto un anello carico sarebbe
risultato instabile ad oscillazioni in direzione ortogonale al piano di rotazione dell'anello.
Nel 1908 fu lo stesso Nagaoka a riconoscere l’inadeguatezza del modello atomico proposto.
2.3 Gli esperimenti sulla diffusione delle particelle alfa
Nel 1909 H. Geiger e E. Marsden, due ex allievi di E. R. Rutherford, studiando le radiazioni
emesse da un campione di radio, realizzarono un’esperimento con il dispositivo schematizzato in
figura 3.
Figura 3. Diagramma schematico del dispositivo utilizzato da Geiger e Marsden
Le particelle alfa (vedi appendice a fine capitolo) colpiscono una sottile lamina di metallo; quelle
diffuse sono raccolte da uno schermo (di solfuro di zinco) che permette di studiarne la distribuzione
angolare (contando le scintillizioni o lampi luminosi prodotti).
La struttura elettronica degli atomi
10
prof. Teugi Pirozzi
Il risultato sperimentale qualitativamente importante risiede nel fatto
che mentre la maggior parte delle particelle attraversano la lamina senza
subire deviazioni consistenti, alcune di esse sono diffuse sotto grandi angoli
(fino a 180 gradi).
Rutherford, all’epoca in cui furono eseguiti gli esperimenti, sapeva che
le particelle alfa erano atomi di elio doppiamente ionizzati (portatori di
carica positiva e di massa atomica 4) la cui velocit• poteva essere misurata
con il metodo della deflessione della traiettoria sotto l’azione di un campo
magnetico.
L’elevata energia cinetica da esse posseduta conduceva all’ipotesi che l’atomo fosse la sede di
un’enorme forza elettrica responsabile delle grandi deflessioni osservate. Era dunque chiaro che
questa forza doveva essere esercitata da un corpo di notevole massa non individuabile nel leggero
elettrone.
La riflessione totale subita da alcune particelle, suggeriva inoltre l’idea che la carica positiva
dell’atomo fosse confinata in una ridotta porzione di spazio.
Rutherford giunse quindi alla conclusione che l’atomo, invece di essere una sfera di massa e
densit• di carica uniformi come aveva proposto Thomson, si presentava di gran lunga non uniforme
e l’elettricit• positiva doveva essere concentrata in un piccolo ma pesante nucleo.
Rutherford forn… quindi una spiegazione coerente con i dati sperimentali. Supponendo che la
forza che si manifesta tra nucleo e particella alfa fosse di tipo elettrostatico, egli dimostr„ che la
traiettoria seguita dalle particelle deviate doveva essere un’iperbole.
Figura 4. Traiettoria di una particella alfa che passa vicino al nucleo di carica +Ze. La particella ha velocit• v,
massa m, carica ze e parametro di impatto b
L’angolo di deflessione θ (esterno tra gli asintoti dell’iperbole, vedi figura 4), dipende dall’errore
di mira o parametro di impatto b, secondo la relazione
La struttura elettronica degli atomi
11
prof. Teugi Pirozzi
zZe 2
tg ( )
2
mv 2 b
dove z e Z sono inumeri atomici delle particelle alfa e del nucleo, e ‚ il valore della carica
dell’elettrone, m e v sono la massa e la velocit• della particella alfa (quando b = 0, θ = 180).
In ogni dato esperimento di diffusione z, Z, m e v sono costanti e poich‚ viene usato un fascio
relativamente ampio di particelle alfa, si verificano tutti i valori di b, e la diffusione ‚ riscontrabile
sotto tutti gli angoli.
Figura 5. Traiettoria di una particella alfa che passa vicino al nucleo di carica +Ze. La particella ha velocit• v,
massa m, carica ze e parametro di impatto b
Come ‚ mostrato dalla figura 5 la probabilit• che il parametro di impatto b si trovi nell’ intervallo
b, b ƒ db ‚ proporzianale all’area di un anello circolare di raggio b ed ampiezza db. Quest’area ‚
uguale a 2πbdb, prodotto della circonferenza dell’anello circolare 2πb, e della sua largezza db. L’area
aumenta man mano che cresce b e di conseguenza grandi valori di b risultano i pi‰ probabili.
In tal modo, la maggior parte della diffusione si verificher•, nella direzione iniziale di moto (b
grande, θ piccolo) e poche particelle saranno deviate sotto grandi angoli. Questo ‚ proprio un modo
complicato di dire che vi sono pi‰ modi di mancare un bersaglio piccolo che di colpirlo.
Usando la probabilit• dei vari valori di b, Rutherford dedusse che la frazione, f(θ), delle particelle
iniziali, deviate sotto un angolo θ ‚ data da
zZe 2 2 sin( )
f ( ) 2t (
)
2mv 2 sin 4 ( )
2
(6)
dove t ‚ lo spessore della lamina e ρ ‚ la sua densit•.
Questa espressione per la distribuzione angolare delle particelle ‚ valida soltanto se la forza tra il
nucleo e le particelle ‚ data dalla legge di Coulomb.
Geiger e Marsden, lavorando nel laboratorio di Rutherford, mostrarono che la distribuzione
sperimentale delle particelle diffuse obbediva all’equazione ( 6) entro l’errore sperimentale.
La struttura elettronica degli atomi
12
prof. Teugi Pirozzi
Inoltre, poich‚ la quantit•
zZe 2
poteva essere valutata sperimentalmente e poich‚ z, e, m e v erano
2mv 2
note, f‰ possibile stabilire il numero atomico Z del nucleo di diffusione. Per il nucleo dell’oro,
Rutherford calcol„ che Z era 100 • 20; si tratta di una ragionevole approssimazione a 79 che
sappiamo essere il valore corretto.
In tal modo l’esperimento di diffusione delle particelle alfa f‰ uno dei primi metodi per la
valutazione del numero atomico; col progredire dei metodi sperimentali. divenne possibile in seguito
misurare Z esattamente.
Si ‚ gi• fatto notare che il nucleo ‚ piccolo in confronto a 10-8 cm, ma quanto ‚ piccolo?
L’esperimento della diffusione potr• dirlo. Quando una particella alfa viene deviata di un angolo di
180 gradi essa ha avuto una collisione frontale con un nucleo. In tale collisione la particella alfa si
avvicina al nucleo fino a che l’energia potenziale coulombiana di repulsione zZe2/r diventa uguale
alla sua energia cinetica iniziale mv2/2. In tal modo l’equazione
1 2 zZe 2
mv
2
rmin
permette di calcolare rmin, la distanza del massimo avvicinamento, noti tutti gli altri fattori.
Per le particelle alfa ottenute dalla disintegrazione del radio,
v = 1.6 ˆ 109 cm/s
e = 4.8 ˆ 10-10 ues
m = 6.68 ˆ 10-24 g
e se il nucleo che diffonde ‚ il rame, Z = 29, si ricava
rmin
2 zZe 2
1.7Ä10 12 cm
2
mv
Poich‚ le particelle possono arrivare a circa 10-12 cm dal nucleo e possono essere ancora diffuse
secondo la legge di Coulomb, il nucleo stesso deve essere minore di 10-12 cm.
Altri esperimenti con particelle alfa pi‰ veloci e nuclei piu leggeri (Z minore, rmin piu piccolo)
mostrano che la legge di diffusione basata sulle forze di Coulomb non viene osservata se le parti
celle alfa arrivano pi‰ vicine al nucleo di circa 0,8 ˆ 10-12 cm. Questo implica in verit• che la carica
positiva del nucleo occupa una sfera di circa 10-10 cm di raggio.
In tal modo l’esperimento di diffusione delle particelle alfa non soltanto forn… un’indicazione
qualitativa sull’esistenza del nucleo, ma diede una misura quantitativa della sua carica e della sua
grandezza.
La struttura elettronica degli atomi
13
prof. Teugi Pirozzi
2.4 Il modello atomico di Rutherford
Sulla
base dei risultati
sperimentali,
Rutherford nel 1911,
comunicando la scoperta del nucleo, propose il suo modello atomico,
(detto anche atomo planetario per la sua struttura analoga a quella del
sistema solare), menzionando correttamente il modello di Nagaoka.
Il modello prevedeva che la carica positiva fosse concentrata in un
volume piccolissimo al centro dell'atomo, il nucleo, il cui raggio variava
da 10-15 a 10-14 metri passando dall'idrogeno agli elementi pesanti, mentre gli elettroni, in numero
tale da bilanciare la carica positiva del nucleo, ruotavano su orbite di raggio compreso tra 10-10 e
3ˆ10-10 metri.
Questo modello, semplice ed elegante, spiegava bene i risultati sperimentali, ma presentava il
difetto di essere instabile. Infatti le cariche elettriche non possono comportarsi stabilmente come
satelliti intorno al nucleo perchƒ la teoria classica dell’elettromagnetismo prevede che una carica che
oscilla emetta onde elettromagnetiche della stessa frequenza di rotazione.
Gli elettroni avrebbero dovuto emettere continuamente radiazione elettromagnetica e quindi
perdere energia a ritmo costante, avvicinandosi sempre di pi‰ al nucleo, fino a cadervi e questo
doveva avvenire in un tempo molto breve, in contrasto con l'evidente stabilit• della materia.
Si era ad un punto di crisi: o il modello di Rutherford non andava bene e allora non si potevano
spiegare in nessun modo i risultati sperimentali sulla deflessione della particelle α, o la fisica classica
non era adeguata alla descrizione dell'atomo.
APPENDICE: le particelle alfa
Le particelle alfa, raggi alfa o elioni, sono una forma di radiazione corpuscolare altamente
ionizzante e con un basso potere di penetrazione dovuto all'elevata sezione d'urto. Consistono di
due protoni e due neutroni legati insieme dalla forza forte, si tratta quindi di nuclei 4He. Da un
punto di vista chimico possono anche essere identificati con il simbolo 4He2+.
Sono tipicamente emesse da nuclidi radioattivi degli elementi pesanti (dagli isotopi dell'uranio,
del torio, del radio) in un processo denominato decadimento alfa. A volte questo decadimento
lascia i nuclei in uno stato eccitato, e conseguentemente l'eccesso di energia pu„ essere rimosso con
l'emissione di raggi gamma.
La struttura elettronica degli atomi
14
prof. Teugi Pirozzi
A causa della carica elettrica positiva che trasportano, interagiscono fortemente con la materia e
quindi vengono facilmente assorbiti dai materiali e possono viaggiare solo per pochi centimetri
nell'aria. Possono essere assorbiti dagli strati pi‰ esterni della pelle umana e cos… generalmente non
sono pericolosi per la vita a meno che la sorgente non venga inalata o ingerita. In questo caso i
danni sarebbero invece maggiori di quelli causati da qualsiasi altra radiazione ionizzante.
La struttura elettronica degli atomi
15
prof. Teugi Pirozzi