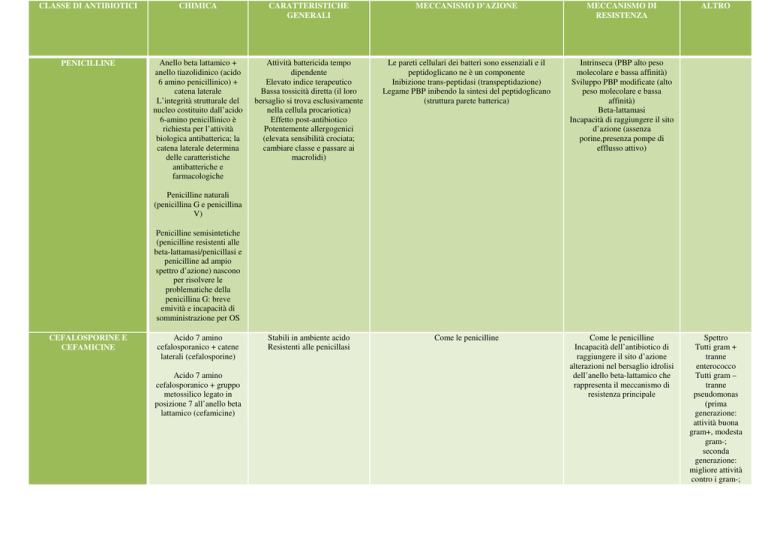
CLASSE DI ANTIBIOTICI
CHIMICA
CARATTERISTICHE
GENERALI
MECCANISMO D’AZIONE
MECCANISMO DI
RESISTENZA
PENICILLINE
Anello beta lattamico +
anello tiazolidinico (acido
6 amino penicillinico) +
catena laterale
L’integrità strutturale del
nucleo costituito dall’acido
6-amino penicillinico è
richiesta per l’attività
biologica antibatterica; la
catena laterale determina
delle caratteristiche
antibatteriche e
farmacologiche
Attività battericida tempo
dipendente
Elevato indice terapeutico
Bassa tossicità diretta (il loro
bersaglio si trova esclusivamente
nella cellula procariotica)
Effetto post-antibiotico
Potentemente allergogenici
(elevata sensibilità crociata;
cambiare classe e passare ai
macrolidi)
Le pareti cellulari dei batteri sono essenziali e il
peptidoglicano ne è un componente
Inibizione trans-peptidasi (transpeptidazione)
Legame PBP inibendo la sintesi del peptidoglicano
(struttura parete batterica)
Intrinseca (PBP alto peso
molecolare e bassa affinità)
Sviluppo PBP modificate (alto
peso molecolare e bassa
affinità)
Beta-lattamasi
Incapacità di raggiungere il sito
d’azione (assenza
porine,presenza pompe di
efflusso attivo)
Stabili in ambiente acido
Resistenti alle penicillasi
Come le penicilline
Come le penicilline
Incapacità dell’antibiotico di
raggiungere il sito d’azione
alterazioni nel bersaglio idrolisi
dell’anello beta-lattamico che
rappresenta il meccanismo di
resistenza principale
ALTRO
Penicilline naturali
(penicillina G e penicillina
V)
Penicilline semisintetiche
(penicilline resistenti alle
beta-lattamasi/penicillasi e
penicilline ad ampio
spettro d’azione) nascono
per risolvere le
problematiche della
penicillina G: breve
emività e incapacità di
somministrazione per OS
CEFALOSPORINE E
CEFAMICINE
Acido 7 amino
cefalosporanico + catene
laterali (cefalosporine)
Acido 7 amino
cefalosporanico + gruppo
metossilico legato in
posizione 7 all’anello beta
lattamico (cefamicine)
Spettro
Tutti gram +
tranne
enterococco
Tutti gram –
tranne
pseudomonas
(prima
generazione:
attività buona
gram+, modesta
gram-;
seconda
generazione:
migliore attività
contro i gram-;
terza generazione:
attivi sui gram+ e
molto più attivi
sulle
enterobacteriaceae
e pseudomonas
aeruginosa;
quarta
generazione:
mantengono lo
spettro di attività
dei composti di
terza generazione
e sono più
resistenti
all’idrolisi da
parte delle betalattamasi
inducibili)
CARBAPENEMI
E MONOBATTAMI
Anello beta lattamico +
anello a 5 atomi
(carbapenemi)
Si lega a più di una PBP (Imipenem)
Non hanno ancora sviluppato
una resistenza importante nei
loro confronti
Spettro molto
ampio
Inattivazione enzimatica
(l’acetiltransferasi impedisce il
legame del farmaco con il
ribosoma)
Diminuzione della permeabilità
Mutazioni nei ribosomi
Ampio spettro
d’azione (attivo
sia sui gram + sia
sui gram - )
Anello beta lattamico
(monobattami)
INIBITORI BETA
LATTAMASI (ACIDO
CLAVULANICO)
CLORAMFENICOLO
Anello beta lattamico
ma privi di attività
antibatterica
Devono avere caratteristiche
farmacocinetiche simili
all’antibiotico co-somministrato
Devono essere assorbiti insieme
perché devono essere presenti
nello stesso momento nel luogo
di infezione
Si lega irreversibilmente alle beta-lattamasi
inattivandole e prevenendo così la distruzione degli
antibiotici beta-lattamici che sono substrati di questi
enzimi, facendo in modo che l’antibiotico al quale è
associato possa agire liberamente (substrato suicida)
Può essere responsabile
dell’insorgenza di discrasie
ematiche gravi e letali quindi
prescritto solo per la terapia di
gravi infezioni che non possono
essere trattate con antibiotici più
sicuri a causa di fenomeni di
resistenza o ipersensibilità
(rapporto rischio beneficio)
Inibisce la sintesi proteica legandosi reversibilmente
alla sub unità ribosomiale 50s in corrispondenza del
sito peptidiltransferasico inibendo la reazione di
transpeptidazione
Entra nelle cellule per diffusione passiva
MACROLIDI
CHETOLIDI
TELITROMICINA
Composti lipofilici
caratterizzati da un anello
lattonico a molti membri al
quale sono legati uno o più
deossizuccheri
Alto peso molecolare
Carattere basico
Avendo un carattere basico la
loro attività sarà superiore a pH
alcalino in quanto le cellule sono
più permeabili alla forma non
ionizzata del farmaco
Derivato semisintetico
dell’eritromicina
Presenta un’affinità maggiore
dell’eritromicina nei confronti del
ribosoma pertanto ne bastano
dosi inferiori per avere lo stesso
effetto
Batteriostatici che inibiscono la sintesi proteica legando
reversibilmente la sub unità ribosomiale 50s dei
microrganismi sensibili
I meccanismi che producono
resistenza all’eritromicina
influenzano tutti i macrolidi (la
resistenza crociata tra loro è
completa)
-meccanismi di efflusso attivo
-protezione del ribosoma
attraverso la sintesi inducibile o
costitutiva di metilasi che
modificano il bersaglio
ribosomiale portando a un
ridotto legame del farmaco al
sito d’azione
-mutazioni a carico della sub
unità 50s
-inattivazione enzimatica del
farmaco (idrolisi dei macrolidi
mediata da esterasi)
Riescono a
penetrare più
facilmente i
gram+ rispetto ai
gramEsplicano il loro
effetto
esclusivamente
sui microrganismi
in moltiplicazione
Spettro
sovrapponibile
alla penicillina G
ed è il farmaco da
utilizzare in
alternativa in caso
di ipersensibilità
Macrolidi e chetolidi hanno lo
stesso bersaglio ribosomiale ma
le differenze strutturali dei
chetolidi neutralizzano i comuni
meccanismi di resistenza che
rendono i macrolidi inefficaci
-meno sensibili ai meccanismi
di resistenza mediati da metilasi
in quanto a differenza dei
macrolidi non inducono le
metilasi
-prevengono l’efflusso del
farmaco (perché generano un
substrato meno affine)
-introducono una nuova
interazione tra i chetolidi e il
ribosoma quindi ne aumenta il
legame al sito d’azione
ribosomiale anche quando
questo è metilato
Spettro d’azione
simile a quello dei
macrolidi con la
differenza che
sono attivi nei
confronti di molti
ceppi batterici
gram+ resistenti ai
macrolidi
I ceppi di
S.Aureus e
S.Pyogenes
produttori
costitutivi di
metilasi sono
resistenti alla
telicromicina
perché la forza
d’interazione tra i
chetolidi e il sito
di legame
ribosomiale
totalmente
metilato non è
sufficiente a
prevalere sul
meccanismo di
resistenza
TETRACICLINE
Struttura tetraciclica
Batteriostatici che inibiscono la sintesi proteica dei
batteri legandosi alla sub unità 30s del ribosoma
batterico e prevenendo l’accesso dell’aminoacil-tRNA
al sito accettore sul complesso mRNA-ribosoma
Il sito P (peptidico) della sub unità 50s dell’RNA
ribosomiale contiene la catena polipeptidica nascente;
in condizioni normali, l’aminoacil tRNA, che porta
l’amiacido (aa) che deve essere aggiunto alla catena,
raggiunge il sito A (accettore) e qui si lega
Le tetracicline inibiscono la sintesi proteica batterica
legandosi alla sub unità ribosomiale 30s e bloccando il
legame del tRNA al sito A
Vedi figura 46-1 (pg. 1174 goodman)
Questi farmaci entrano nei batteri gram- per diffusione
passiva attraverso i canali idrofilici formati dalle porine
(la membrana esterna) e per trasporto attivo attraverso
un sistema energia-dipendente (la membrana interna);
nei batteri gram+ richiede un sistema di trasporto
energia-dipendente
-diminuzione dell’accumulo di
tetracicline, come risultato sia
di un ridotto ingresso
dell’antibiotico sia
dell’acquisizione di una via di
estrusione energia-dipendente
(la via di efflusso attivo non dà
resistenza crociata in quanto
tale sistema di efflusso non
presenta la stessa affinità per
tutte le tetracicline)
-modificazione del ribosoma:
produzione di una proteina di
protezione ribosomiale che
sposta la tetraciclina dal suo
bersaglio (un meccanismo di
protezione che può insorgere
anche per mutazione e produce
una resistenza crociata cioè il
microrganismo diventa
resistente a tutte le tetracicline
in quanto il sito bersaglio
protetto è lo stesso per tutte le
tetracicline)
-inattivazione enzimatica delle
tetracicline
Ampio spettro
(gram+ e gramaerobi ed
anaerobi)
soprattutto:
rickettisie
treponema
pallidum (sifilide)
malattia di lyme
colera
urea plasma
acne
NON si deve
usare nelle
infezioni acute
tonsillari o
broncopolmonari
perché i batteri
sono già resistenti
(streptococco beta
emolitico,
pneumococco,
haemofilus
influenzae)
Più attive nei
confronti dei
gram+
Sono resistenti:
enterobacteriaceae
pseudomonas
aeruginosa
n.gonorreae
AMINOGLICOSIDI
Gli aminoglicosidi
consistono di due o più
aminozuccheri uniti da un
legame glicosidico a un
nucleo esoso che
generalmente è in
Farmaci tossici ma utilissimi
Impiego limitato a causa della
resistenza
Mentre la maggior parte degli
inibitori della sintesi proteica
microbica è batteriostatica, gli
Gli aminoglicosidi penetrano la membrana esterna dei
gram- attraverso le porine e quindi entrano nello spazio
periplasmico
Il successivo trasporto degli amino glicosidi attraverso
la membrana interna dipende da un trasporto di
elettroni ossigeno-dipendente
Mancata penetrazione
dell’antibiotico (alterato
trasporto all’interno della
cellula)
(incapacità del farmaco di
penetrare la membrana interna)
Principalmnente
utilizzati nel
trattamento di
infezioni causate
da batteri aerobi
gram-
posizione centrale (non
importante)
Questi farmaci contengono
aminozuccheri uniti a un
aminociclitolo mediante
legami glicosidici
Sono dei policationi e la
loro polarità è in parte
responsabile delle
proprietà farmacocinetiche
condivise da tutti i membri
del gruppo
aminoglicosidi sono inibitori
battericidi della sintesi proteica
Rapida azione battericida
Dose-dipendenti (più è alta la
concentrazione del farmaco e
maggiore è la velocità con cui i
batteri vengono uccisi)
Effetto post-antibiotico
(persistente attività antibatterica
residua dopo che la
concentrazione plasmatica è
scesa al di sotto della MIC)
La durata di tale effetto è
anch’essa dose-dipendente
(il goodman parla di azione
battericida concentrazionedipendente; più alta è la
concentrazione, più elevata è la
velocità con la quale i batteri
vengono uccisi)
Questa fase di trasporto è stata denominata fase I
energia-dipendente, è dipendente dall’ossigeno e
rappresenta la fase limitante che può essere bloccata o
inibita da cationi bivalenti come Ca2+ e Mg2+,
iperosmolarità, riduzione del pH e anaerobiosi (le
ultime due condizioni diminuiscono la capacità dei
batteri di mantenere la forza trainante necessaria al
trasporto) quindi l’attività antimicrobica degli amino
glicosidi è fortemente ridotta nell’ambiente anaerobico
di un ascesso, nelle urine acide iperosmolari e in altre
condizioni che limitano la fase I (i batteri strettamente
anaerobi sono quindi resistenti a questi farmaci poiché
non hanno il necessario sistema di trasporto;
similmente, i batteri facoltativi generalmente sono
molto più resistenti quando sono cresciuti in condizioni
anaerobiche
Una volta all’interno della cellula, gli amino glicosidi si
legano ai polisomi e interferiscono con la sintesi
proteica causando un’errata decodificazione e
un’interruzione prematura della traduzione dell’mRNA
Le proteine aberranti prodotte possono essere inserite
nella membrana cellulare, determinando un’alterata
permeabilità e un ulteriore stimolo del trasporto degli
amino glicosidi
Questa fase del trasporto degli amino glicosidi,
denominata fase II energia-dipendente è legata alla
distruzione della struttura della membrana
citoplasmatica, forse da parte delle proteine aberranti
Questa progressiva distruzione della membrana
cellulare contribuisce a spiegare l’effetto letale degli
amino glicosidi
Gli amino glicosidi distruggono il normale ciclo
funzionale dei ribosomi interferendo, almeno in parte,
con l’inizio della sintesi proteica e portando a un
accumulo di complessi di iniziazione anomali o
monosomi streptomicinici
Un altro effetto degli amino glicosidi è la loro capacità
di indurre un’errata lettura dello stampo di mRNA
portando all’incorporazione di aminoacidi errati nelle
catene polipeptidiche in formazione
Quindi interferiscono con la sintesi proteica causando
un’errata decodificazione e un’interruzione prematura
della traduzione dell’mRNA portando a due effetti:
-accumulo di complessi di iniziazione anomali (o
I metaboliti degli amino
glicosidi possono competere
con il farmaco immodificato per
il trasporto intracellulare
attraverso la membrana interna
ma non sono in grado di legarsi
efficacemente ai ribosomi e di
interferire con la sintesi proteica
Bassa affinità del farmaco per il
ribosoma batterico
Inattivazione del farmaco da
parte di enzimi microbici che
metabolizzano gli amino
glicosidi (rappresenta
ampiamente il meccanismo più
importante dell’acquisizione
della resistenza microbica agli
amino glicosidi
Mutazioni a livello delle
proteine del ribosoma batterico
La streptomicina è
un importante
farmaco nel
trattamento della
tubercolosi
La loro attività
contro i gram+ è
limitata e non
dovrebbero essere
impiegati da soli
ma in associazioni
con dei farmaci
che agiscono nei
confronti della
parete cellulare
(penicillina o
vancomicina) con
i quali presentano
un effetto
battericida
sinergico
monosomi streptomicinici)
-produzione di proteine aberranti che possono essere
inserite nella membrana cellulare determinando
un’alterata permeabilità e un ulteriore stimolo al
trasporto degli amino glicosidi
Questa fase di trasporto è denominata fase II energiadipendente cui segue l’ingresso del farmaco nella
cellula batterica
L’inserimento delle proteine aberranti nella membrana
plasmatica determina la distruzione della sua struttura e
l’alterazione della sua permeabilità, condizioni che
portano a morte la cellula batterica
L’aminoglicoside si lega alla sub unità ribosomiale 30s
e interferisce con l’inizio della sintesi proteica legando
il complesso ribosomiale 30s-50s al codone d’inizio
(AUG) dell’mRNA
Quando a valle i complessi 30s-50s completano la
traduzione dell’mRNA e si staccano, i complessi di
iniziazione anomali, denominati monosomi
streptomicinici, si accumulano, bloccando l’ulteriore
traduzione del messaggio
L’aminoglicoside, legandosi alla sub unità 30s
determina anche un’alterata lettura dell’mRNA
portando a un’interruzione prematura della traduzione
con distacco del complesso ribosomiale e sintesi
incompleta della proteina o all’incorporazione di
aminoacidi errati, causando la produzione di proteine
anomale o non funzionali
LUCA GORDINI











