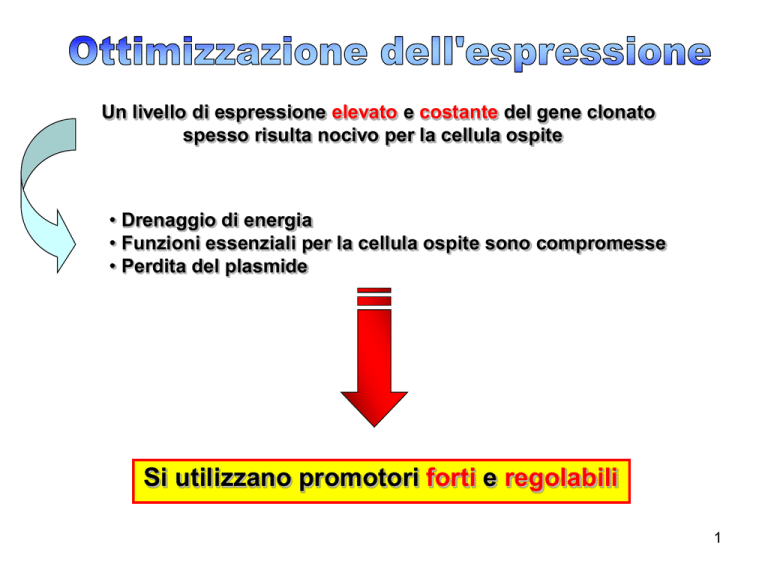
Un livello di espressione elevato e costante del gene clonato
spesso risulta nocivo per la cellula ospite
• Drenaggio di energia
• Funzioni essenziali per la cellula ospite sono compromesse
• Perdita del plasmide
Si utilizzano promotori forti e regolabili
1
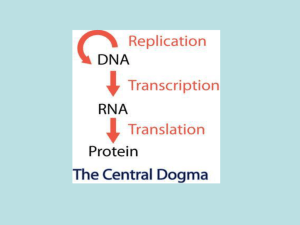
Il lattosio è un disaccaride costituito da galattosio e glucosio → quando
il batterio si trova in un ambiente che contiene lattosio come unica fonte di
zuccheri esprime i seguenti geni strutturali:
• β-galattosidasi: enzima codificato dal gene lacZ, catalizza l’idrolisi del
legame tra galattosio e glucosio
• Permeasi del lattosio: enzima trans-membrana che permette l’ingresso del
lattosio nella cellula dall’ambiente esterno → in assenza di tale enzima,
codificato dal gene lacY, la membrana è fondamentalmente impermeabile
al lattosio
• Tiogalattoside transacetilasi: enzima a funzione ignota, codificato dal gene
lacA
operone lac
2
Se nel mezzo di coltura manca il lattosio,
il promotore lac di E.coli è represso,
cioè spento, dalla proteina repressore lac,
la quale impedisce la trascrizione
dell’operone lac
L’induzione o l’accensione del promotore
lac
si
ottiene
aggiungendo
al
mezzo lattosio o un suo analogo
(isopropil-β-D-tiogalattopiranoside, IPTG)
Entrambe le sostanze impediscono che il
repressore lac si leghi all’operatore lac,
consentendo perciò la trascrizione
3
La trascrizione dell’operone lac è regolata anche dal legame della proteina
di attivazione da catabolita (CAP) alla regione del promotore
Legandosi al promotore, la CAP ne accresce l’affinità per l’enzima RNA
polimerasi, determinando un incremento della trascrizione dei geni a valle
del promotore
L’interazione della proteina CAP con il cAMP determina un incremento della
sua affinità per il promotore → l’elevata concentrazione intracellulare di
cAMP (segnale di carenza energetica) può determinare elevati livelli di
trascrizione dei geni a valle del promotore lac
4
Si tratta di un promotore piuttosto debole che non consente di ottenere
elevati livelli di produzione della proteina ricombinante
I geni lac sono trascritti a livelli significativi anche in assenza di induzione
→ è possibile, però, risolvere parzialmente il problema attraverso
l’espressione di versioni mutate del gene lacI, le quali determinano
un incremento dell’efficienza di legame del repressore al DNA
Nei vettori di espressione plasmidici è generalmente presente il promotore
lacUV5, variante del promotore lac, che contiene una sequenza nucleotidica
alterata nella regione -10 (cioè 10 coppie di nucleotidi a monte del sito di
inizio della trascrizione) ed è più forte del promotore lac presente in natura
5
Il promotore trp è regolato negativamente dal complesso triptofano-proteina
repressore di trp, che si lega all’operatore trp ed impedisce che l’operone trp
sia trascritto. L’attivazione del promotore trp si ottiene allontanando il
triptofano dal mezzo di coltura.
6
Il promotore tac è stato realizzato in vitro e comprende la regione -10 (cioè 10
coppie di nucleotidi a monte del sito di inizio della trascrizione) del promotore
lac e la regione -35 del promotore trp.
Anche il
promotore
tac
è
spento
dal repressore lac
ed attivato
dall’aggiunta di lattosio o di IPTG.
Tale promotore è risultato 5 volte più forte del promotore lac.
Il promotore tac è in grado di indurre l’espressione di geni bersaglio in modo
che il polipeptide codificato si possa accumulare a livelli pari al 20-30% della
massa proteica cellulare complessiva.
7
8
Il promotore pL è un promotore del batteriofago λ
E’ controllato dalla proteina repressore cI del batteriofago λ
Per regolare la trascrizione diretta da pL si utilizza generalmente un
mutante termosensibile del repressore cI, denominato cI857
Le cellule in possesso del repressore termosensibile sono fatte
crescere ad una temperatura di 28-30°C, temperatura alla quale il
repressore cI impedisce la trascrizione diretta dal promotore pL
Quando la coltura cellulare ha raggiunto lo stadio di crescita
desiderato (fase log intermedia), si innalza la temperatura a 42°C,
ciò che inattiva il repressore termosensibile cI e consente che la
trascrizione abbia luogo
Tale metodo consente di ottenere elevati livelli di produzione di
proteina ricombinante, ma lo stimolo termico necessario per indurre
la sua produzione può essere difficile da controllare
9
repressore
termosensibile
cI857
X
Gene di interesse
Se si innalza la temperatura
il repressore cI857 (termolabile) si inattiva
→ attivazione della trascrizione
10
Regulation by pL promoter
A 30°C
active cI protein
pcI
cI - ts
oL
pL
target gene
Temperatura permissiva: produzione del repressore
Regulation by pL promoter
B) 42°C
inactive cI protein
pcI
oL
cI - ts
pL
target gene
Temperatura restrittiva: repressore inattivo e induzione
dell’espressione del gene di interesse
12
Un secondo metodo per indurre tale promotore consiste nel porre il gene
cI sotto il controllo del promotore trp, il quale è strettamente regolato
L’espressione del gene bersaglio può essere indotta dall’aggiunta
dell’amminoacido triptofano al mezzo di coltura, ciò che impedirà la
trascrizione del gene cI, con la conseguente attivazione del promotore λpL
Questo sistema può essere controllato così strettamente da poter essere
utilizzato anche per produrre proteine altamente tossiche
13
Il promotore del batteriofago T7 è riconosciuto dalla RNA polimerasi del fago
Per servirsi di questo promotore si inserisce il gene della RNA polimerasi T7
nel cromosoma batterico, sotto il controllo del promotore tac
La trascrizione diretta da entrambi i promotori (T7 e tac) è indotta
dall’aggiunta di IPTG
In tali condizioni la polimerasi è prodotta ed il gene clonato è trascritto e
tradotto
Tra il momento in cui è indotta la trascrizione del gene della polimerasi T7 e
quello in cui è trascritto il gene bersaglio si verifica spesso un ritardo di
circa un’ora
Per trarre vantaggio dalla forza del promotore T7 è stata messa a punto una
serie di plasmidi detti vettori pET
Gli elevati livelli di espressione di questo sistema a cascata hanno spesso
reso necessaria l’introduzione nella cellula ospite di un altro plasmide, detto
pLysS, contenente il gene del lisozima del fago T7, che è in grado, legandosi
alla RNA polimerasi T7, di inattivarla
14
L’RNA polimerasi del fago T7 è così attiva e selettiva che il prodotto proteico
desiderato può costituire più del 50% delle proteine cellulari totali dopo
poche ore di induzione
I livelli di espressione possono essere ridotti diminuendo la concentrazione
di induttore
La riduzione dei livelli di espressione può incrementare la resa di proteina
di interesse in forma solubile
15
16
17
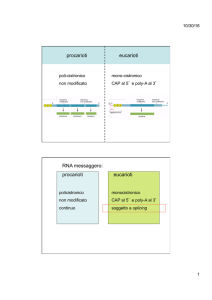
Il legame della proteina di attivazione da catabolita (CAP) alla regione del
promotore dipende dai livelli cellulari di cAMP
I livelli di cAMP sono fortemente influenzati dalla fonte di carbonio
presente nel mezzo di crescita
In presenza di glucosio i livelli di cAMP sono bassi ed il livello di
trascrizione sarà basso, dal momento che si osserverà una riduzione
dell’affinità della proteina CAP per il promotore
Quando il glucosio è assente e la cellula è forzata ad utilizzare una fonte
di carbonio alternativa, ad es. glicerolo, i livelli di cAMP aumentano e la
conseguente formazione del complesso CAP/cAMP attiva la trascrizione
a partire dal promotore lac
Dunque l’induzione completa dell’operone lac è raggiunta solo in
presenza sia dell’induttore sia di elevati livelli di cAMP
18
L’induttore IPTG lega il repressore, riducendo la sua affinità per l’operatore
lac, con conseguente attivazione della trascrizione
Quando i livelli di cAMP sono sufficientemente elevati, ad es. in assenza di
glucosio, il complesso CAP/cAMP che si forma lega immediatamente la
regione a monte del promotore, attivando ulteriormente la trascrizione
In presenza di glucosio, il complesso CAP/cAMP non si forma e la
trascrizione è ridotta (repressione da catabolita)
19
Il profago λDE3 codificante la RNA polimerasi T7 è posto sotto il controllo del
promotore L8-UV5, che ha 3 mutazioni puntiformi che lo distinguono dal
promotore lac wild type
Due mutazioni puntiformi nella regione -10 determinano un aumento di forza
del promotore ed una riduzione della sua dipendenza dalla stimolazione
CAP/cAMP
La terza mutazione è localizzata nel sito di legame al complesso CAP/cAMP e
determina una riduzione dell’affinità per tale complesso → tale mutazione
riduce, ma non elimina, la sensibilità alla repressione da catabolita
L’effetto delle 3 mutazioni è la creazione di un promotore più forte, ma meno
sensibile all’effetto del glucosio, ciò che consente una forte induzione
dell’espressione della RNA polimerasi da parte dell’IPTG in presenza di
glucosio
20
Sebbene il promotore L8-UV5 sia meno sensibile all’attivazione da parte del
complesso CAP/cAMP rispetto al promotore wild type, è stata riscontrata
una riduzione significativa della trascrizione basale in presenza di glucosio
Tale fenomeno risulta importante soprattutto quando gli ospiti batterici,
trasformati con un vettore di espressione pET e non dotati del plasmide
pLysS, sono fatti crescere fino a raggiungere la fase stazionaria
E’ stato infatti osservato che durante la fase stazionaria l’espressione
basale è massima
L’aggiunta di glucosio alla concentrazione finale di 0.5-1.0% al mezzo di
coltura LB previene l’incremento della trascrizione basale osservato in
colture batteriche che raggiungono la fase stazionaria
21
Uno svantaggio dell’utilizzo del glucosio risiede nel fatto che,
dopo una fase iniziale di crescita rapida, i prodotti del
catabolismo del glucosio determineranno una diminuzione del
pH del mezzo di coltura, con conseguente riduzione della
densità cellulare nella fase stazionaria
E’ stato osservato che una forte induzione della trascrizione del
gene della RNA polimerasi T7 può essere ottenuta in presenza di
glucosio
Bisogna comunque ricordare che i livelli più elevati di induzione
sono attesi quando il glucosio è assente ed i livelli di cAMP sono
elevati
22
Sebbene i promotori lac e L8-UV5 siano repressi in assenza di induttore,
entrambi mostrano una certa attività basale
Nel caso dei lisogeni λDE3, l’espressione di una piccola quota di RNA
polimerasi T7 può provocare problemi se il gene clonato nel vettore pET
codifica una proteina tossica per la cellula ospite → per tale motivo
ulteriori meccanismi di controllo sono costruiti nei vettori pET e negli
organismi ospiti
I vettori con un promotore “T7lac” hanno un promotore T7 seguito da
una sequenza operatore lac
In questi vettori il repressore si lega all’operatore, riducendo la
trascrizione da parte di eventuali molecole di RNA polimerasi T7 che
possono essere espresse in assenza di induttore
Un altro meccanismo di controllo è fornito dall’utilizzo di ospiti batterici
contenenti il plasmide pLysS, che esprime il lisozima T7, una proteina
che lega ed inibisce la RNA polimerasi T7
23
La necessità di adoperare tali meccanismi di regolazione aggiuntivi
dipende dal tipo di proteina ricombinante che si desidera esprimere → le
proteine più tossiche per le cellule batteriche sono quelle che richiedono
meccanismi di regolazione aggiuntivi
Le condizioni ottimali (inibizione stringente della trascrizione basale ed alti
livelli di espressione indotta) possono essere raggiunte facendo crescere
le cellule batteriche in presenza di glucosio per poi utilizzare un mezzo di
coltura privo di glucosio al momento dell’induzione
24
I ceppi batterici lisogeni per λDE3, trasformati con i vettori pET, possono
essere fatti crescere in una varietà di mezzi di coltura se le proteine
ricombinanti espresse non sono tossiche
E’ preferibile adoperare sia un vettore pET dotato di un promotore T7lac sia
ospiti batterici dotati del plasmide pLysS nel caso in cui le proteine
ricombinanti siano potenzialmente tossiche per la cellula batterica ospite
In generale è preferibile che un ceppo lisogeno per λDE3, trasformato con
un plasmide pET contenente il gene di interesse, non raggiunga la fase
stazionaria
In caso contrario è preferibile aggiungere glucosio 0.5-1.0% al mezzo di
coltura, in modo da ridurre la trascrizione basale
25
In alcuni casi è necessario rimuovere il gluciosio dal
mezzo di coltura affinchè si realizzi un’efficiente
induzione dell’espressione della proteina ricombinante
di interesse.
26
Una strategia alternativa, adatta all’espressione di geni i cui prodotti sono
molto tossici per la cellula ospite, consiste nell’introduzione della RNA
polimerasi T7 mediante infezione con il batteriofago CE6
CE6 è un fago λ ricombinante contenente il gene della RNA polimerasi
sotto il controllo del promotore pL e del repressore termosensibile cI857
Quando il fago CE6 infetta un determinato ospite, l’RNA polimerasi
di nuova sintesi trascrive il DNA bersaglio in maniera così attiva che il
normale sviluppo del fago non può procedere
Sebbene tale metodo sia meno conveniente dell’induzione del lisogeno
DE3, è preferibile in quei casi in cui il prodotto proteico ricombinante è
troppo tossico per essere mantenuto in altro modo
Nessuna molecola di RNA polimerasi T7 è presente nella cellula prima
dell’infezione, ciò che consente di esprimere in questo modo un
qualunque DNA bersaglio clonato sotto il controllo di un promotore T7
27
Produzione di Proteine Ricombinanti
pET-22b(+)
28
29
30
31
Il legame della proteina di attivazione da catabolita (CAP) alla regione del
promotore dipende dai livelli cellulari di cAMP
I livelli di cAMP sono fortemente influenzati dalla fonte di carbonio
presente nel mezzo di crescita
In presenza di glucosio i livelli di cAMP sono bassi ed il livello di
trascrizione sarà basso, dal momento che si osserverà una riduzione
dell’affinità della proteina CAP per il promotore
Quando il glucosio è assente e la cellula è forzata ad utilizzare una fonte
di carbonio alternativa, ad es. glicerolo, i livelli di cAMP aumentano e la
conseguente formazione del complesso CAP/cAMP attiva la trascrizione
a partire dal promotore lac
Dunque l’induzione completa dell’operone lac è raggiunta solo in
presenza sia dell’induttore sia di elevati livelli di cAMP
32
L’induttore IPTG lega il repressore, riducendo la sua affinità per l’operatore
lac, con conseguente attivazione della trascrizione
Quando i livelli di cAMP sono sufficientemente elevati, ad es. in assenza di
glucosio, il complesso CAP/cAMP che si forma lega immediatamente la
regione a monte del promotore, attivando ulteriormente la trascrizione
In presenza di glucosio, il complesso CAP/cAMP non si forma e la
trascrizione è ridotta (repressione da catabolita)
33
Il profago λDE3 codificante la RNA polimerasi T7 è posto sotto il controllo del
promotore L8-UV5, che ha 3 mutazioni puntiformi che lo distinguono dal
promotore lac wild type
Due mutazioni puntiformi nella regione -10 determinano un aumento di forza
del promotore ed una riduzione della sua dipendenza dalla stimolazione
CAP/cAMP
La terza mutazione è localizzata nel sito di legame al complesso CAP/cAMP e
determina una riduzione dell’affinità per tale complesso → tale mutazione
riduce, ma non elimina, la sensibilità alla repressione da catabolita
L’effetto delle 3 mutazioni è la creazione di un promotore più forte, ma meno
sensibile all’effetto del glucosio, ciò che consente una forte induzione
dell’espressione della RNA polimerasi da parte dell’IPTG in presenza di
glucosio
34