1
A.S. 2016-17
INDIRIZZO
TECNOLOGICO: CHIMICO, MATERIALI E BIOTECNOLOGIE;
ARTICOLAZIONE: BIOTECNOLOGIE SANITARIE
PROGRAMMA PREVENTIVO
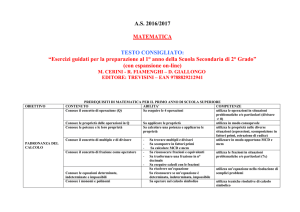
SCIENZE INTEGRATE: CHIMICA E LABORATORIO
DOCENTE
Prof. ALESSANDRO VILLA
Prof. CARLA BISARO
CLASSE
I_B BIO
I_B BIO_
Ore settimanali: 3 (1)
FINALITA' E OBIETTIVI
COMPETENZE TRASVERSALI
Saper distinguere tra osservazioni, dati sperimentali e teorie scientifiche.
Saper riassumere i fenomeni e i fatti oggetto di studio.
Saper esprimere il risultato di un calcolo con le corrette unità di misura.
Saper gestire le informazioni acquisite così da organizzare le attività sperimentali.
Saper trarre conclusioni basate sui risultati ottenuti.
Saper redigere relazioni tecniche.
Saper risolvere situazioni problematiche utilizzando linguaggi specifici.
COMPETENZE DELLA DISCIPLINA
Osservare, descrivere ed analizzare fenomeni appartenenti alla realtà naturale ed
artificiale.
Analizzare
qualitativamente
e
quantitativamente
fenomeni
legati
alle
trasformazioni della materia a partire dall'esperienza.
Riconoscere che un miscuglio è costituito da componenti diversi, ciascuno dei quali
risponde in modo specifico alle tecniche di separazione.
2
Effettuare sulla base di tecniche conosciute, la
separazione dei componenti di un
miscuglio, fino ad ottenere sostanze pure, riconoscendo che l’operazione ha termine
quando si riscontra l’invarianza delle proprietà dei componenti ottenuti. Enunciare i principi
di conservazione che regolano le reazioni chimiche. Utilizzare la quantità di sostanza per
definire i rapporti stechiometrici e per esprimere la concentrazione delle soluzioni.
Utilizzare la struttura degli atomi in termini di protoni, neutroni ed elettroni, distinguendo
queste particelle subatomiche in base alla massa ed alla carica e collocandole
opportunamente all’interno dell’atomo.
Descrivere le interazioni atomiche in termini di legame covalente, covalente polare e
ionico.
Modulo 1
INTRODUZIONE ALLA CHIMICA
Contenuti
U.D. 1: Materia e sue proprietà
Campo d’indagine della chimica.
La materia: massa ed energia.
La materia: sostanza (elementare e composta), miscuglio (omogeneo ed
eterogeneo).
La materia: stati di aggregazione.
La materia:stato fisico (trasformazioni di stato), chimico (reazioni chimiche).
La materia: la struttura della materia determina le proprietà chimiche.
Introduzione alla tavola periodica: elementi chimici e i loro simboli.
U.D. 2: Le Trasformazioni della materia
Energia, calore e temperatura.
Gli stati di aggregazione.
Trasformazioni fisiche e chimiche.
I passaggi di stato di aggregazione.
Curve di riscaldamento e raffreddamento.
Volume e densità.
U.D. 3:Teoria atomica della materia
L’idea “filosofica” dell’atomo.
3
Le leggi ponderali (Lavoisier, Proust, Dalton)
Il modello atomico di Dalton.
Modulo 2
LA QUANTITA’ DI SOSTANZA
Contenuti
U.D. 1: Quantità di Sostanza
L a massa atomica.
La massa formula.
La mole.
Introduzione ai calcoli stechiometrici.
U.D. 2: Le Soluzioni
Soluto e Solvente.
Concentrazione di una soluzione.
Le percentuali.
La molarità.
Modulo 3
LA STRUTTURA ELETTRONICA DELL’ATOMO
Contenuti
U.D. 1: Le particelle sub-atomiche
Le particelle sub-atomiche scoperte negli esperimenti storici (Thomson,
Rutherford).
Modello nucleare dell'atomo.
Numero atomico e numero di massa.
Gli isotopi.
U.D. 2: La meccanica quantistica
Radiazione ed elettromagnetismo (breve introduzione).
L'equazione di Planck
4
L'atomo di Bohr
Il dualismo onda-particella.
Il principio di indeterminazione
U.D. 3: La configurazione elettronica
Gli stati stazionari: livelli e sottolivelli energetici
I numeri quantici.
Lo spin ed il Principio di Pauli.
La configurazione elettronica degli elementi.
Gli orbitali atomici.
Modulo 4
IL LEGAME CHIMICO
Contenuti
U.D. 1:Il sistema periodico
La tavola periodica moderna
I simboli di Lewis
Le proprietà periodiche: E.I. e A.E.
U.D. 2:I legami chimici
Il legame ionico
Il legame covalente.
L'elettronegatività.
Il legame covalente polare.
La polarità nei legami covalenti.
5
Modulo 5
LA NOMENCLATURA INORGANICA
Le principali classi di composti
Ossidi basici e ossidi acidi
Idrossidi e acidi
Sali
Nomenclatura tradizionale
I.U.P.A.C.
Stock
6
MODULO DI LABORATORIO
Esperienze
U.D. Lab:
Introduzione al laboratorio di chimica e sicurezza.
o La misura delle grandezze
o La densità.
Miscugli e sostanze.
o Tecniche di separazione.
o Elementi, composti e miscugli.
Trasformazioni fisiche e chimiche
o Passaggi di stato.
o Le trasformazioni chimiche.
Le reazioni chimiche.
o Reazioni chimiche.
o Tavola Periodica
Modello atomico.
o Legge di Lavoisier.
o Legge di Proust
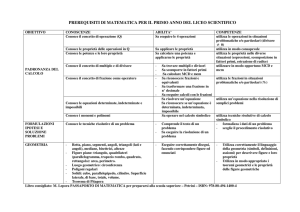
Conoscenze
Mod.
1
Conosce
il
Abilità
significato
dell’ Sa
riconoscere
una
sostanza
da
un
espressione metodo scientifico, modello, miscuglio; un elemento da un composto;
teoria. Sa definire i concetti di: materia, una trasformazione fisica da una chimica.
massa, energia, sistema macroscopico e E’ in grado di individuare le caratteristiche
microscopico. Conosce la differenza tra di
un
elemento
chimico
dalla
proprietà chimica e fisica. Conosce la collocazione nella tabella periodica.
differenza
tra
proprietà
estensiva.
Conosce
la
intensiva
ed
differenza
tra
sostanza e miscuglio. Sa definire i concetti
di: energia, calore, temperatura. Conosce
gli stati di aggregazione della materia. Sa
sua
7
riconoscere una trasformazione chimica da
una
fisica.
Conosce
gli
stati
di
aggregazione della materia e i relativi
passaggi di stato. Sa “leggere” la tabella
periodica degli elementi. Sa enunciare le
leggi ponderali. Conosce la teoria atomica
di Dalton.
Mod. 2 Conosce l’unità di misure delle
Sa calcolare le masse formula. Sa eseguire
masse atomiche. Conosce il concetto di
dei semplici calcoli stechiometrici su
massa formula. Sa definire l’unità di misura reazioni di non equilibrio. Sa “usare” la
della quantità di sostanza. Conosce il
concentrazione di una soluzione.
concetto di massa molare. Conosce il
concetto di soluzione e di concentrazione
di una soluzione.
Mod. 3 Sa descrivere l’atomo attraverso il
Sa “usare” il numero atomico ed il numero
modello nucleare. Conosce le principali
di massa. Sa distinguere un elemento da
particelle sub atomiche. Sa definire il
un composto alla luce del modello atomico
numero atomico ed il numero di massa.
della materia. Sa eseguire semplici calcoli
Conosce il concetto di isotopo. Conosce il
sui nucleoni. Sa costruire le configurazioni
concetto di ione. Conosce la differenza tra
elettroniche.
grandezza fisica continua e grandezza
periodica alle configurazione degli elementi.
Sa
correlare
la
tavola
fisica quantizzata. Conosce il modello
atomico di Bohr. Sa definire il modello
atomico “quantistico”. Sa costruire le
configurazioni elettroniche. Conosce la
classificazione degli elementi per numero
atomico crescente
Mod. 4 Conosce i concetti di E.I EA. Sa Correla le grandezze fisiche periodiche alle
descrivere il legame ionico. Conosce la configurazioni elettroniche e alla tavola
simbologia di Lewis di atomi e molecole. periodica. Mette in relazione EI, AE con la
Sa
descrivere
il
legame
covalente probabilità che si formi un legame ionico.
Conosce il concetto di Elettonegatività.
Interpreta il diagramma % di ionicità di un
legame vs differenza di elettronegatività..
8
Mod. 5
composti.
Conosce le principali classi di Sa rappresentare ossidi. Sa distinguere tra
Conosce formule
di ossidi. ossidi
basici
Conosce le formule di acidi, idrossidi e rappresentare
Sali. Conosce le regole di assegnazione di riconoscere
e
e
ossidi
acidi
e
acidi.
Sa
idrossidi.
Sa
rappresentare
Sali.
Sa
nomi secondo nomenclatura tradizionale. attribuire nomi a partire da formule a ossidi,
Conosce
la
nomenclatura
I.U.P.A.C. acidi, idrossidi e Sali secondo le varie
Conosce la nomenclatura secondo Stock.
nomenclature adottate.
Modulo di Laboratorio
Nozioni sulla lettura delle etichette e sulla
pericolosità di elementi e composti.
Sistemi eterogenei ed omogenei e tecniche
di separazione: filtrazione, distillazione,
cristallizzazione, cromatografia.
Il modello particellare (concetti di atomo,
molecola e ioni) e le spiegazioni delle
trasformazioni fisiche (passaggi di stato) e
chimiche.
Le leggi ponderali della chimica e l'ipotesi
atomica della materia. Il sistema periodico e
le proprietà periodiche; metalli, non metalli,
semimetalli
METODOLOGIA DIDATTICA
1. Lezione frontale e video proiezione.
2. Esercitazioni di laboratorio.
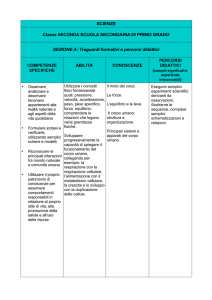
CRITERI DI VALUTAZIONE
GIUDIZIO
Sigla sul VOTO
DESCRITTORI
PRESTAZIONE registro
NULLO-NEGATIVO
1
Prova non svolta.
NULLO-NEGATIVO
2
Prova non svolta per la sua quasi totalità.
NEGATIVO
3
Gravemente carente nei contenuti, mancanza di
GI
linguaggio specifico ed aderenza alla traccia,
esposizione confusa.
9
GRAV.
INSUFFICIENTE
INSUFFICIENTE
4
5
I
SCARSO
5,5
SC
SUFFICIENTE
6
Contenuto corretto anche se non completo,
linguaggio specifico ed aderenza alla traccia
accettabili, esposizione accettabile.
7
Contenuto corretto e quasi completo, linguaggio
specifico ed aderenza alla traccia accettabili,
esposizione accettabile.
Contenuto corretto e completo, linguaggio specifico
ed aderenza alla traccia corretti, esposizione
corretta.
Contenuto corretto, completo e rigoroso, linguaggio
specifico ed aderenza alla traccia corretti,
esposizione corretta.
Contenuto corretto, completo e rigoroso, linguaggio
specifico ed aderenza alla traccia corretti,
esposizione eccellente.
S
DISCRETO
D
BUONO
B
OTTIMO
8
9
O
ECCELLENTE
Carente nei contenuti, nel linguaggio specifico e
nell’aderenza alla traccia, esposizione confusa.
Contenuti parziali e con errori, linguaggio specifico
ed aderenza alla traccia accettabili, esposizione
confusa.
Contenuti parziali ma corretti, linguaggio specifico
ed aderenza alla traccia accettabili, esposizione
accettabile.
10
STRUMENTI
Appunti presi durante le lezioni.
Protocolli delle esercitazioni di laboratorio.
Laboratorio di chimica generale.
Utilizzo tablet/LIM/ rete.
LIBRO DI TESTO
J. E. Brady F. Senese
CHIMICA
Zanichelli