CUORE D’ATLETA
Secondo Morganroth (1975) gli atleti praticanti sport di resistenza (corsa, nuoto, ecc.) presentano
aumento della cavità ventricolare sin. con normale spessore parietale, risultato di un cronico sovraccarico
di volume, mentre gli atleti praticanti sport di potenza (sollev. pesi, lancio, ecc.) presentano aumento dello
spessore delle pareti ventricolari con normali dimensioni della cavità, risultato di un cronico sovraccarico
di pressione.
Osservazioni successive hanno dimostrato che gli atleti praticanti sport di resistenza possono sviluppare
importante ipertrofia delle pareti ventricolari e quelli praticanti sport di potenza non mostrano usualmente
una reale ipertrofia delle pareti.
Le discipline di resistenza (ciclismo, canottaggio, nuoto, sci di fondo) e le specialità di fondo e mezzo
fondo dell’atletica leggera hanno la maggiore influenza nel modificare le dimensioni della cavità e delle
pareti ventricolari. L’effetto delle varie discipline è simile per la cavità e per le pareti, tranne che per le
attività di potenza di potenza, in cui è maggiore l’effetto sull’ispessimento parietale.
Durante attività di resistenza si verificano un aumento della portata cardiaca, che diventa superiore 30
L/min, ed un aumento dellanpressione arteriosa sistolica, che può superare i 200 mmHg.
L’impegno emodinamico (sovraccarico di volume e di pressione) viene mantenuto per un periodo
prolungato (>30 ore/settimana) durante gli allenamenti e durante le gare, che comportano anche un
impegno neuropsichico.
Nelle disciplime sportive di potenza si verifica un importante
sovraccarico di pressione (>300 mmHg sistolica e >200 mmHg diastolica).
La durata del sovraccarico è breve, limitata ai momenti in cui viene eseguito lo sforzo (di solito non
supera 6 ore/settimana) e pertanto non è tale da indurre un significativo rimodellamento ventricolare.
CARDIOMIOPATIE
Processi morbosi che colpiscono elettivamente il muscolo cardiaco e non sono la conseguenza di altre
affezioni cardiovascolari, quali l’ipertensione arteriosa, la cardiopatia ischemica, le valvulopatie e le
cardiopatie congenite.
Classificazione eziologica
Le cardiomiopatie si classificano in Primitive, cioè malattie del muscolo cardiaco da causa sconosciuta, e
Secondarie, cioè malattie del miocardio da causa nota, oppure secondarie a malattie che coinvolgono altri
organi e apparati.
Le principali forme cliniche sono di cardiomiopatie sono: IPERTROFICA, DILATATIVA e
RESTRITTIVA.
Cardiomiopatia Ipertrofica
E’ caratterizzata da un’importante ipertrofia del ventricolo sinistro, che non è associata a dilatazione (la
cavità ventricolare è anzi piccola) e non è associata alle condizioni che notoriamente producono
ipertrofia ventricolare sinistra, come l’ipertensione arteriosa o la stenosi aortica.
Differisce dalle forme di ipertrofia secondaria in quanto interessa soprattutto il setto interventricolare e
talvolta la parete anterolaterale, con cospicua differenza tra spessore del setto e della parete posteriore.
E’ inoltre caratterizzata da una bizzarra forma di ipertrofia delle cellule miocardiche, con anomalie della
struttura, dell’orientamento e della distribuzione, anomalia che viene definita disarrangiamento
(disarray), soprattutto a carico del setto interventricolare.
Nella cardiomiopatia ipertrofica si verifica un’accentuata contrattilità ventricolare, con una frazione
d’eiezione del ventricolo sinistro superiore al normale.
Esiste una forma “ostruttiva”: l’ipertrofia del setto fa sì che durante la sistole si crei un’ostruzione
dinamica allo svuotamento del ventricolo sinistro in aorta (stenosi aortica dinamica). L’ispessimento
sistolico del setto è sempre accompagnato da un anomalo movimento sistolico della mitrale verso il setto
interventricolare (SAM) e c’è una stretta correlazione tra il tempo di contatto del SAM ed il grado di
ostruzione.
Fisiopatologia
La compliance del ventricolo sinistro è ridotta, il ventricolo è rigido, non cedevole. Inoltre la cavità
ventricolare è relativamente piccola. Da ciò deriva aumento della pressione che deve esercitare l’atrio
sinistro per spingere il sangue nel ventricolo sottostante.
L’ostruzione all’efflusso determina grave difficoltà ad aumentare la gittata quando il paziente compie
sforzi e, conseguentemente, dispnea da sforzo, lipotimie o sincopi da sforzo, nonchè dilatazione dell’atrio
sinistro e stasi che, alla lunga, si ripercuote sul circolo polmonare.
L’insufficiente rilasciamento diastolico del ventricolo, assieme all’ipertrofia, è causa frequente di angina
pectoris.
Ostruzione all’efflusso: l’ipertrofia settale determina deformazione della geometria del tratto di efflusso,
con spostamento sistolico del lembo anteriore della mitrale (SAM) verso il setto, provocata dall’alta
velocità del flusso ematico nel tratto di efflusso (effetto Venturi).
Sintomatologia
La maggior parte dei pazienti è asintomatica e la malattia viene diagnostica occasionalmente.
Il sintomo più frequente è la dispnea da sforzo, come conseguenza di un’elevata pressione di riempimento
del ventricolo sinistro e quindi atriale sinistra e delle vene polmonari.
Un altro sintomo è l’angina da sforzo, conseguenza soprattutto dell’alterato equilibrio tra domanda e
apporto di ossigeno ad un muscolo ipertrofico.
Il 20% dei pazienti presenta sincope o lipotimie, che talvolta possono comparire da sforzo o nella
posizione eretta. Potenziali meccanismi della sincope possono essere anche: aritmie ventricolari e
sopraventricolari, malattia del nodo del seno e del nodo A-V. L’insorgenza di aritmie ventricolari gravi
può essere causa di morte improvvisa, che a volte può essere la prima manifestazione della patologia,
soprattutto in atleti.
Cardiomiopatia ipertrofica e cuore d’atleta
La Morte Improvvisa, spesso in relazione all’attività fisica, può essere la prima manifestazione clinica
della malattia.
La diagnosi differenziale tra cardiomiopatia ipertrofica e cuore d’atleta può essere ancora più difficile
quando la malattia ha un’espressività modesta, con spessore non eccessivamente aumentato.
Considerato che nella maggio parte dei casi la cardiomiopatia ipertrofica è una patologia ereditaria, la
valutazione dell’atleta con ipertrofia dubbia deve essere completata dallo screening clinico ed
ecocardiografico dei familiari: il riscontro di ipertrofia in uno dei familiari conferma la diagnosi di
cardiomiopatia ipertrofica.
Lo screening genetico è una tecnica utile, ma con lunghi tempi di esecuzione e costi elevati, per cui non
viene attualmente utilizzato come routine.
Entità, sviluppo e distribuzione dell’ipertrofia miocardica: Nei pz con cardiomiopatia ipertrofica lo
spessore medio delle pareti è di 22 mm, con variabilità da 16 a 60 mm. Il massimo spessore negli atleti
ben allenati non supera i 15-16 mm. Nella maggioranza dei pazienti con cardiomiopatia ipertrofica lo
sviluppo dell’ipertrofia ed il rimodellamento avvengono durante l’adolescenza, in associazione allo
sviluppo corporeo. Nella cardiomiopatia ipertrofica l’ipertrofia è asimmetrica, mentre nel cuore d’atleta la
distribuzione dell’ipertrofia è simmetrica
Cavità ventricolare sinistra: nella cardiomiopatia ipertrofica le dimensioni della cavità sono ridotte e la
geometria del ventricolo sinistro è anormale. Nel cuore d’atleta le dimensioni della cavità sono aumentate
e la conformazione spaziale del ventricolo sinistro è normale.
Gli atleti con ipertrofia dopo un periodo di disallenamento di circa tre mesi mostrano una significativa
riduzione dello spessore parietale (circa 3 mm).
Le alterazioni morfologiche dell’elettrocardiogramma nella cardiomiopatia ipertrofica sono simili a quelle
che si possono verificare negli atleti con ipertrofia.
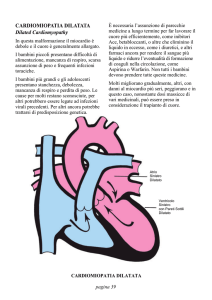
Cardiomiopatia dilatativa
Malattia del miocardio caratterizzata da dilatazione e depressa funzione sistolica del ventricolo sinistro.
Può essere secondaria a numerose malattie sistemiche. Si manifesta anche in associazione a malattie
valvolari, ipertensione arteriosa o cardiopatia ischemica.
L’eziologia della cardiomiopatia dilatativa nella maggior parte dei casi è ignota, per cui viene definita
idiopatica. In circa un quarto dei pazienti si presenta come malattia familiare, dimostrata dalla presenza di
più soggetti con le stesse caratteristiche della malattia nella stessa famiglia o dal sospetto anamnestico. La
modalità con cui viene ereditata è prevalentemente di tipo autosomico dominante.
È stato ipotizzato che parte dei casi idiopatici derivino da un meccanismo autoimmune, conseguenza, a
sua volta, di un’infezione virale in un soggetto predisposto.
In alcuni casi la malattia è sicuramente dovuta all’effetto tossico dell’alcool sul miocardio, si può
assistere infatti alla regressione della disfunzione ventricolare in seguito all’astensione dall’alcool.
Può anche manifestarsi al termine della gravidanza o dopo il parto. In queste pazienti la gravidanza può
avere svelato una patologia preesistente o aver determinato l’insorgenza della cardiopatia, verosimilmente
attraverso un processo autoimmune.
Il cuore è globalmente ingrandito e le cavità sono dilatate, con pareti inizialmente di spessore normale,
ma che, con il passare del tempo, si assottigliano progressivamente. Gli apparati valvolari e le coronarie
sono anatomicamente normali.
Istologicamente si apprezzano alterazioni aspecifiche, comunemente presenti in altre situazioni
caratterizzate da importante dilatazione ventricolare.
Marcata dilatazione biventricolare con assottigliamento delle pareti
Fisiopatologia
La fisiopatologia della cardiomiopatia dilatativa è caratterizzata dalla riduzione della contrattilità
miocardica e dalla riduzione della funzione sistolica ventricolare, di solito prevalentemente del ventricolo
sinistro. La dilatazione mantiene, inizialmente, la gittata sistolica e la portata cardiaca, ma tende a far
aumentare la pressione telediastolica ventricolare.
La dilatazione del ventricolo sinistro non si accompagna ad un grado di ipertrofia sufficiente a mantenere
nella norma lo stress di parete, misura del post-carico ventricolare. Ciò determina un aumentato consumo
di ossigeno e crea le conseguenze per il deterioramento delle funzioni del ventricolo sinistro, con
conseguente riduzione della portata cardiaca.
La dislocazione dei muscoli papillari, dovuta alla dilatazione del ventricolo sinistro, determina
un’insufficienza mitralica secondaria. L’aumento della pressione telediastolica e il rigurgito mitralico
determinano l’aumento della pressione nelle cavità a monte (atrio sinistro, vene e capillari polmonari) e
la comparsa dei sintomi e segni dello scompenso sinistro.
Si instaura progressivamente l’ipertensione polmonare, che contribuisce a deteriorare la funzione del
ventricolo destro, con comparsa del reflusso tricuspidale. Il reflusso tricuspidale e l’aumento della
pressione telediastolica del ventricolo destro determinano l’aumento della pressione nell’atrio destro e
nelle vene sistemiche, con la comparsa dei segni dello scompenso destro.
Sintomatologia
I sintomi più importanti sono dispnea, astenia, facile affaticabilità e cardiopalmo.,
Cardiomiopatia dilatativa e cuore d’atleta
Il problema della diagnosi differenziale si pone quando nell’atleta la cavità ventricolare è molto
aumentata (il limite dell’ingrandimento da allenamento è 70 mm)
Negli atleti l’ingrandimento è gobale ed omogeneo, per cui la geometria ventricolare non è alterata, lo
spessore delle pareti è normale o aumentato e il rapporto raggio/spessore è normale.
Nella cardiomiopatia dilatativa la dilatazione si associa a rimodellamento, per cui il ventricolo assume un
aspetto globoso, lo spessore è ridotto o se normale il rapporto raggio/spessore è ridotto. E’ spesso
presente insufficienza mitralica.
La funzione ventricolare negli atleti è normale, con frazione di eiezione superiore al 50%, mentre nei
pazienti con cardiomiopatia dilatativa è ridotta.
Cardiomiopatia restrittiva
La cardiomiopatia restrittiva è più rara rispetto alle forme ipertrofica e dilatativa. In generale si definisce
restrittiva una malattia del miocardio caratterizzata da alterata distensibilità dei ventricoli, che sono di
normali dimensioni e con funzione sistolica normale o poco alterata.
La forma primaria è caratterizzata da un’alterata funzione diastolica ventricolare in assenza di un grado di
ipertrofia parietale che possa spiegarla. La funzione sistolica è, di solito, normale.
All’istologia il reperto più frequente è la fibrosi interstiziale.
L’aumentata rigidità è imputabile alla fibrosi e non all’ipertrofia di parete. La ridotta distensibilità di
entrambi i ventricoli si traduce in un aumento della pressione telediastolica, di solito più rilevante a
sinistra. L’aumentata pressione di riempimento ventricolare causa aumento della pressione negli atri, che
si dilatano, e dei distretti venosi sistemico e polmonare.
I sintomi più frequenti sono l’astenia e la dispnea da sforzo.
Obiettivamente sono spesso presenti i segni periferici dello scompenso del cuore destro (edemi declivi,
epatomegalia, turgore delle giugulari) e/o sinistro (rumori inspiratori umidi polmonari).
Cardiomiopatia aritmogena del ventricolo destro
Malattia primitiva del miocardio che interessa in modo particolare il ventricolo destro.
Su base ereditaria in circa il 40% dei casi.
È caratterizzata dal punto di vista istologico da sostituzione fibro-adiposa del miocardio ventricolare.
La manifestazione clinica più rilevante è la morte improvvisa, spesso precipitata dall’esercizio fisico,
determinata da gravi aritmie ventricolari.
Manifestazione clinica
Si distinguono una fase occulta o silente, in cui sono presenti alterazioni strutturali del ventricolo destro
sfumate, associate o meno a manifestazioni aritmiche minori. In questa fase la Morte Improvvisa può
rappresentare la prima e definitiva manifestazione clinica della malattia, soprattutto in soggetti giovani
impegnati in attività fisica o competizioni sportive.
Una Fase di scompenso cardiaco destro, dovuta alla progressiva perdita di miocardio ventricolare destro,
che ne causa una progressiva disfunzione contrattile, in presenza di conservata funzione di pompa del
ventricolo sinistro.
Una Fase di scompenso cardiaco biventricolare, caratterizzata dal coinvolgimento del setto e del
ventricolo sinistro (simula una cardiomiopatia dilatativa biventricolare) che porta allo scompenso
congestizio ed alle complicanze correlare (fibrillazione atriale con o meno eventi tromboembolici).
Diagnosi
La diagnosi precoce è molto importante per la prevenzione della morte improvvisa negli atleti.
Negli atleti il ventricolo destro subisce un rimodellamento che in alcuni casi può creare problemi di
diagnosi differenziale. Inoltre in atleti di fondo rispetto ai controlli l’area della cavità ventricolare è
aumentata del 26% e lo spessore del 22%.
Cardiomiopatia aritmogena del ventricolo destro e cuore d’atleta
Morfologia e cinesi del ventricolo dx Nel cuore d’atleta l’ingrandimento è globale, senza alterazioni della
geometria ventricolare e lo spessore è normale.
Nella cardiomiopatia aritmogena le alterazioni sono spesso limitate ad alcune zone della parete libera,
spesso in associazione ad anomalie distrettuali della funzione sistolica.
La risonanza magnetica permette una migliore definizione delle caratteristiche anatomiche delle pareti,
della geometria della camera ventricolare e permette di rilevare l’alterata intensità del segnale,
caratteristica dell’infiltrazione fibro-adiposa
Elettrocardiogramma Può non essere utile per la diagnosi differenziale, ma il riscontro di tachicardia
ventricolare con aspetto a blocco di branca sinistra è assente nel cuore d’atleta e suggestivo per
cardiomiopatia aritmogena.