Riassunto delle lezioni precedenti…..
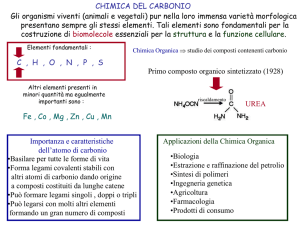
Chimica del Carbonio
L’atomo di Carbonio può formare legami singoli, legami
doppi e legami tripli
IDROCARBURI
formati solo da carbonio e idrogeno
Si dividono in 3 classi:
1) SATURI
2) INSATURI
3) AROMATICI
Legami semplici
C-C
Legami multipli
C=C
CΞC
composti ciclici,
presenza anelli
benzenici
IDROCARBURI
formati solo da carbonio e idrogeno
Si dividono in 3 classi:
1) SATURI
catena
aperta
cicloAlcani
Alifatici
2) INSATURI
3) AROMATICI
Alcani
Alcheni
Alchini
Ciclici
cicloAlcheni
cicloAlchini
ISOMERIA :
molecole con lo stesso numero e tipo di
atomi ma con diverse disposizioni degli
atomi nello spazio
ISOMERI CONFORMAZIONALI:
forme diverse della stessa molecola che
possono trasformarsi le une nelle altre
per rotazioni intorno a legami semplici
ETANO:
CH3CH3
STEREOISOMERIA :
Gli atomi sono legati nella stessa sequenza ma con
diverse disposizioni nello spazio
ISOMERIA cis-trans :
Nei cicloalcani che hanno almeno due sostituenti
NON SI
POSSONO
INTERCONVERTIRE
cis
Sostituenti dalla stessa parte
trans
Sostituenti da parti opposte
ISOMERI CONFIGURAZIONALI
ALCHENI
Formula generale: CnH2n n=2,3,4…
Sono idrocarburi insaturi
contengono lungo la catena 1 o più doppi
legami carbonio-carbonio
Etene
C 2H4
CH2
Desinenza: -ene
H
CH2
C
H
H
H
H
H
H
H
C
I doppi legami possono essere:
1) CUMULATI:
I doppi legami si trovano in
successione
2) CONIUGATI:
I doppi legami si trovano
alternati con legami semplici
3) ISOLATI:
(non CONIUGATI)
I doppi legami si trovano
separati da più legami
semplici
Isomeria cis-trans
STEREOISOMERIA GEOMETRICA:
Ogni C del doppio legame deve essere legato a
due atomi o gruppi differenti
cis butene
trans butene
H
H
C
H3C
C
CH3
H
C
CH3
H3C
C
H
ALCHINI
Formula generale:
CnH2n-2
n=2,3,4…
1
HC
2
2
CH
1
• Idrocarburi
insaturi
• Presenza di tripli
legami C Ξ C
• Desinenza -ino
1
HC
2 3
CCH3
Etino
Propino
ETEROCICLICI AROMATICI
composti ciclici con l’anello formato non solo da atomi di C e H ma con
eteroatomi es O,N,S
anello a 6 atomi
anello a 5 atomi
piridina
pirimidina
Eterociclici con anelli condensati
Benzene+pirrolo = INDOLO
N
H
N
N
N
imidazolo
N
H
N
N
H
Pirimidina + Imidazolo =
PURINA
Gruppi Funzionali
Gruppi Funzionali
• Atomo o gruppi di atomi presenti
H
H C OH
H C OH
H C OH
H
all’interno di una molecola con
proprietà chimiche e fisiche
caratteristiche
•In molte reazioni organiche le
trasformazioni chimiche
avvengono a loro carico
• Sono le unità strutturali, in base
alle quali suddividiamo i composti
Gruppo ossidrilico –OH organici in famiglie di composti
Principali Gruppi Funzionali
R-NH2
R-CH2-OH
R1-COO-R2
R1-O-R2
R-CONH2
R1-CO-R2
R-PO(OH)2
Gruppo funzionale:
Ossidrile -OH
legato con legame semplice ad un atomo di C che
è impegnato in altri tre legami semplici
(C tetraedrico)
R-OH
Ar-OH
Alcoli
es. CH3-OH ( Metanolo)
Fenoli
es. C6H5-OH
Suffisso IUPAC :
-OLO
Il nome convenzionale degli alcoli si costruisce
aggiungendo il suffisso -olo al nome
dell’idrocarburo corrispondente per numero di
atomi di carbonio
Metanolo
Etanolo
1-Propanolo
C 3H8O
POLIALCOL
H
H C OH
H C OH
H C OH
H
CH2OH
1,2-etandiolo
(glicole etilenico)
CH2OH
1,2,3-propantriolo
(glicerolo)
Analoghi solforati degli alcoli sono i tioli
La reattività del gruppo tiolico o sulfidrilico (-SH) è simile
a quella dell’ ossidrile (-OH), dando origine a composti
analoghi solforati
E’ caratteristica dei tioli una reazione di
ossidazione ( deidrogenazione)
che porta alla formazione di un legame chiamato
PONTE DISOLFURO
Un legame etere si ottiene per eliminazione di una
molecola di H2O tra due ossidrili alcolici
2 molecole di
alcol
condensazione
Etere
CARBONILE :
Nomenclatura IUPAC
-ale
Metanale
(Formaldeide)
Etanale
(Acetaldeide)
Nomenclatura IUPAC
-one
Propanone
(Acetone)
Reattività del carbonile: Attacco Nucleofilo
120°
120°
120°
Legame fortemente polarizzato
e- attratti dall’O
Nucleofilo: è una specie che prende parte ad una reazione
donando un doppietto elettronico ad un'altra specie
(l'elettrofilo) e legandosi ad esso
Reattività del carbonile:
●●
●●
δ+
Reazione di
Addizione
●●
δ-
Allo stesso atomo di C sono legati il
gruppo funzionale degli alcoli e il
gruppo funzionale degli eteri
Reattività del carbonile:
Reazione di
Condensazione
Ammine
gruppo amminico –NH2
Ammine
gruppo amminico –NH2
N
N
R
R
N
R
R
R
N
R
Ammine: Nomenclatura
CH3 – NH2
metilammina
CH3 – CH2- NH2
etilammina
CH3 – NH2
CH3 – CH2- NH2
amminometano
amminoetano
Ammine
Ammine
Dissociazione in acqua
Sono più basiche dell’acqua
Hanno un doppietto elettronico non condiviso sull’atomo di N
sono basi e nucleofili
Ione prende
Ammonioparte ad
Nucleofilo: è una specie che
una reazione donando un doppietto elettronico ad
un'altra specie (l'elettrofilo) e legandosi ad esso
Acidi Carbossilici
Gruppo funzionale
- COOH
Carbossile
Carbossile
Gruppo
amminico
Formula Generale di
un Amminoacido
Formula Generale di
un Acido grasso
Il carbossile è il gruppo funzionale degli acidi carbossilici
(carbossile= carbonile + ossidrile)
acidi
carbossilici
alifatici
acidi
carbossilici
aromatici
Acidi Carbossilici:
Nomenclatura
IUPAC:
•suffisso –oico
al nome dell’alcano
corrispondente
•La catena
carboniosa viene
numerata a partire
dall’atomo di C
carbossilico
Acidi Carbossilici: Dissociazione
Anione carbossilato
acidi deboli
Reazioni degli acidi carbossilici
Reazione di disidratazione
• Eliminazione di H2O da
• connessione tra un ossidrile
alcolico ed un carbossile
Reazione di disidratazione
• Eliminazione di acqua da
2 gruppi carbossilici
• connessione dei due
frammenti
Reazioni degli acidi carbossilici
Reazione
Reazione di
di disidratazione
Condensazione
• Eliminazione
di H2O da
(disidratazione)
•• connessione
un ossidrile
Eliminazione tra
di acqua
ed un
carbossile
• alcolico
Importante
in biochimica:
formazione del legame peptidico
Reazione di disidratazione
• Eliminazione di acqua da
2 gruppi carbossilici
• connessione dei due
frammenti
Legame Peptidico
Gruppo
carbossilico
Gruppo amminico
Legame peptidico
Esteri: triacilgliceroli
Legame
estere
Sono composti da 3 acidi grassi legati ai gruppi ossidirilici
di una molecola di glicerolo