Accademia europea dei
pazienti sull'innovazione
terapeutica
http://www.eupati.eu
Scheda informativa: Sintesi dei concetti normativi e della legislazione, nonché
ruolo delle organizzazioni di pazienti
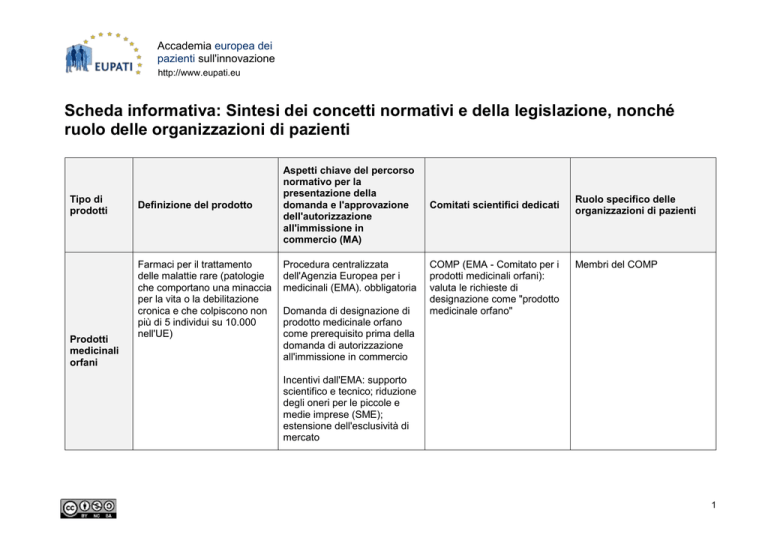
Tipo di
prodotti
Prodotti
medicinali
orfani
Definizione del prodotto
Farmaci per il trattamento
delle malattie rare (patologie
che comportano una minaccia
per la vita o la debilitazione
cronica e che colpiscono non
più di 5 individui su 10.000
nell'UE)
Aspetti chiave del percorso
normativo per la
presentazione della
domanda e l'approvazione
dell'autorizzazione
all'immissione in
commercio (MA)
Procedura centralizzata
dell'Agenzia Europea per i
medicinali (EMA). obbligatoria
Domanda di designazione di
prodotto medicinale orfano
come prerequisito prima della
domanda di autorizzazione
all'immissione in commercio
Comitati scientifici dedicati
COMP (EMA - Comitato per i
prodotti medicinali orfani):
valuta le richieste di
designazione come "prodotto
medicinale orfano"
Ruolo specifico delle
organizzazioni di pazienti
Membri del COMP
Incentivi dall'EMA: supporto
scientifico e tecnico; riduzione
degli oneri per le piccole e
medie imprese (SME);
estensione dell'esclusività di
mercato
1
Accademia europea dei
pazienti sull'innovazione
terapeutica
http://www.eupati.eu
Farmaci complessi realizzati
con geni e cellule o tessuti
(diversi dai farmaci
convenzionali prodotti con
sostanze chimiche o proteine)
Farmaci per
terapia
avanzata
(ATMP)
Propongono nuovi approcci
per la cura di patologie e
lesioni (non soltanto malattie
genetiche) e sono frutto di
avanzate ricerche scientifiche
Procedura centralizzata
dell'EMA: obbligatoria
Oltre a qualità, sicurezza ed
efficacia, la valutazione può
tenere conto anche di criteri
correlati alla natura del
prodotto:
per es., rischio ambientale
TAC (EMA - Comitato per le
terapie avanzate): valuta la
domanda di autorizzazione
all'immissione in commercio
Membri del CAT
PDCO (EMA - Comitato
pediatrico): valuta i PIP e
rilascia le deroghe ai PIP
Membri del CAT
È richiesta la piena
tracciabilità
Incentivi dall'EMA: riduzione
degli oneri
Farmaci per bambini dalla
nascita al compimento del 18°
anno
Farmaci
pediatrici
Procedura centralizzata
dell'EMA
Presentazione di una proposta
di piano di indagine pediatrica
(PIP) come prerequisito prima
di sottoporre una domanda a
livello dell'EMA (obbligatoria
per tutti i nuovi prodotti
medicinali)
La domanda di autorizzazione
all'immissione in commercio
deve contenere i risultati e le
informazioni richieste nel PIP,
2
Accademia europea dei
pazienti sull'innovazione
terapeutica
http://www.eupati.eu
ad eccezione dei casi in cui si
ottiene la deroga al PIP,
quando un prodotto è
destinato al trattamento di
patologie che non colpiscono i
bambini
Incentivi dall'EMA:
consultazione scientifica ed
estensione dell'esclusività del
brevetto
Farmaci
generici
Farmaci sviluppati allo scopo
di risultare simili a un prodotto
medicinale che è già stato
autorizzato, detto "farmaco di
riferimento"
Procedura centralizzata
dell'EMA (soggetta a
condizioni) o
procedure nazionali o di altro
genere
Contiene le stesse sostanze
attive del farmaco di
riferimento, ed è utilizzato alle
medesime dosi per trattare le
stesse malattie
Fascicolo della domanda:
basato sui dati del farmaco di
riferimento e sui dati di
bioequivalenza del farmaco
generico rispetto a quello di
riferimento
Tuttavia, può differire in
termini di eccipienti, nome,
aspetto, gusto
Nessun comitato specifico
L'autorizzazione
all'immissione in commercio
viene concessa solo una volta
che il periodo di esclusività del
farmaco di riferimento è
terminato
3
Accademia europea dei
pazienti sull'innovazione
terapeutica
http://www.eupati.eu
Farmaci
biosimilari
Farmaci che vengono
sviluppati in modo da risultare
simili ai farmaci biologici (i
farmaci biologici sono prodotti
medicinali complessi prodotti
o derivati da una fonte
biologica o da cellule vive, che
possono contenere sangue o
componenti ematici, terapie
geniche, tessuti e proteine).
Procedura centralizzata
dell'EMA o procedure
nazionali e di altro tipo
Nessun comitato specifico ma
un gruppo di lavoro sui
medicinali biosimilari (EMA Biosimilar Medicinal Products
L'autorizzazione
Working Party, BMWP)
all'immissione in commercio
fornisce le raccomandazioni al
viene concessa solo una volta CHMP e tiene i contatti con le
che il periodo di esclusività del parti interessate
farmaco biologico (di
riferimento) è terminato
È una delle parti interessate e
mantiene i contatti con il
BMWP
4