Programma svolto nella classe 1 D MA , anno scolastico 2014-2015
Docenti: Gangemi Pier Paolo ( teoria)- Rodaro Adriano (laboratorio)
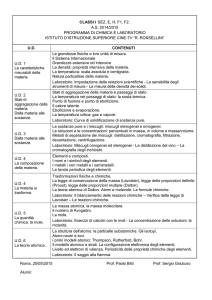
Grandezze fisiche: sistema internazionale delle unità di misura. Grandezze fondamentali, derivate,
estensive ed intensive: massa; densità; temperatura ( scale Kelvin e Celsius, relativa conversione).
Energia ( cinetica e potenziale); calore ( legge fondamentale della termologia, equivalenza tra calore
e lavoro); notazione scientifica.
Natura particellare della materia.
Stati fisici della materia.
Passaggi di stato fisico di sostanze pure, relative curve di riscaldamento e di raffreddamento.
Miscugli, composti ed elementi; abbondanza relativa di alcuni elementi sulla crosta terrestre e nel
corpo umano.
Metalli, non metalli e semimetalli.
Principali metodi di separazione di miscugli omogenei ed eterogenei: filtrazione; centrifugazione;
cristallizzazione; estrazione con solvente; cromatografia su colonna; distillazione ( semplice,
frazionata, distillazione del petrolio).
Soluzioni: distinzione tra solvente e soluto. Soluzioni liquide, solide e gassose. Gas in soluzione:
legge di Henry. Liquidi in soluzione: definizione di solubilità di un solido e di un liquido, soluzioni
sature e insature, andamento della solubilità solido/liquido con la temperatura. Concentrazione delle
soluzioni: percentuale in massa, percentuale in volume, massa su volume ( unità fisiche di
concentrazione).
Rappresentazione degli atomi e delle molecole: simboli degli elementi, significato di formula
chimica, regole e simboli delle formule chimiche.
Trasformazioni fisiche e trasformazioni chimiche, differenza tra di esse. Significato di equazione
chimica. Fenomeni che accompagnano le reazioni chimiche.
Classificazione formale delle reazioni chimiche ( tra composti inorganici, senza variazione dei
numeri di ossidazione): reazioni di sintesi, di decomposizione, di scambio semplice, di doppio
scambio.
Bilanciamento delle equazioni chimiche semplici ( non di ossidoriduzione).
Leggi ponderali: legge della costanza delle masse nelle reazioni chimiche ( legge di Lavoisier).
Legge delle proporzioni definite ( legge di Proust ). Legge delle proporzioni multiple ( legge di
Dalton ).
Teoria atomica di Dalton.
Struttura della materia: particelle subatomiche ( elettroni, protoni, neutroni).
Primi modelli atomici: Thomson, Rutherford. Esperimento di Rutherford.
Nucleo atomico: numero atomico, numero di massa, isotopi.
Massa atomica relativa, anche come media ponderale dei numeri di massa degli isotopi.
Unità di massa atomica, massa molecolare.
Mole e numero di Avogadro, semplici calcoli con la mole.
Composizione percentuale di un composto, formula minima e molecolare di un composto.
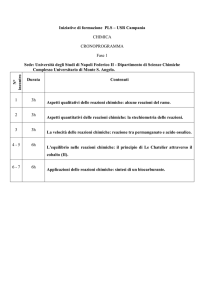
LABORATORIO
1. Sicurezza in laboratorio: illustrazione vetreria e discussione.
2. Uso corretto, portata, sensibilità di alcuni strumenti e cifre significative.
3. Metodi di separazione: separazione di un miscuglio solfato di rame-sabbia tramite
solubilizzazione del sale e successiva filtrazione.
4. Purificazione del solfato di rame per cristallizzazione.
5. Metodi di separazione: distillazione semplice.
6. Metodi di separazione: distillazione frazionata.
7. Esempi di reazioni chimiche.
8. Tecniche di problem solving ( densità).
9. Verifica del principio di Lavoisier tramite: reazione del nitrato di piombo con lo ioduro di
potassio; reazione dell’acido acetico con l’idrogenocarbonato di sodio.