Aterosclerosi
L’aterosclerosi è una patologia delle arterie, principale causa di malattie
cardiovascolari nei paesi più industrializzati.
E’ caratterizzata dall’accumulo di lipidi ed elementi fibrosi nella parete dei
vasi arteriosi (ateroma).
Evoluzione dell’ateroma
lipidiche – compaiono precocemente (15-20 anni)
Monociti/macrofagi passano attraverso l’endotelio nell’intima e
fagocitano colesterolo e i suoi esteri.
Fibrocellule muscolari della tonaca sottostante proliferano e
contribuiscono all’ispessimento della parete con la deposizione di
fibrina e matrice connettivale.
Placca fibrosa – struttura rilevata nel lume del vaso costituita da
Fibrocellule muscolari in proliferazione
Macrofagi ripieni di grasso fagocitato
Linfociti
Ateroma – caratterizzato dalla comparsa di un core necrotico con detriti
cellulari e depositi di calcio.
Formazione di trombi - per perdita del rivestimento endoteliale e
attivazione di fenomeni coagulativi
Emorragia – per rottura dei vasi neoformati
Ulcerazione – per il ridotto apporto di O2 e di nutrienti.
Strie
Evoluzione dell’ateroma
Cellule
Strie
Schiumose Lipidiche
Lesione
Intermedia Ateroma
Placca Lesione/rottura
Fibrosa complicata
Disfunzione endoteliale
Prima decade
Dalla terza decade
Crescita dovuta principalmente all’accumulo di lipidi
Dalla quarta decade
Muscolo
liscio e
collagene
Trombosi
Localizzazione delle lesioni
aterosclerotiche
Le lesioni aterosclerotiche
interessano principalmente
le arterie di maggior
calibro e si localizzano
preferenzialmente
nei
punti di biforcazione dove,
turbolenze
del
flusso
creano condizioni favorenti
lo sviluppo della placca.
Ruolo dell’endotelio
Fattori di rischio
Fattori genetici – è una malattia multifattoriale, esistono forme a modalità di
trasmissione mendeliana.
Ipercolesterolemia familiare (dominante) in cui mutazioni nel gene per il
recettore delle LDL determina elevati livelli plasmatici di LDL/VLDL.
Età – è tipicamente una patologia dell’età avanzata.
Sesso –
prevalenza del sesso maschile che si riduce con la menopausa
femminile
L’estrogeno ha proprietà anti-aterogeniche modificando i livelli di lipoproteine
plasmatiche.
Dieta – ipercalorica e ricca in grassi.
Attività fisica
Fumo di sigaretta
Iperlipidemia –
i livelli di lipidi associati a proteine (lipoproteine) circolanti
rappresentano uno dei principali fattori predisponenti.
Ipertensione – l’aumento della pressione arteriosa favorisce alterazioni del flusso,
tra le cause che innescano lo sviluppo della placca aterosclerotica.
Diabete mellito – nella fase di scompenso metabolico è un importante fattore di
rischio.
Trasporto dei lipidi nel sangue (1)
Trasporto dei lipidi nel sangue (2)
Assorbimento intestinale e trasporto dei lipidi esogeni a tessuti e fegato
La lipasi lipoproteica (secreta dagli adipociti e c. muscolari sotto stimolo
insulinico) si lega ai proteoglicani dell’endotelio dei vasi e agisce idrolizzando i
trigliceridi che sono assorbiti dai tessuti (adiposo muscolare)
I remnants tramite uno specifico recettore per Apo E, sono captati dal fegato. Il
colesterolo esogeno e utilizzato nella sintesi di ac. Biliari, membrane cellulari,
immeso in altre lipoproteine secrete dal fegato.
Trasporto dei lipidi nel sangue (3)
La sintesi endogena di lipoproteine si realizza nel fegato a partire da ac. grassi e
colesterolo legati a remnants, LDL e IDL.
I lipidi sono assemblati con Apo B100 e fosfolipidi nelle VLDL e secreti in circolo.
In circolo, la LPL e la TGLE (lipasi epatica dei TG) concorrono al rilascio degli ac.
grassi utilizzati dai tessuti ( IDL-> LDL). Le VLDL sono la principale classe di
lipopropteine secrete dal fegato.
Pressoché tutti i tessuti hanno il recettore per Apo B100 che consente
l’internalizzazione delle LDL e l’utilizzo del colesterolo (s. ormoni, s. membrane,
ecc.)
Trasporto dei lipidi nel sangue (4)
Il colesterolo in eccesso viene
rimosso dai tessuti tramite le
HDL (trasporto inverso del
colesterolo).
Le HDL sono sintetizzate dal
fegato (e dall’intestino).
Raccolgono il colesterolo libero
(membrane cellulari) e quello il
eccesso di altre lipoproteine.
La lecitina-colesterolo aciltrasferasi (LCAT epatica) si
lega nel plasma alle HDL e
esterifica il colesterolo.
Le HDL sono captate a livello
del fegato tramite il recettore
SR-B1 che favorisce
l‘internalizzazione selettiva
degli esteri del colesterolo
Eziopatogenesi della lesione
aterosclerotica (1)
Eziopatogenesi della lesione
aterosclerotica (2)
Eziopatogenesi della lesione
aterosclerotica (3)
Eziopatogenesi della lesione
aterosclerotica (3)
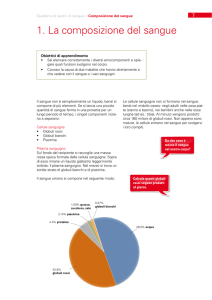
Il sangue
Il sangue è un tessuto a sostanza intercellulare liquida costituito da:
Cellule ematiche (45%)
• Eritrociti (emazie, globuli rossi)
• Leucociti
• Polimorfonucleati (granulociti neutrofili, basofili, eosinofili)
• Linfociti
• Monociti
• Piastrine
Plasma
• Acqua
• Proteine
• Nutrienti
• elettroliti
• Ormoni
• Cataboliti
Al di fuori dei vasi il sangue coagula. Il siero è il plasma privato del
fibrinogeno.
Esame emocromocitometrico
E’ un esame di laboratorio fondamentale che valuta il numero totale e
relativo delle cellule ematiche la cui variazione rispetto a valori di riferimento
è di utile indirizzo diagnostico.
Globuli rossi (4.4-5.9x106/mm3 M; 3.8-5.2x106/mm3 F)
Globuli bianchi (4500-11000/mL)
Piastrine (200000-400000/mL)
Formula leucocitaria
• Neutrofili (40-60%)
• Eosinofili (0-3%)
• Basofili (0-1%)
• Linfociti (15-45%)
• Monociti (2-7%)
Anomalie morfologiche
Volume medio globulare degli eritrociti (MCV) (80-100mm3)
Concentrazione emoglobinica corpuscolare media (MCH) (27-34pg)
Emoglobina corpuscolare media (MCHC) (31-36% per mL di sangue)
Emoglobina ed Ematocrito
La concentrazione dell’emoglobina
sopratutto dal numero degli eritrociti.
13-18 gr./dL (maschio adulto)
11-16 gr/dL (femmina adulta)
(Hb)
dipende
L’ematocrito (Hct) rappresenta il volume occupato dagli
eritrociti rispetto al sangue intero.
42-52% (maschio adulto)
37-48% (femmina adulta)
Variabili che alterano gli intervalli di riferimento sono l’età,
il sesso, il luogo di residenza, il fumo, la gravidanza.
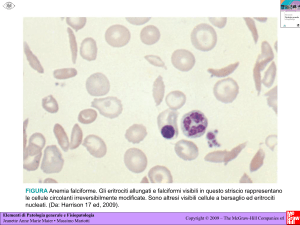
Lo striscio periferico è un altro esame fondamentale nella
valutazione ematologica, che fornisce informazioni sulla
dimensione, morfologia e contenuto di emoglobina degli eritrociti,
ma anche dei leucociti.
L’emopoiesi
L’emopoiesi è un complesso processo proliferativo-differenziativo che porta alla
formazione degli elementi figurati del sangue.
Si può distinguere una emopoiesi prenatale e una postnatale.
L’emopoiesi prenatale è a sua volta divisa in quattro fasi: mesoblastica,
epatica, splenica, mieloide.
Nella vita postnatale, ha luogo nel midollo osseo.
Tutte le cellule del sangue originano da:
Cellule staminali emopoietiche totipotenti
L’emopoiesi è regolata da numerose citochine (fattori di crescita emopoietici) che
stimolano cellule bersaglio inducendone la proliferazione/differenziazione.
Eritropoietici (eritropoietina per la produzione di globuli rossi)
Mielomonocitari (granulociti e monociti)
Magacariocitici (piastrine)
Linfopoietici (linfociti)
Emopoiesi prenatale
Inizia alla seconda settimana nel mesoderma
del sacco vitellino (fase mesoblastica)..
Verso la sesta settimana di vita intrauterina
inizia la fase epatica. Gli eritrociti sono ancora
nucleati e verso l’ottava settimana compaiono
i leucociti.
Nel secondo trimestre inizia la fase splenica
che insieme a quella epatica va avanti fino al
termine della gravidanza.
La fase mieloide inizia verso la fine del
secondo trimestre e man mano che si sviluppa
il sistema scheletrico, il midollo osseo assume
un ruolo sempre più importante nella
produzione di cellule ematiche.
Il fegato (fase epatica) e la milza (fase
splenica) non partecipano alla emopoiesi
postnatale.
Emopoiesi postnatale: cellule
staminali emopoietiche pluripotenti
L’emopoiesi postnatale avviene quasi esclusivamente nel midollo osseo.
Tutte le cellule del sangue derivano da cellule staminali emopoietiche
pluripotenti (PHSC) che sono circa lo 0,1% di tutte le cellule nucleate del
midollo osseo
Le PHSC oltre a mantenere la loro popolazione possono produrre due
tipi di cellule staminali emopoietiche multipotenti (CFU-S e CFU-Ly)
Il tipo CFU-S è precursore della linea mieloide: eritrociti, granulociti,
monociti e piastrine
Il tipo CFU-Ly è precursore delle cellule della linea linfoide (cellule B e
T)
Le cellule progenitrici che derivano dalle CFU sono unipotenti, cioè
formano una sola linea cellulare
Le cellule precursori che derivano dalle progenitrici perdono la capacità
di autoriprodursi.
Eritropoiesi
Gli eritrociti come tutte le cellule del sangue sono soggetti ad un
continuo turnover (v.m. 120 giorni). L’eritropoiesi è la formazione dei
globuli rossi.
Ogni giorno deve essere sostituita una quantità di eritrociti pari all’1%
della massa circolante.
Tale produzione è resa possibile dalla presenza di due cellule
progenitrici unipotenti derivanti dal tipo CFU-S
Queste sono le BFU-E e le CFU-E dette unità eritrocitarie
Il differenziamento è indotto dalla eritropoietina, un ormone
glicoproteico prodotto principalmente dal rene.
L’eritropoietina ha un’emivita di 6-9 ore e agisce legandosi a
specifici recettori delle BFU-E che maturano in CFU-E e quindi in
proeritroblati che daranno infine gli eritrociti maturi.
Reticolocita (5)
Eritrocita (6)
Eritroblasto basofilo (2)
Proeritroblasto (1)
Eritroblasto ortocromatico (4)
Eritroblasto policromatofilo (3)
Emocateresi
Gli eritrociti (v.m. 120 ± 20 gg) sono eliminati
dai macrofagi della polpa rossa della milza
(90% per emolisi extravasale, 10% per
emolisi intravasale).
I magrofagi della polpa rossa
1. Riconoscono gli eritrociti
eventualmente legati da Ab o fattori
complementari C3.
2. Fagocitano gli eritrociti vecchi
3. Fagocitano gli eritrociti con forma
anomale o anomalie di membrana
La ridotta deformabilità degli eritrociti vecchi ne impedisce il passaggio attraverso le
fenestrature spleniche e ne determina la distruzione ad opera dei fagociti.
Nell’ambito del processo emolitico avviene il catabolismo dell’emoglobina:
• Le catene globiniche sono ridotte ad aminoacidi
• L‘eme viene metabolizzato in Fe e protoporfirina che è poi metabolizzata in
birilubina.