Idrocarburi Aromatici
CH3
CH3
OH
OH
(Cl)n
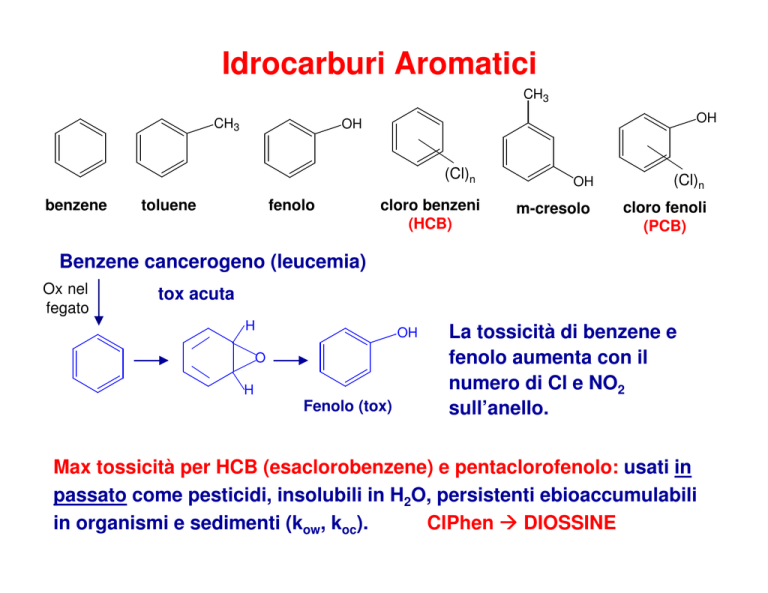
benzene
toluene
fenolo
cloro benzeni
(HCB)
OH
(Cl)n
m-cresolo
cloro fenoli
(PCB)
Benzene cancerogeno (leucemia)
Ox nel
fegato
tox acuta
H
OH
O
H
Fenolo (tox)
La tossicità di benzene e
fenolo aumenta con il
numero di Cl e NO2
sull’anello.
Max tossicità per HCB (esaclorobenzene) e pentaclorofenolo: usati in
passato come pesticidi, insolubili in H2O, persistenti ebioaccumulabili
in organismi e sedimenti (kow, koc).
ClPhen DIOSSINE
Composti Aromatici Policiclici
IPA o PAH
Sono composti con due o + anelli aromatici condensati: cioè con
nuvole di elettroni π aromatici in comune.
Da combustioni sia naturali
sia antropogeniche
(presenti nell’atmosfera
come aerosol essendo solidi
a bassa tensione di vapore)
se > 4 anelli Me aumentano
tossicità.
Metabolismo ossidativo PAH
OH
O
{O}
ossidasi
GSH
idrolisi
enzimatica
OH
SG
OH
OH
GSH = glutadione – glutamilcistamilglicina solubilizzante
in acqua al fine di favorire escrezione con urine
Tossicità di benzo(a)pirene (BAP)
prima fonte: fumo sigaretta
Via epossidazione con ossidasi
idrolisi epossido
epossidazione
coniugazione con basi DNA-RNA
“bay
region”
regione
recesso
O
HO
H
O
H
OH
seconda maggior fonte di PAH: alimentazione cottura cibi, depos. su
vegetali a foglia larga, affumicati.
PAH ⇒ cancro
ossidasi
idratasi
O
Benzo(a)pirene
HO
apertura trans diolo
cancerogeno del fumo di
sigaretta, della carne alla
brace……
OH
DNA
O
NH
ossidasi
HO
HO
HO
OH
CANCEROGENO
OH
Si pensa che un nucleofilo NH2 delle basi azotate del DNA
attacchi l’epossido a dare una base del DNA modificata
perché alchilata.
Diossine
O
O
1,4-diossina
o p-diossina
Cl
O
Cl
Cl
O
Cl
2,3,7,8-TCDD
tetraclorodibenzodiossina
75 congeneri planari
Fonti: per riscaldamento
OCH2COOH
Sottoprodotta nella sintesi di:
Cl
• 2,4,5-T acido 2,4,5-triclorifenossiacetico (erbicida)
OH
Cl
Intermedio di partenza
Cl
Cl
Cl
Cl
Cl
Cl
O-
Cl
Cl
O-
Cl
Cl
230-260°C
-2Cl-
Cl
O
Cl
Cl
O
Cl
• da pentaclorofenolo o congeneri
Cl
Cl
Cl
Cl
OH
Cl
Cl
OH
HO
Cl
Cl
Cl
calore
Cl
Cl
Cl
O
Cl
(non molto tox.)
Cl
O
Cl
Cl
Cl
PCBs (PolyChloro Biphenyls)
209 congeneri
Bifenili
Cl(n)
Cl(n)
Usati come addittivi per colori da stampa plastiche isolanti
nei trasformatori elettrici. Miscele: AROCLOR.
Grandissima stabilità: si accumulano negli organismi
(BIOMAGNIFICAZIONE) e sedimenti.
Persistenza dell’inquinamento (anche ai poli), caratteristica
di “estrogeni”: diminuiscono fertilità maschile.
Formano DIBENZOFURANI:
Cl
Cl
Cl
Cl
-H2O
Cl
Cl
H
Cl
Cl
Cal.
.
X
X
.
OH
Cl
Cl
Cl
Cl
.
+O2
-X
Cl
Cl
O
.
X
Cl
Cl
O
2,3,7,8-TCDF
Si elimina o Cl2 o HCl o H2
Tossicità di PCB, DIOSSINE, FURANI
PCB non alta tox acuta
cloracne
FURANI-DIOSSINE > tox acuta
Si ritiene che siano tox a lunga scadenza cancro? (≠
≠ a seconda
della specie)
PCB quando sono simili ai DIBENZOFORANI
Cl Cl
PCB + tox
PCB con il Cl io orto non sono planari (circa 70° angolo)
Solo diossine senza Cl in orto sono planari!
I PCB che non hanno i Cl in orto sono strutturalmente
simili alle diossine planari entrano nel sito attivo
dell’enzima recettore
⇓
AZIONE TOSSICA
Cl
Simile a DIOSSINA + tox (2,3,7,8-TCDD)
Cl
Cl
Cl
Cl
Cl
β
α
O
Cl
O
Cl
Analogamente DIOSSINE con Cl in α sono meno tox
PESTICIDI
Classificazione
Presidi Fitosanitari (o Fitofarmaci)
Antiparassitari
(pesticidi)
Diserbanti
(erbicidi)
Fitoregolatori
Algicidi
Insetticidi, Acaricidi, Rodenticidi, Nematocidi, Anticrittogami o
Fungicidi, Limacidi (o Molluschicidi), Battericidi, Larricidi,
Disinfettanti
Ogni anno nel Nord America : 1 milione di chilogrammi
Tossicità Acuta
LD50 (o DL50)
1°classe : LD50 ≤ 50mg\kg
2°classe : 50< LD50 ≤ 500 mg\kg
3°classe : LD50 ≥ 500 mg\kg
4°classe : “non tossici”
Fitotossicità
• Specifica ⇒ certe specie non sopportano la molecola
• Varietale ⇒ solo alcune varietà
EPA-USA ha fissato per ogni pesticida :
A.D.I. Admissible Daily Intake = NOEL\100 (no-effect level)
Pesticidi naturali!!!!! ATTENZIONE
Modalità d’uso
Trattamenti:
• in stagioni particolari (aratura, semina, pre o post emergenza)
• tutto l’anno
• secondo calendari
• secondo soglie di danno
• secondo densità di popolazione
Dispersione:
30% si perde per deriva
25% si perde per percolazione, gocciolamento, volatilizzazione
40% rimane come residuo sulla cottura
5% raggiunge l’insetto
1% (o meno) viene assorbito dagli insetti
MALATTIE TRASMESSE ALL’UOMO DA ANIMALI
CONTROLLABILI DAGLI ANTIPARASSITARI
Malattia
Malaria
Filarosi
Vettore
zanzara (gen.
Anopheles)
Plasmodium spp.
zanzara (gen. Culex,
Wuchereria bancrofti
Aedes, Anopheles)
zanzara (Aedes
aegypti)
Encecefalite virale zanzara
Tifo petecchiale
pidocchio
Peste bubbonica
pulce e ratto
Febbre dele
montagene
zecca
rocciose
Febbre gialla
Agente eziologico
Arbovirus del groppo
B
Arbovirus
R. prowazeki
Pesteurella pestis
R. rickettsi
ORDINE DI PRECEDENZA DEL RISCHIO DI
CONTAMINAZIONE
Secondo l'opinione
corrente
Secondo la statistica
sanitaria
1. Contaminazioni
1. Additivi volontari
microbiologiche
2. Rischi di cottura
2. Residui di pesticidi
dei cibi
3. Contaminazioni
3. Contaminazioni
ambientali
ambientali
4. Contaminazioni
4. Tossici naturali
microbiologiche
5. Addittivi volontari
Vantaggi della lotta chimica
EFFICACIA: gli insetticidi sono efficaci nel controllo di migliaia di insetti
dannosi; praticamente tutte le specie possono essere controllata con
almeno uno dei prodotti attualmente disponibili.
RAPIDITA’: grandi popolamenti di insetti nocivi possono essere ridotti
nel giro di poche ore e questo consente una protezione pressoché
immediata.
VERSATILITA’: gli insetticidi offrono una ampia varietà di proprietà, usi
e metodi di applicazione a diverse situazioni e tipi di infestazioni.
SEMPLICITA’: dal punto di vista operativo, la lotta chimica è (almeno
apparentemente) il più semplice mezzo di controllo delle infestazioni.
POSSIBILITA’ di APPLICAZIONE NELL’EMERGENZA: la lotta
chimica è l’unico mezzo realisticamente utilizzabile in caso di
improvvise emergenze.
ECONOMICITA’: tra tutti i metodi di controllo, la lotta chimica è
probabilmente quello che presenta il più favorevole rapporto costi/
benefici.
Svantaggi della lotta chimica
•INSORGENZA DI SPECIE RESISTENTI
•CRESCITA DI IMPORTANZA DI INFESTAZIONI SECONDARIE
•EFFETTI DANNOSI SU SPECIE NON BERSAGLIO: nemici
naturali degli infestanti, api e altri impollinatori, altri organismi
diversi dagli Artropodi (vertebrati e invertebrati).
•RISCHI PER GLI UTILIZZATORI
•RESIDUI NEGLI ALIMENTI
•ALTRI RISCHI PER L’UOMO E PER L’AMBIENTE
SINTESI DI
NUOVE
MOLECOLE
SCREENING
IN LAB. E
SERRA
PROVE
PRELIMINARI
TOSSICOLOGICHE
STUDI DI
CHIMICA
ANALITICA
PROVE PRELIMINARI
IN SERRA E CAMPO
STUDI DI PRODUZIONE
INDUSTRIALE
PRODUZIONE
SU SCALA
INDUSTRIALE
STUDIO
FORMULAZIONI
STUDI
TOSSICOLOGICI
AUTORIZZAZIONE DEL
MINISTERO DELLA
SANITA’
COMMERCIALLIZZAZIONE
Scema di sviluppo di un antiparassitario
PROVE DI
CAMPO
DATI RICHIESTI IN ITALIA PER CONCEDERE LA REGISRAZIONE DI
UN FITOFARMACO
•Dati di carattere generale: dati di identità e sulle proprietà chimico-fisiche
•Dati agronomici: campi d’impiego, modo d’azione, tipo di parassita
combattuto, dosi d’applicazione, numero e epoca d’applicazione, fitotossicità
•Dati sulla tossicità: tossicità orale, dermale, inalatoria e per altre vie,
irritabilità pelle e occhi, sensibilità allergica, studi metabolici, tossicità a lungo
termine, effetti mutageni, teratogeni e cancerogeni, neurotossicità, studi sulla
produzione, effetti potenziati, osservazioni dirette sull’uomo, risultati di
monitoraggio su operai dell’industria e dell’agricoltura, informazioni per il pronto
soccorso eventuali intossicati.
•Dati sui residui: vie metaboliche, metodo di analisi dei residui, dati sui residui
•Dati sugli effetti su ambiente e fauna selvatica: tossicità su uccelli, pesci,
altri animali, api insetti utili, vermi e invertebrati, cambiamenti in ecologia del
suolo e microrganismi, movimento e persistenza nel terreno.
In Italia non è prevista alcuna autorizzazione provvisoria basata su una documentazione ridotta in attesa di quella
definitiva. Alcune forme di autorizzazione provvisoria sono invece concesse in Francia, Gran Bretagna, Stati
Uniti….
INSETTICIDI INORGANICI
Più antico insetticida (fumigante): 1000 a.c. (XIX sec.)
DERIVATI DELLO ZOLFO: polisolfuri di calcio e di bario, attivi
contro stadi giovanili di molti gruppi di insetti; hanno anche
azione fungicida.
DERIVATI DELL’ARSENICO: arsenati di piombo, calcio e sodio,
efficaci insetticidi per ingestione. Arseniti attivi per contatto e
per ingestione, attualmente in uso come rodenticidi (es. CuAsO4
o CuAsO3 “verde di Parigi” 900 d.c. fino anni ’50)
DERIVATI DEL FLUORO: insetticidi per ingestione con un certo
effetto fitotossici (es. NaF per formiche e scarafaggi)
DERIVATI DELLO ZINCO: es. fosfuro di zinco usato soprattutto per
la protezione delle derrate contro insetti roditori.
Tossici per uomo e animali alle alte dosi necessarie per essere efficaci
Non biodegradabili – Accumulano nell’ambiente
NICOTINICI
Altre classi
origine vegetale
ORGANOSTANNICI
N
CH3
N
SnOH
ROTENONE
origine vegetale
OCH3
H3CO
o
o
o
o
C
Copiati da insetticidi naturali
CH3
CH2
PIRETRINE
acido piretrico
CH3
H
H3C
R
H
H2
C C
COO
CH3
C
H
C
H
H
O
CH3
R: -CH3 o –COOCH3
R’: -CH=CH2,–CH3 o -CH2CH3
R'
H
Usati in Cina 2000 anni fa.
Origine : piante del
genere Chrysanthmum
(=Pyrethrum)
Effetto: potente e rapidissimo effetto per contatto su tutti gli insetti
(effetto Knock-down). Agisce sul sistema nervoso gangliare. Modalità
d’azione ancora poco chiara.
Uso: eccellente per uso domestico per rapidità d’effetto, trascurabile
tossicità sui Vertebrati, rapida scomparsa. Usi agricoli trascurabili per
alti costi e rapida fotodegradazione.
Degradazione: facile per idrolisi estere, instabilità anello a 3C
Ossidazione CH3 → CH2OH → COOH.
PIRETROIDI ARTIFICIALI
Proprietà dei Piretroidi Artificiali
•Solubilità in acqua: generalmente compresa tra 0.1 e 6 mg/l
(bassa)
•Tensione di vapore: generalmente compresa tra 10-3 e 10-7 Pa
(bassa)
•logkOW = generalmente compreso tra 4 e 6 (alta idrofob.)
Persistenza:
(bassa)
• in generale facilmente fotodegradabili
• in presenza di alogeni riduce la fotolabilità
• nel complesso classificabili come prodotti non persistenti
Tossicità su non target:
(selettività)
• molta alta su tutti gli artropodi
• trascurabile o comunque ridotta sui Vertebrati,
presumibilmente a causa di una inattivazione metabolica da
parte dei sistemi enzimatici
CLORORGANICI
Cl
Cl
CH
Cl
Cl
Cl
Cl
C
Cl
Cl
Cl2C
H2C
Cl
Cl
Cl
Cl
Cl
Cl
Cl
DDT family, e.g.DDT
HCH family, only γ-HCH
Anni ’40-’50:
•Stabilità verso degradazione
•Bassissima solubilità
•Alta lipofilia
•Tox. elevata specifica non verso uomo
Cl
Aboliti dal 1972 per loro
persistenza e
biomagnificazione
Ancora in uso in paesi non
sviluppati
Cl
Cl
Cl
Cl
Chlorinated cyclodiene family
e.g. aldrin
Cl
HCB fungicida per cereali dopo II° guerra mondiale
ORGANOCLORURATI
Alto accumulo, persistenza, biomagnificazione
a) DDT e analoghi
non tox. ma forte cancerogeno
b) Esacloro cicloesani (HCH)
c) Famiglia di ciclodieni clorurati
a) DDT e analoghi
p,p’- DDT
p,p’-diclorodifeniltricloroetano
rid
Cl
-Cl
Cl
CH
Cl
Cl
CH
Cl
CHCl2
OH
Cl
ox
C
Cl
DDD
Cl
Cl
CCl3
(Detox)
DDTasi
-HCl
C
Cl
C
DDE
(resistenza)
CCl2
Non insetticida
Cl
METOSSICLOR
DeMet
HO
CH
OH
CCl3
H3CO
CH
OCH3
(solubile)
C
Cl
Cl
Cl
-HCl
tipo DDE
b) Esaclorocicloesani (HCH)
Miscele di più isomeri strutturali (8)
Forma attiva γ-HCH = Lindano
Cl
Cl
3 eq. adiac.
3 ox adiac.
Cl
Cl
Detox:
• per isomerizzazione a forme inattive
• per monoox (-Cl)
• per coniugaxione con GluS-
ClCl
c) Da ciclopentadieni clorurati
(1950 , ora sono banditi)
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
O
Cl
ALDRINA
Cl
DIELDRINA
Cl
Cl
idrolisi
-CH2OH
-CH2OH
Cl
Cl
Cl
O
Cl
S
Cl
O
Cl
-SO42-
O
ox
Cl
ENDOSULFAN
ORGANOFOSFATI
R1
O
O
P
R2
Ortofosfati
O
O
H2O
O
R2
O
R1
O
O
O
2) H2O
O
R3
S
R3
HO
OH
+ R1OH
R2OH
R3OH
Tiofosfati
R1 R2
-OCH3
-OCH2CH3
R3 varie catene
S
P
R2
1) O2
S
P
HO
P
Detox
R1
R3
Ditiofosfati
Altri (fosfonati, fosforamidi ,ecc)
+ tossiche ma meno persistenti (non accumulano, si biodegradano)
Uso in minor quantità
Più selettive
Inibitori acetilcolinesterasi (AchE)
Attività neurotossica
Esteri ortofosforici
Esteri tionofosforici
Esteri ditiofosforici e altri
CARBAMMATI
O
HO
C
O
NH2
R1
O
C
NH
R2
ACIDO CARBAMMICO
carbofuran
aldicarb
HN
O
O
S
N
O
NH
O
O
Log kow= 1.13
Sw= 6000 ppm
Vp= 1x10-4 mmHg (0.013Pa)
DL50= 0.9 mg/kg (ratti)
Log kow= 2.32
Sw= 700 ppm
Vp= 8.3x10-6 mmHg (1.1 mPa)
DL50= 8 mg/kg (ratti)
carbaryl
O
O
O
HN
N
H
propoxur
O
O
Log kow= 2.36
Sw= 32mg/L
Vp= 1.36x10-6 mmHg (0.18 mPa)
DL50= 307 mg/kg (ratti)
No tox per uomo e animali domestici
Si per api (giardini e prati)
Log kow= 1.52
Sw= 1750mg/L
Vp= 3x10-6 mmHg (0.4 mPa)
DL50= 307 mg/kg (ratti)
Neurotossici – inibitori AchE (diretti)
Bassi log P: non idrifobiche
Volatili
Poco persistenti (si idrolizzano)
Bacillus thuringiensis
•Elevata attività su larve di
Lepidotteri.
•Effetto dovuto ad una proteina
prodotta dalle spore
(endotossina).
•Alta specificità.
•Trascurabile effetto su non
target (eccetto Lepidotteri).
•Persistenza relativamente
bassa.
•La proteina può venire oggi
prodotta con metodi di
ingegneria genetica.
FEROMONI
Prodotti non insetticidi ma
comunque classificati
nell’ambito degli strumenti
della lotta chimica.
Molecole relativamente
semplici, spesso composti
alifatici a catena lineare (C10C18).
ERBICIDI
Il controllo delle malerbe presenta dei problemi diversi
rispetto a quello del controllo di funghi ed insetti.
Le malerbe riducono seriamente la resa o la qualità
delle colture solamente quando competono per l’acqua
disponibile, nutrienti e luce
Fra le tecniche per ridurre l’infestazione da malerbe si
citano:
Diserbo meccanico (estirpazione manuale o con
macchine)
Rotazioni
False semine
Uso di erbicidi
Persistenza degli erbicidi
La persistenza degli erbicidi è una caratteristica desiderata,
perché prolunga il periodo di azione della molecola.
A volte però diventa un problema perché può indurre effetti
di fitossicità nella cultura successiva.
Classificazione degli erbicidi
Una classificazione possibile è la seguente, che si basa
essenzialmente sul tipo di applicazione:
Erbicidi applicati alle foglie
Composti bipiridilici: i più famosi sono diquat e paraquat. Hanno azione
sulle foglie in crescita. Non vengono assorbiti dalle radici perché si
adsorbono fortemente sulle argille (e non sul carbonio organico). Sono
diserbanti totali.
paraquat
N+
diquat
N+
N+
N+
Glyphosate: è un composto organofosfato, inattivo dal suolo, dalla
tossicità (per i vertebrati) bassissima. E’ un diserbante totale. Mediante
tecniche di ingegneria genetica si è prodotta una varietà di soia
N
resistente.
N
OH
HO
OH
P
N
H
O
glyphosate
HN
NH2
N
O
aminotriazole
NH2
N
N
CH2CHCH2OOH
NH2
3-ATAL
Erbicidi che agiscono sulle malerbe allo stato di
plantula
Sono erbicidi applicati al suolo, usati in preemargenza, prima cioè che
le plantule della cultura appaiano.
Possiamo distinguere alcuni grandi gruppi:
INIBITORI DELLA FOTOSINTESI (REAZIONE DI HILL):
Erbicidi ureici: (diuron, linuron, chlorbromuron). Sono
molto importanti, assieme alle triazine, dal punto di vista
quantitativo. Sono adsorbite al materiale organico
Cl
linuron
O
urea
O
O
N
H2N
NH2
O
N
H
Cl
Cl
Cl
chlorbromuron
diuron
N
HN
Cl
Br
NH
O
N
O
Erbicidi triazinici: (atrazina, simazina) sono molecole
abbastanza solubili e poco volatili, piuttosto persistenti.
Alcune piante (mais, sorgo ecc.) possono inattivarle e quindi
sono intolleranti a dosi piuttosto alte di erbicida.
Cl
HN
N
HN
Simazine
N
N
N
N
H
N
Cl
Atrazine
Cl
N
N
N
N
NH
Trietazine
N
N
H
Derivati dell’acido fenossiacetico: sono una categoria di
erbicidi che controllano infestanti a foglia larga, specialmente
cereali. Come esempio si cita il 2,4-D, il mecoprop, MPCA. Il
2,4,5-T è stato bandito perché conteneva diossina come
impurità. Si ha il fenomeno di “ enhanced degradation” nel
suolo, dopo l’uso per un certo periodo di anni.
Sono molecole dall’azione auxino-simile, che causano crescita
abnorme dei tessuti vicino ai meristemi.
O
OH
O
O
OH
O
O
O
OH
OH
O
O
Cl
Cl
Cl
Cl
Cl
2,4-D
Mecoprop
Cl
MCPA
Cl
2,4,5-T
SOSTANZE CHE AGISCONO A LIVELLO DELLA DIVISIONE
CELLULARE:
Fenilcarbammati: (chlorprophan).
Sulfoniluree: (chlorsulfuron) sono la classe di erbicidi più
promettente, perché agiscono a dosi da 10 a100 volte minori
rispetto agli altri erbicidi (10-100 g/Ha). Sono di recente
introduzione. Si sono mostrati però problemi dovuti alla
persistenza di alcune di questa molecole.
Cl
O
S
NH
NH
O
O
N
N
Chlorosulfuron
O
N
FUNGICIDI
Combattono parassiti fungini che provocano malattie
(infettive), ovvero “alterazioni”, deviazioni delle normali
funzioni e struttura della pianta, ad esempio:
• attività fotosintetica
• attività respiratoria
• assorbimento radicale
• traslocazione
• alterazioni morfologiche, anatomiche e strutturali, come
galle, tumori, screziature (cambiamenti di colore), gommosi
(es. pesco), ipertrofie (bolla del pesco).
Fasi dell’attacco fungino
raggiungimento della pianta da parte del patogeno
penetrazione del patogeno
invasione del patogeno
comparsa di sintomo ad eventuale riproduzione del
patogeno
Caratteristiche dell’attacco fungino
I problemi dell’attacco da funghi sono in parte diversi da quelli
della difesa dagli attacchi degli insetti, per la quasi illimitata
capacità dei funghi di rigenerarsi da piccolissime quantità di
micelio: un fungo già insediato è di difficile estirpazione.
Le strategie di lotta chimica ai funghi si basano essenzialmente
su quando avviene l’infezione:
preventiva: si usano prodotti di copertura (attivi per contatto) o
sistemici
dopo l’infezione: in questo caso i prodotti di copertura sono
poco efficaci (limitano solo la diffusine dell’infezione), mentre i
sistemici sono solo in grado di estirpare il fungo
Occorre notare che i fungicidi, al contrario degli insetticidi, sono
molto selettivi: ci sono almeno 20 gruppi di fungicidi, la maggior
parte dei quali con limitato spettro d’azione.
FUNGICIDI
Come detto, la classificazione è difficile: un esempio di
classificazione è la seguente (meccanismo d’azione e classe
chimica):
INORGANICI e METTALLORGANICI
ORGANICI NON SISTEMICI
ORGANICI SISTEMICI
INORGANICI e METTALLORGANICI
Composti del rame
La tossicità dello ione Cu++ è piuttosto alta e deriva dalla
capacità di formare complessi.
Sono impiegati come fungicidi di copertura, con azione
preventiva in frutticoltura, viticoltura, orticultura contro
peronospore, ticchiolature, bolla del pasco, anche in miscela
con altri prodotti.
• ossicloruri (es: 3CuO • CaCl2 • 4H2O, polvere Caffaro). E’ il composto
contenente rame più usato, come polvere o liquido colloidale
(dispersione
• ossiduli di rame (Cu2O): come sospensione acquosa, soprattutto per la
“concia” dei semi.
• poltiglia bordolese: sostanza di composizione non ben definita
ottenuta per reazione fra Ca(OH)2 e CuSO4. Il composto a cui si deve le
proprietà anticrittogamiche è il solfato basico CuSO4 • 3Cu(OH)2
Composti del mercurio
Sono composti organometallici (ad es.: cloruri di fenilmercurio e
corrispondente acetato). Sono vietati in Italia dal 1972.
Composti dello stagno
Sono molecole estremamente
fungitossiche, del tipo RSnX3, R2SnX2 e
R3SnX (in ordine di tossicità, dove R è
un radicale alchilico o arilico, e X un Fentin acetato
anione monovalente.
O
O
Sn
Zolfo
E’ uno dei più antichi fitofarmaci. Impiegato nelle pratiche
agricole da più di due secoli. L’azione tossica (probabilmente
della sostanza allo stato elementare) è generalmente ad ampio
spettro, in particolare lo zolfo è molto tossico verso la famiglia
delle Erysiphaceae (Oidi). La tossicità verso le piante ad animali
è invece molto bassa.
FUNGICIDI ORGANICI NON SISTEMICI
Agiscono per contatto e spesso agiscono su molteplici siti
d’azione. Ciò è estremamente importante perché riduce il pericolo
della comparsa dei fenomeni di resistenza (che stanno diventando
sempre più importanti con i fungicidi sistemici).
Ditiocarbammati (tra i più importanti)
Sono tra i fungicidi organici più impiegati al mondo. Sono
derivati dell’acido carbammico, sostituendo entrambi gli atomi di
O
S
ossigeno. O
H2N
C
OH
H2N
C
SH
ac. tiocarbammico
ac. carbammico
H2N
C
SH
ac. ditiocarbammico
I composti ad azione fungicida sono sali dell’acido
ditiocarbammico:
alchilditiocarbammati: derivano dalla sostituzione con un
radicale alchilico di uno o di entrambi gli atomi di idrogeno legati
S
allo zolfo.
R
N
C
SMe
R'
alchilenbisditiocarbammati: derivano dalla sostituzione di un
atomo di idrogeno legato all’azoto amminico con un alchilene
S
(es. –CH2-CH2-).
H
H2C
H2C
N
C
SMe
N
H
C
SMe
S
Alchilditiocarbammati:
Fra i più importanti vi sono lo ziram ed il thiram.
-
S-
S
Zn+2
N
N
S
S
N
S
S
N
S
S
Alchilenbisditiocarbammati:
Fra i più importanti vi sono lo zimeb, il maneb ed il mancozeb.
Zn+2
S-
-
Mn+2
S
S
SS
NH
-
S
S
NH
S
NH
NH
zineb
maneb
DL50 orale ratto 5200 mg/kg
DL50 orale ratto 6750 mg/kg
FUNGICIDI ORGANICI SISTEMICI
Hanno avuto un grosso successo perché in grado di attaccare il
micelio contenuto all’interno della pianta. Un altro vantaggio rispetto
ai fungicidi di copertura deriva dal fatto che la loro presenza
all’interno della pianta sottraeva la molecola all’attacco degli agenti
atmosferici (dilavamento, degradazione).
Si possono dividere in 8
gruppi che caratterizzano per
modalità di azione e identità
chimica:
Benzimidazoli:
I derivati del benzimidazolo, come il benomyl, carbendazim,
thiabendazolo, sono senz’altro fra i fungicidi sistemici più usati,
per l’ampio spettro di azione contro ascomiceti e basidiomiceti.
Il loro grande vantaggio, dovuto principalmente allo specifico
sito d’azione tossica, è quello di indurre resistenze, al punto di
rendere il loro effetto assolutamente inefficace.
O
NHCOOCH3
N
benzimidazolo
N
N
H
benonyl
NH
N
O
O
H
N
carbendazim
H
N
NH
N
thiabendazolo
S
O
O
N
N












