Trasformazioni Chimiche
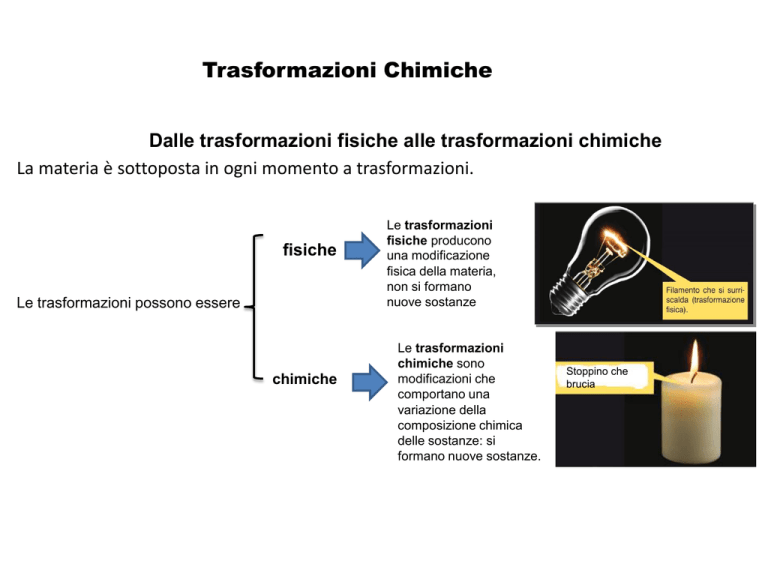
Dalle trasformazioni fisiche alle trasformazioni chimiche
La materia è sottoposta in ogni momento a trasformazioni.
fisiche
Le trasformazioni possono essere
chimiche
Le trasformazioni
fisiche producono
una modificazione
fisica della materia,
non si formano
nuove sostanze
Le trasformazioni
chimiche sono
modificazioni che
comportano una
variazione della
composizione chimica
delle sostanze: si
formano nuove sostanze.
Stoppino che
brucia
Trasformazioni Chimiche
Dalle trasformazioni fisiche alle trasformazioni chimiche
Trasformazioni Chimiche
Nelle trasformazioni chimiche le sostanze originarie si dicono reagenti, le nuove sostanze
prendono il nome di prodotti.
Per descrivere la trasformazione chimica si usa la seguente scrittura
reagenti
prodotti
la freccia indica che le sostanze di partenza: reagenti si trasformano in nuove sostanze: prodotti
Riprendiamo l’esempio della diapositiva precedente
Stoppino che brucia
Stoppino + ossigeno
reagenti
luce + calore + fumo (gas)
prodotti
Trasformazioni Chimiche
Le trasformazioni chimiche possono presentare alcuni cambiamenti
caratteristici:
• formazione di bollicine;
• variazione di colore;
• formazione o scomparsa di un solido;
• liberazione di prodotti gassosi profumati o maleodoranti;
• riscaldamento o raffreddamento del recipiente in cui avviene la reazione.
Trasformazioni Chimiche
RIPASSO SISTEMI
Sistema aperto, scambia con l’ambiente materia e energia
Sistema chiuso, scambia con l’ambiente solo energia e non materia
Sistema isolato, non scambia con l’ambiente né materia né energia
Trasformazioni Chimiche
REAZIONI CHIMICHE E MASSA DEL SISTEMA
Che cosa succede alla massa del sistema durante una trasformazione chimica?
Uno scienziato di nome Lavoisier verso la metà del 1700 riuscì a dare una risposta a tale domanda
L’immagine mostra Lavoisier, nel 1776, intento in
un esperimento con l'ossigeno. Antoine-Laurent
Lavoisier (1743-1794) scienziato francese
considerato tra i fondatori della chimica
moderna. Lavoisier interpretò nella giusta
maniera il ruolo dell'ossigeno nelle reazioni di
combustione.
Famosa è la legge di Lavoisier ovvero il principio
della conservazione della massa, ma è giusto
anche ricordare che egli stabilì le formule
dall'acqua e dell'anidride carbonica.
Nella sua attività laboratoriale Lavoisier condusse una serie di esperimenti sulle reazioni chimiche ponendo l'attenzione sugli aspetti
quantitativi delle stesse.
In particolare se le reazioni venivano condotte in recipienti chiusi, la massa complessiva durante la reazione rimaneva invariata.
Servendosi di una bilancia eseguì accurate misure di massa dei reagenti e dei prodotti delle reazioni riuscendo a dimostrare, nel
1789, che la massa totale delle sostanze ottenute dalla reazione chimica era esattamente uguale alla massa totale delle sostanze
messe a reagire
Trasformazioni Chimiche
La legge di Lavoisier nota anche come legge di conservazione della massa afferma che
nel corso di una reazione chimica la somma delle masse dei reagenti è uguale alla somma delle masse dei prodotti.
In altre parole, nel corso di una reazione chimica la materia non si crea e non si distrugge.
Spiegazione della legge di Lavoisier
Quando bruciamo un pezzo di legno e osserviamo la piccola quantità di cenere che è stata prodotta, ci viene da pensare che la
legge di Lavoisier non sia rispettata.
In realtà commettiamo un grosso errore e cioè quello di considerare soltanto la massa dei solidi (legno come reagente e cenere
come prodotto) e non delle sostanze gassose messe in gioco durante la reazione.
Un'analisi più accurata consente di confermare che la legge di Lavoisier è rispettata.
La somma delle masse dell‘ossigeno consumato e del legno (reagenti della reazione) è esattamente uguale alla somma delle
masse della cenere e dei gas prodotti durante la reazione di combustione.
nell’immagine a il legno sta bruciando (sta reagendo con l’ossigeno
dell’aria)
Nell’immagine b il legno è bruciato completamente (la reazione tra
legno e ossigeno è conclusa)
massa legno + massa ossigeno = massa cenere + massa gas
Trasformazioni Chimiche
REAZIONI CHIMICHE E ENERGIA
Molte reazioni avvengono liberando energia o assorbendo energia
L’immagine mostra la reazione tra metano e ossigeno
Questa reazione produce anidride carbonica, acqua e energia
L’energia che proviene dal sole viene
trasformata dalle piante in energia chimica
contenuta nel glucosio (lo zucchero), noi
mangiamo lo zucchero e trasformiamo tale
energia in calore e energia meccanica
Trasformazioni Chimiche
REAZIONI CHIMICHE E ENERGIA
Le reazioni che avvengono trasferendo energia dal sistema all’ambiente si dicono
esoenergetiche
sistema
energia
ambiente
Le reazioni che avvengono trasferendo energia dall’ambiente al sistema si dicono
endoenergetiche
sistema
energia
ambiente
Trasformazioni Chimiche
REAZIONI CHIMICHE E ENERGIA
In particolare se il sistema chimico cede calore all’ambiente, la reazione si chiama esotermica; se il sistema
assorbe calore dall’ambiente, la reazione si dice endotermica.
Scrittura di una reazione esotermica:
Metano + Ossigeno → Anidride carbonica + acqua + calore
(ik calore è un prodotto, si ottiene dalla reazione)
Scrittura di una reazione endotermica:
Azoto + Ossigeno + calore→ ossido di azoto
(il calore è un reagente, serve per far avvenire la reazione)
Trasformazioni Chimiche
REAZIONI CHIMICHE E ENERGIA
Le reazioni trasformano l’energia: Il primo principio della termodinamica afferma che l’energia può essere
convertita da una forma all’altra, ma non può essere né creata né distrutta.
Ogni sostanza è un magazzino di energia e quando
Sostanze reagenti
Si trasformano
Sostanze prodotto
Energia reagenti
Si trasforma
Energia prodotti
Spesso l’energia dei reagenti è diversa dall’energia dei prodotti e, per quanto affermato sopra,
il ΔEreazione (Eprodotti – Ereagenti) compare sotto altra forma
Trasformazioni Chimiche
REAZIONI CHIMICHE E ENERGIA
Altre
forme di
energia
Energia
chimica
reagenti
Serbatoio energia reagenti = serbatoio energia prodotti + serbatoio altre forme di energia
Energia
chimica
prodotti
Reazione esoenergetica
Altre
forme di
energia
Serbatoio energia reagenti + serbatoio altre forme di energia = serbatoio energia prodotti
Energia
chimica
reagenti
Energia
chimica
prodotti
Reazione endoenergetica
Trasformazioni Chimiche
CINETICA CHIMICA
Quanto impiega una reazione ad avvenire?
Nella nostra quotidianità incontriamo reazioni lente e reazioni veloci
La reazione di formazione della ruggine che scriviamo in questo modo:
Ferro + Acqua + Ossigeno → Idrossido ferrico (ruggine) + Energia è un esempio di reazione lenta
La reazione di combustione del metano che scriviamo come
Metano + Ossigeno → Anidride carbonica + Acqua + Energia è un esempio di reazione veloce
La cinetica chimica è quella parte della chimica che si occupa dello studio della velocità di una reazione
quantità
Trasformazioni Chimiche
La quantità di prodotto aumenta il tempo aumenta
La quantità di reagente diminuisce il tempo aumenta
tempo
Trasformazioni Chimiche
CINETICA CHIMICA
I fattori che influenzano la velocità di una reazione:
Natura dei reagenti (non è un fattore sul quale si può intervenire)
Contatto tra i reagenti
temperatura
Trasformazioni Chimiche
CINETICA CHIMICA
VELOCITA’ DI REAZIONE E SUPERFICIE DI CONTATTO
La velocità di una reazione chimica che avviene tra reagenti in soluzione aumenta se si aumenta la
concentrazione dei reagenti in soluzione
Se i reagenti si trovano in stati di aggregazione diversi, ad esempio uno solido e uno in soluzione, come ad es. la seguente
reazione
Zinco(solido) + acido cloridrico(soluzione) cloruro di zinco(soluzione) + idrogeno(gas)
oppure uno solido e uno allo stato aeriforme come ad es. la seguente reazione,
Legno(solido) + ossigeno(gas)
anidride carbonica(gas) + acqua + cenere
Si può aumentare la velocità della reazione riducendo il solido in frammenti molto piccoli
Trasformazioni Chimiche
CINETICA CHIMICA
VELOCITA’ DI REAZIONE E SUPERFICIE DI CONTATTO
Quando un solido viene finemente suddiviso in pezzi più piccoli, la superficie totale di tutti i pezzi diventa molto
estesa, come si vede dall’immagine.
Se il solido deve reagire con un reagente
in soluzione o aeriforme, nella seconda
immagine offre una maggiore superficie di
contatto e quindi la reazione avviene più
velocemente.
La velocità di una reazione, in cui i reagenti si trovano in stati fisici diversi, aumenta se si aumenta la
superficie di contatto tra i reagenti.
Trasformazioni Chimiche
CINETICA CHIMICA
Velocità di reazione e temperatura
Sperimentalmente si è potuto stabilire che la velocità delle reazioni chimiche
dipende dalla temperatura alla quale I reagenti si trasformano in prodotti
La velocità di una reazione aumenta se si aumenta la temperatura dei
ragenti e diminuisce se la temperatura diminuisce
Trasformazioni Chimiche
CINETICA CHIMICA
Le sostanze reagenti si trasformano in seguito a urti tra le particelle reagenti
Tutti gli interventi che fanno aumentare il numero di urti tra tali particelle provocheranno
un aumento della velocità di reazione.
Se aumenta la concentrazione dei reagenti o la superficie di contatto tra i reagenti
aumenta il numero di particelle reagenti e quindi aumenta il numero di urti
Se aumenta la temperatura aumenta la velocità con cui le particelle reagenti si muovono
e quindi aumenta il numero di urti