Cap. 7 I fenomeni chimici saperi essenziali
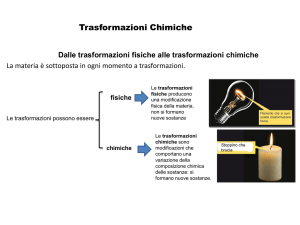
7.1 Reazioni chimiche
Quando due elementi si uniscono per formare un composto questo
possiede proprietà diverse da quelle degli atomi di partenza. Queste
trasformazioni prendono il nome di reazioni chimiche.
Fig. 1
La reazione chimica è un fenomeno chimico per il quale alcune
sostanze, dette reagenti, si combinano fra loro formando altre
sostanze dette prodotti.
L'acqua è un composto che deriva dalla reazione di due elementi
idrogeno e ossigeno.
7.2 Reagenti e prodotti
Osserviamo la reazione chimica mostrata qui sotto. Prima della
Fig. 2
formazione dell’acqua avevamo: due molecole di idrogeno e una di
ossigeno.
Fig. 3
Le sostanze di partenza (idrogeno e ossigeno) sono dette reagenti
da questa si è formata una nuova sostanza (l’acqua) prodotto
della reazione.
Altri esempi di reazione sono:
1) L'anidride solforosa che è un composto che deriva dalla
combinazione dell'ossigeno con lo zolfo (fig. 2)
2) Il solfuro di ferro deriva dalla combinazione di ferro e zolfo
(fig. 3)
Riassumendo
Si definiscono reagenti le sostanze di partenza della reazione
chimica.
Si definiscono prodotti le sostanze che si formano quando la
reazione chimica è avvenuta.
7.3 Equazioni e leggi chimiche
Tutte queste reazioni possono essere rappresentate con le equazioni
chimiche.
Un'equazione chimica descrive una reazione ponendo in genere i
reagenti con la loro formula chimica a sinistra e i prodotti a
destra con al centro una freccia che rappresenta il verso che
segue la reazione.
7.4 Leggi chimiche
Le leggi chimiche che prenderemo in considerazione sono tre:
1) Leggi della conservazione della massa o legge di Lavoisier
2) Legge delle proporzioni definite o legge di Proust
3) Legge delle proporzioni multiple o legge di Dalton
7.4.1 Legge della conservazione della massa
In una qualsiasi reazione chimica la massa complessiva delle
sostanze reagenti è uguale alla massa complessiva dei prodotti della
reazione.
Consideriamo la seguente reazione
Se sommiamo la massa di metano e ossigeno questa è esattamente
uguale alla somma della massa di anidride carbonica e acqua. Una
reazione di questo genere si dice bilanciata.
7.4.2 Legge delle proporzioni definite
In una qualsiasi reazione chimica de divido i pesi delle sostanze
reagenti il quoziente è sempre uguale
7.4.3 Legge delle proporzioni multiple
Nel 1808 l’inglese John Dalton formula la legge delle proporzioni
multiple.
Quando un elemento si combinano con un altro per formare due
composti i pesi del secondo elemento che si combinano col primo
Fig. 4
sono in rapporto costante.
Un esempio è dato dalla reazione fra carbonio e ossigeno
(combustione) che permette di ottenere due molecole dalle proprietà
profondamente differenti, uno tossico e l’altro no.
1g C + 1,33g O → 2,33g CO (monossido di carbonio)
1g C + 2,66g O → 3,66g CO2 (biossido di carbonio)
L’ossigeno utilizzato per le due reazioni ha il seguente rapporto
1,33g : 2,66g = 1 : 2, ovvero numeri piccoli ed interi.