Ripiegamento proteico: dalla
Rice University il nuovo
metodo di studio
I fisici della Rice University hanno scritto un capitolo nuovo
riguardante lo studio delle forze che tengono insieme le
proteine. La nuova ricerca è sulla copertina del numero del 6
agosto del Journal of Physical Chemistry. Le proteine, come
dice il loro stesso nome, derivato dal greco antico proteios,
che significa “al primo posto”, sono alla base della vita.
Ogni proteina è una serie di aminoacidi associati come un filo
di perle. L’ordine degli aminoacidi proviene direttamente dal
“progetto” del DNA, ma questo ordine non indica agli
scienziati quale struttura tridimensionale esse assumono e
perciò quale funzione la
proteina è destinata a compiere.
Le proteine si ripiegano su se stesse poco dopo essere
prodotte (o contestualmente). Questo processo è critico,
perché il ripiegamento potenzialmente potrebbe dare diversi
risultati, di cui solo uno è quello giusto, quello che renderà
funzionale la proteina. Ma che succede se qualcosa va storto?
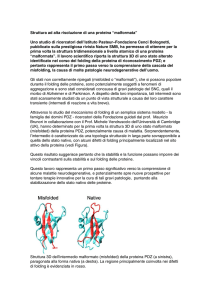
Si ritiene che malattie come il morbo di Alzheimer, la fibrosi
cistica, la BSE (il morbo della mucca pazza), una forma
ereditaria di enfisema e anche molti tipi di cancro siano il
risultato di un processo di folding ovvero di ripiegamento non
corretto (misfolding). Quando le proteine non si avvolgono nel
modo corretto, esse possono raggrupparsi insieme (aggregarsi).
Questi aggregati spesso si accumulano nel cervello, dove si
suppone siano la causa dei sintomi del morbo della mucca pazza
o del morbo di Alzheimer.
Il team di Ching-Hwa Jiang, assistente professore di fisica e
astronomia alla Rice, è specializzato nello studio delle forze
che tengono insieme i filamenti proteici. Il suo gruppo
utilizza un microscopio a forza atomica (AFM). Questo
microscopio consiste di una microleva (cantilever) alla cui
estremità è montata una punta acuminata (tip), tipicamente
composta di silicio o nitruro di silicio che ha raggio di
curvatura dell’ordine dei nanometri. La punta viene collocata
nelle strette vicinanze della superficie del campione di cui
effettua la scansione. La forza di Van der Waals che agisce
tra la punta ed il campione provoca una deflessione della
microleva (la cui costante elastica è nota). La deflessione è
misurata fornendo dati sulla struttura della terziaria e
quaternaria della proteina.
Il lavoro di Jiang non è l’unico modo per studiare il
ripiegamento proteico. Altri gruppi utilizzano sostanze
chimiche per determinare l’energia necessaria a dispiegamento
delle proteine. “Il metodo che utilizza un denaturante chimico
dà informazioni molto accurate sullo stato di “folding” della
proteina e compendia i risultati ottenuti con il nostro
studio” sostiene Jiang.
“Questa è una ricerca fondamentale” ha detto Jiang. “Abbiamo
bisogno di rispondere a queste domande per comprendere meglio
come le proteine si ripiegano, il che riguarda la salute delle
persone, nella speranza di trovare i dati che potrebbero
portare a nuove terapie”.
La ricerca è stata sponsorizzata dalla National Science
Foundation, il National Institutes of Health e la Fondazione
Welch.
Fonte: Rice University
Copyright © - Riproduzione riservata