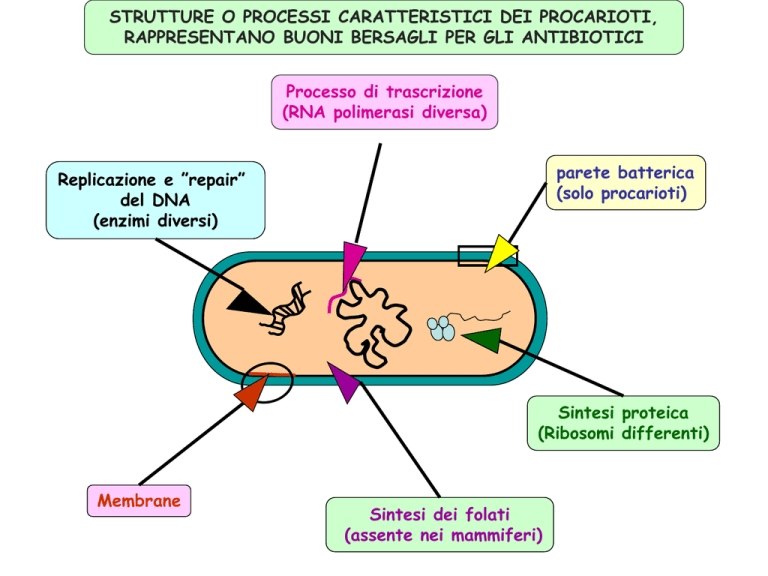
STRUTTURE O PROCESSI CARATTERISTICI DEI PROCARIOTI,
RAPPRESENTANO BUONI BERSAGLI PER GLI ANTIBIOTICI
Processo di trascrizione
(RNA polimerasi diversa)
parete batterica
(solo procarioti)
Replicazione e ”repair”
del DNA
(enzimi diversi)
Sintesi proteica
(Ribosomi differenti)
Membrane
Sintesi dei folati
(assente nei mammiferi)
Antibiotici beta-lattamici e antibiotici glicopeptidici
bloccano la sintesi del peptidoglicano
NAG
NAM
NAG
NAM
NAG
NAM
DAP
DAP
DAP
D-A
D-A
D-A
D-A
D-A
PBP
ANTIBIOTICI BETA-LATTAMICI
prodotti da funghi (penicilline e cefalosporine) e da batteri
(carbapenemi) o di sintesi (monobattami)
IL LORO BERSAGLIO E’ L’ENZIMA (PBP che operano transpeptidazione
e transglicosilazione per la sintesi del peptidoglicano)
Agiscono come pseudosubstrato per le PBP legandosi
covalentemente al sito attivo e acilandolo
Le PBPs si deacilano con estrema lentezza e
risultano quindi inattivate
ANTIBIOTICI GLICOPEPTIDICI (gruppo della vancomicina): IL BERSAGLIO E’
IL SUBSTRATO
Gli antibiotici glicopeptidici sono un gruppo vasto
(es.Vancomicina prodotta da una specie di Amycolatopsis-batterio Gram +)
si legano al dipeptide D-Ala - D-Ala e lo mascherano
Il substrato non è più disponibile per
l’azione delle PBP
I CHINOLONI (di sintesi) BLOCCANO LA
DUPLICAZIONE DEL CROMOSOMA BATTERICO:
Si legano alla topoisomerasi-II
E impediscono che il DNA venga rilegato
Nella cellula si accumulano frammenti di DNA
Le RIFAMICINE prodotte da una specie di Amycolatopsis
si legano alla subunità beta
delle RNA-polimerasi batteriche
“Core enzima”
σ
E impediscono la trascrizione genica, perché la RNA polimerasi non
può più legarsi al DNA da copiare
I RIBOSOMI (LA SINTESI PROTEICA) SONO BERSAGLIO
DI MOLTI ANTIBIOTICI
E
P
A
Le tetracicline naturali sono prodotte da
Streptomiceti, ne sono state anche create
molte semisintetiche
30S
TETRACICLINE
le tetracicline si legano alla subunita’ 30s
deformando il sito “A” e impediscono l’alloggiamento degli
AA-tRNA
GLI AMINOGLICOSIDI
(prodotti da batteri Gram+ di diversi generi del gruppo degli attinomiceti)
SI LEGANO ALLA SUBUNITA’ 30S
“BLOCCANDO” IL COMPLESSO DI INIZIO
e impediscono il legame con la subunità
50S e la lettura del messaggero
QUANDO LA SINTESI E’ GIA’ INIZIATA
Gli aminoglicosidi, legandosi al 30S, Rendono permissivo il sito “A” che accoglie
AA-tRNA non corrispondenti ai codoni del mRNA
vengono quindi sintetizzate proteine con mutazioni
che possono renderle non funzionali
CLORAMFENICOLO, MACROLIDI E LINCOSAMIDI
(da streptomiceti)
50S
30S
Competono per il medesimo sito di legame
sulla subunità 50S
Cloramfenicolo
Macrolidi
Lincosamidi
Interferiscono con l’azione della peptidil-transferasi
bloccando l’allungamento della catena
F-Met
A1
30S
Macrolidi e lincosamidi possono anche fermare lo
scorrimento del ribosoma sul messaggero
Gli involucri esterni sono critici nei batteri
La membrana esterna, tipica dei batteri Gram-negativi, delimita la cellula
batterica impedendo l’accesso a molti composti
La membrana interna è vitale per la produzione di energia e
il trasporto dei nutrienti
A basse dosi la POLIMIXINA
(prodotta da una specie di Bacillus)
Disorganizza la membrana
esterna
sensibilizzando la cellula batterica a
componenti del siero o altri antibiotici
Mentre a dosi elevate
Provoca il collasso della membrana interna e
la morte della cellula batterica
A differenza di noi, i batteri sintetizzano acido
folico
PABA
acido folico
Sintesi DNA-RNA
Sintesi proteine
I sulfamidici (di sintesi) interferiscono con la
biosintesi di acido folico dal PABA
Sintesi DNA-RNA
Sulfamidico
acido folico
Sintesi proteine
Il Trimethoprim (di sintesi) sostituisce l’acido
folico e blocca le vie biosintetiche a valle
Sintesi DNA-RNA
PABA
Trimethoprim
Sintesi proteine
I BATTERI
POSSONO DIVENTARE RESISTENTI
MECCANISMI BIOCHIMICI
FENOMENI BIOLOGICI
ENZIMI INATTIVANTI
Enzimi
β-lattamasi
Farmaci inattivati
β-lattamici
Acetil-transferasi
Fosfo-transferasi
Aminoglicosidi
Adenil-transferasi
Acetil-transferasi
Cloramfenicolo
Le β-lattamasi secrete nello spazio periplasmico, inattivano
le penicilline e le cefalosporine prima che si leghino alle PBP
R
H
S
CH3
CH3
O
O
HN
R
Acido penicilloico
(inattivo)
β-lattamasi
β-lattamico
O
COO-
TPasi
TGasi
TPasi
H
TGasi
S
CH3
CH3
N
COO-
ENZIMI INATTIVANTI GLI AMINOGLICOSIDI
GLI ENZIMI DI MODIFICAZIONE NON DISTRUGGONO LA MOLECOLA
MA LA RENDONO INSERVIBILE
N-acetilare
O
HO
HN
O-fosforilare
2-O P
3
O
HO
Enzimi batterici in grado di:
PREVENGONO IL LEGAME
DELL’ANTIBIOTICO AL RIBOSOMA
AMP-O
O-adenilare
i microrganismi non sprecano mai energia
per questo motivo molti enzimi sono inducibili
prodotti solo quando la loro attivita’ si rende davvero necessaria
molti degli enzimi che modificano gli antibiotici sono
codificati da geni la cui espressione è regolata
Tutti i ceppi di P. aeruginosa hanno nel cromosoma
un gene (ampC ) che codifica una β-lattamasi (AmpC)
Pseudomonas aeruginosa
cromosoma
Spazio periplasmico
La produzione di AmpC è inducibile
Perché la resistenza si manifesti
è necessario che un antibiotico β-lattamico induca la trascrizione del gene e
sia allo stesso tempo un substrato per il prodotto
In un sistema “in vitro” AmpC
Ampicillina
Cefalosporine
Carbenicillina
Piperacillina
Ceftazidime
DA QUESTI DATI, CI SI
ASPETTEREBBE SENSIBILITA’
SOLO NEI CONFRONTI DEI
CARBAPENEMI
Carbapenemi
ma “in vivo”...
Ampicillina
Cefalosporine
Sono riconosciuti come
induttori e degradati da
AmpC
Carbenicillina
Piperacillina
Ceftazidime
Carbapenemi
Sono riconosciuti come
Sarebbero degradati da
induttori, AmpC
AmpC che però non viene
prodotta perché queste È prodotta ma è inefficace
su queste molecole
molecole NON sono
riconosciute come induttori
MODIFICAZIONI DEL BERSAGLIO
IL BERSAGLIO PUO’ ESSERE ASSENTE
I MICOPLASMI, CHE NON HANNO PARETE,
SONO INTRINSECAMENTE RESISTENTI AI β-LATTAMICI
IL BERSAGLIO PUO’ ESSERE NATURALMENTE INSENSIBILE
RESISTENZA INTRINSECA ALLE RIFAMICINE NEI MICOPLASMI
“Core enzima”
σ
RESISTENZA INTRINSECA ALLE CEFALOSPORINE NEGLI ENTEROCOCCHI
Le PBP degli enterococchi sono strutturate in modo da
non essere legate dalle CEFALOSPORINE
IL BERSAGLIO PUO’ MODIFICARSI PER MUTAZIONE *
Gene
Bersaglio modificato
Resistenza
acquisita a:
gyrA
DNA girasi (sub.A)
Chinoloni
parC
Topoisomerasi IV
Chinoloni
rpoB
RNA polimerasi (sub β)
Rifampicina
IL BERSAGLIO PUO’ VENIRE MODIFICATO
BIOCHIMICAMENTE
CH3
Alcuni microrganismi metilano il proprio rRNA , rendendolo
così meno affine nei confronti di Macrolidi e Lincosamidi
I ceppi VRE
(Vancomycin-Resistant-Enterococci)
Sintetizzano un dipeptide
D-alanil-D-lattato
Eliminando le normali
terminazioni D-ala-D-ala
I nuovi dipeptidi non sono
riconosciuti dalla vancomicina
UN’ALTRA PROTEZIONE DEL RIBOSOMA
PUO’ ESSERE OTTENUTA GRAZIE A UN INGOMBRO STERICO
In un altro caso il ribosoma viene protetto da una proteina,
Che lo rende inaccessibile alle tetracicline
UN’ALTRA POSSIBILITÀ È QUELLA DI ALLONTANARE L’ANTIBIOTICO
PRIMA CHE FACCIA DANNI
E’ quello che i microrganismi ottengono con le
pompe di efflusso
LE POMPE DI EFFLUSSO TRANSMEMBRANA
Perché un antibiotico sia efficace, la sua concentrazione all’interno della
cellula batterica deve essere sufficiente a inattivare il bersaglio
I batteri sintetizzano proteine che hanno
la funzione di espellere attivamente la
molecola di antibiotico..
Le pompe di efflusso impediscono alla
concentrazione intracellulare
di risultare efficace
ESISTONO DIVERSI TIPI DI POMPE DI EFFLUSSO
Membrana
plasmatica
Alcune sono specifiche..
Tetracicline (Gram+ e Gram-)
Citoplasma
Macrolidi
(streptococchi stafilococchi)
Disinfettanti e
Intercalanti
(Gram+ e Gram-)
Chinoloni (streptococchi)
..altre non lo sono (Sistemi di efflusso multidrug)
IMPEDIRE ALL’ANTIBIOTICO DI RAGGIUNGERE IL
BERSAGLIO E’ UN’ALTRA STRATEGIA POSSIBILE
Resistenza intrinseca ai GLICOPEPTIDI
nei batteri Gram-negativi
IMPERMEABILITA’
DELLA PARETE
Resistenza intrinseca ai MACROLIDI in
molti batteri Gram-negativi
Resistenza intrinseca a molti farmaci
nei micobatteri
L’impermeabilita’ della parete puo’ anche essere
dovuta ad una mutazione
Pseudomonas aeruginosa
carbapenemi
La porina D2 rappresenta
il canale di ingresso per i carbapenemi
?
?
?
carbapenemi
In seguito a mutazione la cellula può
perdere la capacità di produrre la porina D2
Resistenza acquisita
ai carbapenemi
I VACCINI
PROCESSO DI IMMUNIZZAZIONE ATTIVA
L’OSPITE PRODUCE ANTICORPI CONTRO L’ANTIGENE SOMMINISTRATO
PREVENZIONE
DELL’INFEZIONE
A
SEGUITO
DI
SUCCESSIVE
ESPOSIZIONI ALL’AGENTE PATOGENO OGGETTO DELLA VACCINAZIONE
I SIERI IMMUNI:
PROCESSO
DI
IMMUNIZZAZIONE
PASSIVA:
SOMMINISTRAZIONE DI ANTICORPI PREFORMATI
1) Vaccini interi uccisi: influenza, Salk, epatite A, rabbia, pertosse intero
2) Vaccini vivi attenuati: BCG, MPR, Sabin, febbre gialla, varicella, Ty21a
3) Vaccini con componenti purificati: influenza a sub-unità o split,
pertosse acellulare, anatossina difterica e tetanica, vaccini coniugati
(Hib, pneumococco e meningococco)
4) Vaccini coniugati (Haemophilus influenzae tipo b, meningococco,
pneumococco): polisaccaridi coniugati con proteine carrier che li rendono
maggiormente immunogeni e aumentano il coinvolgimento dei linfociti T
5) Reverse vaccinology: studio del genoma, individuazione dei possibili antigeni
meningococco gruppo B
6) Vaccini DNA ricombinanti: es. HBsAg
7) Vaccini a DNA: contro tutti gli agenti infettivi; non ancora in commercio
8) Vaccini da piante, geneticamente modificate
TECNICHE TRADIZIONALI
Colture batteriche inattivate
rabbia
amplificazione su animali
vaiolo
amplificazione su uova (es. Virus
influenzale) e inattivazione
LIMITI DEI VACCINI TRADIZIONALI
Non tutti i patogeni possono essere coltivati
Problemi di sicurezza per il personale di laboratorio
Costi elevati
Attenuazione insufficiente
Ritorno allo stato infettivo
Necessità di conservazione in luoghi refrigerati
Non disponibile per tutti i patogeni
VACCINI RICOMBINANTI A SUB-UNITA’
Clonazione in batteri o lieviti del gene che
codifica l’immunogeno più rappresentato
Antibatterici:
proteine di adesione o
tossine modificate
Antivirali: una proteina del
capside o dell’envelope
es.: HBsAg ANTIGENE
DELL’ENVELOPE DI HBV
Ottenuto in lievito
PURIFICAZIONE
HBsAg ANTIGENE DELL’ENVELOPE DI HBV
E’ la molecola di scelta per allestire il vaccino
clonandola nell’ospite SACCHAROMYCES
Proteina di
superficie HBs
L’antigene prodotto dal lievito presenta tutte
le caratteristiche della proteina HBsAg nativa
NON si usano virus o batteri interi,
ma solo componenti
Vantaggi: non si somministrano altre
molecole del patogeno
Svantaggi:
La proteina manterrà la conformazione
naturale?
costi
VACCINI ATTIVI RICOMBINANTI OMOLOGHI:
mutanti di specie patogene (delezione/mutazione dei geni di virulenza)
Vantaggio: la delezione dei geni di virulenza non
permette la reversione allo stato virulento
Più efficaci dei vaccini uccisi e di quelli a subunità (proteine)
Es: Produzione di PTX inattiva da parte di B.pertussis
Allo studio:
Virus Erpetico dopo delezione del gene TK che ne causa la virulenza
Vibrio Cholerae :
Il vaccino disponibile è a base di batteri uccisi col fenolo e
l’immunità non dura più di 3-6- mesi
VACCINI ATTIVI RICOMBINANTI ETEROLOGHI:
clonazione in virus o batteri, geneticamente modificati usati come vettori
VIRUS
Es virus del vaiolo bovino: vettore
per vaccini ricombinanti, tra cui
alcuni sperimentali anti-HIV
Il vaccinia virus si replica direttamente nel citoplasma,
non è patogeno e il suo genoma è stato sequenziato
Queste caratteristiche ne fanno un buon candidato per
portare determinanti antigenici di patogeni
Diversi antigeni sono stati inseriti nel
genoma del virus del vaccino:
Proteina G (virus della rabbia)
Antigene superficiale di HBV
proteine NP e HA del virus influenzale
Un vaccino ricombinante per la rabbia nel virus vaccinale, è in grado di
immunizzare le volpi che sono i principali portatori della malattia
MUTANTI DI BATTERI INVASIVI
Mutanti di Salmonella enterica sono stati usati per lo
sviluppo di un nuovo vaccino anti-HBV
Anche batteri non invasivi ma del tutto sicuri (LAB)
sono stati studiati come vettori
VACCINI A DNA
Lo scopo di un vaccino a DNA è promuovere la sintesi
dell’antigene direttamente all’interno di una cellula
Mimando quello che succede nelle infezioni virali
Le cellule Dendritiche sono
critiche in questo processo
vaccini uccisi o attenuati:
gli antigeni penetrano dall’esterno
Seguono la via endolisosomiale;
sono degradati
E i loro frammenti sono
presentati su MHC-II
II
l’informazione inserita direttamente
nella cellula, invece
Raggiunge il nucleo
È trascritta
L’antigene è prodotto nel
citoplasma e segue due vie:
I
Esce dalla cellula
S.I. come i vaccini
tradizionali
E’ tagliato e
presentato su MHC-I
Attiva i CD8
CD8
La forma di rilascio nella cellula
è su di un plasmide
Il gene deve essere sotto un
promotore eucariotico
La somministrazione può avvenire per via
INTRADERMICA
INTRAMUSCOLARE
Queste vie di somministrazione hanno l’effetto di incrementare
l’intercettazione dell’antigene da parte delle cellule dendritiche
INTRADERMICA
Gene gun
Inoculazione seguita da un
trattamento con il laser
Il trattamento con il Laser aumenta il tasso di
ingresso nelle cellule dendritiche
Il “Gene gun” è un dispostivo che spara particelle
d’oro ricoperte con l’antigene
Portacartucce
Cartuccia
per le
particelle
ELIO
Particelle d’oro
ricoperte di DNA
Canale di
accelerazion
e
Le particelle entrano così in contatto direttamente con DC
immature situate subito sotto la pelle (cellule di Langerhans)
All’interno di
microparticelle
INOCULAZIONE
INTRAMUSCOLARE
come DNA nudo
seguita da un trattamento
di elettroporazione
Il trattamento di elettroporazione aumenta
la permeabilità delle DC al vaccino
Le particelle favoriscono l’uptake
E’ STATO ANCHE PROPOSTO UN RILASCIO
ALTERNATIVO AI PLASMIDI
CLONARE IL GENE NEL GENOMA DI
UN BATTERIOFAGO
AMPLIFICARE IL FAGO
INOCULARE IL
FAGO PURIFICATO
LE CELLULE APC CATTURANO IL
BATTERIOFAGO
IL CAPSIDE E’ DEGRADATO
L’INFORMAZIONE E’ RILASCIATA
NEL CITOPLASMA..
I VANTAGGI DEI VACCINI A
DNA SONO MOLTI
STABILITA’
PRODUZIONE SEMPLICE ED
ECONOMICA
FACILITA’ DI
MANIPOLAZIONE
DELL’ANTIGENE (SEGUIRE LE
MUTAZIONI DEL PATOGENO)
SINTESI PROTEICA DIRETTA
DA PARTE DELL’OSPITE
STIMOLAZIONE
PROLUNGATA DEL S.I.
LE PREVISIONI SUL FUTURO DEI
VACCINI:
2000
Uccisi
Attenuati
Immunoterapia
prime boost
(vaccino a DNA +
richiamo successivo con
antigene proteico o
microrganismo inattivato)
Per mezzo di vettori che
non si replicano
Attraverso “reverse vaccinology”
2020
a DNA
Mucosale
A subunità