Rivista Italiana di Genetica e Immunologia Pediatrica - Italian Journal of Genetic and Pediatric Immunology
Anno III numero 1 - gennaio 2011 | direttore scientifico: Carmelo Salpietro - direttore responsabile: Giuseppe Micali
Ossigenoterapia
Rossella Pecoraro, Tiziana Timpanaro, Papale Maria, Francesco Di Mauro1
Dipartimento di Pediatria, Università degli studi di Catania, 1Dipartimento di Pediatria 2 Università Di Napoli
Definizione
L’ossigenoterapia consiste nella somministrazione di ossigeno, generalmente
miscelato con aria, in circostanze patologiche che impediscono la normale
ossigenazione del sangue e dei tessuti. Lo scopo dell’ossigenoterapia è quello di
evitare l’istaurarsi dell’ipossia, aumentando la concentrazione dell’ossigeno, e quindi
la sua tensione parziale negli alveoli polmonari, in modo da favorirne il passaggio
dallo spazio alveolare al sangue [1].
Basi di fisiopatologia respiratoria
L’insufficienza respiratoria rappresenta la principale causa di ossigenoterapia e si
definisce come l’incapacità dei polmoni a soddisfare le esigenze metaboliche
dell’organismo. Si verifica per riduzione della capacità del sistema respiratorio a
mantenere l’omeostasi degli scambi gassosi ed è caratterizzata dalla presenza di
una PaO2 <60 mmHg o di una PaCO2 >50 mmHg [2]. L’alterazione più
comunemente riscontrata in corso di insufficienza respiratoria è la diminuizione della
concentrazione di ossigeno nel sangue arterioso (ipossiemia), cui può far seguito
una anomala ossigenazione tissutale (ipossia), associata talvolta ad una ridotta
eliminazione di anidride carbonica (ipercapnia). Si distinguono quattro forme di
ipossia che sono riassunte nella tabella 1 [1].
Al fine di definire una corretta indicazione all’ossigenoterapia è necessario
distinguere l’insufficienza respiratoria in due differenti forme [tabella 2]:
• Insufficienza respiratoria di tipo I: definita ipossiemico e normo/ipocapnica. E’
relativa a patologie delle vie aeree centrali (croup, corpo estraneo, anafilassi,
tracheite/epiglottite batterica, ascesso retrofaringeo) e del parenchima polmonare
(asma, bronchiolite, polmonite, edema polmonare, fibrosi cistica, displasia
broncopolmonare). E’ determinata da alterazioni del rapporto ventilazione/perfusione
(V/Q) con persistenza di una buona perfusione in aree del polmone poco ventilate
(accesso acuto d’asma, bronchiolite, malattia delle membrane ialine nel neonato) od
anche da condizioni che riducono la perfusione polmonare con ventilazione
conservata (embolia polmonare, cardiopatia congenita cianotica, scompenso
cardiaco). In entrambi i casi l’alterazione del rapporto V/Q comporta il ritorno di
sangue non ossigenato al cuore con conseguente ipossiemia. La risposta
compensatoria all’ipossiemia è rappresentata dall’aumento della frequenza
respiratoria con una conseguente maggiore eliminazione di CO2.
• Insufficienza respiratoria di tipo II: definita ipossiemico-ipercapnica. E’ dovuta ad
una condizione di ipoventilazione alveolare con conseguente incapacità del sistema
respiratorio ad eliminare CO2 in modo adeguato. Si realizza più frequentemente
nelle condizioni che impediscono direttamente la ventilazione, quali: riduzione
dell’input a livello del SNC (trauma cranico, emorragia intracranica, apnee della
prematurità) ; alterazioni delle giunzioni neuro-muscolari (danno al midollo spinale,
avvelenamento da organofosfati/carbammati, sindrome di Guillain-Barrè, miastenia
gravis, botulismo) e patologie neuromuscolari (miopatie e distrofie muscolari).
Questa forma può instaurarsi insidiosamente per il sopraggiungere della fatica dei
muscoli respiratori come complicanza di una patologia preesistente (processo
broncopneumonico acuto, stato di male asmatico, bronchiolite grave) esordita
inizialmente con ipossiemia senza ipoventilazione. La sola supplementazione di
ossigeno in questa forma di insufficienza respiratoria può non essere appropriata.
Questo è vero soprattutto in quelle condizioni cliniche nelle quali il soggetto si è
adattato ad una condizione di ipercapnia cronica (come nei bambini con fibrosi
cistica) ed è relativamente dipendente dai chemocettori periferici ossigeno-sensibili
per mantenere il drive ventilatorio. In questa forma il trattamento con solo ossigeno
può portare ad una depressione del drive ventilatorio con aumento dei livelli di
ipercapnia [1, 2].
L’insufficienza respiratoria in età pediatrica può essere inoltre classificata in acuta,
cronica e cronica riacutizzata, in base al tempo intercorso tra la presentazione dei
sintomi e il suo sviluppo. Nella forma acuta la compromissione della funzione
respiratoria è spesso di entità grave e avviene in un periodo temporale molto breve
(ore o giorni) ; nella forma cronica, invece, insorge lentamente (settimane o mesi) ed
è di severità minore per l’istaurarsi dei meccanismi di compenso; mentre la forma
cronica riacutizzata rappresenta il deterioramento acuto di un’insufficienza
respiratoria cronica [2].
Nella tabella 2 sono riportate le patologie nelle quali viene più frequentemente
utilizzata l’ossigenoterapia.
L’inizio dell’ossigenoterapia è indicato per valori di PaO2 inferiori a 60 mmHg ed
una SaO2 inferiore al 90%, e comunque in tutte quelle condizioni cliniche in cui è
legittimo sospettare una condizione di ipossia [4, 5, 6].
Quali segni clinici precoci di ipossia si possono considerare i seguenti:
• aumento della frequenza respiratoria e cardiaca in relazione all’età;
• utilizzo dei muscoli respiratori accessori;
• ridotta tolleranza alla sforzo;
• irritabilità;
• riduzione delle capacità mentali;
• insorgenza di crisi di apnea e bradicardia (soprattutto nei lattanti).
Tra i segni più tardivi si annoverano:
• stato confusionale;
• alterazioni dello stato di coscienza fino al coma;
• aritmie cardiache;
• cianosi [1, 7, 8].
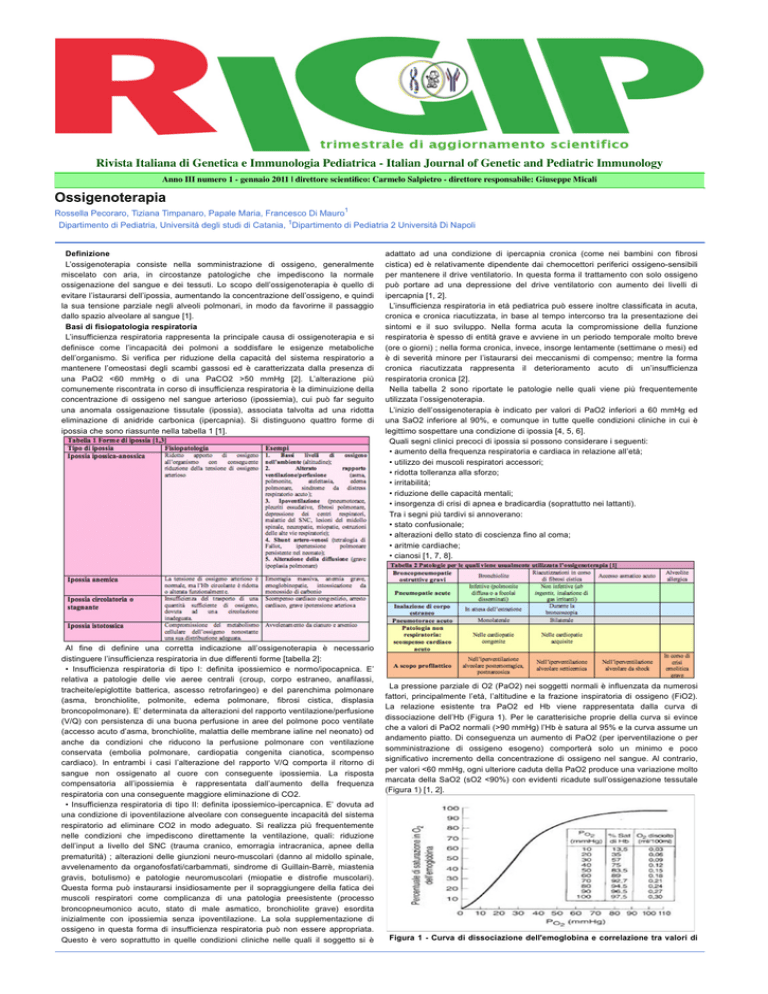
La pressione parziale di O2 (PaO2) nei soggetti normali è influenzata da numerosi
fattori, principalmente l’età, l’altitudine e la frazione inspiratoria di ossigeno (FiO2).
La relazione esistente tra PaO2 ed Hb viene rappresentata dalla curva di
dissociazione dell’Hb (Figura 1). Per le caratterisiche proprie della curva si evince
che a valori di PaO2 normali (>90 mmHg) l’Hb è satura al 95% e la curva assume un
andamento piatto. Di conseguenza un aumento di PaO2 (per iperventilazione o per
somministrazione di ossigeno esogeno) comporterà solo un minimo e poco
significativo incremento della concentrazione di ossigeno nel sangue. Al contrario,
per valori <60 mmHg, ogni ulteriore caduta della PaO2 produce una variazione molto
marcata della SaO2 (sO2 <90%) con evidenti ricadute sull’ossigenazione tessutale
(Figura 1) [1, 2].
Figura 1 - Curva di dissociazione dell'emoglobina e correlazione tra valori di
SaO2 e PaO2 su sangue arterioso
Il valore ideale di SO2 si trova dunque sulla parte piatta della curva, tale per cui
una minima riduzione della PaO2 non determini una netta riduzione della
saturazione, e non sia troppo elevata da ridurre il drive respiratorio da ipossia nei
pazienti con eventuale lieve ipercapnia.
In età pediatrica, la definizione dello stato ottimale di ossigenazione, rimane
comunque controversa. In letteratura [9, 10, 11] il range di normalità di
pulsossimetria (SatpO2) misurata durante il respiro spontaneo, in aria ambiente, è
tra 94% e 97% nei bambini tra 2 e 11 mesi, durante il sonno. Nei primi 2 mesi di vita
sono riportate desaturazioni fino al 72%, con respiro periodico, anche in neonati sani
[2].
Dose da somministrare
Nelle situazioni cliniche acute la dose di ossigeno da somministrare può essere
variabile, raggiungendo inizialmente anche concentrazioni del 60-100% per brevi
periodi di tempo. In seguito, l’ossigeno andrà somministrato alla dose in grado di
correggere l’ipossiemia minimizzando gli effetti collaterali, con valori di FiO2 del
25-40% [1]. Tutti i bambini con asma grave o con SaO2 <92% devono ricevere
ossigeno umidificato attraverso maschera facciale, nasocannule con flussi sufficienti
per raggiungere e mantenere una normale saturazione di ossigeno (≥95%).
Attenzione però, perché la somministrazione non controllata di ossigeno al 100% ai
pazienti con asma acuto grave può essere causa di ipercapnia, particolarmente nei
bambini [12]. Nei casi di ritenzione cronica di anidride carbonica (fibrosi cistica, gravi
pneumopatie croniche) andranno utilizzati anche in fase acuta bassi flussi di
ossigeno, per evitare ulteriori incrementi di anidride carbonica a seguito del venir
meno dell’ipossia, che in questi soggetti rappresenta un efficace stimolo alla
respirazione. Particolare attenzione deve essere posta, inoltre, quando la PaCO2
arteriosa raggiunge valori di 60-70 mmHg (evento possibile soprattutto in soggetti
con patologia respiratoria cronica) ; l’azione del gas carbonico in questi casi diviene
paradossa, vale a dire che, anziché stimolare i centri del respiro l’anidride carbonica
li può deprimere fino alla narcosi. In questi casi l’ipossia resta l’unico stimolo atto a
far funzionare i centri stessi; sopprimendola con la somministrazione di ossigeno si
può procurare un arresto respiratorio centrale.
Nei casi in cui il monitoraggio dei gas ematici mostri una tendenza all’accumulo di
anidride carbonica oltre i valori limite vi è l’indicazione all’invio del paziente in
un’unità di terapia intensiva; in questi casi la ventilazione artificiale escluderà la
necessità dello stimolo centrale e consentirà una normale ossigenazione [1].
Un approccio diverso si instaura nelle patologie respiratorie croniche neonatali
(chronic neonatal lung disorders, CNLD), condizioni che rappresentano le principali
cause di ossigenoterapia domiciliare nei bambini. Per questo gruppo di pazienti
sottoposti ad ossigenoterapia per lunghi periodi di tempo, esistono due principali trial
randomizzati sui target di SO2 (STOP-ROP e BOOST) che valutano la progressione
della retinopatia da ossigenoterapia e suggeriscono un range di SO2 tra 89%-94%
quale target ragionevole. Tuttavia, in assenza di patologia, dopo l’epoca neonatale
una SatpO2 <95% indica una condizione di ipossia; pertanto superata l’età della
retinopatia O2 dipendente si raccomanda che la somministrazione di O2 sia
sufficiente a mantenere una satpO2 > 95%. Studi recenti dimostrano che, in questi
pazienti, avere come target alti livelli di saturazione (95-98%) non determina
vantaggi significativi in termini di crescita staturo-ponderale o sviluppo
neurocomportamentale rispetto al mantenimento di saturazioni standard (91-94%) ;
inoltre il mantenere saturazioni più elevate comporta una più lunga ossigenodipendenza con conseguenti maggiori rischi legati alla terapia. È chiaro che, al
tempo stesso, devono essere evitati prolungati periodi di ipossiemia ed oscillazioni
nella saturazione di ossigeno; tali condizioni possono a lungo termine condurre, per
una cronica attivazione della muscolatura arteriolare polmonare da ipossiemia, a
quadri di ipertensione polmonare [2, 5, 13].
Effetti tossici dell’ossigeno
In tutti i pazienti sottoposti a ossigenoterapia deve essere somministrata la quantità
minima di ossigeno capace di riportare a valori normali la PaO2 senza superarne il
limite massimo, per non incorrere negli effetti tossici. In effetti, contrariamente alla
nozione che l’ossigeno protegga le cellule da lesioni, le evidenze raccolte mettono in
luce come l’ossigeno, attraverso la produzione di metaboliti tossici, sia responsabile
di molte delle lesioni cellulari dei pazienti critici. Esiste un rapporto inversamente
proporzionale tra concentrazione di ossigeno e tempo di comparsa del danno:
concentrazioni di ossigeno inspirato superiori all’80% producono danni tissutali entro
48 ore; concentrazioni del 50% sono più sicure nelle somministrazioni prolungate [1,
14]. Gli intermedi del metabolismo dell’ossigeno sono dei potenti ossidanti capaci di
danneggiare le membrane cellulari, denaturare le proteine e rompere il DNA in
filamenti producendo effetti tossici sul sistema nervoso centrale (nausea, vomito,
ansia, alterazione della vista, allucinazioni, tinnito, vertigini, singhiozzo, convulsioni),
sul polmone (tosse secca, congestione, edema polmonare, fibrosi polmonare,
atelettasia per danno del tensioattivo), sul circolo (bradicardia e ipotensione) e sui
sistemi enzimatici (blocco degli stessi per inibizione degli enzimi respiratori con
accumulo di prodotti tossici) [14]. La retinopatia del prematuro (ROP) è una
condizione che continua a presentarsi nonostante si attui un buon controllo
dell’ossigeno. Questo, oggi, è più probabilmente dovuto alla sempre maggiore
sopravvivenza di prematuri con basso peso alla nascita piuttosto che alla sola PaO2
elevata. Ciò suggerisce che siano implicati sia l’ossigeno che fattori non correlati
all’ossigeno. La ROP è una malattia bifasica in cui l’ambiente relativamente
iperossico che si ha come conseguenza della distribuzione iniziale conduce ad un
rallentamento o persino ad una cessazione dello sviluppo vascolare retinico del
bambino prematuro. L’ossigeno addizionale può ulteriormente contribuire a questo
problema, influenzando l’espressione dei fattori di crescita vascolari e
dell’eritropoietina. La seconda fase della malattia è caratterizzata da una
neovascolarizzazione ipossia-indotta, simile a quella osservata nella retinopatia
diabetica. Ciò porta alla cicatrizzazione fibrosa con il rischio di distacco di retina.
Quale sia la quantità di ossigeno definibile come eccessiva rimane controverso e
sono necessarie ulteriori ricerche. [2, 3, 15, 16, 17]. Inoltre l’ossigeno può provocare
danni locali come l’arrossamento e il senso di secchezza alle narici e al faringe,
disturbi psicologici e rischio di incendio ed esplosioni [2].
Monitoraggio dell’ossigenoterapia
Il monitoraggio dell’ossigenoterapia si avvale di metodi invasivi e metodi non
invasivi, con peculiarità e indicazioni differenti.
Metodi invasivi
Emogasanalisi arteriosa
Tra i metodi invasivi l’emogasanalisi arteriosa rappresenta il gold standard
soprattutto perché ha il vantaggio di essere completa nello studio dei gas ematici
(pH, PaO2, PaCO2, SaO2, eccesso basi). Tuttavia presenta lo svantaggio di essere
una tecnica invasiva, di provocare gravi complicanze (embolia arteriosa, neuropatia
periferica, infezione, emorragia) in caso di prelievi ripetuti e di avere valori falsati
come conseguenza del dolore da puntura, di errori nel prelievo (campione venoso,
bolle d’aria) o durante il trasporto del campione.
Emogasanalisi da sangue venoso arterializzato
Viene eseguita dopo aver riscaldato in acqua calda per circa 5-7 minuti la sede del
prelievo (polpastrello di un dito nel bambino, tallone nei neonati). La relativa facilità
di esecuzione e l’assenza di complicanze costituiscono i vantaggi di tale tecnica,
sebbene l’imperfetta correlazione con i valori del sangue arterioso per la PaO2 ne
sconsigliano l’utilizzo soprattutto in epoca neonatale.
Metodi non invasivi
Valutazione transcutanea dei gas ematici
Si realizza attraverso l’applicazione sulla cute di un sensore in grado di determinare
continuamente le pressioni parziali di ossigeno, anidride carbonica e della
saturazione dell’emoglobina circolante.
Misurazione transcutanea della PtcO2 e della PtcCO2
La pressione parziale di ossigeno viene misurata sulla superficie cutanea,
preferibilmente in sede sottoclaveare, attraverso un elettrodo che riscalda la cute
sottostante a 43-44° arterializzando il letto capillare. L’O2 dai capillari diffonde
attraverso la cute intatta e raggiunge l’elettrodo che misura direttamente la PO2.
Questo valore di solito ha una buona correlazione con la PO2 sia nel neonato che
nel bambino più grande. Tuttavia, in presenza di vasocostrizione periferica o cute
spessa, la misurazione può essere errata. Una diminuizione della gittata cardiaca
tende a determinare una riduzione artefatta della PO2 transcutanea a causa
dell’ipossia cutanea che ne deriva. Il monitoraggio transcutaneo dei gas è
particolarmente utile nei lattanti, in cui il flusso ematico cutaneo locale tende ad
essere elevato. Questi strumenti richiedono una calibrazione frequente, la necessità
di una manutenzione periodica dell’elettrodo e di un riposizionamento frequente del
sensore per evitare l’insorgenza di ustioni cutanee. Tuttavia presentano il vantaggio
di non essere invasivi, di poter realizzare un monitoraggio continuo ed essere
utilizzati a domicilio o durante il trasporto. L’elettrodo per la misurazione della
pressione parziale dell’anidride carbonica si basa, invece, sul principio della
variazione del pH di un sottile film elettrolitico separato dalla cute da una membrana
permeabile all’anidride carbonica. Anche questi sensori presentano vantaggi e limiti
sovrapponibili a quelli descritti per il sensore PtcO2 [1, 18, 19].
Saturimetria (ossimetria pulsatile)
Il saturimetro (o pulsossimetro) è un piccolo strumento che va applicato
all’estremità del dito del paziente al fine di valutare la saturazione del sangue
arterioso e la frequenza cardiaca. Esso misura, attraverso un fascio di luce rossa,
l’emoglobina ossigenata nell’arteriola digitale. Consente il monitoraggio continuo e
prolungato dell’ossigenazione ematica e la lettura dei valori in tempi reali.
La misurazione della SaO2 è fisiologicamente correlata alla tensione arteriosa di
ossigeno (PaO2) in accordo con la curva di dissociazione dell’emoglobina. Per la
conformazione sigmoide della curva, l’ossimetria è relativamente insensibile
nell’identificare l’ipossiemia in pazienti con un’alta PaO2 di base (figura 1). La
presenza di carbossiemoglobina o di metaemoglobina non viene registrata dallo
strumento che fornirà un dato errato. La lettura è inaffidabile in presenza di
ipotermia, ipoperfusione periferica, grave anemia, ed è molto sensibile ai movimenti
del bambino [1, 8, 20].
Poiché la SatpO2 può variare in modo considerevole durante il sonno,
l’alimentazione e l’attività fisica, l’ossigenazione va controllata con un monitoraggio
continuo in tutte queste situazioni, al fine di ottimizzare l’ossigenoterapia e di evitare
i danni da O2. Questo è importante, soprattutto nei bambini in terapia a lungo
termine, nei quali il monitoraggio della SatpO2 avviene almeno per 6-12 ore nel
primo anno di vita ed almeno durante il sonno nelle età successive. Il follow up del
bambino dimesso in ossigenoterapia a lungo termine, dovrebbe essere effettuato a 1
settimana dalla dimissione e, quindi, secondo le necessità, ma sicuramente ogni 3
mesi. Il controllo deve includere la misurazione della SatpO2 in varie condizioni
(veglia, sonno, alimentazione) ed una registrazione continua è ideale, per poter
stabilire la reale necessità. La eventuale sospensione della ossigenoterapia deve
quindi essere presa in considerazione dopo monitoraggi effettuati nelle diverse
condizioni. Sono consigliati distacchi progressivi di alcune ore, piuttosto che una
sospensione totale, anche quando i valori di saturimetria siano buoni; bisogna inoltre
considerare che può essere necessario riprendere la ossigenoterapia in caso di
riacutizzazione respiratoria [2, 21].
La quantità di ossigeno da erogare per mantenere i normali valori di saturazione è
un indice dello stato di salute del bambino con broncodisplasia. In pratica, se è
necessario un maggiore flusso di ossigeno per mantenere i consueti livelli di
saturazione è probabile che ci si trovi di fronte ad un aggravamento del distress
respiratorio che merita un controllo a tempi brevi; al contrario, indice di un
miglioramento clinico è quando il flusso di ossigeno, normalmente erogato, produce
più elevati livelli di saturazione.
Va ricordato che il monitoraggio della saturazione viene consigliato anche ai
bambini gravemente prematuri (EG <28 settimane) anche se non
ossigenodipendenti. Il monitoraggio viene eseguito durante le infezioni delle vie
aeree, anche apparentemente banali, per poter cogliere i primi segni di insufficienza
respiratoria ed anticipare i controlli clinici [13].
Ossigenoterapia iperbarica
L’Ossigenoterapia iperbarica (OTI) consiste nella somministrazione di ossigeno
puro in ambienti ermeticamente chiusi (camere iperbariche) in cui si respira ad una
pressione superiore rispetto a quella atmosferica (1 ATA). In questo modo si ottiene
un aumento della frazione di ossigeno disciolta nel plasma che rappresenta la
frazione in grado di diffondere più rapidamente ai tessuti. Questo, a sua volta,
comporta la possibilità di ripristinare l’ossigenazione in aree dove i vasi sanguigni
sono carenti o danneggiati (aree ipossiche o ipoperfuse) permettendo la ripresa di
funzioni tissutali ossigeno-dipendenti e la possibilità di contrastare effetti tossici che
abbiano implicato una ipossia tessutale. L’OTI è quindi utile in tutti quegli stati
morbosi in cui esiste e persiste uno squilibrio locale fra necessità, apporto e capacità
di utilizzazione dell’ossigeno [22, 23, 24].
Nella tabella 3 sono riassunti i principali effetti dell’ossigeno iperbarico e le
principali indicazioni per il suo utilizzo.
Un cenno particolare meritano gli interventi di cardiochirurgia eseguiti in camere
iperbariche opportunamente attrezzate. Secondo alcuni autori il vantaggio di un
intervento in ambiente iperbarico consiste nella possibilità di mantenere alti livelli di
ossigeno a livello tessutale allorquando si produca un arresto circolatorio durante il
clampaggio dei grossi vasi, di innalzare la soglia di fibrillazione ventricolare e di
abbassare quella di defibrillazione [25]. Inoltre, è bene ricordare che l’OTI viene
applicata anche nel difficile campo della rianimazione neonatale: sono stati raggiunti
in alcuni casi risultati sufficientemente accettabili, ma ancora da sottoporre a
conferma scientifica univoca [26, 27].
L’insita tossicità dell’O2 ed il potenziale danno da innalzamento della pressione
ambientale devono essere considerati ogni volta che l’OTI viene utilizzata come
terapia. Il barotrauma dell’orecchio medio è l’effetto avverso più comune, mentre un
evento estremamente raro è il barotrauma polmonare. La pressione terapeutica
abitualmente scelta va da 2 a 3 ATA; al di sopra di questa pressione la tossicità
biochimica dell’ossigeno può manifestarsi con danni a carico dei polmoni, del
sistema nervoso centrale (convulsioni) e degli occhi (retinopatia).
Per le varie affezioni morbose la somministrazione di ossigeno viene effettuata con
schemi terapeutici caratteristici per ogni terapia. Il numero delle sedute può variare
da 2-6 alla settimana, per alcune lesioni trofiche vascolari, fino a 4 nelle 24 ore nel
trattamento della gangrena gassosa. Il protocollo terapeutico può prevedere
complessivamente da poche sedute, nel caso di affezioni acute, fino a 40-60
trattamenti in alcune forme croniche refrattarie [23, 28].
Metodi di erogazione dell’ossigeno
I sistemi di erogazione dell’ossigeno sono classificati come sistemi a basso e ad
alto flusso e sono riportati nella tabella 3.
L’ossigeno utilizzato a scopo terapeutico è un gas incolore e inodore conservato ad
alte pressioni (120-200 atm) in impianti di distribuzione centralizzati oppure in
bombole trasportabili. La strumentazione necessaria per la sua somministrazione è
costituita da un riduttore, un flussometro e un umidificatore. La funzione del riduttore
è quella di ridurre l’alta pressione esistente nelle bombole al fine di assicurare una
fuoriuscita costante di gas indipendentemente dalla pressione esistente nella
bombola. Il flussometro consente di regolare la quantità di ossigeno erogata al
paziente (esistono differenti flussometri con range di flusso compresi tra 0-1, 5 l/min,
0-5 l/min, 0-15 l/min); l’umidificatore, invece, serve a umidificare l’ossigeno erogato
per evitare l’essiccamento delle mucose e fluidificare le secrezione tracheobronchiali. Le apparecchiature migliori in commercio sono quelle che consentono
contemporaneamente l’umidificazione e il riscaldamento della miscela inspirata. Una
miscela troppo fredda (< 35° C), infatti, può determinare a sua volta effetti negativi,
quali l’aumento della lesività dell’ossigeno sulla mucosa, l’aumento delle resistenze
vascolari polmonari e della contrattilità polmonare e la riduzione della temperatura
corporea. Quando l’ossigeno viene somministrato a bassi flussi (1-4 l/min)
generalmente l’orofaringe e il nasofaringe sono in grado di provvedere
all’umidificazione e riscaldamento in modo adeguato. La scelta del metodo di
somministrazione dell’ossigeno nel bambino è funzione di diversi fattori: la FiO2 che
si intende raggiungere, il livello di umidificazione desiderato, la tollerabilità del
sistema da parte del paziente, la durata del trattamento e il tipo di insufficienza
respiratoria.
Sistemi di somministrazione
Catetere nasale singolo
Può essere inserito per 2-3 centimetri nella coana anteriore oppure essere
introdotto fino alla coana posteriore ad una distanza dalle narici uguale a quella
esistente tra l’ala del naso e il trago (tabella 3). I cateteri sono costruiti in plastica
morbida e provvisti di numerosi forellini nella parte terminale allo scopo di ridurre
l’effetto essiccante e irritante che l’ossigeno esercita. Tuttavia, la presenza
dell’estremità del catetere nell’orofaringe non permette il contatto dell’ossigeno con
la mucosa rinofaringea, fisiologicamente deputata all’umidificazione dell’aria, e può
provocare distensione gastrica per insufflazione nello stomaco, nonché ulcerazione
delle mucose nasali per eccessiva permanenza. Questo tipo di cannula viene
utilizzata soprattutto nel neonato-lattante. Consente di raggiungere valori alti e
costanti di FiO2 a scapito di più frequenti complicazioni.
Cannule o occhiali nasali
Le cannule nasali sono un presidio semplice e comodo da utilizzare, e possono
essere tollerate meglio della mascherina. Hanno la capacità di favorire la normale
umidificazione dell’ossigeno inspirato a bassi flussi e permettono di non
interrompere l’ossigenoterapia durante l’alimentazione, la fisioterapia ecc. Viene
utilizzata nel caso in cui il soggetto necessita solo di una piccola quantità di
ossigeno per mantenere l’adeguata ossigenazione. La FiO2 massima erogabile è
usualmente compresa tra 0, 24-0, 44 e il flusso massimo è di 6 l/min. Non bisogna
superare 3 l/min nei lattanti e a partire dai 4 litri è necessaria l’umidificazione.
Esistono diverse misure ed è opportuno utilizzare quella più idonea all’età del
bambino (tabella 3). Per flussi di ossigeno alti possono causare irritazione locale e
secchezza. Il loro uso è controindicato nei soggetti con apnea, ipossia severa e nei
soggetti con occlusione delle narici e/o che respirano a bocca aperta con frequenza
respiratoria elevata.
Cappette di Hood
Sono involucri di plexiglass trasparente atti a contenere la sola testa o l’intero corpo
di neonati o lattanti. La maggior parte di esse presenta delle aperture che possono
essere chiuse parzialmente a seconda della FiO2 che si intende raggiungere
(all’interno della cappa si possono raggiungere concentrazioni di ossigeno fino a
90-95%). Si utilizzano con umidificatore riscaldato. Il flusso del gas deve essere
mantenuto superiore a 7 l/min per consentire l’eliminazione dell’anidride carbonica
prodotta. Utilizzando questo presidio è consigliabile controllare la FiO2 con un
analizzatore di ossigeno posto vicino al viso del bambino. Risultano particolarmente
utili nei neonati e lattanti che richiedono alte FiO2 (durante il divezzamento dal
respiratore, nelle tachipnee transitorie neonatali). Non essendo sistemi monouso
bisogna prestare particolare attenzione alla loro pulizia e disinfezione dopo l’utilizzo.
Maschere facciali (maschere semplici, maschere di Venturi, maschere con
reservoir, tende a ossigeno)
Sono utili per l’ossigenoterapia nei bambini che non tollerano le cannule nasali e
solitamente sono indicate per brevi cicli terapeutici. Sono costruite in materiale
plastico, soffice e trasparente, e permettono di somministrare l’ossigeno in
concentrazioni note variabili dal 24% al 100%. Le maschere semplici sono indicate
per la somministrazione di ossigeno a concentrazioni intorno al 50%. Non sono
perciò in grado di provvedere interamente alle richieste respiratorie: l’aria
dell’ambiente viene trascinate all’interno attraverso fori della maschera per
supplementare il basso flusso di ossigeno. Soprattutto per basse velocità di flusso si
può verificare un significativo rebreathing, in quanto l’aria espirata dal bambino non
è adeguatamente allontanata tra viso e maschera. Il loro uso è da proscrivere,
pertanto, in caso di insufficienza respiratoria con ipercapnia. Le maschere di Venturi,
invece, sono dotate di particolari valvole che sfruttano il principio del jet mixing o
effetto Bernoulli secondo il quale al passaggio dell’ossigeno attraverso un orifizio
ristretto si genera una corrente ad alta velocità che attira all’interno del sistema una
quota costante di aria ambiente. La quantità di aria che viene attirata all’interno della
maschera è funzione di due parametri: la velocità del getto di ossigeno (dipendente
dalla velocità del flusso di ossigeno e dalle dimensioni dell’orifizio della valvola) e le
dimensioni delle aperture laterali della valvola [1].
Le maschere seguono un codice colore, ossia ad ogni colore corrisponde una
precisa percentuale di ossigeno nonché i litri al minuto (l/min) per garantire la FiO2
desiderata, così le concentrazioni di ossigeno raggiungibili sono [73]:
particolarmente utile nei casi di ipossiemia in presenza di una ventilazione
sufficiente, in quanto permette una precisa valutazione della FiO2 ed è utile anche in
caso di respirazione naso buccale o prevalentemente buccale. Le maschere con
reservoir esistono in due varietà: la partial re-breathing mask e la non re-breathing
mask. La prima è sprovvista di valvole unidirezionali tra maschera e reservoir,
motivo per cui una parte dei gas espirati, circa un terzo, entra nel reservoir
divenendo parte della successiva respirazione, mentre i restanti due terzi vengono
allontanati attraverso apposite aperture nella maschera. Con tali maschere si
raggiungono FiO2 di 0, 80. La seconda invece è dotata di una valvola unidirezionale
tra maschera e reservoir, in modo che il bambino inali solo dal reservoir e possa
espirare solo attraverso valvole ad una via poste sul bordo della maschera. Un
sistema di valvole di sicurezza permette inoltre all’aria di entrare nel sistema nel
caso in cui la sorgente di ossigeno venisse accidentalmente sconnessa. Con tale
tipo di maschera sono raggiungibili FiO2 di 0, 95. Le indicazioni maggiori per questo
tipo di presidio sono tutte le situazioni acute in cui vi sia la necessità di
somministrare ossigeno ad alte concentrazioni e per un breve periodo.
Le tende a ossigeno sono sistemi misti che possono usare tanto tecniche ad alto
flusso quanto a basso flusso. Si tratta di dispositivi in materiale plastico che
avvolgono completamente il letto del paziente (tabella 3). Consentono di controllare
la concentrazione di ossigeno, la temperatura e l’umidità all’interno ed hanno il
vantaggio, inoltre, di evitare al paziente il fastidio dell’applicazione di cannule,
cateteri o maschere. Numerosi, tuttavia, sono gli inconvenienti legati al loro utilizzo,
quali la necessità di flussi di ossigeno molto alti (10-15 l/min), la necessità di molto
tempo per il raggiungimento di una data FiO2, il calo repentino della FiO2
all’apertura della tenda e la difficoltosa osservazione del paziente da parte del
personale medico e dei genitori [1, 74].
Nei trattamenti a lungo termine è previsto l’utilizzo del sistema a basso flusso, in
grado di erogare anche quantità di 0, 1 l/min, in considerazione delle esigenze e
dell’età del paziente. Le fonti attualmente disponibili per la somministrazione di
ossigeno domiciliare sono, attualmente, le bombole ad alta pressione (gassoso), i
sistemi ad ossigeno liquido e i concentratori di ossigeno (Tabella 3). La scelta dei
diversi sistemi è legata, oltre ai vantaggi e svantaggi, anche all’età del paziente, al
livello di autonomia ed al flusso di ossigeno necessario. I dispositivi di erogazione
dell’ossigeno comunemente utilizzati sono le cannule nasali, nei bambini con vie
respiratorie integre, sostituite dalle maschere facciali nei soggetti con occlusione
delle narici e/o che respirano a bocca aperta. Nei bambini tracheostomizzati, invece,
la somministrazione di ossigeno attraverso la cannula tracheostomica, qualora ve ne
sia precisa indicazione, può avvenire attraverso il collegamento mediante specifiche
maschere per tracheotomia; tuttavia, essendo questo presidio difficilmente fissabile
in un bambino, non consentendo quindi una somministrazione precisa
dell’ossigenoterapia, si può ovviare con l’uso del “naso artificiale” che consiste in un
filtro umidificatore passivo che prevede una presa per l’ossigeno ed un foro centrale
per l’aspirazione, che risulta di fatto, quello di uso più comune, in quanto più pratico
ed efficace. Tuttavia, per tale presidio, è raccomandato l’uso su pazienti con peso
corporeo superiore a 15 Kg. Per i bambini di peso corporeo inferiore non risulta ci
siano attualmente strumenti certificati per la somministrazione di O2 domiciliare
attraverso la tracheotomia [2, 76].
Durante la ventilazione meccanica, è possibile migliorare l’ossigenazione
aumentando la FiO2 o la pressione media delle vie aeree. La ventilazione
meccanica viene iniziata per fornire un supporto a polmoni che funzionano
normalmente o per malattie che fanno diminuire la compliance (sindrome da distress
respiratorio acuto, atelettasia, polmonite, edema polmonare ed emorragia
polmonare) o aumentare la resistenza (asma, bronchiolite, displasia
broncopolmonare, inalazione di fumo e fibrosi cistica). Le situazioni in cui i polmoni
sono normali possono non richiedere supplemento di ossigeno, in caso contrario si
inizia con una FiO2 al 100% per poi ridurla al 50%. Le malattie di diminuita
compliance, invece, causano una ipossiemia significativa ed è consuetudine iniziare
con una FiO2 al 100% per poi ridurla al 60% o meno al fine di evitare la tossicità da
ossigeno. Nelle malattie di aumentata resistenza, infine, si inizia con una FiO2 al
100% riducendola lentamente al fine di mantenere un’adeguata ossigenazione ed
evitando, al tempo stesso, una tossicità da ossigeno. Gli obiettivi principali della
ventilazione meccanica sono: fornire un adeguato scambio di gas e favorire
l’eliminazione dell’anidride carbonica senza causare un barotrauma polmonare o una
tossicità da ossigeno.
L’ECMO (ExtraCorporeal Membrane Oxygenation, ossigenazione di mambrana
extracorporea) è usata nel trattamento di neonati e lattanti con insufficienza
respiratoria refrattaria potenzialmente fatale che non risponde alla ventilazione
meccanica e si prevede che si risolva in un breve periodo di tempo. Tuttavia a causa
dei suoi rischi (da cateterizzazione vascolare e anticoagulazione) e del fatto che i
suoi vantaggi rispetto al trattamento convenzionale nei pazienti non-neonatali non
stati dimostrati in modo inequivocabile, le indicazioni per l’ECMO richiedono
notevole esperienza, prudenza e giudizio [75, 77].
Bibliografia
1. Niccoli AA, Castellucci G. Insufficienza respiratoria e ossigenoterapia.
Broncopneumologia. 2008;5-10.
2. Esposito F, Cavaliere P, Esposito I et al. Ossigenoterapia domiciliare nei bambini
con insufficienza respiratoria cronica. Pneumologia Pediatrica 2009; 33: 31-42.
3. Wagstaff AT. Ossigenoterapia. In: Bersten A.D., Soni N. Oh Manuale di Terapia
Intensiva. 6 th ed. Elsevier. 2010;319-31.
4. Kallstrom TJ. AARC Clinical Practice Guideline: oxygen therapy for adults in the
acute care facility: 2002 revision & update. Respir Care 2002;47:717-20.
5. Duke T, Graham SM, Cherian MN. Oxygen is an essential medicine: a call for
international action. Int J Tuberc Lung Dis. 2010;14 (11) :1362-8.
6. Ashworth A, Bickler S, Deen J. Guidelines for the management of common
illnesses with limited resources. World Health Organization. 2005;72-5.
7. Philip Ayiekoa and Mike English. In Children Aged 2–59 months with Pneumonia,
Which Clinical Signs Best Predict Hypoxaemia?. J Trop Pediatr. 2006;52:1-2.
8. Terzano C, Pacilio R. Ossigenoterapia. In: Terzano C. Malattie dell’apparato
respiratorio. Springer. 2006:741-56.
9. Mac Lean JE, Fitzgerald DA. A rational approach to home oxygen use in infants
and children. Pediatric Respiratory Reviews. 2006;7:215-22.
10. Statement on the care of the child with chronic lung disease of infancy and
childood. Am J Respir Crit Care Med. 2003;168:356-96.
11. Katecha S, Allen J. Oxygen therapy for infants with chronic lung disease. Arch
Dis Child Neonatal. 2002;87:11-4.
12. Indinnimeo L, Barbato A, Cutrera R et al. Gestione dell’attacco acuto di asma in
età pediatrica: Linee Guida della Società Italiana di Pediatria. Pneumologia
Pediatrica 2008;29:5-20.
13. Patria MF, Giannì L, Colnaghi M et al. Il follow-up del neonato prematuro: quello
che il pediatra deve conoscere. Pneumologia Pediatrica. 2005; 19: 13-23.
14. Marino PL, Conti G, Gattinoni L. The ICU book Terapia intensiva principi
fondamentali. 3 th ed. Elsevier. 2007;389-404.
15. Chen M, Çitil A, McCabe F. Infection, Oxygen, and Immaturity: Interacting Risk
Factors for Retinopathy of Prematurity. Neonatology. 2011;99:125–132.
16. Sapieha P, Joyal JS, Rivera JC et al. Retinopathy of prematurity: understanding
ischemic retinal vasculopathies at an extreme of life. J Clin Invest. 2010;120 (9)
:3022-32.
17. Figueras-Aloy J, Alvarez-Domínguez E, Morales-Ballus M et al. Early
administration of erythropoietin in the extreme premature, a risk factor for
retinopathy of prematurity?. An Pediatr. 2010;73 (6) :327-33.
18. Critical Care Monitoring Clinical Reference and Troubleshooting Guide of the
Ge Medical Systems Information Technologies. 2005 General Electric Company.
19. Moon RE, Camporesi EM. Monitoraggio respiratorio. In: Miller RD, Fleisher LA,
Johns RA et al. Anestesia. 6 th ed. Elsevier. 2006;l:1437-82.
20. Chierego ML, Nadalin S, Sallusti R et al. Medicina perioperatoria. In: Gullo A.
Terapia intensiva Emergenza. Springer. 2003;3-130.
21. Urquhart DS, Montgomery H, Jaffe A. Assessment of hypoxia in children with
cystic fibrosis. Arch Dis Child. 2005;90:1138-43.
22. De Martino G, D’Alicandro G, Vaira MI. Ossigenoterapia iperbarica. In: Mazzeo
F. Trattato di clinica e terapia chirurgica. Piccin. 2001;1:999-1008.
23. Chenchen Wang, MD, MSc; Steven Schwaitzberg, MD; Elise Berliner.
Hyperbaric Oxygen for Treating Wounds A Systematic Review of the Literature. Arch
Surg. 2003;138:272-279.
24. G. Aprea, M. Brauzzi, C. Costanzo et al. Linee guida SIMSI: Medicina
subacquea ed iperbarica. 2007:7-36.
25. Waisman D; Shupak A, Weisz G et al. Hyperbaric Oxygen Therapy in the
Pediatric Patient: The Experience of the Israel Naval Medical Institute. Pediatrics.
1998;102 (5) :1-9.
26. Saugstad OD, Ramji S, Soll RF et al. Resuscitation of newborn infants with 21%
or 100% oxygen: an updated systematic review and meta-analysis. Neonatology.
2008;94 (3) :176-82.
27. The International Liaison Committee on Resuscitation. The International Liaison
Committee on Resuscitation (ILCOR) Consensus on Science With Treatment
Recommendations for Pediatric and Neonatal Patients: Neonatal Resuscitation.
Pediatrics 2006;117;978-88.
28. Thom SR. Ossigeno iperbarico in ICU. In: Fink MP, Abraham E, Vincent JL et
al. Terapia intensiva. 5 th ed. Elsevier Masson. 2007;539-42.
29. Uzun G, Sen H, Mutluoğlu M et al. Hyperbaric oxygen therapy for pediatric
patients with carbon monoxide poisoning. Turk J Pediatr. 2009;51 (4) :403-4.
30. Von Heimburg D, Noah EM, Sieckmann UP et al. Hyperbaric oxygen treatment
in deep frostbite of both hands in a boy. Burns. 2001;27 (4) :404-8.
31. Wiebers J, Purdy I, Lieber M et al. Perinatal/Neonatal case presentation:
Hyperbaric oxygen in treatment of neonatal arterial thromboembolism of lower
extremities. Journal of Perinatology. 2006;26: 777-9.
32. Mazariegos GV, Toole KO, Mieles LA et al. Hyperbaric Oxygen Therapy for
Hepatic Artery Thrombosis After Liver Transplantation in Children. Liver
Transplantation and Surgery. 1999;5 (5) :429-36.
33. Chaudry T, McMahon A and Pilkington C. Wegener's Granulomatosis:
paediatric presentation with ischaemia of the feet and novel use of hyperbaric
oxygen. Pediatric Rheumatology. 2008;6 (1) :265.
34. Olivieri AN, Mellos A, Duilio C et al. Refractory vasculitic ulcer of the toe in
adolescent suffering from Systemic Lupus Erythematosus treated successfully with
hyperbaric oxygen therapy. Italian Journal of Pediatrics. 2010;36:72.
35. Alsheikheh A, Lieb W, Grehn F et al. Criswick-Schepens syndrome -- familial
exudative vitreoretinopathy. Report of six cases in two consanguineous families.
Ophthalmologe. 2004;101 (9) :914-8.
36. Minghua Chen a Ayse Çitil a Frank McCabe b. Infection, Oxygen, and
Immaturity: Interacting Risk Factors for Retinopathy of Prematurity. Neonatology.
2011;99:125-32.
37. Bernbeck B, Christaras A, Krauth K et al. Bone marrow oedema and aseptic
osteonecrosis in children and adolescents with acute lymphoblastic leukaemia or
non-Hodgkin-lymphoma treated with hyperbaric-oxygen-therapy (HBO) : an
approach to cure? -- BME/AON and hyperbaric oxygen therapy as a treatment
modality. Klin Padiatr. 2004;216 (6) :370-8.
38. Zhdanov GG, Nechaev VN, Alipov PA et al. Hyperbaric oxygenation and
antioxidants in the complex intensive therapy of severe forms of pneumonia in
children. Anesteziol Reanimatol. 1991; (2) :54-8.
39. Ponikvar R, Buturović J, Cizman M et al. Hyperbaric oxygenation, plasma
exchange, and hemodialysis for treatment of acute liver failure in a 3-year-old child.
Artif Organs. 1998 ;22 (11) :952-7.
40. Ohno Y, Kanematsu T. Hyperbaric oxygen therapy for intestinal obstruction in
children: an exceptional experience in a compromised child. J Pediatr Surg. 1998;33
(10) :1543-5.
41. Maritschnegg P, Sovinz P, Lackner H et al. Granulomatous amebic encephalitis
in a child with acute lymphoblastic leukemia successfully treated with multimodal
antimicrobial therapy and hyperbaric oxygen. J Clin Microbiol. 2011;49 (1) :446-8.
42. Segal E, Menhusen MJ and Simmons S. Hyperbaric Oxygen in the Treatment of
Invasive Fungal Infections: A Single-Center Experience. IMAJ 2007;9:355-7.
43. Vecchione R, Ruocco F, Colloca R et al. Pediatria e ossigenoterapia iperbarica:
revisione della letteratura. Med Sub Iper. 1995;7-12.
44. Smith-Slatas CL, Bourque M and Salazar JC. Clostridium septicum Infections in
Children: A Case Report and Review of theLiterature. Pediatrics. 2006;117:796-805.
45. Takac I, Kvolik S, Divkovic D et al. Conservative surgical management of
necrotic tissues following meningococcal sepsis: case report of a child treated with
hyperbaric oxygen. Undersea Hyperb Med. 2010;37 (2) :95-9.
46. Siraneci R, Hatipoğlu N, Hatipoğlu H et al. Acute arterial thrombotic purpura
complicating varicella and the role of hyperbaric oxygen as an adjunctive therapy.
Turk J Pediatr. 2004;46 (3) :256-8.
47. Krzelj V, Petri NM, Mestrovic J et al. Purpura fulminans successfully treated
with hyperbaric oxygen--a report of 2 cases. Pediatr Emerg Care. 2005;21 (1) :31-4.
48. Hsieh WS, Yang PH, Chao HC et al. Neonatal Necrotizing Fasciitis: A Report of
Three Cases and Review of the Literature. Pediatrics. 1999;103;53.
49. Murphy JJ, Granger R, Blair GK et al. Necrotizing fasciitis in childhood. J
Pediatr Surg. 1995 Aug;30 (8) :1131-4.
50. Kurschel S, Mohia A, Weigl V et al. Hyperbaric oxygen therapy for the treatment
of brain abscess in children. Childs Nerv Syst. 2006;22 (1) :38-42.
51. Baechli H, Schmutz J, Mayr JM et al. Hyperbaric oxygen therapy (HBO) for the
treatment of an epidural abscess in the posterior fossa in an 8-month-old infant.
Pediatr Neurosurg. 2008;44 (3) :239-42.
52. Saunders PJ. Hyperbaric oxygen therapy in the management of carbon
monoxide poisoning, osteoradionecrosis, burns, skin grafts, and crush injury. Int J
Technol Assess Health Care. 2003 Summer;19 (3) :521-5.
53. Stoller KP. Quantification of Neurocognitive Changes Before, During, and After
Hyperbaric Oxygen Therapy in a Case of Fetal Alcohol Syndrome. Pediatrics.
2005;116;586-591.
54. Collet JP, Vanasse M, Marois P et al. Hyperbaric oxygen for children with
cerebral palsy: a randomised multicentre trial. Lancet. 2001;357 (9256) :582-6.
55. Papazian O, Alfonso I. Hyperbaric oxygen treatment for children with cerebral
palsy. Rev Neurol. 2003;37 (4) :359-64.
56. Muller-Bolla M, Collet JP, Ducruet T et al. Side effects of hyperbaric oxygen
therapy in children with cerebral palsy. Undersea Hyperb Med. 2006;33 (4) :237-44.
57. McDonagh MS, Morgan D, Carson S et al. Systematic review of hyperbaric
oxygen therapy for cerebral palsy: the state of the evidence. Developmental
Medicine & Child Neurology. 2007;49:942-7.
58. Zhou BY, Lu GJ, Huang YQ et al. Efficacy of hyperbaric oxygen therapy under
different pressures on neonatal hypoxic-ischemic encephalopathy. Zhongguo Dang
Dai Er Ke Za Zhi. 2008;10 (2) :133-5.
59. Rossignol DA, Rossignol1 LW, James SJ et al. The effects of hyperbaric oxygen
therapy on oxidative stress, inflammation, and symptoms in children with autism: an
open-label pilot study. BMC Pediatrics. 2007;7:36.
60. Rossignolab DA, Rossigno LW. Hyperbaric oxygen therapy may improve
symptoms in autistic children. Med Hypotheses. 2006;67 (2) :216-28.
61. Buompadre MC, Arroyo HA. Accidental cerebral venous gas embolism in a
young patient with congenital heart disease. J Child Neurol. 2008;23 (1) :121-3.
62. French LK, Horowitz BZ, McKeown NJ. Hydrogen peroxide ingestion associated
with portal venous gas and treatment with hyperbaric oxygen: a case series and
review of the literature. Clin Toxicol. 2010;48 (6) :533-8.
63. Beltz K, Christaras A, Kovacevic A et al. A novel element in the management of
chronic granulomatous disease (CGD) ? - treatment of osteomyelitis with additional
hyperbaric oxygen therapy (HBO). Klin Padiatr. 2008;220 (6) :380-3.
64. Paim LB, Liphaus BL, Rocha AC et al. Chronic recurrent multifocal
osteomyelitis of the mandible: report of three cases. J Pediat. 2003;79 (5) :467-70.
65. Chuba PJ, Aronin P, Bhambhani K. Hyperbaric Oxygen Therapy for RadiationInduced Brain Injury in Children. Cancer. 1997;80 (10) :2005-12.
66. Stanková J, Kavan P, Krízová H et al. 131I meta-iodobenzylguanidine in
combination with hyperbaric oxygen therapy in the treatment of prognostically
high-risk forms of neuroblastoma. Cas Lek Cesk. 2001;140 (1) :13-7.
67. Asharnalla HL, Goldwein JW, Thorn SR et al. Hyperbaric Oxygen Therapy for
the Treatment of Radiation-Induced Sequelae in Children The University of
Pennsylvania Experience. Cancer. 1996;77 (11) :2407-12.
68. Rapley JH, Lawrence WT, Witt PD et al. Composite grafting and hyperbaric
oxygen therapy in pediatric nasal tip reconstruction after avulsive dog-bite injury. Ann
Plast Surg. 2001;46 (4) :434-8.
69. McCrary BF. Hyperbaric oxygen (HBO2) treatment for a failing facial flap.
Postgrad Med J. 2007;83.
70. Bennett M, Heard R. Hyperbaric oxygen therapy for multiple sclerosis. CNS
Neurosci Ther. 2010;16 (2) :115-24.
71. Bennett M, Heard R. Hyperbaric oxygen therapy for multiple sclerosis.
Cochrane Database Syst Rev. 2004; (1).
72. Olszański R, Pachut M, Sićko Z et al. Efficacy of hyperbaric oxygenation in
atopic dermatitis. Bull Inst Marit Trop Med Gdynia. 1992;43 (1-4) :79-82.
73. Battistini E, Fasce L, Defilippi AC et al. Asma e near fatal asthma. In: Lorini R,
Di Pietro P, Romano C et al. Pediatria d’urgenza. Masson. 2005;431-43.
74. Sànchez Sànchez MM. Ossigenoterapia. In: Moreno ML, Rivera SA, de la Torre
AE. Il paziente critico. Protocolli e procedure di assistenza generale e specialistica.
Masson. 2005; 550-5.
75. Frankel LR. Distress respiratorio e insufficienza respiratoria. In: Kliegman RM,
Behrman RE, Jenson HB et al. Nelson Textbook of Pediatrics. 18th ed. Elsevier.
2009;438-41.
76. Balfour-Lynn IM, Field DJ, Gringras P et al. BTS guidelines for home oxygen in
children. Thorax. 2009;64 (2) :1-26.
77. Lorry R, Kache F, Kache S. Ventilazione meccanica. In: Kliegman RM, Behrman
RE, Jenson HB et al. Nelson Textbook of Pediatrics. 18th ed. Elsevier.
2009;18:442-8.
Trimestrale di divulgazione scientifica dell'Associazione Pediatrica di Immunologia e Genetica
Legge 7 marzo 2001, n. 62 - Registro della Stampa Tribunale di Messina n. 3/09 - 11 maggio 2009
Direttore scientifico Carmelo Salpietro - Direttore responsabile Giuseppe Micali - Segreteria redazione Basilia Piraino - Piera Vicchio
Direzione-Redazione: UOC Genetica e Immunologia Pediatrica - AOU Policlicnico Messina
www.geneticapediatrica.it/rigip