IBD HIGHLIGHTS
a cura di
Fortunata Civitelli
Alimenti, microbiota e infiammazione:
la tempesta perfetta nelle malattie
infiammatorie intestinali
Diet, gut microbiota and inflammation:
the perfect storm in inflammatory bowel diseases
Marina Aloi (foto)
Giulia D’Arcangelo
Sapienza Università di Roma,
Dipartimento di Pediatria e
Neuropsichiatria Infantile, Unità di
Gastroenterologia ed Epatologia
Pediatrica, Policlinico Umberto I,
Roma
Key words
Inflammatory bowel disease • Diet •
Gut microbiota • Inflammation
Abstract
The prevalence of inflammatory bowel diseases is
rising worldwide in concomitance with the acquisition of a “Westernized” lifestyle, thus suggesting an influence of environmental factors in the
pathogenesis of these complex diseases. Diet may
have an impact on host immunity both directly and
by influencing the structure and composition of
the gut microbiota in the genetically susceptible
host.
Indirizzo per la corrispondenza
Marina Aloi
viale Regina Elena 324, 00161 Roma
E-mail: [email protected]
118
L’incidenza dei disordini immunitari, quali le malattie
infiammatorie croniche intestinali (inflammatory bowel
disease – IBD), l’artrite reumatoide, il diabete mellito
tipo I e la sclerosi multipla, ha subito un incremento
nel mondo occidentale. Si tratta di patologie croniche
a eziologia multifattoriale risultante da una complessa
interazione tra geni, sistema immunitario, microbiota intestinale e fattori ambientali. Le IBD [malattia di
Crohn (MC) e rettocolite ulcerosa (RCU)] sono processi
infiammatori cronici e recidivanti del tratto gastrointestinale, per i quali si ritiene che fattori ambientali, quali
abitudini alimentari e modificazioni dello stile di vita
(l’incremento dell’igiene, la dieta, il consumo di alcol,
il fumo), giochino un ruolo nell’innescare e sostenere il
processo infiammatorio cronico in individui geneticamente predisposti 1, 2. Gli studi di associazione genome-wide (genome wide association studies – GWAS)
hanno individuato diversi geni (finora 163) correlati allo
sviluppo di MC e RCU 3. D’altra parte non tutti i soggetti portatori di tali polimorfismi genetici svilupperanno la malattia. Questo dato enfatizza come la genetica
da sola non sia in grado di spiegare la propensione di
alcuni individui di sviluppare la malattia e come, invece, fattori ambientali scatenanti giochino un ruolo nella
patogenesi delle IBD.
È ormai ampiamente dimostrato che una dieta ricca
di grassi, carni rosse e carboidrati raffinati e povera di
vegetali, frutta e pesce (la cosiddetta “western diet”)
possa avere un effetto diretto sul sistema immunitario dell’ospite e causare disbiosi. Quest’ultima, intesa
come modificazione della struttura e della funzione del
microbiota intestinale, è in grado di scatenare e sostenere una condizione di infiammazione, attraverso
la predominanza di microrganismi pro-infiammatori e
la riduzione dei commensali favorenti meccanismi di
tolleranza immunitaria.
Questo articolo ha lo scopo di illustrare le più recenti
evidenze nel campo dell’eziopatogenesi del processo
infiammatorio delle IBD, con particolare attenzione agli
aspetti riguardanti la dieta e la sua influenza sul microbiota intestinale.
Giorn Gastr Epatol Nutr Ped 2016;VIII:118-121; doi: 10.19208/2282-2453-124
IBD HIGHLIGHTS
Alimenti, microbiota e infiammazione: la tempesta perfetta
nelle malattie infiammatorie intestinali
La genetica
La genetica è innegabilmente una
componente fondamentale nell’eziopatogenesi delle IBD, rappresentando non soltanto un fattore
di rischio di per sé, ma giocando
anche un ruolo chiave nella costituzione del microbiota intestinale
e nel processo di educazione del
sistema immunitario dell’ospite.
La maggior parte delle oltre 160
varianti genetiche e polimorfismi
identificati mediante GWAS in
relazione alle IBD codificano per
proteine implicate in meccanismi
di attivazione immunitaria nel contesto della risposta dell’ospite ai
microrganismi, inclusi la funzione
di barriera, la guarigione mucosale, l’autofagia e la risposta allo
stress. L’identificazione di uno di
questi geni, il primo a essere individuato, il nucleotide-binding oligomerization domain-containing
protein 2 (NOD2 o CARD15), fornì
evidenze sull’implicazione del microbiota intestinale nello sviluppo
e progressione delle IBD, in particolare la MC 4. NOD2 codifica
per un recettore intracellulare (un
cosiddetto pattern recognition
receptor – PPR) per il muramil dipeptide (MDP), un peptidoglicano
della parete batterica. Si tratta
dunque di una proteina essenziale a livello dell’enterocita nel
discriminare tra la flora microbica intestinale normale e i batteri
patogeni. L’attivazione di NOD2
comporta infatti l’inizio di una
cascata infiammatoria legata alla
traslocazione nel nucleo di NFκB
e la conseguente trascrizione e
traduzione di specifici geni della
risposta immune innata e adattativa. Mutazioni a carico del gene
NOD2 sono state messe in relazione a una maggiore suscettibilità nello sviluppo della MC,
prevalentemente ileale. Uno dei
possibili effetti è la riduzione della
produzione di α-defensina da parte delle cellule del Paneth che in
circostanze normali operano me-
diante meccanismi dell’immunità
innata nella regolazione del microbiota intestinale. I topi knock-out
per NOD2 mostrano un significativo aumento di Bacteroides, Firmicutes e Bacilli nell’ileo terminale,
oltre a una ridotta capacità di eliminare un potenziale batterio patogeno, l’Helicobater hepaticus. In
assenza di microbiota intestinale
(topi germ-free), inoltre, l’espressione di NOD2 rimane bassa. A
partire da queste evidenze numerosi altri loci di suscettibilità sono
stati individuati: CARD9, IL23R,
ATG16L1. IL-23R, ad esempio, è
essenziale nel promuovere una
risposta immune diretta contro
patogeni intracellulari, inducendo
la produzione e il mantenimento
di linfociti Tγδ produttori di IL-17,
IFN-γ e TNFα ed essenziali per
l’induzione
dell’infiammazione
mediata dai linfociti T.
L'ambiente
Se da un lato la predisposizione
genetica rappresenta un elemento chiave nello sviluppo delle IBD,
essa da sola non è sufficiente. Un
modello mendeliano semplice di
trasmissione ereditaria (correlazione diretta tra gene e malattia)
non è applicabile alle IBD: queste
malattie sono infatti poligeniche
e multifattoriali. In questi disordini il fenotipo clinico è la manifestazione dell’interazione tra
determinanti genetici e fattori di
rischio ambientali, pertanto ogni
variante genetica individuale avrà
un effetto relativo (mai 100%) sul
rischio di sviluppo della malattia.
I tassi di concordanza tra gemelli
monozigoti nella MC e nella RCU,
rispettivamente il 35-58% e il 1618,5%, insieme ai rapidi cambiamenti epidemiologici registrati negli ultimi decenni e non spiegabili
con paralleli cambiamenti genetici
(che richiedono tempi molto più
lunghi), supportano l’ipotesi di un
coinvolgimento di altri fattori. Nei
paesi in cui è stato registrato un
significativo aumento dell’incidenza delle IBD nel corso del 20° secolo, si è assistito parallelamente
a enormi cambiamenti ambientali e dello stile di vita, tra cui una
maggiore igiene personale, l’ampio uso di vaccini e antibiotici e
l’introduzione di differenti abitudini alimentari. Più recentemente, paesi in cui tali malattie erano
sconosciute fino a pochi decenni
fa, come il Giappone, l’India, Hong
Kong, hanno visto crescere il numero di nuovi casi diagnosticati
in concomitanza con l’adozione
di uno stile di vita occidentale 1.
Analoghe osservazioni sono state
riportate a seguito dello studio su
popolazioni di immigrati trasferitisi
da paesi in via di sviluppo in quelli
industrializzati.
Sebbene a oggi un singolo trigger
ambientale non sia stato identificato, l’attenzione è stata posta su
numerosi possibili fattori tra cui la
dieta. È indubbio che il regime alimentare occidentale abbia subito
profondi cambiamenti (aumento
della quantità di grassi e carboidrati) nell’ultimo mezzo secolo,
e in concomitanza si è assistito
all’aumento della prevalenza delle
IBD.
Queste modificazioni ambientali
hanno comportato un cambiamento nella composizione del
microbiota intestinale, sia nella
sua struttura che funzione, tale
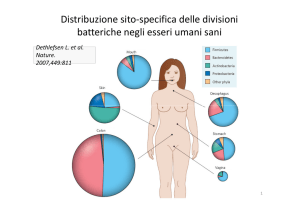
da essere implicato nella patogenesi delle malattie 5, 6. La quantità
di batteri intestinali supera quella delle cellule umane di circa 10
volte e contiene oltre 1.000.000
di geni (rispetto ai 23.000 nell’uomo), rendendo ragione del ruolo
chiave che tali microrganismi rivestono nello sviluppo di queste
patologie complesse. La combinazione della predisposizione genetica, insieme a fattori ambientali
che modifichino la composizione
del microbiota intestinale, può
dunque risultare in una “tempesta
119
M. Aloi, G. D'Arcangelo
perfetta” che conduce allo sviluppo delle IBD.
Esiste una stretta interrelazione tra
la nostra flora microbica e la mucosa intestinale, essenziale per il
metabolismo di quei nutrienti che
non siamo in grado di digerire e
per l’educazione del nostro sistema immunitario. Tale mutualismo
metabolico tra ospite e batteri, se
cronicamente alterato, può portare a una “disregolazione” della risposta immune che conduce alla
malattia. Le prove più importanti
a sostegno di tale ipotesi derivano dallo studio di modelli animali.
Ad esempio i topi knock-out per il
gene dell’IL-10 sviluppano spontaneamente un’enterocolite cronica, predominata da un fenotipo
infiammatorio T-helper1/IFNγ. Tuttavia, topi germ-free deficitari di
IL-10 non sviluppano la malattia,
mentre l’aggiunta di specifici batteri, oltre a condurre a un aumento della penetranza della malattia
fino a quasi il 100% (è il caso di
H. hepaticus, Bacteroides vulgtus,
Enterococcus faecalis), è in grado
di determinare fenotipi diversi di
malattia. Ad esempio la colonizzazione di topi germ-free deficitari
di IL-10 con Bilophila wadsorthia
conduce a una colite distale lieve,
mentre l’ Escherichia Coli determina un’infiammazione lieve-moderata a carico del ceco.
È evidente che il tipo di risposta
ai singoli microrganismi è correlata alla specificità dell’ospite. Ad
esempio E. Coli, ma non Bacteroides vulgatus, è in grado di indurre
una colite nei topi knock-out per
il gene dell’IL-10. Situazione opposta si verifica nei topi transgenici per HLA-B27. Analogamente,
diversi probiotici determinano diversi risultati nello stesso ospite
mentre ospiti diversi mostrano risposte variabili allo stesso probiotico. Queste osservazioni, ancora
una volta, sottolineano come il
rischio di malattia ed il suo fenotipo sono strettamente dipendenti
120
dalla composizione del microbiota intestinale nel contesto di differenti background genetici.
La dieta
Come accennato in precedenza,
tra i fattori ambientali in grado di
innescare il meccanismo patogenetico delle IBD, la dieta è certamente uno dei più studiati. Gli
alimenti, infatti, oltre a interagire
con le cellule direttamente, sono
in grado di modificare la composizione della flora intestinale. È
stato dimostrato che la natura dei
grassi assunti con la dieta può
modificare il microbiota intestinale, in particolare grassi saturi
derivati dal latte sono in grado di
determinare l’esordio della colite
nei topi deficitari di IL-10 inducendo una predominanza della
B. wadsworthia 8. Analogamente,
carboidrati non assorbibili (prebiotici) come l’inulina e i fruttooligosaccaridi (FOS) stimolano la
crescita di specie protettive quali
Bifidobatteri e Lattobacilli, fornendo loro substrati per la produzione di acidi grassi a catena corta
(short chain fatty acid – SCFA).
Questi prodotti, in particolare il
butirrato, rappresentano degli ottimi substrati metabolici per le cellule mucosali coloniche stimolandone diverse funzioni di barriera.
Da uno studio condotto su coppie
di gemelli, di cui un affetto da MC,
è emerso che le cascate enzimatiche coinvolte nel metabolismo
dei carboidrati per la produzione
di SCFA erano diminuite, analogamente a quelle coinvolte nella
degradazione della mucina.
Oltre alla sua influenza diretta sulla composizione e funzione del
microbiota intestinale, la dieta è in
grado di avere effetti pro-infiammatori di per sé 10. Alcuni detergenti ed emulsionanti sono in grado di danneggiare direttamente la
mucosa intestinale. Il polisorbato
80, presente in diversi prodotti
alimentari lavorati, aumenta, ad
esempio, la traslocazione di E.
Coli nelle placche di Peyer nella
MC. Anche la gliadina, antigene
implicato nella malattia celiaca,
agisce sulla permeabilità intestinale aumentandola anche nei soggetti non celiaci, mediante il legame al recettore epiteliale CXCR3 e
il rilascio di zonulina. Sono dotati
invece di attività antinfiammatoria
gli eicosanoidi derivanti dagli acidi
grassi poliinsaturi n-3 (n-3 PUFA).
Il loro consumo, negli ultimi decenni, è notevolmente diminuito,
mentre è aumentato quello di n-6
PUFA, dotati, al contrario di attività proinfiammatoria.
Conclusioni
L’impatto della “Western diet” sul
microbiota intestinale è ormai ampiamente riconosciuto e potrebbe giustificare l’aumento dell’incidenza di
patologie croniche, comprese le IBD,
osservato nell’ultimo mezzo secolo.
Lo studio del microbiota intestinale e delle sue complesse interazioni con i geni e con fattori ambientali quali la dieta, rappresenta
attualmente un importante campo
di sviluppo, che apre nuovi scenari volti a realizzare un approccio terapeutico “personalizzato” a
seconda del profilo genetico e del
microbiota dei singoli pazienti.
Bibliografia
1
Ananthakrishnan AN. Epidemiology and risk factors for IBD.
Nat Rev Gastroenterol Hepatol
2015;12:205-17.
2
Loftus EV Jr. Clinical epidemiology
of inflammatory bowel disease: incidence, prevalence and environmental influences. Gastroenterology 2004;142:46-54.
3
Brant SR. Promises, delivery,
and challenges of inflammatory
bowel disease risk gene discovery. Clin Gastroenterol Hepatol
2013;11:22-6.
IBD HIGHLIGHTS
Alimenti, microbiota e infiammazione: la tempesta perfetta
nelle malattie infiammatorie intestinali
4
5
6
Ogura Y, Bonen DK, Inohara N,
et al. A frameshift mutation in
NOD2 asoociated with susceptibility to Crohn’s disease. Nature
2001;411:603-6.
Turnabaugh P, Ridaura VK, Faith
JJ, et al. The effect of diet on the
human gut microbiome: a metagenomic analysis in humanized gnotobiotic mice. Sci Transl Med
2009;1:6-14.
Chapman-Kiddell CA, Davies
PSW, Gillen L, et al. Role of diet in
the development of inflammatory
bowel disease. Inflamm Bowel Dis
2010;16:137-51.
7
8
Molodecky NA, Soon IS, Rabi
DM, et al. Increasing incidence
and prevalence of the inflammatory bowel diseases with time,
based on systematic review.
Gastroenterology 2012;142:4654.
Devkota SD, Wang Y, Musch MW,
et al. Dietary-fat-induced taurocholic acid promotes pathobiont
expansion and colitis in Il10−/−
mice. Nature 2012;487:104-8.
9
Erickson AR, Cantarel BL, Lamendella R, et al. Integrated metagenomics/metaproteomics reveals
human host-microbiota signatures
of Crohn’s disease. PLoS ONE
2012;7:e49138.
10
Levine A, Wine E. Effects of enteral
nutrition on Crohn’s disease: clues
to the impact of diet on disease
pathogenesis. Inflamm Bowel Dis
2013;19:1322-9.
• Le malattie infiammatorie intestinali sono disturbi cronici multifattoriali del tratto gastrointestinale, risultato dell’inte-
razione tra predisposizione genetica, microbiota intestinale, fattori ambientali e sistema immunitario.
• La dieta gioca un ruolo fondamentale sia indirettamente, modulando la struttura e funzione del microbiota intestinale,
che direttamente tramite nutrienti e composti chimici che agiscono da veri e propri antigeni che stimolano la risposta
immune del soggetto.
• Una dieta ricca di grassi, carni rosse e carboidrati raffinati e povera di vegetali, frutta e pesce (la cosiddetta “western
diet”) ha un effetto diretto sul sistema immunitario dell’ospite ed è causa di disbiosi.
• Numerosi studi effettuati su modelli animali hanno dimostrato come la prevalenza di determinati batteri in un contesto
di predisposizione genetica sia in grado di portare all’insorgenza di malattia e determinarne il fenotipo.
121