UNIVERSITA
G. d ANNUNZIO -CHIETIPESCARA
DIPARTIMENTO DI SCIENZE BIOMEDICHE
Sezione di Terapia Medica
CORSO DI PERFEZIONAMENTO
IN
MEDICINA BIOINTEGRATA
www.centrostellamaris.it
Psico-NeuroEndocrinoImmunologiaGenetica
(PNEIG)
in
Medicina
Biointegrata
Programma AA.2010-2011
• Definizione di PNEI. Il Sistema nervoso: le cellule del SN e loro
connessioni; il tronco encefalo, diencefalo, SNV. Sistema
endocrino: gli ormoni, loro funzioni e comunicazioni. Controllo
cerebrale sul Sistema endocrino. Assi
neuroendocrini: ipotalamo-ipofisi,
ipotalamo-ipofisi-surreni, ipotalamoipofisi-tiroide, ipotalamo-ipofisi-gonadi.
Sistema immunitario: cenni di immunologia (teoria della
selezione clonale, immunità naturale ed acquisita, sistema
HLA, sistema immunitario come organo di senso, produzione di
ormoni da parte del sistema immunitario che fungono da
mediatori tra cervello e sistema endocrino). Cervello e psiche.
La grande connessione: Sistema nervoso ed immunità; sistema
dello stress; sistema endocrino e cervello.
Endocrinosenescenza e P.N.E.I.. DCA prototipo di PNEIG.
Assi
neuroendocrini
Natura e unità di misura
Cascate
ormonali
• Stimoli
iniziali
neurosensoriali
• Anelli di
retroazione
negativa
(feedback)
(ng)
(µg)
Ipotalamo-ipofisi
strutture importanti
del Sistema
Nervoso,
responsabili dei
meccanismi di
elaborazione, verifica
e trasmissione di
emozioni
• L ipotalamo è organizzato in circa una dozzina
di "nuclei" di cellule che si coordinano fra loro,
la sua costituzione anatomica, è
sostanzialmente simile in tutti i vertebrati;
questo particolare neuroanatomico
sembrerebbe non essersi evoluto... è come
se fosse "nato" perfetto!
• La differente efficienza funzionale, nelle diverse
specie viventi, sarebbe data dagli
apprendimenti acquisiti, più che dall assetto
cellulare genetico. La base predisponente, è
uguale per tutti; cambiano solo le informazioni
depositate in memoria (conoscenze fatte).
•
•
•
•
ha un ruolo di coordinamento e
sincronizzazione nella gestione e nella
trasmissione delle emozioni
Gestisce l apparato endocrino, tramite la
collaborazione dell Ipofisi
Regola, coordina e sincronizza le attività
cosiddette "autonome", con il coinvolgimento
del Sistema Nervoso Vegetativo (SNV-SNA)
(Temperatura corporea, fame e sete, ritmo
sonno - veglia, funzioni sessuali, secrezione
acida dello stomaco, etc.).
Per svolgere tutte queste funzioni, l Ipotalamo
prende informazioni sia dall interno che
dall esterno dell organismo:
• dall interno: dal Sistema limbico ( in dialogo"
con Sistema Neuroendocrino e
Neurovegetativo), da Amigdala e Ippocampo
(attraverso il fornice) e dalla Corteccia tramite il
Talamo (relé di informazioni). Verso il basso, è
connesso con midollo allungato e midollo
spinale: dialoga col SNA.
• dall esterno: tramite il Nucleo
soprachiasmatico, l Ipotalamo riceve il segnale
della luce e del buio che gli consente di
regolare gli orologi biologici interni.
• La sua Eminenza mediana (fibre nervose e vasi
sanguigni), attraversa la barriera
ematoencefalica e va a costituire, all esterno
dell encefalo nella fossa ipofisaria del corpo
dell osso sfenoide ("sella turcica ), la
neuroipofisi. Lo stretta unione fra Ipotalamo e
Neuroipofisi realizza una connessione forte fra
Sistema Nervoso, Sistema Endocrino e
Sistema Immunitario, garantendo la
regolazione dei processi vitali fondamentali.
• Alla Neuroipofisi si collega, anteriormente,
l Adenoipofisi composta da tessuto ghiandolare
e "governata" dall Ipotalamo tramite una serie
di ormoni ("releasing factors" - Fattori di
rilascio) che giungono attraverso il circolo
sanguigno ipotalamo - ipofisario e stimolano
l Ipofisi a secernere ormoni che attiveranno
ghiandole endocrine (tiroide, surreni, pancreas,
ovaie, etc.) e organi non strettamente endocrini
(ad esempio, i reni) a svolgere le proprie
mansioni.
G. Edelman in "Sulla materia della mente",
descrive due grandi vie di connessione:
a) la via tronco-encefalica-limbica-autonoma
legata a comportamenti affettivi, sessuali,
consumatori, di difesa e alla regolazione di
alcuni fenomeni vitali di tipo vegetativo
(frequenza cardiaca, respiratoria, digestione,
sonno ecc) e "dialoga" con il sistema endocrino
attraverso la produzione di ormoni che
impiegano minuti o ore per raggiungere il
bersaglio.
b) la via talamo - corticale che invece,
rappresenta un sistema sviluppato per ricevere
segnali dai recettori sensoriali e inviarli ai
muscoli volontari. Collegamenti più veloci
rispetto alla via precedente perché mediati da
neurotrasmettitori.
I due sistemi hanno
il loro collegamento
nel Talamo, stazione
fondamentale per
la circolazione delle
informazioni che
vengono
dal basso e dall alto,
dalla periferia e dalla corteccia.
• Secondo J. W. Papez, gli impulsi nervosi
partirebbero dalla corteccia cerebrale e,
passando attraverso il giro del Cingolo e
dell Ippocampo, raggiungerebbero l Ipotalamo.
Dall Ipotalamo i messaggi, passando per il
Talamo, potrebbero ritornare alla Corteccia.
• Si realizzerebbe così uno
scambio di informazioni
che verrebbero via via
sempre più verificate
e riconosciute prima
di essere trasmesse.
Ormoni ipofisari e ipotalamici
Impulso nervoso
Ipotalamo
Ormoni di rilascio
Ipofisi anteriore
(adenoipofisi)
Ormoni di rilascio
Altre ghiandole endocrine
Metabolismo
5 assi endocrini
Ormoni di rilascio
Ipofisi posteriore
(neuroipofisi)
Ormoni di rilascio
Bilancio idrico
Produzione latte
Vasopressina (ADH)
Ossitocina (OXT)
Biosintesi degli ormoni ipotalamici
Come tutti gli ormoni e ipofisari
polipeptidici:
• Sintetizzati in forma
pre-pro (pre-provasopressina, pre-proossitocina…)
• La catena polipeptidica
nella forma pre-pro
contiene:
– una sequenza segnale,
per esportare la proteina
fuori dalla cellula
– una o più sequenze
rimosse durante la
maturazione
Pre-pro-vasopressina
NH2Peptide segnale
-COOH
Maturazione
NH2-
-COOH
Vasopressina Neurofisina I
Pre-pro-ossitocina
NH2Peptide segnale
-COOH
Maturazione
NH2-
-COOH
Ossitocina Neurofisina II
l asse ipotalamo-ipofisi-surrene (HPAA)
• Il CRH è un neurotrasmettitore (recettori
nell amigdala, locus ceruleus, stria terminale),
prodotto dalle cellule neuroendocrine del NPV
ipotalamico, attraverso il circolo portale arriva alle
cellule corticotrope dell eminenza mediana
dell adenoipofisi. Queste rilasciano nel circolo
sistemico corticotropina (ACTH), sintetizzata dal
precursore proteico Pro-opio-melanocortina (POMC),
insieme ad altre sostanze biologiche . L ACTH
presenta un ritmo circadiano di secrezione (con
massima produzione al mattino 5AM) e di
conseguente stimolazione dei glucocorticoidi
corticosurrenalici (cortisolo), aldosterone e
androgeni.
Pre-pro-opiomelanocortina
8 ormoni codificati
da un solo gene
Asse ipotalamo-ipofisi-surrene
• Ipotalamo → Ormone di rilascio della
corticotropina (CRH) e vasopressina (ADH)
– cAMP
• Ipofisi anteriore → Ormone adrenocorticotrofico
(ACTH)
– Derivato dalla pro-opiomelanocortina
– Implicato in bioritmi (picco max 5 AM)
– T1/2=10 min
– Agisce tramite cAMP come 2° messaggero
• Surrenali
– Zona glomerulare: mineralocorticoidi
– Zona fascicolata: glucocorticoidi
– Zona reticolare: ormoni sessuali
– Zona midollare: adrenalina e noradrenalina
• La corteccia surrenalica è distinguibile in
• Zona glomerulare (cellule parenchimali
sintetizzano e secernono ormoni
mineralocorticoidi per il mantenimento
dell'equilibrio idrico)
• Zona fascicolata : sintetizza e secerne i
glucocorticoidi e controlla il metabolismo dei
carboidrati (↓ l'utilizzo del glucosio,
↑gluconeogenesi), grassi e proteine
• Zona reticolata (produce gli ormoni sessuali
come androgeni, estrogeni e progesterone).
• Zona midollare completamente ricoperta dalla
corticale, sintetizza vari ormoni tra i quali le
catecolamine. Comprende due popolazioni di
cellule parenchimali: cellule cromaffini e cellule
gangliari simpatiche.
Ormoni steroidei della
corteccia surrenalica
• Tutti gli ormoni steroidei
derivano dal colesterolo
• Catena laterale al C17:
– Accorciata a 2 C → progestinici,
corticosteroidi
– Rimossa completamente →
androgeni, estrogeni
• Aggiunta di gruppi -OH o chetonici
• Mineralocorticoidi: aldeide al C18
• Estrogeni: anello A aromatico
Biosintesi degli ormoni steroidei
Colesterolo
Pregnenolone
17-OH pregnenolone
deidroepiandrosterone
Progesterone
17-OH progesterone
Androstenedione
11-deossi corticosterone
11-deossi cortisolo
Testosterone
Androgeni,19C
Corticosterone
Cortisolo
Glucocorticoidi, 21C
Aldosterone
Stimolatori della gluconeogenesi
Mineralocorticoidi, 21C
Adattamento dell organismo allo stress
Antiinfiammatori
Ritenzione di Na+
Escrezione di K+
Differenziazione sessuale
Oncogenesi
Estradiolo
Estrogeni, 18C
Il CRF modula la risposta di adattamento allo
stress, attraverso la secrezione di ormoni
ipofisari e connessioni nervose dirette con
neurotrasmettitori ( noradrenalina e adrenalina),
glucosio e glucagone. Anche la serotonina
partecipa alla risposta adattativa, ma solo per
deplezione dopo stimolo intenso. Il CRF
correlato anche agli oppiodi endogeni:
dinorfina, prodinorfina ed encefalina (peptidi
connessi con la riduzione della percezione del
dolore, della fatica, della sensazione di
benessere e di energia ecc.).
Glucocorticoidi e cortisolo
• Sintesi e secrezione nella fascicolata surrenale sotto controllo di
ACTH
– Soggette a bioritmi (mattina > sera)
– Proteina di trasporto: Cortisol-binding globulin (CBG)
– t1/2=100 min
• EFFETTI:
– Aumento di gluconeogenesi, glicogeno epatico, lipolisi, biosintesi
proteica (come il glucagone, ma più lento) ma infine prevale il
catabolismo. Può causare diabete
– Soppressione di risposta immunitaria ed infiammatoria (cortisone)
– Incremento dell’ultrafiltrazione renale
• PATOLOGIE PRINCIPALI
– Morbo di Addison: insufficienza surrenalica → ipoglicemia, intolleranza
a stress, debolezza, ipotensione
– Sindrome di Cushing: eccesso di glucorticoidi (somministrazione
farmacologica o adenoma delle surrenali, o aumento di ACTH) →
iperglicemia, catabolismo delle proteine, perdita di massa corporea,
“faccia a luna piena” (accumulo di tessuto adiposo sul viso)
Catecolamine (ormoni) della midollare
surrenale che mediano l adattamento
allo stress
• Tyr: precursore (anche Phe)
– Tyr idrossilasi: Reazione limitante
• DOPA, diidrossifenilalanina (carente in
Parkinson)
– Passa la barriera emato-encefalica e funge
da farmaco
• Dopamina: non passa la barriera ematoencefalica
– In caso di deficit: DOPA
– In caso di eccesso: metil-DOPA
• Adrenalina e noradrenalina
– Accumulate nei granuli cromaffini
– Rilasciate con stimolazione β-adrenergica
– Metabolizzate rapidamente nel plasma
• catecolo metiltransferasi (COMT) e
monoamina ossidasi (MAO)
• Inibitori di COMT e MAO: eccitatori nervosi
• La noradrenalina è sintetizzata da una
serie di passaggi enzimatici nella
midollare surrenale a partire dall'aa.
tirosina. La prima reazione è l'ossidazione
in diidrossifenilalanina (L-DOPA), seguita
dalla decarbossilazione nel
neurotrasmettitore dopamina, e infine
dalla β-ossidazione in noradrenalina.
Questa può essere ulteriormente metilata
dalla feniletanolamina N-metiltransferasi
(PNMT) in adrenalina (epinefrina in USA).
Noradrenalina
Fenilalanina
Tirosina
L-DOPA
DOPAMINA
• Nell'alimentazione umana, essenziali i seguenti
aminoacidi che l organismo NON sintetizza:
• H Istidina
• I Isoleucina
• L Leucina
• K Lisina
• M Metionina + C Cisteina
• F Fenilalanina + Y Tirosina (aromatici)*
• T Treonina
• W Triptofano**
• V Valina
• Arginina, cisteina, istidina e tirosina sono essenziali durante
l'infanzia e lo sviluppo.
* La fenilalanina abbondante in aringa sott'aceto, avocado, banane, fagioli Lima,
formaggio, formaggio casereccio, latte non grasso in polvere, mandorle, noccioline,
semi di sesamo, semi di zucca gialla. Fabbisogno OMS di F+Y 25mg/kg
** Il triptofano abbondante nel cioccolato, nell'avena, nelle banane, nei datteri, nelle
arachidi, nel latte e nei latticini. Fabbisogno raccomandato dall'OMS 4mg/kg.
Mineralocorticoidi e aldosterone
• Sotto controllo del sistema renina-angiotensina
– Stimolato da ipotensione, dieta priva di sali
– Inibito da ipertensione, dieta ricca di sali
• EFFETTI:
– ↑riassorbimento di Na+ nel rene (riassorbimento di
H2O)
– ↑secrezione di K+ e H+ (urine acide)
• PATOLOGIE:
– Sindrome di Conn (aldosteronismo primario) →
↑riassorbimento di Na+, ↑volume extracellulare,
ipertensione, ↓K+
– Insufficienza surrenalica →↓gluconeogenesi,
↑sensibilità a insulina, ipoglicemia, ipotensione
Ormoni pancreatici:
insulina e glucagone
Pancreas
Aumenta il
glucosio
ematico
Cellule α
Cellule β
Glucagone
Insulina
Fegato
↓ Glicolisi
↑ Gluconeogenesi
↑ Glucosio
↓ Glicogeno
↑ Glicolisi
↓ Gluconeogenesi
↓Glucosio
↑ Glicogeno
Diminuisce il
glucosio
ematico
Insulina
• Cellule β delle isole di Langerhans
– Agonisti α-adrenergici inibiscono
– Agonisti β-adrenergici e i derivati della
sulfonilurea (tolbutammide) stimolano
• Fortemente conservata: insulina bovina e
suina usabili nell uomo
• Pro-insulina dà reazioni crociate con
insulina
• Livello di peptide C discrimina insulina esoed endogena
Pre-pro-insulina
Reticolo
endoplasmico
Pro-insulina
Pro-insulina
5%
Insulina + C
Insulina + C
95%
Apparato di Golgi
Circolazione
Recettore per insulina
•
•
•
Legame con insulina attiva recettore Tyr
chinasi (autofosforilazione)
Attivazione di cascata kinasica
Risposte metaboliche veloci (tendenti a
diminuire la glicemia)
– Aumento di:
•
•
•
Trasporto di glucosio (GLUT-4)
Sintesi di glicogeno
Glicolisi
– Inibizione di:
•
•
•
•
Gluconeogenesi
Glicogenolisi
Lipolisi
Risposte biosintetiche lente o a lungo
termine
– Aumento di:
•
•
•
Sintesi proteica
Replicazione cellulare
Regolazione dell attività del recettore e
del livello di ormone circolante tramite
endocitosi (desensibilizzazione)
Glucagone
• Cellule α delle isole di Langerhans
– Secreto come pro-glucagone
– Agisce tramite recettori e cAMP
• Inattivato nel fegato
– Breve t1/2 in circolo
• Stimolatore di:
–
–
–
–
Gluconeogenesi
Glicogenolisi
Chetogenesi
Assunzione di
aminoacidi
• Inibitore di:
– Glicolisi
– Glicogenogenesi
Insulina vs glucagone
Asse dell ormone della crescita
(GH)
• Ipotalamo → Ormone di rilascio di GH (GHRH)
– cAMP, Ca++-CaM
– Inibito da somatostatina
• Ipofisi anteriore → GH
– Proteina di trasporto specifica
– Rilascio in picchi ogni 3-4 h (specie durante il sonno)
• Fegato
– Stimolazione di lipolisi, induce resistenza all’insulina
– Produzione di insulin-like growth factor (IGF-I)
• Proteina di trasporto specifica
• Marker dell’attività di GH
• Tessuti
– Stimolazione dell’utilizzo di acidi grassi con risparmio di glucosio
– Stimolazione dell’utilizzo di aminoacidi con sintesi proteica
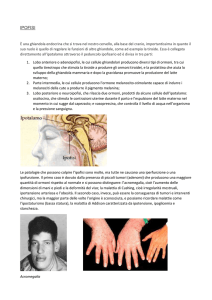
• Patologie:
– ↓GH (ipopituitarismo): difetti di crescita
– ↑GH (tumore dell’ipofisi): gigantismo, acromegalia
Somatostatina
• Cellule γ delle isole di Langerhans
• Secreta come precursore
• Targets:
– Pancreas: Inibisce la secrezione di insulina e
glucagone
– Stomaco e intestino: Diminuisce la secrezione
di gastrina
• Prolunga il tempo di svuotamento gastrico
• Rallenta l’assorbimento intestinale degli zuccheri
• Riduce il passaggio dei nutrienti in circolo
– Cervello e ipofisi: inibisce secrezione di GH
Asse ipotalamo-ipofisi-tiroide
• Ipotalamo → Ormone di rilascio della tirotropina (TRH)
– Fosfolipasi C e Ca++
• Ipofisi anteriore → TSH
• glicoproteina cAMP, PKA
• Iodio
– >150 µg/giorno di I2 (dieta)
– I2 → I- nell’intestino
• Tiroide → triiodiotironina (T3), triiodiotironina inversa
(rT3), tiroxina (T4)
– rT3 inattiva, T4 preormone, T3 metabolicamente più attiva
– Attività sotto controllo di deiodinasi (tiroide e tessuti target):
T4 → T3
• Targets: Gran numero (tutti?) di tessuti
Gli ormoni tiroidei tiroxina (T4) e triiodotironina
(T3) regolano il metabolismo di tutti i tessuti
dell'organismo. Essi aumentano il metabolismo
basale, incrementando il consumo di ossigeno
e la produzione di calore, attraverso l aumento
degli enzimi cellulari, soprattutto quelli dei
mitocondri coinvolti nella respirazione cellulare.
Una diminuzione del T3 e T4 nel sangue ed un
abbassamento della temperatura corporea,
stimolano l'ipotalamo a produrre TRH , il quale
agisce nell'ipofisi anteriore e provoca il
rilascio di prolattina, GH e TSH (ormone
stimolante la tiroide), che ripristina la
concentrazione di T3 e T4 nel sangue
aumentando la temperatura corporea.
• L eccesso di T3 ha effetto adrenergico inotropo
e cronotropo positivo sul cuore. La deficienza di
T3 nelle fasi iniziali della vita causa ritardo di
sviluppo del SNC seguito da un deficit cognitivo
e motorio (cretinismo): il flusso sanguigno nel
cervello e il metabolismo cerebrale di glucosio
sono più bassi. L ormone tiroideo aumenta
anche la velocità e l'ampiezza dei riflessi
nervosi periferici, la vigilanza e reattività a
diversi stimoli, la memoria e la capacità di
apprendimento. La T3 partecipa al
rimodellamento osseo negli adulti e il suo
eccesso può causare osteoporosi
• La T3 inibisce la sintesi e aumenta la
degradazione dei glicosaminoglicani , della
matrice dermale, aumenta la produzione di
eritropoietina e l emopoiesi. L ormone
aumenta anche i livelli di 2-3 difosfoglicerato
negli eritrociti, promuovendo la dissociazione
dell ossigeno dall emoglobina, elevando quindi
la disponibilità di ossigeno libero ai tessuti.
Promuove la maturazione dei pre-adipociti ad
adipociti. La T3 abbassa i livelli plasmatici di
colesterolo (LDL), aumentando la sintesi di
recettori LDL sulla membrana cellulare.
L ormone aumenta anche la lipolisi degli acidi
grassi nel tessuto adiposo.
• L azione termogenica obbligatoria della T3
avviene grazie all attivazione dell espressione
delle proteine UCP che promuovono il ritorno di
protoni attraverso lo spazio intermembranoso
della membrana mitocondriale, senza attivare
l ATP sintetasi e, quindi, senza produrre ATP.
Questo flusso di protoni dissipa la loro energia
potenziale chimica sotto la forma di calore. La
T3 aumenta anche la lipolisi, fondamentale per
questo processo di generazione di calore che è
denominato disaccoppiamento.
• Nella termogenesi obbligatoria può esserci
anche l idrolisi dell ATP da parte delle
ATPasi, promossa dalla T3. Negli ambienti più
freddi, è necessaria l attivazione di un altro
meccanismo, la termogenesi facoltativa; questa
è attivata da parte del sistema nervoso
simpatico grazie a stimoli esterni, ma subisce
un'influenza importante da parte della T3. Una
carenza di T3 rende incapaci di sostenere la
risposta noradrenergica per la generazione di
calore supplementare (la T3 e le catecolamine
hanno effetti sinergici).
Asse ipotalamo-ipofisi-gonadi
• Ipotalamo → Ormone di rilascio della
gonadotropina (GnRH)
– Ca++, PIP2 e PKC
• Ipofisi anteriore → Ormone follicolo
stimolante (FSH), ormone luteinizzante
(LH)
• FSH e LH (glicoproteine) hanno funzioni
relativamente simili in entrambi i sessi
• L' GnRH, prodotto nel nucleo arcuato e
nell area preottica ipotalamica induce il rilascio
di FSH, LH dall ipofisi anteriore. Dopo un picco
in età prenatale ed uno minore subito dopo la
nascita, la secrezione di GnRH rimane bassa
fino all'avvento della pubertà (tra gli 8 e i 13
anni nelle femmine; tra i 9 e i 14 anni nei
maschi). Due le ipotesi più accreditate sulla
ripresa della secrezione di GnRH puberale : a)
La precoce degenerazione dall epifisi con
progressiva diminuzione della secrezione di
melatonina, inibitoria sui nuclei ipotalamici che
producono e secernono GnRH.
b)Un troppo basso peso, tramite le leptine
ritarderebbe la pubertà.
• Quando il GnRH si lega a specifici recettori
posti sulla membrana di cellule gonadotrope
adenoipofisarie, viene attivata una cascata di
segnali intracellulari che portano alla
secrezione dell ormone luteinizzante,
precedentemente accumulato nella cellula
all interno di granuli secretori e di cui il GnRH
è in grado di promuovere l ulteriore trascrizione
e sintesi.
FSH e LH nell ovaio
• Secrezioni ritmiche col ciclo mestruale:
– Secrezione di estradiolo →
maturazione del follicolo
– In concerto con progesterone: ciclo
mestruale
– In concerto con insulin-like growth
factor I (IGF-I): crescita e maturazione
dei caratteri secondari femminili
– Turnover dell’osso (osteoporosi senile)
•
FSH
e
LH
nei
testicoli
Secrezione di testosterone (via
proteina G)
– Proteine di trasporto
• Albumina aspecifica
• Sex-hormone binding globulin
(SHBG) specifica
– Targets:
• Organo del Sertoli (spermatogenesi)
• Tessuto muscolare: sintesi proteica
→ anabolismo
• Gli ormoni LH,FSH sono glicoproteine.
Nel maschio, l LH stimola l'attività endocrina
delle cellule interstiziali del testicolo con
produzione di testosterone. Inoltre, a causa del
suo ruolo nella produzione di testosterone,
ormone necessario per la maturazione delle
cellule germinali, l ormone luteinizzante stimola
anche, in maniera indiretta, la spermatogenesi.
• Nella femmina, invece, l LH stimola, insieme
alla prolattina, l ovulazione e la conversione del
follicolo ovarico in corpo luteo, L ormone
steroideo prodotto, quindi, porta alla sintesi dei
precursori dell estradiolo. L LH stimola anche
la sintesi di progesterone da parte delle cellule
della granulosa .
Asse della prolattina
TRH → Ipofisi anteriore → prolattina →
ghiandola mammaria → secrezione di
lattoalbumina
– Meccanismo simile a quello del GH (citochina)
– Neuroni → dopamina (controllo negativo)
– cAMP, Ca++-CaM
– Inibito da somatostatina
• Patologie:
– ↑prolattina (tumore dell’ipofisi o deficit di dopamina):
irregolarità mestruale nelle donne, iperplasia
prostatica negli uomini
• La PRL ormone di 198 aa, è secreto
dall adenoipofisi in modo pulsatile e raggiunge
il picco durante il sonno rem tra le 3 e le 5 del
mattino. Il suo valore medio è di 20 µg/l. La sua
regolazione ipotalamica avviene principalmente
tramite un fattore inibitorio il PIF=PIH risultato
successivamente essere la DA; stimolato
meno dal TRH e da peptidi minori. Essa viene
anche prodotta da cellule specializzate
dell utero, della placenta, delle mammelle ed
anche del sistema immunitario, con un ruolo
paracrino e autocrino come citochina. La PRL
soffre un tono inibitorio costante da parte della
DA ipotalamica.
• Durante la gravidanza, gli estrogeni aumentano
la sua produzione, promuovendo l iperplasia
delle cellule lattotrofe dell'ipofisi e l'aumento
dell espressione del suo gene. La PRL
aumenta col riflesso neuroendocrino della
suzione, attribuito all'azione della serotonina(5HT), la cui liberazione è aumentata dalla
stimolazione sensoriale fatta dal bambino nella
mammella, attraverso il NPV ipotalamico. La
serotonina, pur essendo un importante fattore
di liberazione di prolattina, dipende per questa
funzione da un'altra sostanza: il peptide
intestinale vasoattivo (VIP)
• Questa sostanza, avrebbe un'azione paracrina
nell'ipofisi, segnalando ai lattotrofi di produrre
prolattina. Questo ruolo fondamentale del VIP è
stato dimostrato tramite l'iniezione di serotonina
e di siero anti-VIP nel cervello di conigli, il cui
picco di prolattina nel plasma indotto dalla
serotonina era molto più basso di quello
presentato dai conigli che non hanno ricevuto il
siero anti-VIP.
• La DA è il principale inibitore della PRL ma si
lega ai recettori D2 dei lattotrofi solo ad alte
concentrazioni ematiche. Ciò diminuisce la
produzione di cAMP, apre canali del K+ e
diminuisce il flusso di Ca+ verso il citoplasma
cellulare. Come conseguenza, diminuisce la
secrezione e trascrizione genica della PRL.
• Nel circolo portale ipotalamo-ipofisario
dell eminenza mediana, i livelli di DA sono più
alti di quelli sistemici, visto che gli assoni del
nucleo arcuato ipotalamico che la producono, vi
scaricano il loro contenuto direttamente.
• Questo consente all'ipotalamo di generare un
tono inibitorio sulla produzione di PRL.
• La PRL presenta un meccanismo feedback
negativo con la DA, alti livelli di PRL ne
favoriscono la sintesi nei neuroni dopaminergici
dell'ipotalamo (n.Arcuato). I lattotrofi
presentano recettori per il TRH. il GAP (peptide
associato al GnRH), inibisce la secrezione di
PRL in antagonismo con il peptide liberatore di
prolattina (PrRP), attivato da livelli alti di
estrogeni. Altro ormone capace di aumentare in
modo blando la secrezione di prolattina è
l ossitocina. Gli oppioidi esogeni, come pure la
beta-endorfina, la neurotensina e l'angiotensina
II aumentano la secrezione di prolattina.
• La PRL promuove la captazione di alcuni aa e
la trascrizione di geni che producono le
proteine del latte: la caseina, la lattoalbumina e
la beta-lattoalbumina. La PRL aumenta anche
la produzione di enzimi importanti per la sintesi
del lattosio (il principale carboidrato del latte).
Dopo il parto, i bassi livelli di progesterone,
rendono la PRL capace di indurre la
lattogenesi,come fa pure in questo periodo
l aumento dei livelli di cortisolo, grazie alla
minor produzione di globuline a cui esso si
lega. La PRL ha un effetto anche su altri organi
dell apparato genitale femminile trasmettendo
un segnale inducente refrattarietà alla
fecondazione.
Aumento della prolattina e caduta del
progesterone sembrano essere (nel ratto) le
cause immediate della comparsa del
comportamento materno
• Psychoneuroendocrinology (2009) 34, 382—388
• BDNF Val66Met polymorphism is associated
with HPA axis reactivity to psychological stress
characterized by genotype and gender
interactions
• Idan Shalev a, Elad Lerer b, Salomon Israel c, Florina
Uzefovsky c,
• Inga Gritsenko d, David Mankuta e, Richard P. Ebstein c,d,*,
Marsha Kaitz c
• a Neurobiology, Hebrew University, Jerusalem, Israel
• b Human Genetics, Hebrew University, Jerusalem, Israel
• c Psychology Department, Hebrew University, Jerusalem, Israel
• d S. Herzog Memorial Hospital, Jerusalem, Israel
• e Hadassah Medical Organization, Department of Labor and
Delivery, Jerusalem, Israel
• Molecular Psychiatry (2008), 1–8
• Evidence of biologic epistasis between BDNF
and SLC6A4 and implications for depression
• L Pezawas1,2,6, A Meyer-Lindenberg1,3,6, AL Goldman1, BA
Verchinski1, G Chen4, BS Kolachana1,
• MF Egan1, VS Mattay1, AR Hariri5 and DR Weinberger1
• 1Genes, Cognition and Psychosis Program, National Institute of
Mental Health, National Institutes of Health, Bethesda, MD,
• USA; 2Division of Biological Psychiatry, Medical University of
Vienna, Vienna, Austria; 3Department of Psychiatry and
• Psychotherapy, Central Institute of Mental Health, Mannheim,
Germany; 4Scientific and Statistical Computing Core, National
• Institute of Mental Health, National Institutes of Health,
Bethesda, MD, USA and 5Department of Psychiatry, Western
• Psychiatric Institute and Clinic, University of Pittsburgh School
of Medicine, Pittsburgh, PA, USA