Terapia medica della sindrome di Zollinger-Ellison
Davide Campana, Raffaele Pezzilli, Lydia Piscitelli, Lorenzo Fantini, Francesca Nori,
Paola Tomassetti
Dipartimento di Medicina Interna e Gastroenterologia
Università degli Studi di Bologna
Policlinico S.Orsola-Malpighi
Bologna.
CORRISPONDENZA:
Dott. R. Pezzilli
Dipartimento di Medicina Interna e Gastroenterologia
Università degli Studi di Bologna
Policlinico S.Orsola-Malpighi
Via Massarenti, 9
40138 - Bologna
Tel/Fax. +390516364186
[email protected]
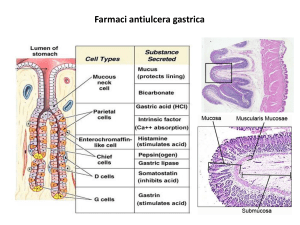
La sindrome di Zollinger-Ellison (ZES) è caratterizzata da ulcera peptica del tratto
gastrointestinale superiore, refrattaria alla terapia medica, diarrea e severa ipersecrezione acida
gastrica, causata da un tumore delle cellule insulari del pancreas [1]; il tumore pancreatico
rilascia ectopicamente gastrina, responsabile dell'ipersecrezione gastrica. Negli Stati Uniti,
l'incidenza annua stimata è un caso per milione di persone e da 0.1 a 1% in pazienti con ulcera
peptica. L'età all'esordio varia da 7 a 90 anni, ma la diagnosi di solito è posta tra i 30 e i 50 anni.
Non c'è una chiara prevalenza di sesso, anche se circa il 60% dei pazienti affetti sono uomini
[2-5]. Negli ultimi trenta anni, il notevole progresso delle tecniche diagnostiche e terapeutiche
ha portato reali benefici in termini di qualità di vita e sopravvivenza.
Il tumore secernente gastrina responsabile della sindrome di Zollinger-Ellison (ZES) è il tumore
più comune nei pazienti affetti da Neoplasia Endocrina Multipla di tipo 1 (MEN1), riscontrabile
nel 20-61% dei casi [6]; al contrario, la MEN 1 si ritrova nel 20-38% di tutti i pazienti con
gastrinoma [7;8]. La MEN 1 è una sindrome ereditaria che comprende lo sviluppo di tumore e/o
iperplasia nelle ghiandole paratiroidi, tumori endocrini nel pancreas, nel duodeno e nell'ipofisi.
Tale sindrome, per la prima volta descritta da Wermer nel 1954, ha una prevalenza di
0.2-2/100.000 persone/anno, anche se questa è sottostimata in quanto generalmente non
vengono adeguatamente inquadrate endocrinopatie che costituiscono tale sindrome [9;10].
Per il trattamento dei pazienti con ZES, le opzioni terapeutiche principali sono la terapia medica
dell'ipersecrezione acida gastrica, la terapia medica dell'ipersecrezione di gastrina, la
chemioterapia, l'utilizzo di interferone e la chemioembolizzazione/embolizzazione.
1. TERAPIA DELL'IPERSECREZIONE ACIDA GASTRICA
Se si sospetta una ZES, mentre si attendono i risultati conclusivi dei test diagnostici, è
importante prevenire le complicanze che potrebbero insorgere; per questo si consiglia di iniziare
tempestivamente una terapia antisecretiva, che di solito è ben tollerata e senza particolari
1/9
Terapia medica della sindrome di Zollinger-Ellison
controindicazioni.
Inibitori della pompa protonica (PPI)
L'omeprazolo si è dimostrato sicuro ed efficace nel controllo dell'ipersecrezione gastrica nei
pazienti con ZES ed ha completamente sostituito l'uso degli H2 antagonisti. I vari PPI utilizzati
comunemente quali omeprazolo, lansoprazolo, pantoprazolo, rabeprazolo, esomeprazolo
[11,12] sono tutti egualmente efficaci nel controllo dell'ipersecrezione gastrica acida. La dose
media di omeprazolo in grado di controllare l'ipersecrezione gastrica nella maggior parte dei
pazienti con ZES è compresa tra 60 e 100 mg di farmaco al giorno [13]. L'obiettivo della terapia
non è l'acloridria, ma un output acido basale (BAO) compreso tra 1 e 10 mmol/h; se si evidenzia
una completa inibizione dell'ipersecrezione acida, la dose di omeprazolo dovrebbe essere
ridotta del 50% e si dovrebbe valutare nuovamente il paziente. Se il BAO è superiore a 10
mmol/h, la dose di PPI dovrebbe essere aumentata gradualmente e, per dosi di omeprazolo
maggiori di 60 mg (o dose equivalente di un altro PPI), sarebbe opportuno somministrare il
farmaco in due dosi, metà prima di colazione e metà prima di cena. La mancanza di controllo
della secrezione acida gastrica può essere un alto rischio per i pazienti affetti da ZES [13;14], e
alcuni dati in letteratura hanno dimostrato che una dose iniziale di 20 mg non è in grado di
controllare la secrezione acida e i sintomi legati alla malattia [15].
Trattamento a lungo termine
Sono riportati molti dati sull'efficacia e la sicurezza dei PPI quando questi farmaci vengono
somministrati a lungo termine nei pazienti con ZES. Dopo aver stabilito la dose iniziale e aver
monitorato la secrezione gastrica, le dosi di mantenimento a lungo termine possono essere
ridotte significativamente nella maggior parte dei pazienti, una volta stabilizzato il controllo della
secrezione gastrica [16;17]. Questo si può facilmente spiegare con il fatto che l'efficacia
dell'omeprazolo aumenta con il tempo [18-20]. Non sembra che il trattamento con PPI nella
ZES abbia indotto alterazioni della percentuale di cellule argirofile [21]. Nonostante questo, si
riscontra un aumento dei livelli di gastrina verosimilmente legato a malattia progressivamente
metastatica o acloridria e conseguente incremento di gastrina di origine antrale.
PPI per via endovenosa
I pazienti affetti da ZES a cui non è possibile somministrare i PPI per via orale o che
necessitano di una terapia che sopprima maggiormente la secrezione acida gastrica sono
candidati a ricevere i PPI per via endovenosa: esempio di ciò sono i pazienti con ulcera
complicata da emorragia o pazienti con stenosi esofagea. Altra possibile via di
somministrazione di soluzioni preparate con PPI orali è quella intragastrica attraverso sonda
che può essere utilizzata come alternativa alla via endovenosa nei pazienti critici.
Carenza di vitamina B12 durante il trattamento prolungato con PPI
Durante il trattamento prolungato con gli inibitori della pompa protonica, sono stati
occasionalmente documentati ridotti livelli di vitamina B12 sierica, ma non di folati [22]. Tale
fenomeno sembra essere correlato all'acloridria indotta dal farmaco, che peraltro non è di
comune insorgenza durante la terapia con i PPI.
2. TERAPIA DELLA SECREZIONE ORMONALE
Trattamento con gli Analoghi della Somatostatina
La somatostatina e i suoi analoghi sono in grado di ridurre l'acido gastrico ed i livelli di gastrina
sierica nei pazienti con ZES, sia con somministrazione a breve termine che a lungo termine
2/9
Terapia medica della sindrome di Zollinger-Ellison
[23]. Attualmente sono disponibili in commercio, oltre all'Octreotide sottocute a rilascio
immediato, altri analoghi della somatostatina a lunga durata d'azione, come il Lanreotide,
somministrabile ogni 10-14 giorni, e l'Octreotide LAR, somministrabile ogni 28 giorni [24;25].
Nel 1993 Rusniewsky ha osservato, nei pazienti con ZES trattati con octreotide sottocute per un
periodo di 9-12 mesi, un decremento medio della gastrina sierica dell'87% [26]. Nello stesso
studio è stato osservato che l'octreotide era in grado di controllare l'ipersecrezione gastrica e di
ridurre, e talvolta annullare, l'iperplasia delle cellule ECL nei casi in cui questa era presente
prima del trattamento [27]. Recentemente, Bordi et al. hanno riportato che il trattamento
prolungato con octreotide è in grado di diminuire significativamente le cellule argirofile del fondo
nei pazienti con patologia gastrica [28].
In seguito numerosi studi hanno evidenziato che il trattamento con gli analoghi della
somatostatina ha un effetto inibente la crescita tumorale nei pazienti con neoplasie
neuroendocrine gastrointestinali maligne, come i tumori pancreatici o i carcinoidi, ed è in grado
di stabilizzare la crescita tumorale nel 37-80% dei pazienti; solo in pochi pazienti (0-17%) si è
osservata una riduzione delle dimensioni del tumore [29;30].
Peraltro fino ad oggi è stato effettuato un solo studio sull'efficacia dell'octreotide nel controllo
della crescita tumorale nei pazienti con gastrinoma metastatico. In tale studio è stato dimostrato
che il 53% dei pazienti (8/15) con gastrinoma maligno ha avuto una progressione della crescita
tumorale; di questi il 47% (7/15) ha presentato una stabilizzazione del tumore e il 6% (1/15) una
riduzione delle dimensioni [31]. Nei pazienti che hanno risposto al trattamento, la stabilizzazione
del tumore è stata di lunga durata e l'incidenza degli effetti collaterali più bassa rispetto al
gruppo trattato con chemioterapia.
Gli effetti collaterali più comuni degli analoghi della somatostatina sono calcoli biliari, dolore
addominale, diarrea e dolore nel sito d'iniezione.
La radioterapia recettori-mediata con 90Y-DOTA-D-Phe1-Tyr3-octreotide per i tumori
neuroendocrini è stata proposta recentemente come trattamento palliativo; questa modalità di
trattamento, tuttavia, può causare mielotossicità e nefrotossicità [32]. Negli ultimi tre anni in
letteratura sono apparse numerose pubblicazioni sull'utilizzo di tale terapia nei tumori
neuroendocrini con l'utilizzo non solo dell'Itrio ma anche del Lutezio, il quale appare essere
anche meno tossico sul rene [33]. Per quanto riguarda la terapia nel gastrinoma è stata
descritta una regressione delle metastasi nel 25% dei pazienti.
Trattamento dei carcinoidi nella ZES-MEN1
Gli analoghi della somatostatina a lunga durata d'azione si sono rivelati in grado di ridurre la
massa di cellule endocrine gastriche [34]; inoltre è stato dimostrato che tali farmaci possono
inibire la crescita nei modelli sperimentali ipergastrinemici che sviluppano carcinoidi gastrici
[35;36]. Tali evidenze supportano la possibilità che l'octreotide possa essere utilizzato nei
pazienti con carcinoidi gastrici. Questi dati sono stati confermati in un recente studio che ha
evidenziato la regressione dei carcinoidi gastrici nei pazienti con ZES-MEN 1 trattati con gli
analoghi della somatostatina a lunga durata d'azione. Risulta pertanto essere corretto trattare i
pazienti affetti da ZES-MEN 1 che abbiano carcinoidi gastrici con 30 mg di octreotide LAR ogni
28 giorni, o con 30 mg o 60 mg di lanreotide rispettivamente ogni 14 o 28 giorni [37].
3. CHEMIOTERAPIA SISTEMICA
La chemioterapia ha fornito solo risultati poco chiari utilizzando i classici agenti antitumorali,
3/9
Terapia medica della sindrome di Zollinger-Ellison
come il 5-fluorouracile, nel controllo dei tumori endocrini metastatici. La chemioterapia sistemica
ha raggiunto una nuova dimensione terapeutica subito dopo l'introduzione della streptozotocina
nell'uso clinico [38]; ci sono stati numerosi studi sugli effetti di questo farmaco sui tumori
metastatici a cellule insulari che hanno confermato l'efficacia della streptozotocina; nonostante
ciò sono molti gli effetti collaterali acuti e cronici, come la grave tossicità renale o ematologica
[39]. Vari studi hanno standardizzato il dosaggio e il programma di somministrazione della
streptozotocina, ed hanno suggerito la combinazione con altri farmaci citotossici come il
5-fluorouracile e la doxorubicina. Altra chemioterapia proposta è la monoterapia con
clorozotocina, una nuovissima nitrosurea con composizione simile alla streptozotocina
caratterizzata da minor tossicità gastrointestinale ma da aumentata mielosoppressione, e la
monoterapia con dacarbazina [40]. Questi studi hanno esaminato tumori endocrini di varie
origini, trascurando il variabile potenziale maligno dei tumori endocrini metastatici che differisce
a seconda che si tratti di tumori endocrini ben differenziati o di carcinomi indifferenziati [41].
Considerando tutti i dati disponibili, si può concludere che la chemioterapia non è il trattamento
di prima scelta nei pazienti con tumore a secrezione di gastrina. La chemioterapia è indicata
solo nei tumori a rapida evoluzione, cioè quelle neoplasie in cui la massa del tumore primitivo
aumenta più del 25% in un periodo di follow-up di 12 mesi o in cui i sintomi tumorali non si
possono trattare con altre metodiche [42].
4. INTERFERONE
Negli ultimi anni si è sostenuta la validità dell'interferone nel trattamento dei tumori
neuroendocrini, specialmente nella sindrome da carcinoide.
I dati della letteratura dimostrano che la terapia con interferone-a determina una stabilizzazione
delle dimensioni dei tumori neuroendocrini gastrointestinali nel 20-40% dei pazienti, ma non ha
mostrato di aumentare la sopravvivenza. Si è proposto, quindi, che i gastrinomi possano essere
trattati con chemioterapia e/o interferone quando crescono e metastatizzano [43].
5. CHEMIOEMBOLIZZAZIONE O EMBOLIZZAZIONE
L'embolizzazione dell'arteria epatica si è dimostrata utile nei pazienti con gastrinoma e con altri
tumori neuroendocrini del pancreas, ma è stato trattato con tale metodica solo un piccolo
numero di gastrinomi, e non si è potuto determinare se questa procedura permetta una
maggiore sopravvivenza.
L'associazione con agenti chemioterapici come la streptozotocina o la doxorubicina può
determinare un notevole miglioramento delle condizioni del paziente ed è di solito
accompagnata da una riduzione dei livelli sierici dei peptidi circolanti e delle dimensioni del
tumore, ma non è stato dimostrato chiaramente che l'inibizione della crescita tumorale porti
anche ad un miglioramento della sopravvivenza [44;45].
Bibliografia
4/9
Terapia medica della sindrome di Zollinger-Ellison
1. Zollinger RM, Ellison EH. Primary peptic ulcerations of the jejunum associated with islet cell
tumors of the pancreas. 1955. CA Cancer J Clin 1989; 39(4):231-247.
2. Zollinger RM, Ayres H.P. The Zollinger-Ellison syndrome. In: Nyhus L.M., Wastell C.,
Donahue Ph.E., editors. Surgery of the Esophagus, Stomach and Small Intestine. 1987:
491-513.
3. Isenberg JI, Walsh JH, Grossman MI. Zollinger-Ellison syndrome. Gastroenterology 1973;
65(1):140-165.
4. Ellison EC, Wilson SD. The Zollinger-Ellison syndrome: re-appraisal and evaluation of 260
registered cases. Ann Surg 1964; 160:512-530.
5. Stage JG, Stadil F. The clinical diagnosis of the Zollinger-Ellison syndrome. Scand J
Gastroenterol Suppl 1979; 53:79-91.
6. Norton JA, Jensen R.T. Multiple endocrine neoplasia. In: DeVita V.T., Hellman S., Rosenberg
S.A., editors. Cancer Principies and practice of oncology. Philadelphia: Lippincott-Raven
Publisher, 1997: 1723-1729.
7. Benya RV, Metz DC, Venzon DJ et al. Zollinger-Ellison syndrome can be the initial endocrine
manifestation in patients with multiple endocrine neoplasia-type I. Am J Med 1994;
97(5):436-444.
8. Mignon M., Cadiot G., Rigaud D et al. Management of islet cell tumors in patients with
multiple endocrine neoplasia type 1. Mignon M., Jensen R.T., editors. Endocrine tumors of the
pancreas: Recent advances in research and management. Karger 1995. Frontiers of
Gastrointestinal Research. Modlin I.M., Rozen P., and Scarpignato C. pp342-359
9. Wermer P. Genetic aspects of adenomatosis of endocrine glands. Am J Med 1954;
5/9
Terapia medica della sindrome di Zollinger-Ellison
16:363-371.
10. Shepherd JJ. The natural history of multiple endocrine neoplasia type 1. Highly uncommon
or highly unrecognized? Arch Surg 1991; 126(8):935-952.
11. Welage LS, Berardi RR. Evaluation of omeprazole, lansoprazole, pantoprazole, and
rabeprazole in the treatment of acid-related diseases. J Am Pharm Assoc (Wash ) 2000;
40(1):52-62.
12. Thomson AB. Are the orally administered proton pump inhibitors equivalent? a comparison
of lansoprazole, omeprazole, pantoprazole, and rabeprazole. Curr Gastroenterol Rep 2000;
2(6):482-493
13. Jensen RT, Gardner J.D. Zollinger-Ellison syndrome: clinical presentation, pathology,
diagnosis and treatment. In: Zakim D., Dannenberg A.J., editors. Peptic ulcer disease and other
acid-related disorder. New York: Accademic Research Associates, 1991: 117-246.
14. Metz M.D., Jensen R.T. Advances in gastric antisecretory therapy in Zollinger-Ellison
syndrome. Mignon M., Jensen R.T., editors. Endocrine tumors of the pancreas: Recent
advances in research and management. Karger, 240-257. 1995. Frontiers of Gastrointestinal
Research. Modlin I.M., Rozen P., and Scarpignato C.
15. Termanini B, Gibril F, Stewart CA, Weber HC, Jensen RT. A prospective study of the
effectiveness of low dose omeprazole as initial therapy in Zollinger-Ellison syndrome. Aliment
Pharmacol Ther 1996; 10(1):61-71.
16. Metz DC, Pisegna JR, Fishbeyn VA et al. Currently used doses of omeprazole in
Zollinger-Ellison syndrome are too high. Gastroenterology 1992; 103(5):1498-1508.
17. Stadil F, Stage JG. The Zollinger--Ellison syndrome. Clin Endocrinol Metab 1979;
6/9
Terapia medica della sindrome di Zollinger-Ellison
8(2):433-446.
18. Andersson T, Bergstrand R, Cederberg C, Eriksson S, Lagerstrom PO, Skanberg I.
Omeprazole treatment does not affect the metabolism of caffeine. Gastroenterology 1991;
101(4):943-947.
19. Metz DC, Pisegna JR, Fishbeyn VA et al. Currently used doses of omeprazole in
Zollinger-Ellison syndrome are too high. Gastroenterology 1992; 103(5):1498-1508.
20. Jansen JB, Lundborg P, Baak LC et al. Effect of single and repeated intravenous doses of
omeprazole on pentagastrin stimulated gastric acid secretion and pharmacokinetics in man. Gut
1988; 29(1):75-80.
21. Maton PN, Lack EE, Collen MJ et al. The effect of Zollinger-Ellison syndrome and
omeprazole therapy on gastric oxyntic endocrine cells. Gastroenterology 1990; 99(4):943-950.
22. Howden CW. Vitamin B12 levels during prolonged treatment with proton pump inhibitors. J
Clin Gastroenterol 2000; 30(1):29-33.
23. Ruszniewski P, Laucournet H, Elouaer-Blanc L, Mignon M, Bonfils S. Long-acting
somatostatin (SMS 201-995) in the management of Zollinger-Ellison syndrome: evidence for
sustained efficacy. Pancreas 1988; 3(2):145-152.
24. Tomassetti P, Migliori M, Gullo L. Slow-release lanreotide treatment in endocrine
gastrointestinal tumors. Am J Gastroenterol 1998; 93(9):1468-1471.
25. Tomassetti P, Migliori M, Corinaldesi R, Gullo L. Treatment of gastroenteropancreatic
neuroendocrine tumours with octreotide LAR. Aliment Pharmacol Ther 2000; 14(5):557-560.
7/9
Terapia medica della sindrome di Zollinger-Ellison
26. Ruszniewski P, Ramdani A, Cadiot G, Lehy T, Mignon M, Bonfils S. Long-term treatment
with octreotide in patients with the Zollinger-Ellison syndrome. Eur J Clin Invest 1993;
23(5):296-301.
27. Arnold R, Simon B, Wied M. Treatment of neuroendocrine GEP tumours with somatostatin
analogues: a review. Digestion 2000; 62 Suppl 1:84-91.
28. Bordi C, Azzoni C, Pilato FP et al. Morphometry of gastric endocrine cells in
hypergastrinemic patients treated with the somatostatin analogue octreotide. Regul Pept 1993;
47(3):307-318.
29. Arnold R, Trautmann ME, Creutzfeldt W et al. Somatostatin analogue octreotide and
inhibition of tumour growth in metastatic endocrine gastroenteropancreatic tumours. Gut 1996;
38(3):430-438.
30. Jensen RT. Carcinoid and pancreatic endocrine tumors: recent advances in molecular
pathogenesis, localization, and treatment. Curr Opin Oncol 2000; 12(4):368-377.
31. Shojamanesh H, Gibril F, Louie A et al. Prospective study of the antitumor efficacy of
long-term octreotide treatment in patients with progressive metastatic gastrinoma. Cancer 2002;
94(2):331-343.
32. Paganelli G, Zoboli S, Cremonesi M et al. Receptor-mediated radiotherapy with
90Y-DOTA-D-Phe1-Tyr3-octreotide. Eur J Nucl Med 2001; 28(4):426-434.
33. Waldherr C, Pless M, Maecke HR, Haldemann A, Mueller-Brand J. The clinical value of
[90Y-DOTA]-D-Phe1-Tyr3-octreotide (90Y-DOTATOC) in the treatment of neuroendocrine
tumours: a clinical phase II study. Ann Oncol 2001; 12(7):941-945.
34. Peghini PL, Annibale B, Azzoni C et al. Effect of chronic hypergastrinemia on human
8/9
Terapia medica della sindrome di Zollinger-Ellison
enterochromaffin-like cells: insights from patients with sporadic gastrinomas. Gastroenterology
2002; 123(1):68-85.
35. Cadiot G, Lehy T, Bonfils S. Action of somatostatin analogue (SMS 201-995) on the
growth-promoting effect resulting from sustained achlorhydria in rat gastric mucosa, with special
reference to endocrine cell behaviour. Eur J Clin Invest 1988; 18(4):360-368.
36. Modlin IM, Kumar R, Nangia A, Soroka CJ, Pasikhov D, Goldenring JR. Gastrin-dependent
inhibitory effects of octreotide on the genesis of gastric ECLomas. Surgery 1992;
112(6):1048-1056.
37. Tomassetti P, Migliori M, Caletti GC, Fusaroli P, Corinaldesi R, Gullo L. Treatment of type II
gastric carcinoid tumors with somatostatin analogues. N Engl J Med 2000; 343(8):551-554.
38. Murray-Lyon IM, Eddleston AL, Williams R et al. Treatment of multiple-hormone-producing
malignant islet-cell tumour with streptozotocin. Lancet 1968; 2(7574):895-898.
39. Broder LE, Carter SK. Pancreatic islet cell carcinoma. II. Results of therapy with
streptozotocin in 52 patients. Ann Intern Med 1973; 79(1):108-118.
40. Kvols LK, Buck M. Chemotherapy of endocrine malignancies: a review. Semin Oncol 1987;
14(3):343-353.
41. Arnold R., Frank M. Systemic chemotherapy for endocrine tunors of the pancreas. Mignon
M., Jensen R.T., editors. Endocrine tumors of the pancreas: Recent advances in research and
management. Karger[23], 431-438. 1995. Frontiers of Gastrointestinal Research. Modlin I.M.,
Rozen P., and Scarpignato C.
42. Rougier P, Mitry E. Chemotherapy in the treatment of neuroendocrine malignant tumors.
Digestion 2000; 62 Suppl 1:73-78.
9/9