SISTEMA PERIODICO
Gli elementi chimici presenti sulla terra sono 92, a
cui, oggi, si aggiungono gli elementi artificiali.
La differenza che li distingue è rappresentata dal
numero di particelle elementari (protoni, elettroni
e neutroni) che li costituiscono.
Tutti gli elementi conosciuti vengono raccolti in
un sistema organico che prende il nome di
SISTEMA PERIODICO DEGLI ELEMENTI o
anche TAVOLA PERIODICA.
17/01/2014
1
La “Tavola” come viene disegnata oggi, deriva dalla
originale tabella che lo scienziato russo D.I.Mendeleev
pubblicò nel 1869, ma ne differisce profondamente poiché
in quel momento solo 41 erano gli elementi conosciuti.
Originariamente Mendeleev (e quasi
contemporaneamente Meyer in Germania) aveva ordinato
gli elementi noti sulla base del peso atomico, ma nel
compiere questo lavoro Mendeleev notò che le proprietà
chimiche che gli elementi presentano, tendevano a variare
prima con continuità, mostravano una brusca variazione,
ancora una variazione continua e così via.
Aveva individuato la legge della periodicità che
contraddistingue gli elementi chimici.
17/01/2014
2
17/01/2014
Utilizzando le indicazioni ottenute dalla Legge della
periodicità, costruì allora la tabella disponendo i simboli
in righe orizzontali formate da 8 elementi
In questo modo ottenne delle colonne verticali lungo le
quali gli elementi presentavano proprietà molto simili e
arrivò ad ipotizzare la presenza di elementi non ancora
scoperti, lasciando vuote le caselle corrispondenti
In realtà aveva ordinato gli elementi in funzione del
Numero atomico (anche se questo concetto non era
ancora noto)
La legge della periodicità, come viene formulata oggi, ci
dice che le proprietà chimiche e fisiche degli elementi
sono funzione del loro numero di massa
3
"The periodical law of the chemical elements"
1889
La sua tesi fu completamente
accettata quando furono
scoperti e identificati scandio,
gallio e germanio, di cui aveva
ipotizzato non solo l'esistenza
ma anche le proprietà in base
alla legge della periodicità e
che corrispondevano
perfettamente alle sue
previsioni
17/01/2014
Dmitrij Ivanovich Mendeleev
4
Terminologia
Fornire un glossario dei termini utilizzati
Illustrare il significato specifico dei termini in
relazione all'argomento trattato
17/01/2014
5
Primo argomento
Entrare nei dettagli
Riportare un esempio
Utilizzare degli esercizi per favorire
l'apprendimento
17/01/2014
6
TAVOLA PERIODICA (2005)
17/01/2014
7
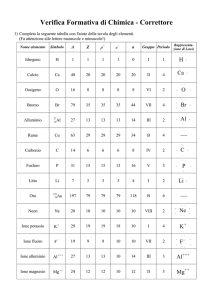
Ogni casella riporta parecchie informazioni:
il simbolo, costituito da una o due lettere,
normalmente le iniziali del nome dell’elemento stesso,
talora del nome latino.
il numero atomico, costituito dal numero scritto di
fianco al simbolo, che rappresenta il numero di protoni
che quell’elemento contiene nel nucleo ed il
corrispondente numero di elettroni che lo stesso
elemento ha negli orbitali.
il peso atomico, rappresentato dal numero scritto
sotto il simbolo, che rappresenta la massa dell’atomo
dell’elemento stesso e che normalmente è costituito
non da un numero intero ma decimale.
17/01/2014
8
Questo può apparire strano, poiché non è
pensabile che esistano “frazioni di atomo”.
Bisogna però tenere presente che il valore
numerico indicato nella tavola è un valore medio,
ottenuto attraverso una media ponderata del
valore dei diversi isotopi dell’elemento stesso.
Cosa significa questo?
Semplicemente che per ogni elemento esistono
atomi leggermente diversi tra di loro.
17/01/2014
9
Utilizziamo come esempio il Carbonio che ha:
Numero
atomico = 6, ossia 6 P e 6 e
Peso atomico = 12, il nucleo contiene anche 6 N
ma esistono anche altri due tipi di atomi di C, vale a dire
due isotopi diversi:
6 protoni
6 elettroni
7 neutroni
6 protoni
6 elettroni
8 neutroni
Che vengono indicati con la notazione:
12C
6
17/01/2014
13C
6
14C
6
10
Un
1
altro esempio può essere dato da:
1 H
2
1 H
3
1
H
Gli isotopi di un qualsiasi elemento sono:
atomi che hanno lo stesso numero atomico ma
diverso numero di massa, poiché contengono
diverso numero di neutroni.
Tutti gli elementi sono rappresentati da isotopi
diversi, che possono essere numerosi.
Tra gli elementi più pesanti alcuni isotopi sono
radioattivi.
17/01/2014
11
Esistono anche gli isobari, ossia atomi che
presentano lo stesso numero di massa ma
diverso numero atomico
Un esempio è dato da:
14C
6
17/01/2014
14N
7
12
Nella Tavola si passa da un elemento al successivo
per aumento di una unità nel NUMERO ATOMICO,
l’idrogeno ha N.A, = 1, l’elio ha N.A. = 2, il litio N.A. = 3
e così via.
Questo significa semplicemente che:
– l’atomo di H contiene 1 solo protone nel nucleo ed 1 solo
elettrone negli orbitali,
– l’atomo di He 2 protoni nel nucleo e 2 elettroni negli orbitali,
– l’atomo di Li 3 protoni nel nucleo e 3 elettroni negli orbitali.
17/01/2014
13
Contemporaneamente all’aumento del
Numero Atomico aumenta il Numero di Massa
Tale aumento non si realizza in maniera
direttamente proporzionale
L’ aumento del numero di massa è, in genere,
superiore al doppio dell’incremento dovuto allo
aumento dei protoni
17/01/2014
14
Protoni, neutroni ed elettroni hanno massa
talmente piccola che si utilizzano dei valori
convenzionali poiché sarebbe estremamente
scomodo e fonte di errore l’uso delle unità di
misura assolute (g)
Si parla infatti di Massa relativa degli atomi che
viene misurata in unità convenzionali
Unità che vengono definite Unità di massa
atomica e dimensionalmente corrispondono a
1/12 della massa dell’ isotopo 12 del C
17/01/2014
15
Nella tavola periodica degli elementi viene
ripotato il valore della massa atomica relativa
(peso atomico)
La somma delle masse atomiche relative degli
atomi che costituiscono una molecola permette
di calcolare il peso molecolare.
Il valore del peso atomico espresso in gr
costituisce il grammo atomo
Il valore del peso molecolare espresso in gr
rappresenta la grammomolecola o mole.
17/01/2014
16
Si può dimostrare facilmente che:
1.
in un grammo atomo di un qualsiasi elemento
sono contenuti 6,022 1023 atomi di
quell’elemento
●
2.
In una grammo molecola di un qualsiasi
composto sono contenute 6,022 1023
molecole di quel composto
●
3.
17/01/2014
6,022 1023 rappresenta il numero di Avogadro
●
17
dato che i protoni sono particelle con carica
elettrica positiva, come fanno a rimanere uniti nel
nucleo, visto e considerato che la Elettrologia ci
dice che cariche uguali si respingono ??
la risposta a questa domanda è:
la repulsione tra le cariche positive dei protoni
viene compensata dalla presenza dei neutroni, (in
numero almeno uguale ma spesso superiore a
quello dei protoni) che si interpongono tra le
cariche positive e rappresentano la ”colla” che
tiene insieme il nucleo.
17/01/2014
18
TAVOLA PERIODICA (2005)
17/01/2014
19
La Tavola Periodica può essere suddivisa in modo
approssimativo in due parti, la linea più scura
tracciata tra il Boro (elemento n° 5) e l’Attinio (n° 85)
separa gli elementi in due gruppi:
– quelli a sinistra della linea sono (molto genericamente)
i metalli
– quelli che stanno a destra sono (sempre in prima
approssimazione) i non metalli.
Il carattere metallico è più netto negli elementi a
sinistra e tende a diminuire mano a mano che ci si
sposta a destra.
17/01/2014
20
Gli elementi elencati nella prima colonna a
sinistra (gruppo IA), rappresentano i metalli del
PRIMO GRUPPO o METALLI ALCALINI,
sono tutti caratterizzati dalla presenza di un
solo elettrone nell’orbitale più esterno,
elettrone che con estrema facilità viene perduto
con la trasformazione di un atomo nel
corrispondente ione positivo.
L’atomo di Sodio (Na) si trasforma nello ione
Sodio (Na+), l’atomo di Litio in ione Litio (Li+) e
così via.
17/01/2014
21
Gli elementi elencati nella seconda colonna
(gruppo IIA), rappresentano i metalli del
SECONDO GRUPPO o METALLI ALCALINOTERROSI.
Sono caratterizzati dalla presenza di 2 elettroni
nell’orbitale più esterno
elettroni che possono essere perduti con
formazione dei corrispondenti ioni positivi.
L’atomo di Calcio si trasforma nello ione Calcio
(Ca2+), l’atomo di magnesio nello ione
Magnesio (Mg2+) e così via.
17/01/2014
22
Gli elementi del GRUPPO IIIA, hanno 3 elettroni
nell’ultimo strato,due localizzati nell’orbitale s ed
uno nell’ orbitale p corrispondente.
Hanno comportamenti diversi, nel senso che:
– il Boro si comporta sostanzialmente da non-metallo,
– l’Alluminio può dare origine a composti nei quali si
comporta da non-metallo (alluminati) ed ad altri in
cui si comporta da metallo (sali di alluminio),
– gli altri elementi hanno caratteri metallici via via
crescenti dall’alto verso il basso
17/01/2014
Il Boro viene anche classificato come metalloide
23
TAVOLA PERIODICA (2005)
17/01/2014
24
Diverso ancora è il comportamento degli elementi
del IV GRUPPO A.
Questi elementi hanno 4 elettroni nell’ultimo
strato, per cui, per raggiungere la configurazione
otteziale, possono acquistare 4 elettroni oppure
perderne 4.
Il carbonio ed il silicio, proprio in virtù di questa
particolare configurazione, possono dare origine:
– sia a composti quali i carbonati ed i silicati, nei quali si
comportano da non metalli,
– sia originare lunghe catena di atomi di carbonio (come
negli idrocarburi) o di silicio (come nei siliconi).
17/01/2014
Silicio e Germanio vengono classificati metalloidi
25
TAVOLA PERIODICA (2005)
17/01/2014
26
Discorso ancora diverso deve essere fatto per gli
elementi che costituiscono il GRUPPO VA
avendo 5 elettroni negli orbitali esterni, tendono ad
acquistare 3 elettroni, trasformandosi nei
corrispondenti ioni negativi
– Azoto e Fosforo si comportano da non-metalli tipici
– Arsenico e Antimonio sono considerati metalloidi
– Azoto, Fosforo, Arsenico, formano gli acidi ed i sali
corrispondenti (nitrati, fosfati, arseniati) ma reagiscono con
H2 formando NH3, PH3, AsH3
– Antimonio forma SbH3, ma non origina acidi, forma sali
(SbCl3, Sb2S3)
– Bismuto ha caratteristiche metalliche
17/01/2014
27
TAVOLA PERIODICA (2005)
17/01/2014
28
Comportamento analogo è quello degli
elementi del GRUPPO VIA che hanno 6
elettroni nell’ ultimo strato
tendono ad acquistare 2 elettroni, (l’atomo di O
si trasforma nello ione O2—, ecc.)
– L’Ossigeno, lo Zolfo ed il Selenio si comportano da
non-metalli
– Tellurio e Polonio sono classificati anche come
metalloidi
17/01/2014
29
TAVOLA PERIODICA (2005)
17/01/2014
30
gli elementi DEL GRUPPO VIIA hanno 7 elettroni
nell’ ultimo strato e tendono ad acquisirne 1
(l’atomo di Cl origina lo ione Cl—, l’atomo di Br
origina lo ione Br—, ecc)
Vengono indicati con il nome di alogeni poiché
originano una grande quantità di composti
Si comportano come dei non-metalli
Reagiscono con l’O2 e con H2
17/01/2014
Nel gruppo o (VIIIA) sono elencati i GAS NOBILI
31
Questi comportamenti, apparentemente
contrastanti, sono dovuti alla necessità, per tutti
gli atomi, di giungere alla cosiddetta
configurazione otteziale
ossia disporre di 8 elettroni nello strato più
esterno, esattamente come avviene per gli
elementi elencati nella colonna indicata 0 (VIIIA),
ossia i GAS NOBILI, così chiamati poiché sono
caratterizzati dalla quasi incapacità di reagire con
altri elementi e originare composti.
17/01/2014
32
Da notare che la configurazione otteziale
(8 elettroni nello strato più esterno)
corrisponde al riempimento di
un orbitale s e di 3 orbitali p
per questo motivo la situazione dei gas nobili può
essere così schematizzata:
17/01/2014
33
Potenziale o Energia di ionizzazione (EI)
Energia che si deve spendere per allontanare un elettrone da un
atomo isolato per produrre uno ione positivo
Da un idea della forza con cui un atomo trattiene i propri elettroni
17/01/2014
34
Affinità elettronica (AE)
Energia che viene guadagnata quando si addiziona un elettrone
ad un atomo per formare uno ione negativo
Tendenza che ha l’atomo a trattenere i suoi elettroni e ad acquistarne altri
Stesso andamento di EI
Misura: quantità di energia che viene liberata quando un
elettrone viene aggiunto ad un atomo
17/01/2014
35
Raggio atomico
Dipende dalla forza di attrazione fra nucleo ed elettroni
Aumenta: scendendo lungo un gruppo
Diminuisce: andando verso destra lungo un periodo
17/01/2014
36
Raggio atomico
17/01/2014
37
Il fenomeno della radioattività è legato alla costituzione del
nucleo di un certo isotopo.
Più precisamente dipende dal rapporto che esiste tra
numero atomico (Z) e numero di protoni (N)
Se i neutroni sono in numero molto minore o molto
superiore al numero dei protoni, il nucleo di quell’atomo
diviene instabile.
Non solo, ma gli isotopi con numero pari di protoni sono più
stabili di quelli con numero dispari.
La radioattività può essere ulteriormente distinta in:
– Radioattività naturale
– Radioattività indotta
17/01/2014
38
La radioattività naturale deriva dalla emissione di
particelle da parte di nuclei instabili
E’ presente in natura per alcuni isotopi con numero
atomico superiore a 82
L’emissione di particelle è spontanea ed è conseguenza
della ricerca di un assetto nucleare più stabile.
E’ sempre accompagnata da eventi termici, la cui entità
dipende dalla velocità con cui si realizza l’evento.
La radioattività indotta si realizza quando un nuclide, sia
stabile che instabile, venga bombardato con particelle
elementari o nuclei leggeri.
17/01/2014
39
17/01/2014
40
Caratteristiche delle particelle coinvolte nelle
principali reazioni nucleari
17/01/2014
41
17/01/2014
42
Tipo di emissione
Raggi alfa
Raggi beta
Raggi gamma
Raggi X
Neutroni liberi
17/01/2014
Particella
4
2He
Distanza percorsa in aria
circa 6-7 cm
elettroni (beta−) e positroni
circa 5-7 metri
(beta+)
fotoni provenienti dal
nucleo (onde
elettromagnetiche)
statistica, qualche km
fotoni provenienti dagli
orbitali elettronici
statistica, qualche km
(soprattutto K): onde
elettromagnetiche
neutroni
statistica, da 30 a 300 m
43
Decadimento alfa
Il decadimento alfa avviene in accordo con
la legge di conservazione della massa/energia
con l'emissione di una particella, detta appunto particella alfa,
composta da due protoni e due neutroni (nucleo di He) da parte
dell’isotopo di un elemento con elevato numero atomico (Z>83)
Perdendo due protoni l'elemento indietreggia di due posizioni
nella Tavola Periodica degli Elementi ovvero il numero atomico
passa da Z a Z-2
17/01/2014
44
17/01/2014
La vita media tipica di questo tipo di decadimento nucleare
è abbastanza varia: si passa, infatti dagli oltre 1010 anni
del Torio, fino alle frazioni di secondo come nel Polonio 214
(1.6 x 10-4 s).
Il decadimento più noto è, però, quello dell‘ Uranio:
dove α sta per il nucleo di Elio prodotto, più noto come
particella α
Altro esempio può essere fornito dalla reazione:
45
17/01/2014
I raggi , a causa della loro carica elettrica,
interagiscono fortemente con la materia e quindi
vengono facilmente assorbiti dai materiali e possono
viaggiare solo per pochi centimetri nell‘aria.
Possono essere assorbiti dagli strati più esterni della
pelle umana e così generalmente non sono molto
pericolosi per la vita a meno che la sorgente non
venga inalata o ingerita.
In questo caso i danni sarebbero invece maggiori di
quelli causati da qualsiasi altra radiazione ionizzante.
Se il dosaggio fosse elevato comparirebbero tutti i
sintomi tipici dell‘ avvelenamento da radiazione.
46
Decadimento beta
La
radiazione beta è una forma di
Radiazione Ionizzante emessa da
alcuni tipi di nuclei radioattivi come il Co60.
Assume la forma di particelle beta (β), elettroni ad alta
energia, espulsi dal nucleo atomico in un processo
conosciuto come decadimento beta.
Nel decadimento β−, un neutrone viene convertito in un
protone, un elettrone e un antineutrino elettronico
(l‘antiparticella del neutrino):
17/01/2014
47
Un isotopo ¯ emittente subisce quindi una
trasformazione caratterizzata:
– dall’aumentare del numero atomico che passa da Z a
Z+1
– dal mantenere costante il numero di massa
– In altre parole l’isotopo emittente si trasforma in un
suo isobaro
17/01/2014
48
Nel
decadimento β+ (osservabile in nuclei ricchi di protoni),
un protone interagisce con un antineutrino elettronico per
dare un neutrone e un positrone (il decadimento diretto del
protone in positrone non è stato ancora osservato):
L’ isotopo + emittente subisce una trasformazione che è
caratterizzata
– dalla diminuzione del numero atomico da Z a Z-1
– e, anche in questo caso, dal mantenere costante il
numero di massa
trasformandosi
Si
ancora in un isobaro
17/01/2014
49
17/01/2014
L’ interazione delle particelle con la materia
ha generalmente un raggio d'azione dieci volte
superiore, e un potere ionizzante pari a un
decimo rispetto all'interazione delle particelle α.
Vengono bloccate completamente da pochi
millimetri di alluminio
50
Decadimento gamma
17/01/2014
I raggi gamma (raggi ) sono una
forma di
radiazione elettromagnetica prodotta
dal cosiddetto decadimento gamma
o da processi nucleari o subatomici consistenti nella
emissione di fotoni ad alta energia
I raggi sono più penetranti delle radiazioni particellari
prodotte sia dal decadimento che dal decadimento ,
a causa della minor tendenza ad interagire con la
materia essendo dei fotoni, ma sono meno ionizzanti
51
I raggi si distinguono dai raggi X per la loro origine: i
raggi sono prodotti da transizioni nucleari o comunque
subatomiche, mentre i raggi X sono prodotti da transizioni
dovute ad elettroni in rapido spostamento sui loro livelli
energetici quantizzati
Poiché è possibile per alcune transizioni elettroniche
superare le energie di alcune transizioni nucleari, i raggi X
più energetici si sovrappongono ai raggi più deboli
Uno schermo per raggi γ richiede una massa notevole.
Per ridurre del 50% l'intensità dei raggi occorreuno
spessore di 1 cm di piombo, 6 cm di cemento o 9 cm di
materiale pressato
17/01/2014
52
17/01/2014
Raggi sono spesso prodotti insieme ad altre forme
di radiazione come quella e .
Quando un nucleo emette una particella o il
nucleo risultante si trova a volte in uno stato eccitato.
Può passare ad un livello energetico più stabile
emettendo un fotone gamma, nello stesso modo in cui
un elettrone può passare ad un livello più basso
emettendo un fotone ottico.
53
Raggi , raggi X, luce visibile e radiazione ultravioletta
sono tutte forme di radiazione elettromagnetica, l'unica
differenza è la frequenza e quindi l’ energia dei fotoni.
I raggi gamma sono i più energetici.
Ecco un esempio di generazione di raggi gamma:
– un nucleo di Co60 decade a Ni60 eccitato mediante
decadimento
– il Ni60 passa al suo stato di energia minima emettendo
un raggio gamma:
17/01/2014
54
A questa prima classificazione, in seguito a ulteriori
investigazioni sul fenomeno, si sono aggiunte:
L’emissione di neutroni
L’emissione di protoni
La fissione spontanea
17/01/2014
55
Il decadimento di un nuclide dipende esclusivamente dalla
sua instabilità ed il numero di nuclei che si disintegrano
nell’unità di tempo è proporzionale al numero dei nuclei
radioattivi presenti
Il decadimento segue una cinetica di 1° ordine, per cui se
k indica la costante di velocità ed N il numero di nuclei
instabili presenti al tempo t, la velocità di decadimento
sarà:
V = dN = k N
dt
K rappresenta la frazione dell’isotopo radioattivo che decade
nell’unità di tempo
17/01/2014
56
Per caratterizzare il decadimento di un certo isotopo,
generalmente si indica il tempo di dimezzamento,
ossia il tempo necessario per dimezzare il numero dei
nuclei instabili presenti in un certo sistema
Il tempo di dimezzamento si ottiene dalla equazione
V = dN/dt = kN, che integrata tra No e N diviene:
ln No/N = kt
Se poniamo N = No/2 e t = t½, l’espressione diviene:
No
ln
= k t½
No/2
17/01/2014
57
No
ln
= k t½
No/2
Passando dai logaritmi naturali a quelli decimali:
k t½
2.303
log 2 =
risolvendo per il tempo, avremo:
t½
17/01/2014
= 2.303
k
log 2
t½ = 0.693 / k
58
17/01/2014
59
17/01/2014
60