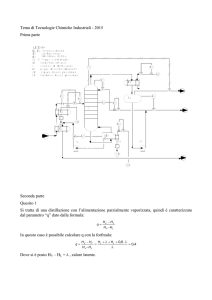
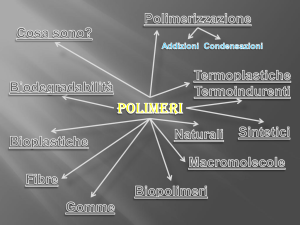
MATERIALI POLIMERICI
G. Carotenuto
Istituto per la Tecnologia dei Materiali Compositi. Consiglio Nazionale delle Ricerche. Piazzale
Tecchio, 80 - 80125 - NAPOLI
1. DEFINIZIONI FONDAMENTALI DELLA CHIMICA MACROMOLECOLARE
Le macromolecole o polimeri sono composti organici di sintesi caratterizzati dal possedere un
elevata massa molecolare, per la quale vengono, più appropriatamente, denominati alti polimeri;
esse si presentano costituzionalmente realizzate dalla ripetizione periodica di una unità strutturale,
di varia complessità, ordinariamente definita unità ripetente. Il termine polimero deriva dalle
parole greche: poli=molto e mera=parte in modo da indicare appunto una sostanza
strutturalmente composta da molte unità fondamentali ripetute identicamente nella molecola. Va
osservato che la parola polimero viene tuttavia frequentemente utilizzata in chimica, non soltanto
per indicare i materiali plastici, ma anche in riferimento a composti inorganici oligomerici,
molecole organiche naturali (polisaccaridi, silani, polisolfuri), sostanze di origine biologica
(polinucleotidi, polipeptidi), ed altro. La molecola a partire dalla quale il polimero viene preparato
e da cui l'unità ripetente risulta derivata, viene chiamata monomero o unità monomerica, mentre
polimerizzazione é la reazione chimica che porta alla sua costituzione. E' di solito necessario,
come regola pratica, avere approssimativamente la ripetizione di almeno un migliaio di unità
prima di poter ottenere un polimero con le caratteristiche proprietà plastiche di una resina
sintetica. Un caso estremo é rappresentato dal polimero dell'etilene a cui necessita raggiungere un
peso molecolare di almeno un milione prima di poter cominciare a mostrare le proprietà fisiche
che noi gli conosciamo, quando lo utilizziamo in forma di bottiglie, contenitori ed altro; all'altro
estremo c'é, invece, il nylon, un prodotto tessile di largo utilizzo, le cui caratteristiche proprietà
fisiche si evidenziano già con un peso molecolare di appena 50.000 u.m.a.. Ciò é dovuto
ovviamente all'entità delle interazioni di non legame che si istaurano tra le macromolecole, che, nel
primo caso, risultano molto deboli, poiché consistenti esclusivamente in labili forze di van der
Waals, mentre nel secondo caso sono di notevole intensità in quanto legami a ponte d'idrogeno.
Una molecola organica per poter portare alla formazione di un polimero deve possedere almeno
due siti reattivi, il suo numero ne definisce la funzionalità; gli amminoacidi, gli idrossiacidi ed
anche i monomeri vinilici, che, per rottura del legame π, sono in grado di costituire due legami σ,
sono, ad esempio, monomeri bifunzionali, ma sono altrettanto utilizzate unità monomeriche
polifunzionali. Quando la polimerizzazione non avviene con eliminazione di molecole piccole
l'unità monomerica si identifica esattamente con l'unità ripetente, altrimenti le loro formule
differiscono per soli pochi atomi. Il numero di unità ripetenti per macromolecola viene indicato
come grado di polimerizzazione. La massa molecolare del polimero é ottenibile dal prodotto
del peso dell'unità ripetente per il grado di polimerizzazione. Le reazioni per la sintesi dei
polimeri non consentono in genere di ottenere macromolecole identiche, cioé aventi tutte il
medesimo grado di polimerizzazione, ma risultano recuperabili a fine sintesi solo miscele di
molecole variamente dimensionate. Il materiale polimerico così costituito é detto polidisperso,
mentre la porzione di macromolecole con simili dimensioni ricavabile da un campione
polidisperso, a mezzo di opportune tecniche di frazionamento, é definita polimero omodisperso.
A seconda del tipo di polimerizzazione le macromolecole prodotte possono risultare lineari se il
loro sviluppo avviene in una unica direzione o reticolate se risultano strutturalmente
tridimensionali, tale reticolo tridimensionale é noto come network mentre crosslink vengono detti
i legami trasversali in esso intercorrenti. Un polimero lineare se opportunamente funzionalizzato
lungo la catena può, mediante reazioni chimiche, essere convertito in un network tridimensionale.
Ne é un esempio, di rilevante importanza, il processo di vulcanizzazione della gomma in cui é
coinvolta la formazione di legami incrociati fra catene polimeriche insature per addizione
radicalica di zolfo elementare ai doppi legami carbonio-carbonio. La natura delle unità strutturali
disposte all'estremità della catena polimerica differisce significativamente da quella dell'unità
ripetente in quanto esse o contengono funzionali irreagiti o sono derivanti da unità
monofunzionali occasionalmente presenti o volutamente aggiunte durante la reazione e vengono
pertanto chiamati terminali di catena. Le macromolecole costituite da unità strutturali tutte
uguali sono indicate come omopolimeri, esse sono generalmente ottenute per polimerizzazione
di un unico monomero. Quando invece due o più unità strutturali differenti sono presenti nella
macromolecole per incorporamento di diversi monomeri si ricorre ai termini copolimero,
terpolimero, ecc.; mentre copolimerizzazione, terpolimerizzazione, ecc. sono le rispettive reazioni
di sintesi. Illustriamo le diverse possibili situazioni strutturali che risultano praticamente
realizzabili, nel caso semplice dei copolimeri cioé, i prodotti della contemporanea
polimerizzazione di due soli monomeri differenti. Quando i due monomeri entrano in catena in
maniera più o meno casuale si parla di copolimero statistico, se invece le due unità
monomeriche si alternano regolarmente lungo la catena polimerica si ottiene un copolimero
alternato, se poi lunghe sequenze di uno dei due monomeri (dette blocchi) sono unite a quelle
dell'altro monomero ciò che ne risulta é un copolimero a blocchi e infine se su una catena
principale formata da una determinata unità ripetitiva si innestano catene laterali (ramificazioni)
costituite dal solo altro monomero, si ottiene un copolimero ad innesto o aggraffato. I
copolimeri spesso presentano proprietà intermedie tra quelle dei polimeri delle singole unità
monomeriche utilizzate. Le percentuali dei due monomeri nella catena del copolimero possono
dipendere da parecchi fattori; le concentrazioni iniziali dei due monomeri, la capacità reattiva di un
monomero rispetto all'altro, la temperatura e la natura del mezzo solvente, costituiscono i
parametri più determinanti.
Potendo la struttura dei polimeri risultare sia lineare che tridimensionalmente reticolata le
macromolecole presenteranno differenti caratteristiche chimico-fisiche ; i primi vengono indicati
con il nome di termoplastici in quanto per azione del calore o di plastificanti o, anche, di
solventi é possibile allontanare tra loro le singole catene lineari disgiunte fino a farle
rispettivamente fondere, rammollire o disciogliere; i polimeri reticolati formano invece le resine
termoindurenti così chiamate in quanto una volta assunta la configurazione tridimensionale non
sono più plastificabili dal calore e non possono più essere portate in soluzione mediante liquidi
solventi o plastificanti. In altre parole un materiale termoplastico può essere rifuso molte volte
senza modificazione alcuna della sua natura, mentre un materiale termoindurente o termostabile
sottostà ad una modificazione permanente (cioé una trasformazione chimica) se viene portato a
fusione e quindi, solidificando, porta ad un rigido e fragile reticolo tridimensionale che non può
più tornare a fondere. L'ampissima varietà di reazioni disponibili per la preparazione degli alti
polimeri possono essere ricondotte a due classi principali: la policondensazione e la
poliaddizione.
I polimeri di addizione sono quelle macromolecole nelle quali la formula chimica dell'unità
ripetente é identica a quella del monomero utilizzato, ad esempio: il polipropilene (C3 H6 )n ,
materiale di ampio impiego, é un polimero di addizione ottenuto a partire dal propilene, olefina di
formula C3 H6 . I polimeri di condensazione sono composti in cui la formula chimica dell'unità
ripetente contiene un numero di atomi inferiore a quello del monomero, o dei monomeri di
partenza. La classificazione dei prodotti di polimerizzazione in polimeri di poliaddizione e
polimeri di policondensazione fu proposta da Carothers nel 1926. Una classificazione più recente
é fondata invece sul meccanismo di crescita delle macromolecole e distingue i processi di
polimerizzazione in polimerizzazione a catena ed in polimerizzazione a stadi. Le
polimerizzazioni a catena si svolgono con un meccanismo del tutto simile alle reazioni a catena
tipiche delle sostanze a basso peso molecolare, con l'unica peculiarità che la catena cinetica é in
questo caso costituita dalla molecola del polimero che si sta formando. Si tratta in genere di
reazioni veloci che procedono attraverso la formazione di un centro attivo su cui avvengono le
successive addizioni ripetute di monomero nel corso della fase di propagazione della catena. Le
polimerizzazioni a stadi sono invece processi nei quali sono coinvolti in genere monomeri
opportunamente funzionalizzati che reagiscono dando luogo a prodotti di peso molecolare
crescente, che possedendo i medesimi gruppi funzionali presenti sulle molecole di monomero di
partenza, nel decorso della reazione possono determinare con uguale probabilità sia interazioni
monomero-monomero che interazioni monomero-polimero. Questa classificazione consente di
raggruppare opportunamente tutte le reazioni di polimerizzazione conosciute e di meglio
classificarne i rispettivi prodotti.
Le caratteristiche fisiche del materiale ottenuto da una reazione di polimerizzazione sono
strettamente correlate al tipo di interazione chimica di non legame che si istaura tra le singole
macromolecole. Questa, a parte dalla specifica natura dell'interazione, dipende strettamente dal
grado di regolarità configurazionale e conformazionale delle catene polimeriche. Ciò in quanto
soltanto una elevata regolarità di struttura consente l'inpacchettamento compatto delle catene
polimeriche interagenti con la possibilità d'instaurare forti interazioni di non legame. I polimeri di
sintesi possono essere dalla struttura o totalmente irregolare o in buona parte regolare.
I polimeri strutturalmente irregolari non hanno la possibilità di cristallizzare e pertanto
rimangono allo stato amorfo anche portandoli alle basse temperature. La mobilità delle catene
polimeriche può tuttavia variare significativamente con la temperatura. In tali polimeri si osserva la
presenza di una temperatura caratteristica nota come temperatura di transizione vetrosa ed
indicata con il simbolo Tg . Questa é assimilabile ad una transizione del secondo ordine
accompagnata tuttavia non da una variazione del volume specifico ma solo da una variazione della
derivata del volume specifico rispetto alla temperatura ovvero dalla variazione della pendenza della
curva volume specifico v.s. temperatura. Sopra tale temperatura é possibile lo scorrimento delle
macromolecole e pertanto il polimero si presenta morbido e flessibile e mostra il fenomeno della
risposta elastica ritardata, nota come viscoelasticità, sotto invece il polimero si presenta duro,
rigido ed estremamente fragile. Più la temperatura viene elevata al di sopra della Tg più lo
scorrimento che ne risulta é facilitato fino al punto di avere un materiale praticamente liquido.
Se il polimero presenta regolarità nella struttura, abbassando la temperatura dal fuso i
movimenti delle macromolecole, che sono, nel fuso, particolarmente ampi per la loro elevata
energia cinetica, divengono sempre più limitati, finché, al di sotto di una certa temperatura si può
verificare la cristallizzazione. La cristallizzazione dei polimeri é un fenomeno complesso ed il
materiale non diviene mai completamente cristallino come si verifica invece con i solidi ordinari.
La parte cristallina é costituita da domini discontinui di differenti dimensioni e grado di purezza
dette cristalliti. Per la differente energia libera delle cristalliti che deriva dalla diversa estensione
superficiale (e quindi energia libera superficiale) il passaggio dallo stato cristallino allo stato fuso
non avviene mai ad una temperatura netta, ma piuttosto in un intervallo più o meno ampio di
temperature. Sotto la temperatura di fusione un polimero anche soltanto parzialmente cristallino si
presenta duro, rigido e molto fragile. Lo sviluppo di un particolare metodo di polimerizzazione: la
poliinserzione, ha consentito la preparazione per sintesi di macromolecole con un elevato grado
di regolarità strutturale che consente loro di cristallizzare abbondantemente in modo da ottenere
materiali plastici altamente cristallini e quindi dalle proprietà meccaniche particolarmente
interessanti.
2. POLICONDENSAZIONE
Per la realizzazione di alti polimeri é evidentemente necessario legare insieme, mediante
apposite reazioni chimiche, in grado di determinare la formazione di stabili legami covalenti, un
gran numero di molecole organiche ed affinché ciò risulti possibile occorre che le molecole che
partecipano alla reazione siano munite di almeno due posizioni reattive. Se facciamo difatti
reagire l'alcool metilico con l'acido acetico (entrambe molecole con una unica posizione reattiva),
o anche l'alcool metilico (una funzione reattiva) con l'acido adipico (due funzioni reattive), in
presenza di un catalizzatore acido, otteniamo dei prodotti di condensazione (noti come esteri)
semplici ed incapaci di reagire ulteriormente tra loro; la reazione é di equilibrio ed é nota come
esterificazione di Fischer:
CH3 -OH + CH 3 COOH
2 CH3 -OH + HOOC-CH2 4 -COOH
→
←
→
←
CH 3COOCH3 + H2 O
CH 3 OOC- CH2 4 -COOCH3 + 2 H2 O
(2.1)
(2.2)
Se però anche l'alcool contiene due funzioni reattive (si tratta cioé di un glicole) é possibile
ottenere la costituzione di un polimero lineare in quanto l'estere, una volta prodotto, é ancora in
grado di reagire con un altra molecola di acido e poi, di nuovo, con altro glicole e così via di
seguito, in modo da realizzare oligomeri di dimensioni via via crescenti, secondo lo schema
seguente:
A
+G
→
GA
+G
→ GAG
+A
→ GAGA
(2.3)
(ove si é indicato con G il glicole e con A l'acido dicarbossilico) e ciò si ripete un grandissimo
numero di volte, venendosi così via via a costituire un alto polimero, e, in questo particolare caso,
un poliestere lineare.
.......
GAGAGAGAGAGA
......
(2.4)
Quindi ogni qual volta che un monomero bifunzionale reagisce chimicamente con un altro
altrettanto funzionalizzato sarà possibile generare una serie infinita di reazioni elementari che
danno luogo ad oligomeri con massa molecolare crescente, contenenti ancora le funzionalità
necessarie per il proseguimento della reazione, purché venga rigorosamente rispettato il rapporto
stechiometrico tra i funzionali dei due reagenti .
Se si pensa all'elevato numero di reazioni organiche che, permettendo la formazione di stabili
legami covalenti, ben si prestano alla preparazione di macromolecole ed alla varietà di composti
chimici che, per ciascuno degli schemi sintetici utilizzabili, possono essere fatte reagire, si può
capire di quale ampiezza sia la gamma delle materie plastiche sintetiche ottenibili per lo meno in
laboratorio.
Se il monomero contiene entrambi i tipi di gruppi funzionali reattivi, le macromolecole
risultanti conterranno una sola unità strutturale. Ad esempio la condensazione intermolecolare
dell'acido lattico genererà una catena polimerica lineare, in cui é la sola unità strutturale esterea a
ripetersi periodicamente lungo la macromolecola. Analoga situazione si avrà nella
policondensazione di un amminoacido.
Nella tabella seguente vengono riportati solo alcuni dei principali tipi di polimeri ottenibili per
polimerizzazione a stadi, con indicazione del tipo di monomero polimerizzabile e dell'unità
ripetente che ne consegue.
POLIMERO
UNITA' RIPETENTE
MONOMERO
-NH-R-NH-CO-R'-CO-
NH 2 -R-NH 2 , ClOC-R'-COCl
-Ar-O-CO-O-
HO-Ar-OH, COCl2
Poliesteri
-R-O-CO-R'-CO-O-
HO-R-OH, HOOC-R'-COOH
Polieteri
-Ar-O-
Ar-OH
-O-SiR2 -
HO-SiR 2 -OH
Polisolfoni
-Ar-SO2 -Ar-
Polisolfuri
-Ar-S-
Cl-Ar-Cl, K+- O-SO 2 -O-K+
Br-C6 H4 -SH
-NH-R'-NH-CO-NH-R-NH-CO-
O=C=N-R-N=C=O, NH2 -R'-NH 2
-O-R'-O-CO-NH-R-NH-CO-
O=C=N-R-N=C=O, HO-R'-OH
-Ar-CH2 -
C6 H5 -OH, H-CHO
-NH-CO-NH-CH2 -
H-CHO, NH 2 -CO-NH2
Poliammidi
Policarbonati
Polisilossani
Poliuree
Poliuretani
Fenolo-Formaldeide
Urea-Formaldeide
Tab.2.1 Unità strutturale e monomero dei principali polimeri di condensazione.
Le reazioni di polimerizzazione possono venire raggruppate in tre classi:
- Reazioni concernenti il gruppo carbonilico, da cui si originano: i poliesteri, le poliammidi, i
poliuretani, le poliuree, la resina fenolo-formaldeide, ecc.
- Reazioni di sostituzione nucleofila, da cui si originano: i polieteri, i polisolfuri, i polisolfoni,
ecc.
- Reazioni di sostituzione elettrofila, da cui si originano: i polibenzili, le resine fenoloformaldeide, ecc.
La condensazione intermolecolare di monomeri bifunzionali porta alla formazione di polimeri
lineari; la bifunzionalità costituisce pertanto un requisito indispensabile e la presenza occasionale
di impurezze monofunzionali (per lo più sottoprodotti della sintesi del monomero) può
determinare molto presto l'arresto della crescita delle catene polimeriche. Purtroppo la presenza di
impurezze monofunzionali non costituisce l'unico inconveniente della reazione di
polimerizzazione a stadi in quanto un problema ulteriore é rappresentato dalla formazione di
composti ciclici che consegue alla condensazione intramolecolare dei funzionali reattivi. Infatti,
nel caso di un monomero contenente nella stessa molecola entrambe le funzionalità reattive, si
può verificare una reazione intramolecolare che genera composti ciclici non suscettibili di ulteriori
reazioni di accrescimento della catena. Analoghe ciclizzazioni possono avvenire
intermolecolarmente, tra molecole di monomeri bifunzionali per generare strutture cicliche di
maggiori dimensioni. In pratica le due reazioni competitive si verificano sempre nel corso di un
processo di polimerizzazione a stadi, tuttavia la scelta delle condizioni sperimentali, dei monomeri
di partenza, di eventuali catalizzatori selettivi e la stereochimica della struttura risultante, possono
indirizzare prevalentemente la reazione in un senso o nell'altro.
3. POLIADDIZIONE
La seconda classe di macromolecole é costituita dai polimeri d'addizione che vengono di solito
preparati a partire da derivati vinilici o comunque monomeri olefinici; cioé molecole contenenti
uno o più insaturazioni. Tali reazioni di polimerizzazione possono realizzarsi con un meccanismo
anionico, cationico, radicalico o mediante poliinserzione in un legame organo-metallico covalente.
La polimerizzazione di un alchene o di un suo derivato viene definita vinilica e può essere
riassunta mediante il seguente schema sintetico:
X-Y
+
C
C
X
C
C
Y
n
(3.1)
Il reagente X-Y é una specie chimica in grado di promuovere, secondo maniere diverse, la
combinazione di un elevato numero di unità monomeriche fino a portare alla formazione dell'alto
polimero. Esso può funzionare da vero e proprio catalizzatore ed allora si rigenera continuamente
al termine del processo di crescita di ciascuna delle catene polimeriche, oppure può restare
incorporato all'inizio ed alla fine della macromolecola, come nello schema sopra riportato, per
quindi consumarsi gradualmente nel corso della reazione. La polimerizzazione degli alcheni
costituisce una tipica reazione di poliaddizione. In essa si verifica la somma di una specie
iniziatrice di catena (precursore del centro attivo) ad una molecola di alchene, in maniera tale da
generare un intermedio altamente reattivo, ma stabilizzato per risonanza, che, nel corso della sua
vita, porta poi ad una successiva rapida addizione di numerose altre molecole di monomero
(stadio detto di propagazione). Lo stadio di propagazione e quindi la polimerizzazione ha termine
con l'arresto della crescita della catena polimerica (terminazione) cosa che avviene o quando una
specie reattiva si attacca alla parte terminale in sviluppo della catena, o quando questa espelle una
specie di piccole dimensioni (reazione detta di β-eliminazione). L'esatto meccanismo in gioco
nella polimerizzazione vinilica e la natura chimica del centro attivo portatore della catena cinetica
dipendono dal particolare tipo di catalizzatore che viene utilizzato per iniziare la reazione.
Vengono qui di seguito descritte, analizzandole in alcuni dettagli, i quattro principali meccanismi
di polimerizzazione a catena ed i rispettivi metodi utilizzati per la loro realizzazione pratica.
3.1. Polimerizzazione radicalica
La polimerizzazione radicalica risulta attualmente la tecnica di maggiore uso per la
preparazione su scala industriale di polimeri vinilici.
La reazione si svolge secondo un meccanismo a catena in cui i centri attivi, cioè i portatori della
catena cinetica, sono radicali liberi al carbonio. Un radicale libero é un frammento molecolare che
si può considerare originato per scissione omolitica di un legame covalente, ed in cui l'elettrone
spaiato, che ne risulta, non prende parte ad alcun tipo di interazione chimica; nei radicali al
carbonio l'elettrone spaiato risiede nell'orbitale 2pz ortogonale al piano dei tre orbitali ibridi 2sp2 .
Perquanto stabilizzati, altrimenti ne risulterebbe estremamente sfavorita la formazione, la presenza
dell'elettrone spaiato fà si che tali radicali risultino comunque specie altamente reattive e quindi, in
grado di addizionarsi con estrema faciltà ai legami multipli di molecole insature. Il processo di
polimerizzazione per via radicalica é appunto fondato su tale tipo di reazione.
Il meccanismo della reazione di polimerizzazione prevede i seguenti stadi cinetici fondamentali:
inizio della catena, stadio in cui si verifica prima la formazione di radicali liberi primari, che
risultando per questo altamente reattivi, sommano istantaneamente una molecola insatura di
monomero originando radicali di maggiore stabilità: i centri attivi della reazione di
polimerizzazione; propagazione o crescita della catena, consistente nell'addizione successiva
di singole unità monomeriche al centro attivo, tramite il susseguirsi di rapide reazioni elementari;
terminazione della catena, consistente nella formazione di un polimero inattivo per la
scomparsa del radicale libero ed infine trasferimento del centro attivo, in cui la macromolecola
cessa di crescrere in quanto il proprio elettrone spaiato passa o su un'altra macromolecola o su
una molecola di monomero. L'intero meccanismo di reazione risulta pertanto così
schematizzabile:
Inizio:
I stadio:
I→ 2 R
II stadio:
R
.
+M
.
.
→ P1
Propagazione:
.
.
P1 + M → P2
.
P2
.
.
.
Pi
Terminazione:
+M
.
→ P3
. . . .
. . . .
+M
.
→ Pi+1
.
.
Pn + Pm → P(n+m)
Trasferimento:
trasferimento:
.
Pn + A-B → PnA + B
.
ri-inizio:
.
.
B + M → P1
.
Dove I é la molecola organica di iniziatore, R il radicale primario originatosi per
.
decomposizione dell'iniziatore, M l'unità monomerica, Pi la catena polimerica ed A-B la molecola
del trasferitore di catena.
Analizziamo ora in maggiore dettaglio i singoli stadi del processo di polimerizzazione. Lo
stadio d'inizio consiste in due distinti processi elementari: nel primo si ha la produzione di
radicali primari, nel secondo, vero e proprio stadio d'inizio, si verifica, per interazione di tali
radicali con una molecola di monomero, la formazione del centro attivo della catena cinetica. I
radicali primari possono essere originati in molti modi diversi; quella a cui più frequentemente si
ricorre é la dissociazione termica o fotochimica (tramite radiazione UV) di legami relativamente
deboli, appartenenti a sostanze, chiamate iniziatori, che vengono appositamente aggiunte al
sistema e che consistono generalmente in perossidi (organici o inorganici), idroperossidi, azo e
diazocomposti, disolfuri, ecc.. L'inizio termico é di gran lunga quello più utilizzato tuttavia la
polimerizzazione fotoiniziata può spesso risultare di grande utilità in quanto consente di eseguire
polimerizzazioni anche a basse temperature.
Lo stesso monomero, quando include sostituendi in grado di stabilizzare l'elettrone spaiato sul
carbonio (stirene, metilmetacrilato, ecc.), può per via termica, a temperature elevate, originare
radicali liberi o, come accade per i monomeri dienici, é sufficiente la presenza di solo ossigeno
gassoso, il quale sommandosi alle insaturazioni produce organoperossidi che poi,
decomponendosi, sono in grado di iniziare la polimerizzazione. Radiazioni ionizzanti (raggi X,
radiazioni γ) e fasci di particelle (elettroni e neutroni) pure possono essere convenientemente
utilizzate a tale scopo. Va infine evidenziata la possibilità di generare radicali liberi per via
elettrolitica, operando generalmente in soluzione acquosa. Per l'ottenimento di una apprezzabile
quantità di radicali liberi primari la reazione deve essere accompagnata dalla formazione di specie
volatili in grado di sottrarsi dall'equilibrio favorendo l'ulteriore svolgimento della reazione, come
ad esempio nel caso del benzoilperossido (BP):
C6 H5 CO OO COC6H5
→ 2 C6 H5 -COO
.
→ 2 C6 H5
.
+ 2 CO2
(3.1.1)
Il radicale primario, una volta formatosi, mediante uno qualunque dei meccanismi sopra citati, é
in grado di reagire con un gran numero di monomeri insaturi attaccando il legame π per formare
poi un nuovo radicale a cui resta covalentemente legato.
C6 H5
.
+ CH2 =CH-C6 H5 → C6 H5 -CH2-CH-C6H5
(3.1.2)
Questa reazione si svolge tanto più facilmente, e cioé con una energia di attivazione tanto
inferiore, quanto più il radicale che viene a formarsi risulta stabilizzato per effetto della risonanza
rispetto al radicale primario.
Nel corso della propagazione che segue viene a verificarsi una rapida addizione di molecole di
monomero sul radicale stabilizzato, costituitosi nello stadio d'inizio; la catena polimerica subirà in
pochi istanti numerosi accrescimenti con successivi spostamenti del centro attivo radicalico
all'estremità della stessa.
Per motivi di stabilizzazione per risonanza risulterà essere privilegiata, ad ogni stadio della
catena cinetica, la formazione di un certo tipo di radicale, quello di maggiore stabilità
termodinamica e pertanto l'unità ripetente tenderà a perpetuarsi identica lungo la catena polimerica
ed il concatenamento che ne consegue risulterà regolare e del tipo testa-coda (regioregolarità).
Si possono presentare occasionalmente lungo la catena polimerica difetti di concatenamento
che ricorrono tanto più frequentemente quanto più é scarsa la stabilizzazione per risonanza del
centro attivo. Fattori sterici, dipendenti dalla natura dell'intorno stereochimico del radicale, pure
risultano in grado di influire significativamente sul grado di regioregolarità delle macromolecole
che si vanno costituendo.
Nella maggior parte dei polimeri derivati da monomeri vinilici esiste un atomo di carbonio
asimmetrico (che ammette cioé una immagine speculare non sovrapponibile) per ciascuna delle
unità ripetenti, pertanto nel corso della crescita testa-coda della catena, l'addizione di una ulteriore
unità monomerica può avvenire in modo che il nuovo atomo di carbonio asimmetrico acquisti una
configurazione d o l. Una successione di uguali configurazioni (tutte d o tutte l) per gli atomi di
carbonio asimmetrici della catena porta ad una molecola isotattica, mentre una catena
sindiotattica é quella che deriverà da una regolare alternanza delle due configurazioni; se
l'alternarsi di queste é puramente casuale la catena che ne risulta verrà detta atattica. I polimeri
isotattici e sindiotattici sono detti stereoregolari e la polimerizzazione che li ha prodotti viene
chiamata di conseguenza stereospecifica. I polimeri stereoregolari presentano proprietà chimicofisiche e meccaniche superiori a quelle degli analoghi atattici. Ciò in quanto, per l'elevata
regolarità sterica delle macromolecole, é possibile, per tratti di macromolecole diverse, il potersi
affiancare strettamente, stabilendo così forti interazioni di non legame, in modo da costituire una
estesa distribuzione di regioni cristalline disperse nella massa di polimero amorfo. Le proprietà
caratteristiche del materiale che ne risulta dipendono dall'ammontare di materiale cristallino
contenutovi e la sua frazione ponderale, nota come grado di cristallinità, cresce proprio con la
stereoregolarità delle macromolecole sintetizzate.
Ordinariamente la polimerizzazione radicalica non consente di ottenere polimeri stereoregolari,
ma soltanto polimeri atattici, in quanto i fattori che nel corso della crescita delle macromolecole
risultano in grado di favorire la formazione di un centro chirale, rispetto all'altro, non sono tali da
portare alla formazione di sequenze stereoregolari sufficientemente lunghe da poter
cocristallizzare. Le cristalliti inglobano inoltre difetti di catena, sia di tipo costituzionale (di
concatenamento), che conformazionale e gruppi terminali (ramificazioni corte e lunghe) che
andranno ad occupare posizioni interstiziali o sostituzionali nel cristallo. Tali imperfezioni e
l'accomodamento nel cristallo, che ne consegue, determinerà una ulteriore riduzione del grado di
cristallinità del polimero risultante.
Indicando con il simbolo
l'unità ripetente, la struttura che risulta lungo il polimero lineare
isotattico sarà cosi rappresentabile:
mentre un polimero sindiotattico:
Le macromolecole atattiche ottenibili per via radicalica presentano, invece, una struttura sterica
del tipo:
come si vede le macromolecole presentano regolarità nel concatenamento (regioregolarità), ma
non nella sequenza stereochimica (stereoregolarità).
Il processo di terminazione della catena può avvenire in diversi modi: quello che ricorre più
frequentemente nel corso della polimerizzazione é la terminazione per reazione bimolecolare tra
radicali polimerici in accrescimento. Tuttavia anche la terminazione per disproporzionamento,
dovuto generalmente a estrazione di idrogeno, è un processo che ricorre con una certa frequenza
nel corso della polimerizzazione:
Pi -CH2 -CH-X + Pj -CH2-CH-X → Pi -CH=CH-X + PjCH2 -CH2 -X
(3.1.3)
I radicali polimerici in accrescimento possono reagire anche con i radicali primari e accanto a
questa vanno pure considerate le reazioni di terminazione per incontro dei radicali primari o d'altri
microradicali (terminazione primaria), originando in tal modo non alti polimeri ma soltanto corti
oligomeri.
.
.
Pn + R → Pn -R
R
.
+R
.
→ R-R
(3.1.4)
(3.1.5)
I radicali polimerici in accrescimento, oltre a reagire con il monomero, come avviene nel corso
della propagazione, possono anche reagire con altre molecole a cui trasferiscono il centro attivo
costituendo una macromolecola "morta", cioé non più in grado di accrescersi ulteriormente ed un
nuovo radicale. Se quest'ultimo non risulta troppo stabile può a sua volta reagire con il
monomero per iniziare una nuova catena. La reazione di trasferimento porta ad una riduzione
della vita media dei radicali polimerici e quindi ad un abbassamento del peso molecolare del
polimero.
Agente di trasferimento può essere qualunque molecola presente nel sistema (solvente,
iniziatore, impurezze varie, ecc.) oppure può trattarsi di sostanze che vengono aggiunte
appositamente in quantità ridotte quali regolatori del peso molecolare. Il trasferimento con il
monomero si verifica in tutte le polimerizzazioni e può avvenire sia per estrazione di idrogeno da
parte del monomero sul radicale polimerico che viceversa. Quindi per un polimero vinilico:
-CH2 -CHX + CH2 =CHX → -CH=CHX + CH3-CHX
(3.1.6)
-CH2 -CHX + CH2 =CHX → -CH2-CH2 X + CH2 =CX
(3.1.7)
e
Il trasferimento con il polimero é in linea di principio sempre possibile ed avviene di norma per
estrazione di idrogeno; si origina una catena in accrescimento con il sito radicalico non più
all'estremità, ma interno alla macromolecola:
.
Pn + -CH2 -CHX- → Pn H + -CH2 -CX-
(3.1.8)
I successivi stadi di propagazione porteranno alla formazione di macromolecole con lunghe
ramificazioni o al limite reticolate. Il fenomeno del trasferimento intramolecolare é un processo
monomolecolare per cui il centro attivo si trasferisce dall'estremità all'interno di una stessa catena
polimerica originando, anche in questo caso, macromolecole ramificate, tuttavia il tipo di
ramificazione, che ne deriva, risulta essere a catene laterali corte, in quanto il trasferimento
intramolecolare coinvolge preferenzialmente l'atomo di carbonio distante sei legami dal centro
attivo, risultando la chiusura di un anello esagonale al contempo assai probabile e stericamente
non impedito.
3.2. Polimerizzazione cationica
La polimerizzazione cationica é in un processo in cui le specie propagandi la catena cinetica,
vale a dire i centri attivi della reazione di polimerizzazione, hanno natura elettrofila (acidi di
Lewis), essi consistono o in veri e propri carbocationi o solo in specie pseudo carbocationiche.
Il carbocatione é uno ione al carbonio positivo costituito da un atomo di carbonio ibridizzato
2sp2 in cui l'orbitale atomico pz, non ibrido (normale al piano degli ibridi), risulta vacante. La
reattività e di conseguenza la vita dello ione dipendono dalla natura e dal numero dei sostituenti
presenti su di esso. Gruppi in grado di donare densità elettronica all'atomo di carbonio (effetto
induttivo di specie elettron donatrici) o sostituenti in grado di rimuovere per risonanza parte della
carica positiva presente su di esso delocalizzandola su di una area più estesa (effetto mesomero o
iperconiugativo e risonanza) riescono a stabilizzare tale ione allungandone la vita e, quindi,
rendendolo idoneo portatore di una catena cinetica che giunga fino alla formazione dell'alto
polimero.
L'inizio del processo di polimerizzazione cationica comprende due distinte reazioni successive:
la prima é relativa alla formazione di specie ioniche altamente instabili e la seconda consta
nell'addizione di tali cationi al monomero con formazione di nuovi ioni di maggiore stabilità, che
costituiscono le specie propagandi la reazione di polimerizzazione, specie cioé che mantenendo
inalterata la propria struttura risultino in grado di dare luogo alla propagazione attraverso una
serie di stadi successivi tutti identici.
I centri attivi della reazione di polimerizzazione vengono generalmente prodotti per addizione di
un catione, quale un protone o anche un altro carbocatione, prodotto dalla prima reazione del
processo, al monomero olefinico; in modo da originare carbocationi di maggiore stabilità (cioé
secondari o terziari).
Gli acidi di Lewis sono tra i composti più largamente impiegati come iniziatori della reazione di
polimerizzazione cationica ed il più importante dei processi industriali in cui si ricorre a questo
metodo di polimerizzazione, quello per la preparazione del poliisobutilene, ha visto utilizzare
inizialmente BF3 ed attualmente AlCl3 . Per alcuni acidi di Lewis, tra cui la specie AlBr3 il
meccanismo proposto prevede prima l'equilibrio di autodissociazione dell'alogenuro, che in
condizioni apolari, come nel mezzo di reazione, esiste in forma oligomerica, e poi la sua
successiva addizione al doppio legame olefinico.
BF3
→
2 ←
2 BF3
BF3 + CH 2=CH-C 6 H5 → F 3B --CH 2 -CH +-C 6 H5
(3.2.1)
(3.2.2)
In alcuni casi é stato osservato che i soli acidi di Lewis, quando messi in contatto con il
monomero, non danno luogo, apprezzabilmente, a reazioni d'inizio. Solo l'aggiunta di una terza
sostanza rende, praticamente, possibile il verificarsi della reazione, a questa é stato poi dato il
nome di cocatalizzatore. Esistono due differenti classi di sostanze che insieme agli acidi di
Lewis possono dare luogo a sistemi catalitici realmente efficienti: la prima é costituita da quelle
sostanze che hanno la possibilità di addizionare un protone al doppio legame, queste sono
generalmente acidi di Bronsted, acqua e acidi organici deboli, per i quali l'acido di Lewis ha la
sola funzione d'incrementarne la proticità; la seconda é invece costituita da alogenuri alchilici o
arilici che in presenza dell'acido di Lewis possono subire scissione eterolitica del legame
carbonio-alogeno, con formazione di specie carbocationiche idonee al processo di inizio.
Gli acidi protici risultano tra le specie in grado di iniziare la reazione di polimerizzazione quelli
più adatti ad un inizio semplice e privo d'indesiderati processi secondari. Quando l'acido protico
viene posto in contatto con un monomero suscettibile di polimerizzazione per via cationica, cioé
una molecola insatura per uno a due legami π, la polimerizzazione potrà avere luogo solo se la
vita media dell'intermedio risultante é lunga abbastanza da permettere la crescita della catena. Se
invece i due controioni si uniscono velocemente, il processo equivale ad una reazione di
terminazione che si compie con una velocità competitiva con la propagazione. Pertanto tutti quei
fattori che sono in grado di stabilizzare gli intermedi carbocationici quali: nucleofilicità del
monomero, polarità del solvente, acidità dell'iniziatore, ecc. allungheranno la durata dello stadio di
propagazione.
La polimerizzazione cationica può essere iniziata, oltre che con metodi chimici, anche con
metodi di tipo fisico. Alcuni monomeri si prestano ad essere polimerizzati per via cationica
mediante inizio fotochimico, il processo in genere consiste nell'estrazione di un elettrone da una
molecola di monomero con conseguente formazione del radicale catione, centro attivo della
reazione di polimerizzazione.
La propagazione consiste in una serie di addizioni ripetute di molecole di monomero alla
catena in crescita. Queste avvengono per sovrapposizione di orbitali molecolari π pieni di
monomeri insaturi, con l'orbitale atomico 2pz vacante del centro attivo.
L'interruzione temporanea della crescita della catena cinetica, stadio noto come trasferimento
di catena, può avvenire o per trasferimento del centro attivo ad un altra catena in crescita, o per
trasferimento dello stesso ad una molecola di monomero, o, infine, per trasferimento a molecole
di solvente (purchè questo sia dotato di coppie ioniche solitarie).
Anche per la reazione di polimerizzazione cationica reazioni di trasferimento di catena
occorrono di frequente nel corso della polimerizzazione, in questo caso più frequentemente si
verifica il trasferimento del centro attivo dalla catena polimerica in crescita ad una molecola di
monomero, originando una catena polimerica morta ed un neocentro attivo.
Le possibili reazioni di terminazione sono di due tipi diversi: il primo detto di
neutralizzazione degli ioni accoppiati, comporta l'interazione tra il catione propagante ed il
controione con formazione di un nuovo composto elettricamente neutro, questo può decorrere o
secondo lo schema seguente:
P+
n + A → Pn A
(3.2.3)
oppure con formazione di due diverse specie chimiche neutre:
P+
n + A → Pn + A
(3.2.4)
E' tuttavia prevedibile che il secondo processo, per essere l'esatto opposto di una reazione
d'inizio, non deve poter ricorrere con notevole frequenza.
Il secondo tipo di terminazione é quella in cui si ha la distruzione del catione propagante e
contemporaneamente, la formazione di un catione di notevole stabilità, tale da non poter dare
ulteriormente propagazione.
+
P+
n + R → Pn + R
(3.2.5)
3.3 Polimerizzazione anionica
Le polimerizzazioni anioniche rientrano nella classe delle poliaddizioni con meccanismo a
catena e sono caratterizzate dall'avere come centro attivo un atomo di carbonio con una carica
negativa parziale o totale, associata ad un controione.
CH 3CH 2 CH2 - CH2 n -CH δ-Liδ + ,
2
CH 3 CH2 CH2 - CH 2 n -CH -2 -Na+
(3.3.1)
Il requisito fondamentale che un monomero deve poter soddisfare per poter essere
polimerizzato per via anionica é quello di risultare in grado di generare una specie carbanionica
sufficientemente stabilizzata attraverso effetti induttivi e mesomeri. I monomeri vinilici e dienici
sono le specie che vengono, ordinariamente, polimerizzate con questo tipo di tecnica.
Per originare, a partire dal monomero, carbanioni in grado di propagare, vengono applicati due
differenti metodi: il primo consiste nell'addizione di uno ione carbonio negativo al doppio legame
dell'unità monomerica, con formazione di un legame covalente ad una estremità ed un carbanione
all'altra; il secondo implica, invece, il trasferimento di un elettrone al monomero da parte di un
specie chimica donatrice d'elettroni.
I reagenti di maggior impiego per iniziare la polimerizzazione per attacco nucleofilo al doppio
legame carbonio-carbonio sono i litio alchili. Per l'elevata differenza di elettronegatività, esistente
tra il carbonio ed il metallo alcalino, il legame covalente che ne risulta é così fortemente
polarizzato da poter considerare la specie come pseudo carbanionica.
In linea di principio un gran numero di composti organo-metallici di metalli di altra natura
potrebbero essere ugualmente impiegati come iniziatori, tuttavia, per l'elevata solubilità dei
litioalchili in solventi idrocarburici ed eterei, che sono quelli ordinariamente impiegati per la
polimerizzazione, cosa conseguente al loro elevato grado di associazione in soluzione, per la
formazione di micelle in cui gli atomi di litio sono disposti all'interno della struttura ed i residui
carboniosi verso l'esterno, i litio alchili risultano, di gran lunga, quelli preferibilmente utilizzati.
Lo stadio di inizio può in questo caso essere così rappresentato:
R-Li + CH2=CH-R'
→ RCH2-C - HR'
(3.3.2)
La reattività di un composto litio organico può variare significativamente a seconda della
diversa basicità dello ione negativo, della concentrazione di litio alchile libero (essendo irreattivo
quello aggregato in micelle) e della natura (costante dielettrica) del particolare solvente utilizzato.
I litio alchili presentano inoltre una singolare caratteristica: sono in grado di promuovere in
solventi idrocarburici, secondo un meccanismo in parte ancora inchiarito, la polimerizzazione
altamente stereospecifica di dieni coniugati, con formazione di alti polimeri elastomerici a
concatenamento 1,4-cis delle unità monomeriche.
La reazione di inizio può essere promossa anche da metalli alcalini. In tal caso la formazione
della specie iniziante avviene per trasferimento di un elettrone dal metallo al monomero con
formazione di una coppia ionica consistente in un radicale-anione con adiacente il controione
metallico.
Me + RCH=CH2 → Me+ RCH- -CH 2
(3.3.3)
Mentre le reazioni iniziate con i litio alchili risultano in fase omogenea, quest'ultime sono
sempre in fase eterogenea a causa della scarsa solubilità del metallo in solventi idrocarburici.
Anche i complessi tra idrocarburi aromatici e metalli alcalini rientrano nel secondo metodo di
inizio. Questi vengono prodotti generalmente per reazione tra sodio elementare e idrocarburi
aromatici policiclici, tipicamente la naftalina. Il radicale anione prodotto può trasferire
rapidamente il proprio elettrone spaiato ad un idrocarburo aromatico avente affinità elettronica
simile o superiore.
C6 H 6 + Na →
C6 H6 -Na+
(3.3.4)
C6 H6 -Na + + CH 2 =CH-Ph → C 6 H 6 + CH 2-C -HPh Na +
(3.3.5)
2 CH 2 -C-HPh Na + → Na+ PhHC--CH 2-CH 2-C -HPh Na+
(3.3.6)
Durante il processo di propagazione i centri attivi sono, in diversa misura, aggregati tra loro
con accoppiati i relativi controioni. Il grado di associazione dipende fortemente dalla costante
dielettrica del solvente e dalla natura del controione.
Se l'ambiente di reazione é esente da qualunque tipo di impurezza elettrofila molte delle
polimerizzazioni ioniche mancano dello stadio di terminazione e pertanto i centri attivi restano
"viventi", cioé potenzialmente in grado di crescere anche a fine reazione per semplice aggiunta di
ulteriore monomero. Quanto alle reazioni di trasferimento di catena và ricordato che, essendo i
carbanioni basi eccezionalmente forti, reazioni di trasferimento di un protone sono possibili da
parte di una qualunque sostanza di natura acida, anche debolissima, attraverso la neutralizzazione
seguente:
R-Me+ + HA → RH + Me+ A-
(3.3.7)
I trasferimenti di catena, che più frequentemente avvengono, sono quelli che si compiono per
reazione del centro attivo con il solvente, il monomero od il polimero. Se il sistema é
rigorosamente esente da qualunque traccia di impurezza di natura elettrofila, la polimerizzazione
che ne risulta é sicuramente vivente.
Pertanto, al termine della reazione di polimerizzazione, i centri attivi carbanionici devono essere
distrutti deliberatamente, per aggiunta di specie protiche (metanolo o acido acetico). La possibilità
di avere nel sistema macromolecole viventi risulta di notevole interesse poiché consente di
preparare per addizione successiva di monomeri di diversa natura copolimeri a blocchi o a stella
(per aggiunta di unità accoppianti polifunzionali), macromolecole dai terminali di catena
variamente funzionalizzati, polimeri aggraffati e materiali sintetici dalla struttura e dalla
composizione controllata.
3.4. Polimerizzazione mediante catalizzatori Ziegler-Natta
I catalizzatori Ziegler-Natta sono dei particolari sistemi catalitici (sia omogenei che eterogenei)
in grado di promuovere la polimerizzazione, altamente regio e stereo specifica, di olefine e derivati
vinilici. Il sistema catalitico, quando eterogeneo, é costituito da due componenti chiamati
catalizzatore e cocatalizzatore. Il primo é un sale, tipicamente un alogenuro, di un metallo di
transizione (generalmente: Ti, Zr, V, Nb, Cr), il secondo é invece un derivato organometallico di
un metallo di non transizione (ordinariamente un alluminio alchile come AlMe3 , AlEt3 , AlEt2 Cl,
etc.). La reazione viene condotta in mezzo idrocarburico (n-eptano) in atmosfera inerte e con
reagenti e solventi accuratamente anidrificati, a causa della nucleofilicità del centro attivo.
Risultando il catalizzatore insolubile (catalisi eterogenea) il sistema deve necessariamente essere
mantenuto in agitazione nel corso della polimerizzazione. Il sistema catalitico più largamente
utilizzato, soprattutto per la produzione del polipropilene isotattico e dell'etilene ad alta densità é il
sistema TiCl3 (in una delle modificazionio a strati) AlEt3 . Il centro attivo della reazione di
polimerizzazione é costituito da un legame covalente fortemente eteropolare che risultando
instabile in quanto altamente reattivo deve venire originato in situ mediante una reazione di
scambio dei leganti tra l'alogenuro ed il cocatalizzatore. Se si tiene in conto che la
polimerizzazione può avvenire anche in assenza di metallo alchili purché nel sistema si possano
creare le condizioni per la formazione di derivati alchilici del metallo di transizione, si può capire
come la specie attiva sia escusivamente il derivato organo metallico del metallo di transizione.
TiCl3 + AlEt3 → TiCl2 -Et + AlEt2 Cl
(3.4.1)
Nei sistemi eterogenei a base di sali di titanio la polimerizzazione si compie su alcune delle
facce dei cristalli e precisamente lì dove é potuta avvenire la reazione di alchilazione per scambio
con il cocatalizzatore. Gli atomi di titanio che risiedono sulle superfici laterali delle modificazioni
a strati del TiCl3 si trovano in una situazione diversa dagli altri. Difatti mentre questi ultimi sono
coordinativamente saturi, risultano cioé circondati da 6 atomi di alogeno (coordinazione
ottaedrica) condivisi con altri ioni metallici, gli atomi di titanio superficiali posseggono nel loro
intorno di coordinazione atomi di alogeno non a ponte con altri atomi di Titanio ed inoltre, per il
principio della elettroneutralità, vi devono essere, su dette superfici, pure atomi di titanio con siti
di coordinazione liberi. Durante l'alchilazione si verifica una reazione di scambio di un atomo di
cloro superficiale, non a ponte, con un gruppo alchilico del cocatalizzatore, originando in questo
modo il centro attivo della reazione di polimerizzazione. Ricordando poi che le olefine possono
formare complessi π con i metalli di transizione, con conseguente destabilizzazione dei legami σ
metallo-carbonio eventualmente presenti, l'intero processo di polimerizzazione risulterà
schematizzabile come riportato in fig.3.4.1.
Cl
Cl
CH3
Cl
+
Ti
Cl
Cl
Cl
CH2
CH2
CH3
Cl
Ti
Cl
Cl
C2 H4
+
Ti
Cl
=
Ti
Cl
Cl
Cl
CH3
Cl
Al(Me) 3
Cl
AlCl(Me) 2
Cl
Cl
CH2
CH2
Cl
Cl
Ti
Cl
CH2 CH2 CH3
Cl
Fig. 3.4.1 - Meccanismo di poliinserzione del propilene.
Per semplicità, nello schema presentato viene illustrato il solo meccanismo monometallico in
cui l'atomo di titanio che porta il sito vacante é lo stesso atomo su cui si verifica la crescita della
catena, meccanismi di maggiore complessità sono pure stati proposti. La polimerizzazione
vinilica, se condotta mediante catalizzatori Zegler-Natta, porta all'ottenimento di un polimero
polidisperso altamente regio e stereoregolare che di conseguenza risulterà con un elevato grado di
cristallinità e quindi dalle proprietà meccaniche particolarmente interessanti. Quanto al tipo di
controllo sterico operante nel sito catalitico, questo può essere attribuito alla struttura
intrinsecamente asimmetrica dell'atomo di titanio coordinativamente insaturo che risiede sulla
superficie cataliticamente attiva. L'asimmetria intrinseca delle due possibilità di coordinazione
della molecola di monomero al sito catalitico non risultano energeticamente equivalenti e di
conseguenza la formazione di una delle due risulterà favorita rispetto all'altra motivo per cui
l'unità monomerica tenderà ad entrare sempre alla stessa maniera nella catena polimerica, in modo
da determinare la formazione di macromolecole di elevata regolarità.
4. METODI DI POLIMERIZZAZIONE
Le reazioni di polimerizzazione (sia di poliaddizione che di policondensazione) possono essere
effettuate ricorrendo a quattro differenti metodologie sperimentali:
- polimerizzazione in massa;
- polimerizzazione in soluzione;
- polimerizzazione interfacciale;
- polimerizzazione in emulsione.
In base alla particolare natura del monomero, alla specifica reazione chimica coinvolta, al costo
dell'intero processo, al grado di purezza disponibile per i reagenti richiesti, ecc. ricorrere ad un
metodo può risultare di maggiore vantaggio rispetto ad altri.
La polimerizzazione in massa é stato il primo metodo a cui si é ricorso per la preparazione
industriale delle macromolecole e, sia per la semplicità della tecnologia, che per il ridotto numero
di reagenti richiesti (monomero ed eventuale iniziatore sono di fatto gli unici componenti
necessari), risulta attualmente la tecnica di polimerizzazione meno dispendiosa di cui si può fare
uso.
Il monomero o entrambi i monomeri devono essere allo stato fuso nel corso della reazione e
pertanto la temperatura del reattore viene regolata su di un valore scelto di conseguenza
(generalmente tra i 150 e i 300°C). Una temperatura moderatamente elevata si rende anche
necessaria per poter adeguatamente aumentare la velocità di reazione, che risulterebbe altrimenti
eccessivamente ridotta.
Consistendo il processo in successive reazioni d'equilibrio, solo la presenza di sottoprodotti
volatili, cioé molecole leggere come acqua, alcoli, eteri, ecc., che allontanandosi continuamente
dall'ambiente di reazione si sottraggono dall'equilibrio, è in grado di assicurare il raggiungimento
di quei pesi molecolari caratteristici degli alti polimeri. Per questo motivo il reattore viene
generalmente mantenuto in vuoto, cosa, tra l'altro, conveniente per limitare gli eventuali fenomeni
d'ossidazione che alle elevate temperature di polimerizzazione e con atmosfere non inerti
verrebbero di sicuro a verificarsi.
Il polimero prodotto risulta generalmente solubile nel monomero, pertanto non si separa
dall'ambiente di reazione nel corso della polimerizzazione, e di conseguenza la viscosità del
sistema aumenta proggressivamente al crescere della conversione. La viscosità elevata riduce la
conducibilità termica, ostacolando la rimozione del calore e pertanto il reattore và necessariamente
munito di potenti agitatori a pale. Per la notevole quantità di calore svolto, anche
l'autoaccellerazione, che ne consegue, risulta di particolare svantaggio in quanto rende la reazione
difficile da controllare.
La completa conversione del monomero ad alto polimero é difficile da realizzarsi per il
ridottissimo valore della velocità di diffusione che caratterizza la fase finale del processo e, per lo
stesso motivo, anche l'eliminazione finale delle tracce di monomero irreagito, dal corpo del
polimero, presenta notevoli complicazioni.
La tecnica di polimerizzazione in soluzione é un metodo largamente impiegato sia per condurre
reazioni di poliaddizione che per reazioni di policondensazione.
In questa entrambi i reagenti vengono solubilizzati in un adatto solvente che risulti irreattivo sia
nei confronti dei reagenti che del polimero via via prodotto. Il solvente assicura una perfetta
omogenizzazione dell'ambiente di reazione, rende meno critica l'agitazione e facilita la rimozione
del calore. La soluzione dei due monomeri deve essere mantenuta sotto energica agitazione, in
quanto il polimero che si forma difficilmente rimane disciolto nel solvente una volta raggiunto un
elevato peso molecolare; l'agitazione consente invece il progredire della reazione di
polimerizzazione anche dopo che le macromolecole si sono separate. Il solvente assolve inoltre la
funzione di assorbire l'eventuale calore di reazione prodotto durante la polimerizzazione, sia
favorendo lo scambio termico con l'esterno, che sottraendo calore quanto distillando vi si
allontana.
I solventi più utilizzati sono composti alifatici o aromatici alogenati ed eventualmente loro
miscele, la scelta é in genere condizionata dalla capacità di solubilizzare il più possibile sia i
monomeri che il polimero prodotto. Più risulta elevata la solubilità del polimero nel solvente più
sarà alto il peso molecolare raggiungibile a fine polimerizzazione.
La reazione procede con velocità controllabile, sia agendo sulla temperatura, che variando la
concentrazione dei reagenti; tuttavia l'aumento indiscriminato della concentrazione porta a valori
di viscosità tali da rendere difficoltosa l'agitazione del sistema e di conseguenza impossibile la
termostatazione. Tuttavia, l'utilizzo di soluzioni troppo diluite richiede costose operazioni di
riciclaggio del solvente, nonché l'introduzione proggressiva di ingenti quantità di impurezze
nell'ambiente di reazione.
I sottoprodotti della polimerizzazione vanno rimossi dall'ambiente di reazione per poter
raggiungere un elevato peso molecolare, ad esempio, introducendo nel sistema opportune
molecole di specie accettrici. Quando gli idracidi sono i prodotti della reazione di eliminazione
l'introduzione di una molecola di ammina secondaria o terziaria stericamente impedita costituisce
la soluzione di maggiore efficacia.
Nella polimerizzazione interfacciale vengono utilizzati due solventi tra loro immiscibili in
quanto uno polare e l'altro apolare, come ad esempio acqua e dicloroetano. In acqua viene
disciolto il monomero idrofilo (diammina, glicole, ditiolo, ecc.) e notevoli quantità di una sostanza
alcalina in grado di neutralizzare l'acido, che gradualmente viene prodotto dalla reazione di
polimerizzazione. La fase organica ha invece il compito solubilizzare il monomero idrofobo ed il
polimero che si forma. La reazione di polimerizzazione avviene all'interfaccia tra le due fasi e la
cinetica é governata dalla diffusione dei monomeri da una fase all'altra.
La reazione, a differenza delle due precedenti, non richiede che i reagenti siano immessi in
rapporto rigorosamente stechiometrico, ma variazioni abbastanza ampie rispetto alla situazione
equimolecolare divengono abbastanza tollerabili. L'intera polimerizzazione và a completezza in
pochi minuti a differenza delle ore necessarie invece per la medesima reazione se condotta in
massa. Non essendo richiesto il raggiungimento della temperatura di fusione il metodo offre,
inoltre, il grosso vantaggio di poter preparare anche polimeri termolabili o di condurre
polimerizzazioni di monomeri termicamente instabili o in grado di isomerizzare già a temperature
moderatamente elevate. Questo metodo consente inoltre di produrre polimeri altamente reticolati
che sono si infusibili, ma non altrettanto insolubili.
Il processo può essere condotto operando sia in assenza di agitazione meccanica, che con
sistemi vigorosamente agitati.
Con il metodo senza agitazione si utilizza un solvente organico in cui il polimero é insolubile,
in modo che il materiale macromolecole prodotto rimanga all'interfase per poter poi essere
agevolmente rimosso in forma di sottile pellicola. Il processo che avviene all'interfase si svolge
rapidissimo e pertanto la velocità di reazione risulta controllata esclusivamente dalla rapidità con
cui i due monomeri diffondono verso l'interfase.
Il grado di polimerizzazione finale dipende dalla velocità con cui il film polimerico viene
rimosso dall'interfase, inoltre si richiede che il processo porti alla formazione di film coerenti e
facilmente rimovibili dalla fase organica. Alla fase acquosa vengono generalmente aggiunti dei
sali che reagendo con gli idracidi prodotti evitano il verificarsi di processi di depolimerizzazione
per idrolisi.
In sistemi con agitazione viene sfruttato il medesimo principio e le reazioni utilizzate in assenza
di agitazione. L'unica differenza e di natura tecnologica consistente cioé nella vigorosa agitazione
meccanica utilizzata.
La polimerizzazione radicalica di diversi monomeri vinilici, tipicamente dieni coniugati, può
essere convenientemente condotta ricorrendo al metodo in emulsione.
La polimerizzazione in emulsione si distingue da quella in sospensione fondamentalmente nei
seguenti tre punti:
a) le goccioline di liquido in emulsione hanno un diametro inferiore a quello delle goccioline
liquide in sospensione (0.05-5 µm contro i 10-1000µm);
b) l'iniziatore é generalmente idrosolubile mentre nella polimerizzazione in sospensione lo é,
ordinariamente, nel monomero;
c) il prodotto finale di reazione non é una sospensione polimerica filtrabile, ma generalmente
un lattice costituito da una emulsione stabile di polimero in acqua, coagulabile con le medesime
tecnologie ed apparati già utilizzati per la gomma naturale.
I componenti fondamentali di una polimerizzazione in emulsione sono: il monomero, un
tensioattivo, l'iniziatore e l'acqua. Il tensioattivo é inizialmente in acqua in forma di micelle
sferiche consistenti in aggregati contenenti da 50 a 100 molecole disposte con le loro estremità
polari (parte idrofila) verso l'esterno della micella e le catene idrofobe unite all'interno. Quando il
monomero idrofobo viene addizionato al sistema, sotto agitazione, una buona parte di esso
rimane in forma di grosse goccioline, ma, essendo comunque moderatamente solubile in acqua,
una certa parte di esso passa all'interno delle micelle. Quando i radicali liberi vengono prodotti
per decomposizione delle molecole disciolte in soluzione acquosa, un certo numero ne penetra
all'interno delle micelle iniziando così il processo di polimerizzazione. Nel corso della
polimerizzazione le macromolecole in crescita rimangono all'interno delle micelle finché le loro
dimensioni sono tali da permetterlo, così che alla fine del processo il sistema risulterà costituito
da particelle di polimero finemente disperse nella fase acquosa. Le successive operazioni per il
recupero del polimero sono analoghe a quelle messe a punto per la preparazione della gomma
naturale.
5. CLASSI PRINCIPALI DI MATERIALI POLIMERICI
Viene qui di seguito riportata una rapida rassegna dei materiali polimerici più rappresentativi e
che risultano attualmente di maggiore diffusione sul mercato. Per ciascun materiale vengono
brevemente riassunte le proprietà caratteristiche principali e il loro particolare campo di utilizzo.
5.1. Materiali poliammidici
Vengono preparati a partire da diammine alifatiche ed aromatiche e da acidi dicarbossilici a
catena lineare; queste sostanze, in opportune condizioni, polimerizzano per condensazione,
eliminando molecole di H2 O e legandosi fra loro per formazione di legami peptidici fino alla
realizzazione di lunghe catene polimeriche. I materiali poliammidici possono essere sintetizzati
anche per polimerizzazione di amminoacidi.
Il Nylon (nailon) è un materiale poliammidico, sintetizzato per la prima volta da W.H.
Carrothers nel 1935, e viene contraddistinto da due cifre che indicano il numero degli atomi di
carbonio contenuti, rispettivamente, nella diammina e nell'acido dicarbossilico: ad es. per
polimerizzazione di acido adipico con esametilendiammina (a loro volta preparati per sintesi) si
ottiene il nailon 6-6:
n
O
H
H
+ n
N-(CH 2 )6 -N
H
O
C-(CH 2 )4 -C
H
(esametilendiammina)
H2 N(CH 2 )6 NH
- n H2 O
OH
(acido adipico)
CO(CH2 )4 CONH(CH2 )6 NH
n-2
CO(CH2 )4 COOH
mentre, per polimerizzazione di esametilendiammina con acido sebacico (HOOC-(CH2 ) 8 COOH) si ottiene il nailon 6-10.
I nailon possono prepararsi anche per polimerizzazione di molecole di un amminoacido, e in tal
caso la parola nailon è seguita da una sola cifra, che indica il numero di atomi carbonio presenti
nella catena dell'amminoacido: l'amminoacido più usato è l'acido amminocaproico
(H2 N(CH2 ) 5 COOH) da cui è ottenuto il nailon 6.
Le polimerizzazioni che portano alla fabbricazione dei nailon vengono controllate mediante
aggiunte di opportune quantità di acidi e di basi che bloccano i gruppi terminali (basici ed acidi)
della catena e arrestano, al momento voluto, la polimerizzazione; in tal modo si ottengono catene
della lunghezza e quindi delle proprietà desiderate.
La presenza di legami a ponte d'idrogeno presenti fra le catene polimeriche, dovuti
all'interazione tra l'ossigeno carbonilico e l'idrogeno sull'azoto ammidico (C=O e N—H) presenti
in ciascuna unità ripetente, incrementa la resistenza del materiale agli sforzi tensili ed impartisce
ad esso un elevato grado di cristallinità.
I tipi di nailon più utilizzati hanno pesi molecolari compresi fra 10.000 e 20.000 e fondono a
circa 250°C; il loro impiego é soprattutto in campo tessile e per la fabbricazione di cordami; la
produzione mondiale può essere stimata fra i 4 ed i 5 milioni di tonn/anno.
5.2. Materiali poliesteri
Vengono ottenuti per condensazione, con eliminazione di acqua, del glicol etilenico con acido
tereftalico (o con tereftalato di metile); la loro diffusione commerciale data dalla metà degli anni
'50. Il polimero polietilentereftalico (temperatura di fusione 250°C; peso molecolare attorno alle
15000 u.m.a.)
H
C
O
OH
C
+
C
OH
C
H
H
...........O
C
C
H
O
O
C
C
H
O
C
C
O ...........
H
è utilizzato nella fabbricazione di bottiglie, di tessuti, frequentemente misto con fibre naturali
(lana, cotone), di cordami e di tele per pneumatici: la sua particolare insensibilità all'umidità lo
rende assai adatto per speciali imballaggi, e gli impartisce la proprietà caratteristica di fornire
tessuti antipiega; in commercio è indicato con i nomi di Terilene, Dacron, Terital ed altri.
5.3 Materiali poliacrilici
Sono materiali che vengono ottenuti mediante polimerizzazione per addizione di derivati
acrilici: ad esempio dal nitrile acrilico (vinilcianuro) si ottiene il poliacrilonitrile:
2n (H2 C=CH-CN)
(-CH2 -CH-CH2 -CH-)n
CN
(nitrile acrilico)
CN
(poliacrilonitrile)
materiale ben noto, per il suo uso nella fabbricazione di tessuti, con i nomi Acrilan, Orlon,
Dralon, Leacril, etc. Dalla polimerizzazione del metacrilato di metile sí ottengono (circa 4 106
tonn/anno) materiali trasparenti, incolori, duri, con indice di rifrazione paragonabile a quello del
vetro ben lavorabili meccanicamente, noti con i nomi di Perspex, Plexiglas, Lucite, largamente
impiegati nella fabbricazione di tubi, lastre, contenitori, lenti, protesi, etc.
CH3
n
H2 C=C
CH3
-H2 C-C-
COOCH3
(metacrilato di metile)
COOCH3
n
(polimero)
5.4. Polietilene
E' il polimero di addizione dell'etilene (H2 C=CH 2 ), che é ottenibile in grandi quantità dai
processi di cracking degli idrocarburi; il polietilene (con masse molecolari dell'ordine di 10.000
u.m.a.) è un materiale bianco, translucido e parzialmente cristallino le cui proprietà variano
significativamente con il grado di cristallinità: cristallino al 50% ha densità pari a 0,92 g/cc e
rammollisce a circa 135 °C; cristallino al 90% ha densità pari a 0,95 g/cc e fonde a 150°C. La
produzione mondiale di polietilene si aggira intorno ai 25 milioni di tonn/anno e viene utilizzato
nella fabbricazione di pezzi stampati, di tubazioni, di contenitori e sacchi da imballaggio, di
tappeti, come isolante nei conduttori elettrici, etc. E' attualmente in commercio con i nomi di
Politene, Dylan, Brea ed altri.
5.5. Polipropilene
E' analogo al polietilene nell'aspetto e negli usi ed è ottenuto mediante polimerizzazione per
addizione del propilene, prodotto anche questo, come l'etilene, in grosse quantità nei processi di
cracking degli idrocarburi; presenta masse molecolari da 150.000 a 500.000 u.m.a.. Questo
polimero può essere atattico, isotattico e sindiotattico, e quando il grado di cristallinità é del 90%
fonde a 160°C. Con l'aumentare della cristallinità si passa da materiali morbidi e flessibili, usati
soprattutto nell'industria tessile, a materiali sempre più duri e rigidi, impiegati nella fabbricazione
dei più svariati pezzi (stampati o lavorati alle macchine utensili) e nelle costruzioni elettriche per le
ottime proprietà isolanti. Se ne producono circa 20 106 tonn/anno, ed è in commercio con i nomi
di Meraklon (prodotti filati), Moplen I (prodotti stampati), Seilon, PRO, ed altri. Il polipropilene è
il miglior isolante termico fra tutte le fibre naturali ed artificiali fin ora conosciute.
5.6. Polistirene
Si prepara, analogamente al polipropilene, mediante polimerizzazione catalitica dello stirene;
questo viene prodotto (circa 107 tonn/anno) a partire da etilene e benzene secondo lo schema:
H2 C-CH 3
H2 C=CH2 + C 6 H6
(catalizz.)
CH=CH2
(catalizz.)
(etilbenzene)
+ H2
(stirene)
La quasi totalità dello stirene prodotto viene impiegato nella fabbricazione delle gomme SBR e
del polistirene:
CH=CH2
(-CH-CH2 -)n
n
Questo è una resina dura, trasparente, simile al vetro, termoplastica. Ha ottime proprietà isolanti,
un elevato indice di rifrazione e una elevata resistenza all'acqua; si presta ottimamente ad ogni tipo
di lavorazione, anche ottica. Come resina espansa è largamente impiegata negli imballaggi e meno
frequentemente come isolante termoacustico. E' attualmente in commercio con i nomi Polistirolo,
Dylene, ed altri.
Opportune aggiunte di divinilbenzene (H2 C=CH-C 6 H4 -CH=CH2 ; dallo 0,002 allo 0,0004%)
eliminano la termoplasticità del polistirene (polistirene reticolato); l'azione del divinilbenzene sul
polistirene è analoga a quella dello zolfo nella vulcanizzazione del caucciù, ed il divinilbenzene,
che può legarsi con due gruppi vinilici, unisce fra loro, lateralmente, le catene polimeriche.
5.7. Cloruro di polivinile
Il cloruro di vinile (H2 C=CHCI) è un monomero gassoso di elevata tossicità che viene
prodotto per addizione elettrofila di acido cloridrico ad acetilene: C2 H2 + HCI -> H 2 C=CHCI
(circa 150-200 °C; in presenza di catalizzatori). Nella polimerizzazione per addizione del cloruro
di vinile si apre il doppio legame e si formano catene del tipo (—CH2 —CHCI—) n ; a seconda
del metodo di polimerizzazione utilizzato il materiale presenta cristallinità e proprietà fisiche assai
differenti. Può essere addizionato di plastificanti ed in questo caso forma un materiale morbido,
dall'aspetto gommoso, tossico poiché in grado di rilasciare il plastificante. E' usato per la
fabbricazione di tubi, pompe, recipienti; come isolante di conduttori elettrici; nella fabbricazione di
dischi grammofonici; della finta pelle; ecc. E' in commercio con i nomi di Vipla, PVC, ed è
prodotto in quantità valutabile attorno ai 20 milioni di tonn/anno.
5.8. Teflon
E' ottenuto mediante polimerizzazione per addizione dal tetrafluoroetilene (gassoso), ed ha
struttura (CF2 ) n analoga al politene (CH2 ) n ; la polimerizzazione avviene facilmente (ad es.
60°C e 10 atm). Il Teflon è perciò un politetrafluoroetilene, e viene spesso indicato con la sigla
PTFE. Ha cristallinità elevata (circa 95%), d(20°C) = 2,3 g/cc, fonde intorno ai 330 °C e fino alla
temperatura di 250 °C conserva inalterate le sue proprietà chimico-fisiche. E' insolubile in tutti i
solventi conosciuti e ciò ne rende difficoltosa la lavorazione, che spesso è effettuata per
sinterizzazione della polvere del polimero; è di elevatissima inerzia chimica (viene attaccato
soltanto dai metalli alcalini o dal fluoro, a caldo). Ha vasti impieghi in elettronica ed in
elettrotecnica come isolante; nell'industria chimica viene usato per la costruzione di pompe,
valvole, cuscinetti, guarnizioni, tubazioni, contenitori per sostanze fortemente corrosive; trova poi
impiego in moltissimi altri campi, sempre per le sue elevatissime proprietà isolanti e di stabilità
chimica è tra i materiali polimerici più costosi, ed è destinato esclusivamente ad impieghi di
qualità; se ne producono circa 70.000 tonn/anno. L'elevatissima inerzia chimica del PTFE è
dovuta al fatto che gli atomi di F, per le loro dimensioni (raggio=0,71A) e per la loro elevata
densità elettronica, costituiscono una efficace schermatura protettiva attorno alla catena degli
atomi di carbonio, a questo proposito si consideri che il polietilene ha la stessa struttura
molecolare del politetrafluoroetilene, ma essendo gli atomi di F sostituiti dai più piccoli atomi di
H (raggio=0,37 A), ha stabilità chimica assai minore, poichè la schermatura della catena di atomi
C da parte degli atomi H che ne risulta é meno efficace.
6. DEFINIZIONI DI PESO MOLECOLARE E SUA DISTIBUZIONE NELLE
REAZIONI DI POLICONDENSAZIONE.
A differenza di quanto accade per le molecole piccole, non risulta possibile assegnare ad un
campione polimerico un valore di massa molecolare esatto e caratteristico, ciò inquanto mentre
per le sostanze a basso peso molecolare la massa é una caratteristica specifica, unica per il
composto tale da poterne consentire addirittura l'identificazione, non altrettanto si verifica nel caso
delle macromolecole, con la sola eccezione di alcuni biopolimeri. E' inevitabile che nel corso del
processo di polimerizzazione, sia esso a stadi che a catena, si formino molecole di diversa
lunghezza a causa degli eventi che in parte casualmente ed in parte volutamente occorrono nel
corso della reazione; il prodotto polimerico che ne risulta sarà pertanto costituito da
macromolecole contenenti un differente numero di unità strutturali (grado di polimerizzazione) ed
aventi quindi differenti dimensioni e pesi molecolari. La massa molecolare dei polimeri deve
pertanto essere indicata necessariamente ricorrendo a valori medi per poter tenere in conto tali
diversità. Esistono diverse definizioni di peso molecolare medio. Il peso molecolare medio
numerale é difinito come il rapporto tra il peso di una certa quantità di polimero ed il numero di
macromolecole in esso presenti:
peso polimero
Mn =
=
numero macromolecole
∑ nM
i
i
= ∑ N iMi
i
∑n
(6.1)
i
i
i
dove ni é il numero delle macromolecole con peso molecolare Mi, Ni indica invece la frazione
molare di tali molecole e la sommatoria deve essere estesa a tutte le specie molecolari presenti. Il
grado di polimerizzazione medio numerale é dato quindi da:
Xn =
Mn
Mo
(6.2)
dove Mo é il peso molecolare dell'unità ripetente caratteristica della macromolecola. Un
secondo valore medio molto usato é quello indicato come peso molecolare medio ponderale, che é
dato dalla sommatoria, estesa a tutte le specie molecolari presenti, del prodotto delle frazioni
ponderali per i rispettivi pesi molecolari:
Mw = ∑ Wi Mi =
i
∑ wM
i
i
∑w
i
∑n
i
=
i
i
M2i
∑n
Mi
i
i
i
(6.3)
FRAZIONE IN PESO
Mn
Mw
PESO MOLECOLARE
Fig. 6.1. - Distribuzione delle masse molecolari.
Altre definizioni di peso molecolare medio pure vengono utilizzate, sono queste di tipo
operativo, in quanto il peso molecolare risulta determinabile in molti modi diversi, che vengono
variamente indicati a seconda della particolare metodologia utilizzata.
L'approccio statistico può essere convenientemente utilizzato per determinare la distribuzione
dei pesi molecolari delle macromolecole prodotte mediante una reazione di policondensazione. Si
rendono necessarie due sole ipotesi semplificatrici: la prima riguarda la reattività dei gruppi
funzionali, che é da assumersi necessariamente invariante col crescere delle dimensioni
dell'oligomero che le porta; con la seconda si assume invece la completa assenza di condensazioni
intramolecolari.
Per semplicità prendiamo in considerazione la polimerizzazione di un unico monomero
bifunzionale A-B, i risultati ottenibili rimangono comunque validi anche per la policondensazione
di due differenti monomeri (A-A e B-B).
Indichiamo con p la frazione dei gruppi funzionali iniziali che hanno reagito al tempo t, per il
loro elevato numero questa risulterà coincidere esattamente con la probabilità per un gruppo
funzionale di aver reagito all'istante t.
1-p sarà invece la probabilità di trovare al tempo t un gruppo funzionale ancora irreagito.
Calcoliamo ora la probabilità di trovare nel sistema, all'istante generico t, una intera
macromolecola con grado di polimerizzazione x. Degli x gruppi funzionali di un certo tipo,
contenuti nella macromolecola, x-1 avranno reagito e uno solo risulterà, in quanto terminale di
catena, irreagito. La probabilità (Px) d'esistenza di una unità x-mera sarà pertanto fornita dalla
espressione:
Px = p
(x-1)
1-p
Tale probabilità coincide con la frazione di molecole x-mere:
(6.4)
Px =
dove
Nx
N
(6.5)
é il numero di molecole x-mere e N il numero complessivo di molecole presenti nel
Nx
sistema all'istante t, pertanto:
Nx = N p (x-1) 1-p
(6.6)
o
detto N il numero delle molecole iniziali ed osservato che le molecole presenti nel sistema
all'istante t coincide con il numero di funzionali irreagiti, si ha:
(6.7)
N = N o 1-p
da cui:
Nx = N
o
2
x-1
1-p p
(6.8)
la frazione molare di molecole x-mere, che indichiamo con nx risulterà data da:
nx =
Nx
N
= o x
= 1-p p
N
N 1-p
x-1
(6.9)
Invece la frazione in peso di molecole x-mere risulterà data da:
wx =
in cui con
Wx
Wx
∑ Wx
=
x Nx M
o
N M
o
o
=
x Nx
N
o
(6.10)
o
si é indicato il peso delle specie x-mere e con M il peso molecolare dell'unità
monomerica (si ritengono trascurabili eventuali variazioni di massa dovute alla perdita di molecole
piccole durante la condensazione). Si ricava così la funzione di distribuzione ponderale:
wx = x 1-p
2
p
x-1
(6.11)
Dalle funzioni di distribuzione così ricavate e poi possibile determinare i valori del grado di
polimerizzazione medio numerico e medio ponderale. Essendo per definizione:
∞
∞
∑
Xn =
∑ Nx x
Nx x
x=1
∞
x=1
=
∑
x=1
∞
=
N
∑
x=1
nx x
(6.12)
Nx
da cui:
∞
∑
Xn =
1-p p x-1 x = 1
1-p
x=1
(6.13)
analogamente dalla definizione di grado di polimerizzazione medio ponderale:
∞
∑ Wx x
Xw =
x=1
=
∞
∑
x=1
∞
∑ wx x
x=1
(6.14)
Wx
da cui:
∞
Xw =
∑
x=1
1-p
2
x2 p
x-1
=
1+p
1-p
(6.15)
7. GRADO DI POLIMERIZZAZIONE MEDIO NUMERICO NELLE REAZIONI DI
POLIADDIZIONE.
I processi elementari che hanno luogo nel corso di una reazione di polimerizzazione a catena,
come ad esempio una poliaddizione di tipo radicalica, risultano essere in numero decisamente
elevato. E' tuttavia possibile costruire un modello cinetico di sufficiente correttezza teorica ma di
altrettanta seplicità che consenta di valutare il grado di polimerizzazione raggiunto a fine reazione,
trascurando tutti quei processi elementari meno importanti poiché ricorrenti con frequenza
inferiore nel corso del processo di polimerizzazione. Ad esempio, reazioni come il trasferimento
di catena, la depropagazione e rare forme di terminazione possono con buona approssimazione
non essere prese in considerazione per un tale tipo di modello cinetico semplificato. Una ulteriore
ipotesi semplificatrice, sicuramente accettabile, risulta inoltre necessaria per il suo sviluppo:
questa ipotesi sostiene che la reattività dei radicali polimerici risulti indipendentemente dalle
dimensioni della catena polimerica in crescita su cui sono collocati. Questa assunzione é più che
giustificata se si pensa che la reattività del centro attivo é determinata, unicamente, dalla struttura
molecolare presente nelle sue immediate vicinanze. Le costanti cinetiche delle reazioni elementari
che coinvolgono i radicali in accrescimento sono quindi indipendenti dalla lunghezza della catena
e, con buona approssimazione, a basse conversioni anche dal grado di avanzamento della
reazione. Lo schema cinetico fondamentale che ne risulta ad esempio per una reazione radicalica
diviene pertanto:
Inizio:
I → nR
ki
R+M
P1
→
Propagazione:
P1 + M
P2 + M
kp
P2
→
kp
→
...................
...................
Pn + M
kp
→
P3
P(n+1)
Terminazione:
Pn + P m → P (n+m)
Pn + P m → Pn + Pm
dove con M é indicato il monomero, con R i radicali primari, con P1 , P 2 , ... Pn i radicali in
accrescimento, costituiti rispettivamente da 1, 2, ...n unità monomeriche e, infine, con P n, P m
molecole di polimero "morte" costituite da n ed m unità monomeriche.
La velocità di polimerizzazione é data dalla rapidità con cui scompare il monomero
dall'ambiente di reazione e quindi dalla somma algebrica della velocità di inizio e della velocità di
propagazione:
-
dove
P =
∑
n
Pn
dM
= v i + v p = ki R M + kp P M
dt
(7.1)
é la concentrazione totale dei radicali polimerici in accrescimento,
prescindendo dalle loro singole dimensioni.
Affinché la reazione di polimerizzazione possa portare alla costituzione di alti polimeri é
necessario che la propagazione avvenga con notevole frequenza e dovrà pertanto aversi che la
reazione di propagazione si svolge più rapidamente di quella di inizio. La relazione precedente si
riduce quindi a:
-
dM
dt
≈ vp = kp P M
(7.2)
Si possono poi scrivere i seguenti bilanci di materia per i radicali:
dR
= vR - v i = vR - k i R M
dt
dP
dt
= v i - v t = ki R M - kt P
(7.3)
2
dove con vR é stata indicata la velocità di produzione dei radicali primari, con
terminazione e con kt la costante globale di terminazione ( kt = k't + k"t ).
(7.4)
vt
quella di
Queste equazioni definiscono un sistema di equazioni differenziali che può essere risolto
agevolmente mediante l'approssimazione dello stato pseudo stazionario di largo uso in cinetica
chimica. Fisicamente esso consiste nell'assumere che la velocità con cui scompaiono i radicali,
inizialmente nulla, vada rapidamente crescendo fino a coincidere con quella con cui si formano.
Quando si verifica ciò la concentrazione di
R
rimane costante nel tempo e quindi
dR
= 0 . Lo
dt
stato stazionario risulta ovviamente assumibile per tutte le specie radicaliche presenti nel sistema e
pertanto anche per i radicali polimerici in accrescimento.
Essendo quindi:
dR
dP
=
= 0
dt
dt
(7.5)
si ha:
0 = v R - ki R
(7.6)
M
0 = ki R M - k t P
2
(7.7)
da cui:
R =
vR
ki M
(7.8)
P
P
2
2
=
=
ki R M
kt
(7.9)
ki M vR
kt ki M
(7.10)
1
P =
v2
(7.11)
R
1
k2t
e quindi:
1
k v2
dM
vp = = kp P M = p 1 R M
dt
k 2t
(7.12)
con l'impiego di iniziatori si può anche scrivere:
(7.13)
vR = 2kd I
e la relazione precedente diviene:
vp =
2kd
kt
1
2
kP I
1
2
M
(7.14)
Il grado di polimerizzazione medio numerico, cioé il numero di unità monomeriche contenute
in media in una molecola di polimero deve essere coincidente con il rapporto tra il numero di
molecole di monomero polimerizzate ed il numero di molecole di polimero formate. Il grado di
polimerizzazione medio raggiunto nell'istante t può quindi scriversi come:
Xn =
velocità istantanea di propagazione
velocità istantanea di formazione di polimero morto
-dM
vP
dt
Xn = v =
2
t
kt P
(7.15)
(7.16)
il grado di polimerizzazione medio che ne risulta invece dopo un tempo t é dato dalla
espressione seguente:
t
dM
dt
dt
0
Xn =
(7.17)
t
Vtdt
0
sostituendovi l'espressioni sopra ricavate si ottiene:
t
1
kP v2R
1
k 2t
Xn =
t
kP
M dt
0
1
v M dt
1
2
t
k
=
t
t
1
2
R
0
2
kt P dt
kt
0
kP
=
t
v
1 2
2
R
1
2t
v 2R M dt
0
1
(7.18)
t
k 2t
v R dt
dt
k
0
0
da cui, tenendo conto che:
(7.19)
vR = 2kd I
si ottiene in definitiva:
t
Xn =
kP
k
t
2k d
1
2
I
1
2
0
1
2
t
1
M dt
I 2 M dt
=
t
kP
2k dk t
0
(7.20)
t
2k d I dt
I dt
0
0
a basse conversioni é possibile assumere gli integrandi indipendenti dal tempo per ottenere:
Xn =
kP
M
2kdk t I 12
(7.21)
mediante la quale risulta possibile valutare il grado di polimerizzazione medio numerico
quando sono conosciuti i valori delle costanti cinetiche dello stadio di propagazione e dello stadio
di terminazione e le concentrazioni iniziali del monomero e dell'iniziatore.
8.
METODI
SPERIMENTALI
PER
IL
FRAZIONAMENTO
DETERMINAZIONE DEI PESI MOLECOLARI
E
LA
8.1. Frazionamento delle macromolecole
Siccome la solubilità delle macromolecole, in un dato solvente, dipende (a parte dal grado di
stereoregolarità) dalla massa molecolare e precisamente decresce col crescere di essa, convenienti
metodi di frazionamento di campioni omodispersi risultano essere sia l'estrazione frazionata
con solventi bollenti, di diversa polarità e punto di ebollizione, che la cristallizzazione
frazionata eseguita sommando proggressivamente ad una soluzione polimerica diluita volumi
crescenti di un liquido non solvente e separando di volta in volta, dopo ricristallizzazione, la
frazione polimerica precipitata (coacervato). Le singole frazioni possono poi essere ulteriormente
frazionate solubilizzandole nuovamente e poi riprecipitandole agendo sia sulla temperatura, che
con nuovi rapporti solvente-non solvente. Entrambe le procedure risultano tuttavia lunghe e
laboriose.
La metodologia che attualmente é di più largo utilizzo per il frazionamento dei polimeri
polidispersi e la contemporanea determinazione della curva di distribuzione dei pesi molecolari é
basata sul metodo cromatografico. La particolare tecnica utilizzata prende il nome di
cromatografia di filtrazione e di permeazione su geli (gel permeation chromatography, GPC).
La tecnica di filtrazione su geli é propriamente la denominazione che fu data da Flodin e
collaboratori ad un metodo di separazione da loro ideato, in cui un polimero idrosolubile veniva
eluito su una colonna impaccata con un polimero idrofilo reticolato, opportunamente rigonfiato
dal liquido eluente. La seconda terminologia é stata utilizzata in riferimento ad una tecnica
sviluppata da Moore per la separazione di polimeri organici idrofobi mediante una colonna
impaccata con del polistirene reticolato, rigonfiato dal liquido eluente. Nella realtà il gel
polimerico non costituisce un componente indispensabile della tecnica cromatografica dal
momento che una colonna impaccata con polvere di un materiale vetroso di adatta porosità
potrebbe funzionare altrettanto bene. Il principio, su cui la tecnica risulta fondata, é il seguente: il
materiale polimerico da frazionare viene solubilizzato in un adatto solvente, in questo le singole
macromolecole assumono la forma di un gomitolo statistico (random coil) avente un proprio
caratteristico volume idrodinamico (dipendente dalla misura in cui le interazioni intramolecolari
risultano favorite rispetto a quelle con le molecole di solvente). Quando la soluzione attraversa la
colonna inpaccata, le macromolecole di maggiori dimensioni non possono penetrare in nessuno
dei pori presenti sulle particelle di gel e pertanto rapidamente escono, irrisolte, dalla colonna
cromatografica; le macromolecole di minori dimensioni possono invece attardarsi a diffondere
attraverso tutti i pori presenti nelle particelle di gel e verranno pertanto eluite per ultime,
praticamente ancora irrisolte. Le macromolecole con dimensioni intermedie potranno invece
penetrare solo nei pori con una luce superiore ad un certo valore, attardandosi così in misura
diversa a diffondere nelle particelle di gel e ciò che ne risulterà sarà una eluizione differenziale. La
risoluzione sarà tanto maggiore quanto più é ampia la distribuzione dei pori del gel cosa che
dipende, come la distribuzione dei volumi idrodinamici del polimero, dalla natura del solvente
utilizzato. Stando al principio su cui tale tecnica é fondata, una denominazione più appropriata é
cromatografia liquida di esclusione. Quando l'impaccante é un vetro poroso é possibile
determinare la distribuzione delle dimensioni dei pori per mezzo di un porosimetro a mercurio ed
é stato così verificato che diametri dei pori da 10 a 250 nm sono necessari per la separazione di
macromolecole con un peso molecolare medio compreso nell'intervallo tra 10 3 a 10 7 u.m.a.. In
condizioni isoterme, e a velocità di flusso costante, il volume di ritensione, cioé il volume d'eluente
necessario per allontanare completamente dalla colonna il campione polimerico, é una funzione
esclusiva del volume idrodinamico del polimero in quello specifico solvente. Di conseguenza é
possibile costruire una curva di calibrazione, per differenti tipi di polimeri, ricorrendo a frazioni
polimeriche omodisperse, dal peso molecolare noto, mediante cui é poi possibile determinare i
valori incogniti dei pesi molecolari di campioni di uguale natura.
La distribuzione dei pesi molecolari può essere trovata riportando le concentrazioni relative del
polimero nell'eluato in funzione del volume di eluente utilizzato e valutando successivamente il
peso molecolare della frazione scelta come riferimento.
Lavori recenti hanno mostrato come una curva di calibrazione, ottenuta riportando il prodotto
del peso molecolare per la viscosità intrinseca del polimero verso il volume di ritensione, coincide
esattamente per macromolecole aventi sia un differente grado di ramificazione che una diversa
composizione e che, pertanto, una curva di calibrazione universale risulta praticamente realizzabile
.
L'apparato sperimentale richiesto nella cromatografia di esclusione é quello che viene
ordinariamente utilizzato anche in altre tecniche di cromatografia liquida e cioé un cromatografo
HPLC. Il rivelatore ordinariamente utilizzato é uno spettrofotometro infrarosso regolato sulla
lunghezza d'onda di assorbimento di un gruppo funzionale caratteristico della macromolecola.
8.2 Determinazione dei pesi molecolari
La determinazione del numero esatto di molecole organiche contenute in un certo campione
polimerico é possibile mediante la semplice valutazione della concentrazione dei gruppi
funzionali, quando però né sia noto con esattezza il numero presente in ciascuna molecola.
Analogamente nel caso di un polimero lineare, come ad esempio un poliestere, la semplice
titolazione mediante una soluzione standardizzata di idrossido di sodio é in grado di fornire il
numero complessivo di gruppi carbossilici presenti. Essendo poi noto che ciascuna
macromolecola contiene un solo gruppo carbossilico, il valore determinato é proprio il numero
delle macromolecole presenti. Il dosaggio dei gruppi funzionali può essere eseguito anche in
maniera più accurata, utilizzando opportuni metodi di indagine chimico-fisica, ad esempio tramite
metodi spettroscopici (IR) o ricorrendo all'uso di traccianti isotopici. Con ciascuno di questi
metodi é possibile valutare il grado di polimerizzazione medio numerico determinando il rapporto
tra il numero di unità monomeriche polimerizzate ed il numero di molecole polimeriche presenti
nel sistema. Da questo é poi ottenibile il peso molecolare medio numerico semplicemente
moltiplicando il grado di polimerizzazione per il peso della particolare unità strutturale ripetente
presente nel polimero.
L'abbassamento del punto di congelamento o l'innalzamento della temperatura di ebollizione di
un solvente per aggiunta di un soluto non volatile e non elettrolita, sono due importanti proprietà
colligative che cioé dipendono esclusivamente dal numero delle molecole di soluto presenti in
soluzione e non dalla loro particolare natura. A queste proprietà, dette colligative, si può ricorrere
per la determinazione del peso molecolare di un soluto. All'abbassamento crioscopico spesso si
ricorre in chimica organica per la caratterizzazione delle molecole a basso peso molecolare.
L'abbassamento crioscopico, Tf-T, é legato alla temperatura di fusione del solvente T f, al calore
latente di fusione ∆Hf, al peso molecolare del solvente M1 e del soluto M2 ed all'ammontare di
solvente w1 e soluto w2 , tramite la relazione:
Tf-T =
2
f
RT
M w
1
2
∆Hf M2 w1
(8.2.1)
dove R é la costante universale dei gas. Per una soluzione di 1g di polietilene con M2 =500 in
100g di canfora (Tf=178.4°C, ∆Hf=2.58 kcal/mol, M1 =152), Tf-T é 0.48°C. Al crescere del peso
molecolare del soluto, l'abassamento crioscopico si va via via riducendo ed una apparecchiatura
sempre più sensibile e sofisticata viene ad essere, di conseguenza, richiesta. Per misurare il
numero delle molecole presenti mediante metodi basati sulle proprità colligative é necessario
utilizzare soluzioni polimeriche diluite. Nella pratica i valori ritrovati per soluzioni diluite di
diversa concentrazione vengono poi estrapolati a diluizione infinita mediante opportune tecniche
di linearizzazione. La pressione osmotica risulta un metodo di misura di grande utilità pratica. Sui
due lati di una membrana semipermeabile, tipicamente fatta in cellophane, vengono poste la
soluzione polimerica ed il solvente puro. La membrana é una sorta di setaccio molecolare che
viene scelto in modo da essere permeabile alle molecole di solvente ma non alle macromolecole, la
velocità di diffusione del polimero attraverso la membrana, risulta al disopra di un certo peso
molecolare, talmente ridotta che un comportamento ideale può essere sicuramente assunto per
essa. Per consentire all'equilibrio di stabilirsi é necessario aumentare la pressione dal lato della
soluzione. La pressione osmotica π può essere misurata per soluzioni polimeriche di diversa
concentrazione. Il peso molecolare medio delle macromolecole in soluzione può essere valutato in
accordo con la seguente relazione:
π
c
c=0
= RT
M
(8.2.2)
in cui:
= pressione osmotica (g/cm2);
c = concentrazione, g/cm3;
T = temperatura assoluta, K;
M = peso molecolare, g/mol;
R = costante universale dei gas, 8.48x104 g cm/mol K.
La relazione tra la pressione osmotica e l'abbassamento della tensione di vapore può essere
illustrata considerando una situazione in cui si pone il solvente puro ad una pressione totale P(0),
si aumenta la tensione di vapore portando la pressione totale a P(0)+π, quindi si riduce la
tensione di vapore aggiungendo un soluto fino ad ottenere una frazione molare N 2 . Assumendo
un comportamento ideale per la soluzione ed il gas perfetto, la condizione per l'equilibrio del
solvente tra la prima e la seconda condizione e che la tensione di vapore p nel solvente puro a
P(0) eguaglia quello della soluzione a P(0)+π. La variazione della tensione di vapore del solvente
con la pressione totale P(T) e data dalla equazione di Poynting:
V
dp
= l
dP(T)
Vg
(8.2.3)
dove V1 é il volume molare del solvente in fase liquida e Vg é il volume molare del solvente in
fase gassosa. Assumendo un comportamento ideale per il gas, si può rimpiazzare Vg con RT/p ed
integrare:
p π
RT
p 0 +π
d lnp = V1
p 0
dP T
(8.2.4)
p 0
da cui:
RT ln
pπ
p0
= Vl π
(8.2.5)
in cui la tensione di vapore risulta incrementata come espresso dai limiti di integrazione quando
la pressione totale viene aumentata della pressione osmotica π. La successiva riduzione della
tensione di vapore avviene addizionando il soluto in accordo con la legge di Raoult, p(N2 ,π)
=N 1 p(0,π). La condizione finale é che p(N2 ,π) é uguale a p(0). Anche, quando N1 é vicino ad 1, -
lnN1 può essere approssimato con 1-N1 , che coincide con N2 , la frazione molare del soluto. Se si
pone al posto di N2 la quantità cV1 /M2 , facendo attenzione alle unità, si ottiene:
pπ
RT ln
p0
= RT ln
p 0,π
p N2, π
= -RT lnN1 = RTN2 =
RTcV1
= V1π
M2
(8.2.6)
E' quindi evidente come la pressione osmotica risulti notevolmente elevata se comparata alla
diminuzione della tensione di vapore, poiché corrisponde ad un cambiamento nella pressione
totale che ne causa l'abassamento. Riarrangiando l'equazione e ponendo infine il cambiamento
della tensione di vapore, per un cambio nella pressione totale, uguale alla pressione osmotica, si é
visto che il rapporto é quello dei volumi di vapore e liquido con ugual peso (generalmente un
fattore di parecchie centinaia).
V
π = g
Vl
∆p
(8.2.7)
L'equazione (8.2.2) vale soltanto a diluizione infinita o in un solvente θ; a concentrazioni finite
la pressione osmotica viene meglio rappresentata mediante una espressione del tipo:
π M = 1 + A Mc + A M2c2
c RT
2
3
(8.2.8)
dove A2 e A3 sono il secondo ed il terzo coefficiente del viriale. Spesso A3 può essere assunto
pari a (A2 /2)2 , così che l'equazione possa essere convenientemente riscritta nella forma:
π
c
1
2
= RT
M
1
2
1+
A2 Mc
2
(8.2.9)
1
Diagrammando πc 2 in funzione della concentrazione spesso si ottiene un andamento lineare
che consente poi l'estrapolazione a diluizione infinita. Il secondo coefficiente del viriale é
ottenibile da un tale diagramma dividendo la pendenza per l'intercetta e per M/2.
La pressione osmotica é, tra i metodi di misura basati sulle proprietà colligative, sicuramente la
più utilizzata. Tuttavia la preparazione della membrana risulta spesso laboriosa, l'equilibrio viene
raggiunto piùtosto lentamente, e inoltre la pressione osmotica π decresce velocemente al crescere
del peso molecolare. L'osmometro automatico, strumentazione ormai disponibile in commercio,
opera sul principio del punto nullo. La pressione del solvente viene cioé aggiustata tramite un
servomeccanismo finché il sensore non misura più alcuna tendenza per il solvente a fluire
attraverso la membrana in entrambe le direzioni. L'equilibrio può essere raggiunto in soli 5 o 10
minuti così che una tale misura risulta, per la rapidità d'esecuzione, di maggiore convenienza
rispetto ad una di viscosità. Pesi molecolari compresi tra 10000 e 500000 u.m.a. possono essere
misurati con una accuratezza del 1% circa. Al di sotto dei 10000 u.m.a. la maggior parte dei
polimeri penetra i materiali ordinariamente utilizzati come membrane. Quando un polimero a
basso peso molecolare viene posto in un osmometro, la velocità di diffusione del polimero
attraverso la membrana é apprezzabile dal momento che v'é un impulso nella pressione necessaria
a mantenere un flusso nullo di solvente. Poiché la velocità di diffusione diminuisce con
l'aumentare delle dimensioni molecolari, il flusso osmotico con il tempo può essere calibbrato per
dare il peso molecolare di un polimero specifico malgrado la penetrazione della membrana.
Questo non è un metodo assoluto. Per pesi molecolari minori di 20000, un altra tecnica è stata
ormai automatizzata. Nel così detto osmometro a tensione di vapore non c'é membrana. Una
goccia di soluzione polimerica ed una goccia di solvente puro vengono posti su due termistori
adiacenti. La variazione di temperatura che risulta dalla differente evaporazione e condensazione
può venire calibrata in termini di peso molecolare medio del soluto. Il metodo é rapido, benché
diverse concentrazioni ed estrapolazioni a diluizione infinita sono spesso necessarie.
La diffusione della luce ad opera di piccole particelle (light scattering) é un fenomeno ben
conosciuto, come, ad esempio, quando si osserva la comparsa di particelle di pulviscolo in un
raggio di luce solare. Analogamente, se le molecole di polimero vengono disciolte in un adatto
solvente, la luce diffusa dal polimero é maggiore di quella diffusa dal solvente ed un metodo
assoluto di misura del peso molecolare ne può conseguire. La relazione utilizzata é quella di
Debye:
H'c =
1 + 2A c
2
k
MP(θ)
(8.2.10)
in cui H' é una costante che include i fattori geometrici e tiene conto della variazione dell'indice
di rifrazione con la concentrazione del polimero per il particolare sistema polimero-solvente in
esame. Questo ultimo parametro viene generalmente valutato, in un esperimento eseguito a parte,
ricorrendo all'uso di un diffrattometro differenziale. Viene misurata l'intensità della luce, l'angolo
θ e la concentrazione c. Il secondo coefficiente viriale A2 e la forma della funzione complessa
P(θ) vengono generalmente ottenuti da determinazioni sperimentali. Il fattore k, relativo alla
intensità della luce diffusa, viene derivato mediante un galvanometro leggendo Ig quando la
fotocellula collegatagli é ad un angolo θ dalla direzione del raggio incidente (fig.8.2.1),
cella
Fascio incidente di
luce monocromatica
0°
Rivelatore
45°
135°
90°
Fig.8.2.1 - Misura dell'intensità del fascio diffuso a vari angoli.
servendosi della relazione:
k =
Ig-Igs sinθ
1+cos 2θ
(8.2.11)
Poiché é noto che P(θ)=1 a θ=0, abitualmente si estrapola a θ=0° e c=0. Ciò può essere
ottenuto plottando H'c/k verso la concentrazione per valori costanti di θ e poi plottando l'intercetta
1/MP(θ) verso sin2 (θ/2) per dare l'intercetta 1/M. Entrambi possono essere dati simultaneamente
in un grafico di Zimm dove un diagramma a rete viene costruito. Come per la pressione osmotica,
le misure in un solvente "povero" forniscono un basso valore per A2 . L'estrapolazione a θ=0° é
eliminabile se la diffusione può venire misurata ad angoli dal fascio incidente inferiori a 2°.
Questo diviene possibile quando la sorgente di luce incidente é un sottile fascio laser. Se il
volume della cella é sufficientemente piccolo, é possibile utilizzare il dispositivo anche come
detector in una colonna cromatografica (GPC o HPLC). Con l'appropriato apparato ausiliario ed i
dispositivi per il calcolo, l'effluente dalla colonna può essere analizzato in termini di peso
molecolare, direttamente e senza ricorrere ad una calibrazione separata con pesi molecolari
standard.
Per vedere quale tipo di peso molecolare medio é possibile misurare mediante diffusione della
luce, possiamo esaminare il contributo apportato dalle singole macromolecole al fattore k. Per un
polimero monodisperso i a θ=0° si ha:
H'ci
= 1
ki
Mi
(8.2.12)
per un polimero polidisperso
k =
∑
ki =
∑
(8.2.13)
H' ci Mi
essendo la concentrazione totale c:
c =
Il peso molecolare medio
totale:
M
M =
Essendo
ci
c
∑ ci
(8.2.14)
é ottenibile dalla diffusione complessiva e dalla concentrazione
k
H'c
=
∑
H'ciMi
H'c
=
∑
ci Mi
=
c
∑
wi Mi
(8.2.15)
uguale alla frazione ponderale del componente i, cioé wi, il peso molecolare medio
coincide esattamente con Mw.
Il problema maggiore del metodo ora descritto é la presenza, nella soluzione, di particelle di
pulviscolo o, anche, particelle di polimero coagulato. Anche una minuta concentrazione di queste
riesce ad oscurare la diffusione prodotta dalle particelle di polimero in soluzione, facendo così
risultare Mw = ∞ . La rimozione della polvere mediante ultracentrifugazione della soluzione può
essere un utile espediente, tuttavia é questo una procedura estremamente costosa.
La stessa ultracentrifuga può essere convenientemente utilizzata per determinare la
distribuzione dei pesi molecolari. Sotto campi gravitazionali eccezionalmente elevati, i polimeri si
separano dalla soluzione così come fanno delle goccioline passando attraverso un fluido viscoso,
in accordo con la legge di Stokes. In una ultracentrifuga il moto Browniano delle molecole é
esattamente bilanciato da un campo centrifugo e la velocità di sedimentazione viene misurata. Una
cella riscaldante la soluzione viene posta in un sistema che ruota a circa 70000 rpm. Il gradiente
di concentrazione attraverso la cella viene stimato utilizzando la misura dell'indice di rifrazione.
Poiché l'estrapolazione a c=0 é ancora necessaria e la differenza nell'indice di rifrazione deve
essere grande, l'ultracentrifuga risulta di grande utilità solo con talune classi di polimeri, per
esempio, proteine. La tecnica non é stata largamente utilizzata, come l'osmometria ed il metodo
della diffusione della luce, per misure assolute di peso molecolare. Un grosso vantaggio della
ultracentrifuga é che l'intera distribuzione delle masse molecolari é ottenibile e non solo una
frazione più o meno ampia, dai pesi molecolari medi. Non solo Mw viene misurato
sperimentalmente, ma anche M n , M z, etc. vengono direttamente determinati, senza ricorrere a
modelli matematici.
Una proprietà idrodinamica delle soluzioni di macromolecole, che dipende dal peso
molecolare, é la loro viscosità. Diversamente dai metodi precedentemente esaminati per ottenere
pesi molecolari, le misure di viscosità non danno valori assoluti. Tuttavia queste determinazioni
vengono eseguite facilmente e trovano un vasto impiego nella valutazione del peso molecolare di
un dato campione. Bisogna fare uso di misure di standardizzazione, che vengono eseguite
determinando la viscosità di soluzioni campione, contenenti frazioni di polimero, i cui pesi
molecolari siano stati già valutati con metodi assoluti. L'aggiunta di molecole di polimero ad un
dato solvente, invariabilmente aumenta la viscosità, rispetto a quella del solvente puro. Per
correlare questo incremento alle proprietà del soluto si utilizzano un certo numero di funzioni
delle viscosità misurabili.
SIMBOLO
η
ηs
ηr =η/ηs
NOME
UNITA' DI MISURA
viscosità della soluzione
Poise o Pa.s
viscosità del solvente
Poise o Pa.s
viscosità relativa
Adimensionale
ηsp =ηr -1
viscosità specifica
Adimensionale
(lnηr )/c
viscosità inerente
dl/g
ηsp /c
viscosità ridotta
dl/g
Tab.8.1 Parametri viscosimetrici
Vengono riassunte nella tabella 8.1 le principali caratteristiche viscosimetriche di una soluzione
polimerica diluita. Una ulteriore importantisima proprietà é rappresentata dalla viscosità
intrinseca, indicata con η . La viscosità intrinseca é definita come il rapporto tra la viscosità
specifica e la concentrazione, in condizioni di diluizione infinita. E cioé, precisamente:
η
=
lim η-ηs
lim η sp
= C
C →o cη
→o c
s
(8.2.16)
in cui η e ηs risultano, rispettivamente, i valori delle viscosità della soluzione e del solvente. Si
deve tenere in conto che soltanto η e ηs hanno le dimensioni di una viscosità. La viscosità
specifica e la viscosità relativa risultano adimensionali. La viscosità intrinseca, la viscosità ridotta e
la viscosità inerente hanno le dimensioni di un inverso della concentrazione. La concentrazione
viene ordinariamente espressa in questo caso particolare come grammi di polimero per decilitro
(100ml) di soluzione. Se ηsp /c o lnηr/c viene plottato verso la concentrazione, ciò che ne risulta é
un diagramma lineare corrispondente, rispettivamente, o alla equazione proposta da Huggins:
ηsp
=
c
η + k' η 2 c
(8.2.17)
o dall'equazione di Kraemer:
lnη r
= η - k" η 2 c
c
(8.2.18)
Per quanto riguarda i parametri contenuti, per molte soluzioni di polimeri in buoni solventi si é
trovato che:
k' = 0,4 ± 0,1
k" = 0,05 ± 0,05
Tuttavia le equazioni sopra riportate sono applicabili soltanto per soluzioni diluite dove ηr é
inferiore a 2. Staudinger fu il primo a proporre una espressione semiempirica ( η =KM) in grado
di legare la viscosità intrinseca al peso molecolare medio per una data coppia polimero-solvente.
Il peso molecolare così determinabile viene definito come peso molecolare medio viscosimetrico
Mv e l'espressione più utilizzata per correlarlo alla viscosità intrinseca é quella, a due parametri,
proposta da Mark-Houwink:
η = K' Mα
(8.2.19)
che predice che log η é una funzione lineare di logMv . Valori di K' ed α per i principali
materiali polimerici di largo utilizzo sono riportati in tabella 8.2. Il valore di α dipende dalla
forma del polimero, ma per polimeri della stessa forma, per esempio gomitoli statistici, il valore di
η fornisce un modo per stimare la massa molecolare.
POLIMERO
SOLVENTE
TEMPERATURA
(°C)
K' x 10 5
Triacetato di cellulosa
acetone
25
8,97
Gomma SBR
benzene
25
54
Gomma naturale
benzene
30
18,5
"
n-propilchetone
14,5
119
Poliacrilammide
acqua
30
68
Poliacrilonitrile
dimetilformammide
25
23,3
Polidimetilsilossano
toluene
20
20,0
Polietilene
decalina
135
62
Poliisobutilene
benzene
24
107
"
benzene
40
43
"
cicloesano
30
27,6
Polimetilmetacrilato
toluene
25
7,1
Polistirene atattico
toluene
30
11,0
Polistirene isotattico
toluene
30
10,6
Polivinilacetato
benzene
30
22
"
etil,n-butil chetone
29
92,9
Polivinilcloruro
tetraidrofurano
20
3,63
Tab.8.2 Prametri per l'equazione di Mark-Houwink
0,90
0,66
0,74
0,50
0,66
0,75
0,66
0,70
0,50
0,60
0,69
0,73
0,725
0,725
0,65
0,50
0,92
RIFERIMENTI BIBLIOGRAFICI
1. F. Ciardelli, M. Farina, P. Giusti, S. Cesca, "MACROMOLECOLE SCIENZA E
TECNOLOGIA ", AIM, Pacini Editore, Pisa.
2. F. Rodriguez, "PRINCIPLES OF POLYMER SYSTEMS ", International Student Edition,
1983.
3. R. Y. Young, "INTODUCTION TO POLYMERS ", Chapman and Hall.
4. H. Morawetz, "POLYMERS THE ORIGINS AND GROWTH OF A SCIENCE ", John
Wiley.
5. B. Wunderlich, "MACROMOLECULAR PHYSICS ", Crystal Melting, Vol.3, Academic
Press.
6. G. Odian, "PRINCIPLES OF POLYMERIZATION ", McGaw-Hill, New York, 1970.