UNIVERSITA
G. d ANNUNZIO -CHIETIPESCARA
DIPARTIMENTO DI SCIENZE BIOMEDICHE
Sezione di Terapia Medica
CORSO DI PERFEZIONAMENTO
IN
MEDICINA BIOINTEGRATA
www.centrostellamaris.it
Psico-Neuro-EndocrinoImmunologia-Genetica
(PNEIG)
in
Medicina Biointegrata
Programma AA.2010-2011
•
Definizione di PNEI. Il Sistema nervoso: le cellule del SN e loro connessioni; il tronco
encefalo, diencefalo, SNV. Sistema endocrino: gli ormoni, loro funzioni e
comunicazioni. Controllo cerebrale sul Sistema endocrino. Assi neuroendocrini:
ipotalamo-ipofisi, ipotalamo-ipofisi-surreni, ipotalamo-ipofisi-tiroide, ipotalamo-ipofisi-
Sistema immunitario: cenni di
immunologia (teoria della selezione
clonale, immunità naturale ed acquisita,
sistema HLA, sistema immunitario come
organo di senso, produzione da parte del
sistema immunitario di ormoni (che
fungono da mediatori tra cervello e
sistema endocrino). Cervello e psiche. La grande connessione:
gonadi.
Sistema nervoso ed immunità; sistema dello stress; sistema endocrino e cervello.
Endocrinosenescenza e P.N.E.I. DCA prototipo di PNEIG
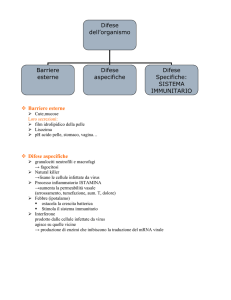
SISTEMA IMMUNITARIO
• Le scoperte degli ultimi anni hanno
rivoluzionato l immagine del SI. La tradizionale
concezione del sistema immunitario come puro
meccanismo difensivo comandato dallo stimolo
antigenico è stata ormai abbandonata.
• Le cellule immunitarie interagiscono
costantemente con il sistema nervoso e il
sistema endocrino a tal punto che non c è
modificazione del SN che non si associ a
modificazioni del SE e SI e viceversa.
• Come può avvenire tutto questo?
• Le fibre del SNA innervano gli organi linfatici
avvolgendoli e infiltrandoli creando delle
strettissime connessioni con i linfociti:
giunzioni neuroimmunitarie
• ogni minima variazione nell equilibrio del
sistema simpatico-parasimpatico viene
registrata dalle cellule immunitarie.
• sulla parete cellulare dei linfociti recettori per
una serie di sostanze che possono attivare o
inibire le loro funzioni , giustificando l influenza
della mente sul sistema immunitario.
• Questi recettori sono come serrature che si
possono aprire avviando delle attività cellulari e
le molecole che interagiscono con essi sono
neurotrasmettitori, neuropeptidi, ormoni.
• I linfociti posseggono recettori per i
neurotrasmettitori del SNA, NA, adrenalina,
acetilcolina. Così ogni minima modificazione
del sistema simpatico-parasimpatico, e della
concentrazione dei suoi neurotrasmettitori, a
livello delle giunzioni neuroimmunitarie,
produrrà i suoi effetti sulle cellule immunitarie
stesse, che verranno più o meno stimolate. In
esperimenti su animali, denervando linfonodi e
milza, organi nei quali le cellule immunitarie
vengono immagazzinate e prodotte, la risposta
immunitaria dopo inoculazione di un virus, era
enormemente ridotta. Dunque il SN non solo è
collegato a quello immunitario, ma è essenziale
per una funzione immunitaria appropriata.
• Se consideriamo poi quanto il sistema nervoso
autonomo, attraverso una eccitazione o
inibizione del simpatico o del parasimpatico,
possa far esprimere a tutto il corpo una
emozione nata nel sistema nervoso centrale,
allora ci apparirà sempre più evidente il nesso
tra emozioni e sistema immunitario.
Altri recettori linfocitari sono specifici per i
neuropeptidi ipotalamici e ipofisari:
CRH, TRH, GRF, GnRH, encefaline, endorfine,
ACTH, VIP, sostanza P, alfaMSH, prolattina e
per ormoni propriamente detti quali estrogeni,
ormoni tiroidei ecc.
• Ogni nuovo assetto neuroendocrino, al variare
delle richieste del nostro corpo per fronteggiare
gli eventi della vita, da ritmi sonno-veglia, alle
cicliche modificazioni ormonali, alle continue
sollecitazioni del mondo esterno che richiedono
adattamenti fisici e psichici, alle emozioni più o
meno forti, si associa ad un adattamento del SI.
E come il SN è in grado di apprendere e di
memorizzare, così anche il SI, è capace di
riconoscere il "sé" dall estraneo e di produrre
quella memoria immunitaria che ci protegge da
nuove aggressioni dello stesso virus o che ci
rende immunodepressi di fronte anche al solo
ricordo di un evento stressante
Noxae patogene 1
agenti patogeni (definiti "antigeni" quando in grado di
indurre la produzione di anticorpi specifici) quali:
- Parassiti (ascaridi, nematelminti, tenie), i più voluminosi ma
non i più temibili, assunti perlopiù tramite cibi contaminati;
- Protozoi (trichomonosa, tovoplasmi), organismi
unicellulari, sono gli agenti patogeni della malaria, della
dissenteria amebica e della malattia del sonno;
- Funghi e miceti (Candida albicans, l'Aspergillus), in
grado di svilupparsi su epitelio e mucose (micosi) coinvolgendo
nei soggetti immunodeficienti anche gli organi interni
- Batteri, procarioti che misurano micrometri, di cui alcuni
vivono nel ns. organismo con vantaggi reciproci (ad es. la flora
intestinale) altri sono cause di infezioni acute localizzate ma
che possono estendersi al circolo sanguineo (sepsi) e quindi a
tutto il corpo;
Noxae patogene 2
• - Virus, agenti patogeni maggiormente nocivi (provocano la
maggior parte delle infezioni) data la loro dimensione di pochi
nanometri che li rende poco aggredibili, non sono organismi
autonomi ma complessi molecolari (costituiti da una catena di
DNA o RNA impacchettata in un involucro proteico o capsula
glicoproteica) che si replicano all'interno di una cellula ospite
programmandola a tal fine, il sistema immunitario deve
necessariamente distruggere le cellule infettate per
neutralizzarli, spesso le infezioni virali si manifestano dopo
un lungo periodo di latenza asintomatico, talvolta si riscontrano
sintomatologie acute (raffreddore, influenza),
Tossine, molecole nocive di grandi dimensioni (es. tossina
difterica, botulinica, tetanica, batterica ecc.),
- Agenti fisici e chimici (es. raggi UV, particelle estranee,
sbalzi di temperatura ambientale) possono provocare danni nel
DNA trasformando cellule normali in neoplastiche.
- Agenti pschici (stress) in grado di attivare la
reazione da stress
• Da qui l'importanza della difesa immunitaria
verso tutti questi agenti patogeni.
• Le difese immunitarie sono mediate da
numerosi sistemi cellulari: linfociti (T e B),
natural killer (LNK), fagociti e cellule presentanti
l'antigene (APC), cellule tissutali, ecc
organi linfoidi primari:
midollo osseo e timo
organi linfoidi secondari:
milza, linfonodi, tonsille,
adenoidi e i MALT
(Tessuti Linforeticolari
Associati alle Mucose)
Le cellule immunitarie
sono moltissime e circolano continuamente dal
sistema linfatico ai linfonodi (dove avviene
l incontro tra i linfociti e gli antigeni) e al sangue,
nei due grandi condotti in cui viene raccolta la
linfa (dotto toracico e dotto linfatico destro)
Negli ultimi 40 anni è cambiato il modello
concettuale dell immunologia:
da scienza dei vaccini
a scienza del SI in salute e in malattia
Il SI non è più orientato solo verso l esterno
(agenti nocivi)
ma anche verso l interno (Io immunologico)
L individuazione del Not Self avviene
previo riconoscimento del Self
(identità precostituita)
• La nuova immunologia nasce nel 1974 da N.K.
Jerne con uno schema organizzativo e di
funzionamento generale del SI inteso come un
network. Questa teoria definisce l'insieme delle
difese immunitarie: dalle componenti
dell'immunità naturale ai meccanismi
dell'immunità acquisita, come un'architettura
intesa a promuovere, accrescere e mantenere
l'identità dell'individuo animale, mediante una
strategia di riconoscimento di quanto è
proprio (self) e di quanto non è proprio (notself).
Poiché il riconoscimento è l'atto elementare
dell'attività conoscitiva, Tauber identifica il Self
con l'io propriamente inteso. Di qui una duplice
inferenza filosofica: la teoria immunologica può
definirsi come una vera e propria disciplina
filosofica, una sorta di storia naturale dell'io;
la relazione profonda della dottrina dell'io
immunitario, con la filosofia postmoderna, dai
suoi precursori ai filosofi che hanno indagato a
lungo sul tema dell'identità o natura "autentica"
dell'io (da Husserl a Heidegger).
teoria della selezione
clonale
Come tutte le cellule ematiche, le cellule del sistema immunitario
derivano da un precursore comune, che, a livello del midollo
osseo, ha il compito di produrre cellule staminali, cioè cellule
madri dalle quali poi si evolvono le cellule del sangue.
I LB e i LT vengono prodotti nel midollo osseo
da qui
↓
I LB migrano in epoca perinatale nelle aree loro
destinate degli organi linfoidi secondari
mentre i LT migrano nel timo, dove avvengono:
a) Selezione negativa → eliminazione dei LT
potenzialmente reattivi contro il Self
b) Selezione positiva → LT non autoreattivi (vergini)
avviati verso le aree loro destinate
negli organi linfoidi secondari.
Recentemente, è stato dimostrato che anche
nel midollo osseo avviene una selezione di LB
• I linfociti si compongono di sottopopolazioni
distinte, molto diverse nelle loro funzioni e nei
loro prodotti proteici, che sono:
LINFOCITI B : uniche cellule capaci di produrre
anticorpi. Il loro recettore per l antigene è
rappresentato da anticorpi fissati alla
membrana cellulare. L interazione
dell antigene con questi anticorpi di superficie,
determina l attivazione dei linfociti B che si
trasformano in plasmacellule capaci di
produrre e secernere anticorpi e in cellule B
della memoria che intervengono nella risposta
secondaria cioè nel caso di una seconda
stimolazione da parte dello stesso antigene.
• LINFOCITI T : come i LB derivano dal midollo
osseo ma successivamente migrano nel timo
dove avviene la loro maturazione e
suddivisione in altre sottopopolazioni : Linfociti
T helper e Linfociti T citotossici.
• Le funzioni principali dei linfociti T sono
quelle di mediare tutte le risposte immuni verso
gli antigeni proteici e di servire come cellule
effettrici per eliminare i microbi intracellulari.
Le cellule T non producono anticorpi e
presentano sulla loro superficie una serie di
molecole che costituiscono il sistema
recettoriale per l antigene, il cosiddetto TCR.
• I linfociti T helper e citotossici sono in grado
di riconoscere e rispondere solo a peptidi
antigenici legati a proteine codificate dai geni
del cosiddetto complesso maggiore di
istocompatibilità (MHC) ed espresse sulla
membrana di cellule accessorie, mentre non
reagiscono ad antigeni solubili.
• I linfociti T helper una volta attivati producono e
secernono citochine che a loro volta agiscono
su altre cellule attivandole, mentre i linfociti T
citotossici uccidono direttamente la cellula
infettata.
• Nel 1954, l immunologo Niels Jerne aveva già
presentato una teoria nella quale affermava
l esistenza di una vasta gamma di linfociti nel
corpo prima di qualsiasi infezione. L'ingresso di
un antigene nel corpo produce la selezione di
un solo tipo di linfociti e quindi stimola la
produzione di anticorpi atti a distruggerlo.
L immunologo australiano Frank Macfarlane
Burnet lavorando su questa teoria è il primo a
chiamarla "teoria della selezione clonale".
• La Teoria della selezione clonale o Teoria di
Burnet spiega come il sistema immunitario
reagisce con linfociti T e B specifici per la
distruzione degli antigeni nel corpo.
• Ogni linfocita porta un solo tipo di recettore con
una specificità unica
• Per attivare la cellula, il recettore deve essere
occupato
• Le cellule derivate da un linfocita attivato
avranno recettori dello stesso tipo della cellula
originale
• I linfociti che riconoscono i self vengono
eliminati già all inizio dello sviluppo
Selezione clonale
Ci deve essere un meccanismo per cui
ogni linfocita produce un anticorpo con
diversa specificità antigenica;
I linfociti che riconoscono il self sono
eliminati all'inizio dello sviluppo, per cui
rimane un repertorio di cloni attivi solo
contro possibili antigeni not-self.
L'interazione tra l'antigene e il linfocita
in grado di produrre l'anticorpo
specifico attiva il linfocita stesso;
Il linfocita attivato inizia a proliferare e
genera tanti linfociti dello stesso clone,
con la stessa specificità anticorpale;
• Burnet spiega il funzionamento della memoria
immunologica come clonazione di due tipi di linfociti:
• Cellule B attive: agiscono immediatamente per
combattere le infezioni rilasciando anticorpi che
durano solo poche ore o giorni.
• Cellule memoria: non agiscono immediatamente ma si
preservano nell organismo per prevenire eventuali
infezioni successive alla prima; queste cellule possono
rimanere nell organismo per periodi di tempo molto
lunghi, il che si traduce in immunità verso tale
antigene.
• Nel 1958 Nossal e Lederberg confermano la teoria,
dimostrando che una cellula B produce sempre un
solo anticorpo.
Esistono due tipi di immunità :
immunità naturale (o innata)
e
immunità acquisita (o specifica)
• 1. Immunità naturale o innata, già presente
alla nascita, prima dell esposizione
all antigene, di cui fanno parte:
• le barriere di difesa meccaniche come la pelle, la
mucosa vaginale (il cui ph impedisce la crescita di batteri), la
mucosa bronchiale (caratterizzata da muco e cellule ciliate), la
mucosa nasale, e secrezioni come la saliva e le lacrime
(contenenti lisozima)
• le cellule fagocitiche, ossia in grado di
digerire agenti
patogeni e corpi estranei (granulociti neutrofili, macrofagi,
monociti)
• i linfociti NK e il sistema del complemento, che
perforano le membrane cellulari degli "aggressori .
• fattori solubili, sostanze che agiscono su altre cellule come
ad es. le citochine prodotte dai macrofagi tra cui INF a - INF b
• il sistema immunitario è presente in tutto l organismo,
cominciando dalla pelle, che è la nostra barriera
verso l esterno; poi lo troviamo nelle mucose, che
rappresenta la nostra barriera verso l interno, e quindi
tutto il tubo digerente dalla bocca all ano, nello
stomaco, intestino, nell apparato respiratorio (dal
naso ai bronchi), nell apparato urogenitale,
nell occhio. Le mucose e la pelle contengono un
tessuto denominato MALT – Mucosal Associated
Lymphoid Tissue, tessuto linfoide associato alle
mucose, che rappresenta un unico sistema e questo
spiega come un infezione alle vie urinarie possa avere
un riscontro a livello polmonare. Una delle mucose
estremamente importanti per il nostro organismo è
quella intestinale, detta GALT, dove la G stà per Gut,
intestino, connessa con il sistema neurovegetativo.
• Granulociti neutrofili, costituiscono la frazione
più numerosa dei globuli bianchi (45-70%).
Sono cellule più piccole dei macrofagi
anch'esse in grado di fagocitare e demolire
agenti patogeni. Essi sono particolarmente
attivi in caso di infiammazioni batteriche dove
migrano in maniera massiccia dal sangue ai
tessuti interessati (il pus è composto
essenzialmente da batteri vivi e morti,
frammenti cellulari e granulociti neutrofili morti).
Hanno una vita media di 4-8 gg. I granulociti
eosinofili e basofili con scarsa o assente attività
fagocitaria.
• Fagociti mononucleati : grazie alla presenza
di enzimi litici al loro interno inglobano l antigene
estraneo e lo distruggono. Componenti di tale sistema
sono: i Monociti ed i Macrofagi. I monociti non
ancora totalmente differenziati sono il primo tipo
cellulare a lasciare il midollo e ad entrare nel sangue
periferico e una volta insediati nei tessuti, maturano in
macrofagi. Questo sistema è particolarmente
sviluppato nei linfonodi, nel fegato e nel midollo osseo.
Il citoplasma dei macrofagi si avvolge intorno al corpo
estraneo inglobandolo in una vescica delimitata dalla
membrana citoplasmatica (fagosoma) che poi si
unisce ai lisosomi (vescicole contenenti enzimi
digestivi attivi) costituendo il fagolisosoma digestivo.
• Natural Killer (NK) : contrastano i virus.
Sono linfociti di grandi dimensioni dotati di
numerosi granuli citoplasmatici contenenti
enzimi litici che provocano la lisi osmotica delle
cellule bersaglio e la morte per apoptosi, una
forma di morte cellulare regolata
fisiologicamente, in cui il nucleo va incontro a
condensazione e frammentazione, la
membrana cellulare mostra fenomeni di
vescicolazione e la cellula morta viene
rapidamente fagocitata senza che il suo
contenuto sia rilasciato all esterno.
• Le strategie naturali o innate di difesa umorale,
non mediata cioè da cellule specifiche, sono le
seguenti:
• sistema del complemento
• migrazione di leucociti
• protezione dalle infezioni tramite interferone
• lisi diretta dei batteri
• L elemento più importante della difesa umorale
aspecifica, è il sistema del complemento
costituito da una serie di circa 20 molecole
proteiche plasmatiche diverse: C1, C2, C3,
C4,C5, C6, C7, C8, C9, C10, C11 più altre di
controllo finalizzate alla stessa funzione.
Questo sistema viene attivato sia tramite una
reazione antigene-anticorpo (via classica), sia
direttamente mediante i carboidrati della parete
cellulare batterica (via alternativa).
Cascata del complemento
• Il complemento media funzioni fondamentali
dell'infiammazione, tra cui la chemiotassi
(richiamo di cellule nel sito di infiammazione),
con attivazione di enzimi che clivano proteine,
lisi cellulare e reazioni vasomotorie. La
vicinanza di Fc delle immunoglobuline
(porzione fissa), come negli immunocomplessi,
attiva la cascata complementare che termina
forando membrana cellulare del patogeno o di
una cellula infettata. Gli immuno-complessi
generalmente innescano la via classica della
cascata complementare.
• In caso di infiammazione vengono liberati dei
mediatori (citochine) che richiamano i leucociti
nei tessuti. L'attrazione di cellule autologhe
tramite messaggeri chimici prende il nome di
chemiotassi. In caso di infezione virale le
cellule infettate e le cellule connettivali per
proteggere le cellule non ancora contagiate
liberano interferone una molecola di
segnalazione . Questo abbassa drasticamente,
anche se solo temporaneamente, la neosintesi
di proteine, proprie o estranee all'organismo,
all'interno delle cellule, rallentando la
proliferazione dei virus.
• L immunità innata è immediata (0-96 h),
altamente efficiente e non ha memoria
immunologica.
• Le macromolecole del SI con azione non
specifica presenti nel sangue, costituiscono il
sistema evolutivo di difesa più antico e
rappresenta un prerequisito necessario per i
meccanismi di difesa specifici.
Il lisozima, un enzima presente anche nella
saliva, attacca direttamente la parete cellulare
di alcuni batteri costituita da carboidrati, a meno
che questa sia protetta da una capsula
glicoproteica, prima che essi penetrino nel
corpo.
2. Immunità acquisita o specifica, sistema più
complesso più efficace del precedente.
Costituito da una serie di cellule e di molecole
che hanno la capacità di riconoscere uno
specifico agente patogeno e di creare una
risposta che si amplifica e di cui resta
memoria nell organismo (memoria
immunologica). In questo modo, un secondo
contatto con l invasore (antigene), attiva una
risposta immunitaria più rapida e amplificata e
quindi più efficace. Di questa immunità fanno
parte i linfociti T e B.
• I linfociti rappresentano i nostri veri occhi interni
che riconoscono gli antigeni e sorvegliano
l ambiente interno.
La necessità della presentazione degli antigeni
si spiega in buona parte tramite i meccanismi di
protezione escogitati dai microrganismi, che
hanno appunto lo scopo di impedire il loro
riconoscimento da parte dei linfociti. Se una
cellula che presenta antigeni assume l'agente
patogeno e lo digerisce parzialmente all'interno
dei suoi fagolisosomi, la possibilità di esporre
in superficie l'antigene stesso è maggiore.
• Alcuni grossi antigeni interagiscono
direttamente con linfociti B per essi specifici
promovendone la proliferazione e la
differenziazione in plasmacellule. Ciò
costituisce un'eccezione in quanto
normalmente i linfociti B e soprattutto i linfociti T
si attivano se l'antigene viene presentato da
una cellula accessoria (principalmente un
macrofago ma anche linfociti B e cellule
epiteliali o endoteliali); l antigene viene
parzialmente digerito dalla cellula presentante
(APC) che lo monta su un determinato sito
della propria membrana cellulare.
• L immunità acquisita agisce in senso specifico, ossia
per ogni tipo di stimolo viene innescata una risposta
che vale per quello stimolo e non per altri, efficiente ed
economica in quanto evita le risposte non necessarie.
Ha memoria immunologica e i tempi di risposta sono
relativamente lunghi (da 96 h in poi).
L immunità specifica può essere di due tipi :
• umorale (mediata da anticorpi). Le cellule responsabili
dell immunità umorale sono i linfociti B. Tale immunità
può essere trasferita in soggetti non immunizzati
(vergini) mediante plasma o siero
• cellulo-mediata (mediata dai linfociti T). Tale immunità
può essere trasferita in individui vergini mediante
linfociti T prelevati da un individuo immunizzato.
• Sono indispensabili entrambe le immunità
specifiche perché, mentre l immunità umorale
costituisce un meccanismo di difesa nei
confronti di microbi extracellulari e delle loro
tossine, dal momento che gli anticorpi possono
legarsi a tali agenti ed eliminarli, l immunità
cellulo-mediata è indispensabile per la difesa
contro microrganismi intracellulari, come virus e
batteri, che proliferano all interno delle cellule
dell ospite e quindi risultano essere
inaccessibili agli anticorpi, ma accessibili ai
linfociti T specifici che determinano la loro
Recentemente sono stati scoperti:
Tra i LB, la sottoclasse dei LB1, che resta nelle pleure
e nel peritoneo, come prima difesa delle mucose
Tra i LT, la sottoclasse dei LT regolatori (CD25),
cruciali nel controllo della risposta immunitaria
Tra i linfociti cosiddetti non convenzionali, i LNKT,
presenti soprattutto nel fegato, intermedi tra NK e LT
↓
La loro attività sembra essere legata allo
sviluppo di alcune malattie autoimmuni
• Per l interazione antigene-anticorpo la
metafora della chiave-serratura. Di fronte
all agente da riconoscere, che funziona da
serratura, il sistema immunitario costruisce a
caso un elevato numero di chiavi differenti tra
cui ci sarà quella giusta. Tali chiavi sono gli
anticorpi naturali che rappresentano il bagaglio
cognitivo del sistema immunitario ed i principali
fautori della resistenza naturale di specie o di
razza verso particolari agenti estranei.
• L unione tra un antigene ed il corrispondente
anticorpo porta alla formazione di un immunocomplesso. essa è altamente specifica e
regolata da forze di tipo chimico-fisico (legami
di natura non covalente) che agiscono tra i
determinanti dell antigene e dell anticorpo. La
formazione degli immunocomplessi determina:
1. NEUTRALIZZAZIONE (virus, tossine
batteriche)
2. AGGLUTINAZIONE (antigeni cellulari)
3. PRECIPITAZIONE (antigeni solubili)
con conseguente FAGOCITOSI
CARATTERISTICHE PRINCIPALI DELLE
RISPOSTE IMMUNI
• SPECIFICITA : ogni linfocita presenta, sulla sua
superficie, un recettore che riconosce un solo epitopo
o determinante dell antigene (la porzione, proteica o
polisaccaridica, dell antigene riconosciuta
dall anticorpo)
• DIVERSITA : ogni individuo possiede un
"repertorio linfocitario" costituito da un numero molto
elevato di linfociti per discriminare almeno 10^9 diversi
determinanti antigenici.
• MEMORIA : il sistema immunitario risponde ad un
particolare antigene estraneo in maniera più efficace
quando è già entrato in contatto con tale antigene una
prima volta. Le risposte immunitarie secondarie sono
più rapide e più intense.
• AUTOLIMITAZIONE : tutte le risposte immunitarie
normali si esauriscono col tempo dopo l eliminazione
del patogeno.
• DISCRIMINAZIONE del self dal not-self : le cellule
del sistema immunitario sono capaci di riconoscere,
rispondere ed eliminare antigeni estranei (not-self)
senza reagire contro i componenti antigenici del
proprio stesso organismo (antigeni autologhi o self).
• Quest ultimo fenomeno prende il nome di
"tolleranza". Anomalie nell induzione o nel
mantenimento della tolleranza verso il self
portano alla generazione di risposte immuni
verso gli antigeni autologhi provocando malattie
"autoimmuni"
• Per risposta primaria si intende la produzione
di anticorpi che fa seguito all'introduzione di un
antigene che viene per la prima volta a contatto
con l'organismo ospite. Questo tipo di risposta
è caratterizzato da un particolare andamento
nel tempo della concentrazione di anticorpi:
dopo un periodo di latenza di qualche giorno
compaiono in circolo anticorpi specifici, che
aumentano in modo esponenziale fino a
raggiungere la massima concentrazione, che si
mantiene tale per un certo tempo per poi
decrescere rapidamente.
• Gli anticorpi prodotti sono inizialmente della
classe IgM al cui rapido decrescere fa seguito il
parallelo incremento della classe delle IgG.
Quando lo stesso antigene viene nuovamente a
contatto con l'organismo ospite si ha la risposta
secondaria, in cui gli anticorpi prevalenti sono
della classe IgG e si evidenzia un andamento
nel tempo della concentrazione anticorpale
caratterizzato da un breve periodo di latenza,
seguito da un notevole aumento della
concentrazione delle IgG e da una fase di
plateau che persiste a lungo (anni).
• Le immunoglobuline sono gli "organi di senso"
del sistema immunitario, essendo in grado di
distinguere e identificare le sostanze proprie
dell'organismo e quelle estranee a esso. Esse
sono localizzate come recettori sulla superficie
dei linfociti B oppure sono secrete come
anticorpi nel plasma sanguigno.
Il sistema HLA
• Il Sistema HLA (Human Leucocyte Antigens),
è composto da molecole che si trovano
sulla superficie cellulare e si comportano
come antigeni gruppo-ematici e tessutali;
venute a contatto con il sistema immunitario di
un individuo diverso, sono riconosciute come
estranee e suscitano una risposta immune. I
geni che codificano la sintesi dei prodotti HLA
costituiscono il complesso maggiore di
istocompatibilità (MHC) e sono localizzati, in
ogni individuo, sul braccio corto del
cromosoma 6. Essi sono stati suddivisi in due
classi principali: la I che contiene 3 loci (A, B,
C) e la II o HLA-D (che comprende i geni DP,
DQ, DR).
• I prodotti "tipici" del complesso MHC legano
frammenti di antigeni ad una loro porzione
molecolare rendendoli visibili ai recettori dei
linfociti T. I geni MCH II per le molecole della
classe II (HLA-D), sono divisi in tre famiglie
(DP, DQ e DR), ognuna codificante per
entrambe le catene α e β, che vanno a formare
il dimero. I geni dell'MHC sono polimorfici e
questo polimorfismo è di grande rilevanza nel
definire qualità e quantità della risposta
immunitaria di un individuo. È un fatto noto che
organismi diversi si comportano in maniera
diversa di fronte ad agenti esterni.
• La definizione univoca degli alleli di ogni
singolo locus è stata affrontata a partire dal
1967 ad opera di un comitato del WHO.
• L'operazione di definizione dei differenti alleli
che caratterizzano un individuo prende il nome
di determinazione dell aplotipo o anche,
nell'uomo, di tipizzazione HLA.
• Tutte le cellule nucleate dell'organismo
possiedono in membrana molecole HLA di
Classe I, formate da un polipeptide
transmembrana di 44.000 dalton, codificato
dall'MHC, associato alla β2-microglobulina, una
molecola invariante di 15.000 dalton codificata
dal cromosoma 15.
• La distribuzione ubiquitaria degli antigeni di
classe I, ne fa presumere l'importanza quali
marker di riconoscimento tra ciò che
l'organismo riconosce come appartenente a sé
stesso (self) e ciò che è estraneo (not-self) e
come mezzo per individuare modificazioni
cellulari indotte da infezioni virali, attivando
all'occorrenza il linfociti T citotossici.
• Le poche cellule che presentano molecole HLA
di classe II : macrofagi, linfociti B e T helper,
monociti, cellule epiteliali e spermatozoi, sono
tutte in grado di effettuare la presentazione
dell'antigene (APC, antigen presenting cell).
Deputate all'innesco della risposta immunitaria,
esse partecipano al riconoscimento del not-self
attivando i linfociti T helper e il processo di
cooperazione tra linfociti B e T. La loro
espressione viene modulata dalla presenza o
meno di alcune interleuchine e/o interferoni.
• Le molecole di Classe II sono proteine di
membrana eterodimeriche, formate cioè da una
catena α (che varia fra i 33.000 e i 34.000
dalton), e da una catena β (fra i 28.000 e i
29.000 dalton).
• Gluten sensitivity is strongly heritable, with about
40% of the genetic load coming from MHC class II
association. In white populations, more than 90% of
patients with coeliac disease carry the HLA DQ2.5
variant (DQA1*05-DQB1*02) and most other patients
carry HLA-DQ8 (DQA1*03-DQB1*0302). A few
patients with coeliac disease do not belong in either of
these groups but carry just one chain of the DQ2
heterodimer, either DQA1*05 (DQ7) or DQB1*02
(DQ2.2), but not both. Of the two heterodimers,
DQA1*05 on its own confers a low predisposition to
coeliac disease. HLA genetic testing is therefore
another useful tool to aid diagnosis, particularly as,
unlike other serological tests, this test is not
dependent on an immunological trigger. However,
the HLA DQ genotype can be used only as a test of
exclusion, as the risk genotype DQ2 is common in
white and Asian populations, and many carriers will
never develop gluten sensitivity.
• We have noted an unusually high frequency of
deviation from the MHC class II pattern typical
for coeliac disease in patients with
neurological disease due to gluten
sensitivity. DQ8 was substantially more
common in patients in the Sheffield neurology
cohort who had no enteropathy (17% [46 of
270]) compared with patients with coeliac
disease presenting to gastroenterologists (<6%
[60 of 1008]). Together with the finding of more
variability in T-cell epitope specificity in patients
carrying DQ8 compared with patients carrying
DQ2, this observation suggests that there are
differences in disease aetiology between
patients whose primary manifestation occurs in
the CNS and those whose primary
manifestation affects the gastrointestinal tract.
• Sia le molecole di classe I che quelle di classe
II fungono da bersaglio per i linfociti T. Affinché
un antigene venga legato su una molecola di
membrana MHC deve essere processato.
Ammettiamo che l'APC sia un macrofago,
quest'ultimo fagocita il corpo estraneo e lo
processa, al termine l'antigene (porzione
proteica) si legherà ad una molecola MHC
classe I o II. Più precisamente se la
processazione avrà una fase citosolica
(comune per proteine di derivazione virale)
l'Ag si legherà ad MHC I attivando un tipo di
linfociti chiamati "citotossici" o "CD8+".
• I linfociti citotossici sono effettori diretti delle
risposta immunitaria specifica cellulo-mediata,
determinando la lisi delle cellule che li hanno
attivati. Se invece la processazione avviene
esclusivamente in vescicole endosomiali (tipico
per proteine di derivazione batterica), L'Ag si
legherà ad una molecola MHC II con
conseguente attivazione dei linfociti "helper" o
"CD4+". Questi svolgono la propria attività
producendo citochine che contribuiranno
all'attivazione di linfociti B (linea Th2) o
all'attività citotossica dei linf TCD8+(lineaTh1).
• I linfociti B costituiscono il ramo "umorale "
della risposta immunologica specifica.
• Gli antigeni di III classe, rappresentati dalle
frazioni complementari C2, C4 e dal Bf, sono i
determinanti sierici .
NB: alcune malattie reumatiche presentano
una associazione con particolari fenotipi HLA.
Oltre il 90% dei malati di spondilite anchilosante
presentano un fenotipo HLA di I classe B27.
Nei soggetti con artrite reumatoide prevale il
fenotipo HLA di II classe DR4.
• Il sistema HLA (MHC-I) è alla base del rigetto
dei trapianti: se il tessuto trapiantato in un
soggetto non è HLA-compatibile (ossia le
cellule che lo compongono non hanno gli stessi
antigeni HLA del ricevente), il trapianto viene
riconosciuto come estraneo e rigettato. Per
questo motivo, prima di eseguire un trapianto, è
necessario accertare che donatore e ricevente
siano HLA-compatibili (tipizzazione tissutale).
Oltre che nel campo del trapianto di organi e
tessuti, le molecole del sistema HLA rivestono
un importanza fondamentale nei meccanismi di
riconoscimento immunologico di tutte le
sostanze estranee che vengono in contatto con
l organismo.
CD4
CD8
Come fa l organismo ad accorgersi che
siamo stati invasi da un agente infettivo?
Il sistema immunitario può essere considerato
un organo di senso → intercetta stimoli non
cognitivi esterni e interni e li neutralizza
E quindi paragonabile al sistema nervoso →
intercetta stimoli cognitivi
I due sistemi comunicano in senso
bidirezionale:
SN→SI: il cervello monitorizza continuamente
l attività del SI, oltre ad innervare tutti gli organi
linfoidi → giunzioni neuro-immunitarie
sistema immunitario come
organo di senso
• il SI come un sofisticato organo di senso, rivolto verso
l interno, effettua un monitoraggio e pattugliamento,
alla ricerca di situazioni e sostanze dannose.
• I cinque organi di senso ci avvisano quando si creano
situazioni pericolose e la percezione interna è volta a
scoprire batteri, virus e tossine ed altre sostanze
dannose per ogni particolare area dell organismo.
• È interessante notare che la struttura del sistema
immunitario ricalca quella del sistema nervoso.
• Questo particolare senso interno è modulato dallo
stato generale, dal sistema endocrino, da quello
neurologico e da tutti gli altri sensi.
In conclusione, la
ricognizione di stimoli
non cognitivi esterni e
interni da parte del SI
viene convertita in
messaggi il cui
linguaggio è costituito
da neurotrasmettitori
ormoni, e citochine,
che arrivano al
sistema
neuroendocrino
• E ormai certo che il SI sia il terzo grande
sistema, network, insieme al SN e a quello
endocrino, di regolazione generale
dell organismo, specializzato
nell organizzazione delle sue difese sia interne
che esterne. Lo scienziato danese Niels Kaj
Jerne riceve il Nobel 1984 per la medicina in
virtù della sua teoria sul network
immunitario . Egli mise in risalto le
straordinarie analogie tra sistema immunitario e
nervoso. Le cellule di entrambi i sistemi sono
infatti in grado di ricevere e trasmettere segnali
sia di natura eccitatoria che inibitoria,
rispondendo in maniera adeguata a una
enorme varietà di segnali.
SN ↔ SI :
linfociti, macrofagi e altre cellule
immunitarie presentano recettori per i
principali neurotrasmettitori e neuropeptidi,
oltre a secernere neurormoni e sostanze attive
sul sistema nervoso
linfocita = cellula neuroendocrina
In questo senso,si può dire che la risposta
all antigene è fortemente condizionata dal SN
e dal SE e che la sua attività dipende
dall ambiente neuroendocrino in cui avviene la
risposta immunitaria
La comunicazione nel SI
Il buon funzionamento del SI dipende da un efficace
comunicazione tra le numerose cellule di cui si
compone
I messaggeri del SI sono:
a) CHEMIOCHINE → proteine che guidano la
migrazione delle cellule immunitarie laddove servono
b) CITOCHINE → ampia famiglia di glicoproteine
che, sotto stimolo, vengono rilasciate transitoriamente
nei tessuti e in circolo. Sono rigorosamente regolate
da vari fattori, spesso dalle citochine stesse, e sono in
grado di portare il loro messaggio in luoghi anche
molto lontani
Alcune cellule del SN (astrociti e microglia)
e della corteccia surrenale producono citochine
• Le chemiochine sono una superfamiglia di
proteine a basso peso molecolare (6-14 kD)
con funzione chemiotattica attive nel richiamo
di varie popolazioni cellulari che partecipano
alla risposta immune, quali granulociti neutrofili
ed eosinofili, monociti e linfociti. Le cellule della
flogosi possono essere richiamate in loco da
molte molecole (componenti del complemento,
formil-peptidi, LTB4, M-CSF e TNF-α), e infine
dalle chemiochine. Esse infatti determinano la
diapedesi, ovvero la capacità dei leucociti di
abbandonare il torrente circolatorio per
accumularsi nelle sedi di flogosi, fenomeno
noto fin dalla fine del secolo scorso.
• Una delle principali attività delle chemochine è
rappresentata dal richiamo delle cellule
immuno-competenti a livello degli organi
linfoidi, un ruolo di fondamentale importanza
nello sviluppo della risposta immune.
• I progenitori comuni linfoidi lasciano il midollo
osseo e circolano per raggiungere gli organi
linfoidi primari guidati da chemochine, specie di
tipo CXC.
Le citochine comprendono vari sottogruppi:
• Interleuchine (IL da 1 in avanti)
• Interferoni (IFN - α, β e γ)
• Fattori di crescita (CSF)
• Fattore di necrosi tumorale (TNF - α e β)
• Fattore di crescita trasformante (TGF - β )
Ogni sottogruppo svolge importanti funzioni biologiche:
• segnalatori generali dell infiammazione (IL-1, TNF, IL-6)
• azione infiammatoria (IL-1)
• azione antivirale e antitumorale (IL-12 e IFN-γ)
Fungono da linguaggio tra cellule del sistema
immunitario; la loro azione è il risultato di un
bilanciamento tra attivazione e inibizione, con fattori che
possono intervenire per interrompere eventuali effetti
tossici sull organismo
I circuiti Th1/Th2
Nella cornice dell autoregolazione del SI, sono state
segnalate due sottoclassi di L-T helper: Th1 e Th2,
coinvolti in due modi diversi nell attivare la risposta
immunitaria e nel produrre le diverse citochine.
I Th1 mettono in moto una risposta cellulo-mediata
(attivando i LT citotossici), sostenuta dalla produzione
di IL-2, IL-12 e INF-γ e con effetto protettivo nei
confronti delle infezioni virali.
I Th2 mettono in moto una risposta umorale
(attivando i LB), sostenuta dalla produzione di IL-4 e
IL-3 e con effetto protettivo nei confronti delle
infezioni batteriche
La differenziazione dei LT
helper in Th1 o Th2 è
fortemente influenzata da
fattori genetici e ambientali
(per es. il tipo di nutrizione e
le differenze sessuali).
Pertanto, in ogni individuo
può verificarsi un eccessiva
polarizzazione su un tipo di
risposta piuttosto che
sull altra
Cruciale è l equilibrio tra la
specificità della risposta
immunitaria e la capacità di
non eccedere, pena
l instaurarsi di un danno
Sono state infatti evidenziate correlazioni tra:
♣una maggiore polarizzazione sulla risposta di tipo Th-1 e una
maggiore predisposizione alle malattie autoimmuni, per un
indebolimento del controllo dei LT autoreattivi
♣una maggiore polarizzazione sulla risposta Th2 (che produce
un eccesso di risposta anticorpale, soprattutto contro gli allergeni)
e una maggiore predisposizione alle allergie e al LES (malattia
autoimmune da immunocomplessi)
Ciò accade perché i due circuiti si condizionano a vicenda,
funzionando come polarità opposte di uno stesso processo
I meccanismi dell autoregolazione sono stati parzialmente
identificati in due particolari popolazioni di LT regolatori :
una permanente e prodotta dal timo (CD25), l altra, indotta
dalle citochine IL-10 e TGF-β solo se c è necessità (ribattezzata
Th3)
il sistema immunitario non reagisce agli
antigeni con cui ha un contatto in fase
intrauterina e nelle prime settimane di vita.
Gli antigeni, se già presenti nell'organismo,
vengono riconosciuti come propri e tollerati.
Tolleranza immunitaria
indica uno stato fisiologico nel quale il SI non
reagisce distruttivamente verso il Self
né verso il Not Self
La costruzione della tolleranza immunitaria è un lungo
processo che inizia nella vita intrauterina, ma la sua fase
cruciale avviene nell infanzia soprattutto nel MALT,
con i suoi due principali reparti: il naso-faringeo (NALT)
e l intestinale (GALT), dove il contatto con gli antigeni
contenuti nell aria e nel cibo è costante.
Data la stretta comunicazione tra Nalt e Galt, la
risposta immunitaria si diffonde da un reparto
all altro e al resto dell organismo,
attraverso sangue e linfa
I circuiti che
uniscono i
MALT
possono
essere usati
anche in
senso
patologico e
veicolare
agenti nocivi
nei due reparti
produzione di ormoni
da parte del sistema
immunitario
E documentata l ubiquitarietà di ormoni
tradizionalmente ritenuti peculiari di un asse.
Fondamentale, a riguardo, è la dimostrazione
che il linfocita (cellula immunitaria) può
produrre CRH (Corticotropin releasing Hormon)
e ACTH (ormone corticotropo) e, tramite i propri
messaggeri (ad esempio la citochina
interleuchina-1), influenzare direttamente il
CRH ipotalamico (schema reazione di stress).
• Pertanto, gli assi neuroendocrini non sono solo
autostrade parallele che uniscono cervelloipofisi-ghiandole endocrine-tessuti bersaglio
ma, tramite scorciatoie e collegamenti laterali
(definiti feedsideward ), formano un vero e
proprio network endocrino a sua volta
strettamente connesso con i networks nervoso
e immunitario; da cui la nascita e l'importanza
della psiconeuroendocrinoimmunologia. Tutto
ciò da un lato configura una realtà più
complessa riguardo il quadro patologico,
dall altro amplia le possibilità terapeutiche
accrescendo i punti di attacco alle varie
patologie.
• immunogenetica
• LE SCIENZE 17/07/2009 Su Science Express
L'interruttore della fabbrica degli anticorpi,
Secondo Mitchell Kronenberg, direttore scientifico del
La Jolla Institute for Allergy and Immunology, uno
specifico gene: Il BCL6 fungerebbe da interruttore
molecolare per la produzione di anticorpi da parte
delle cellule B. Si pensava che fossero i CD4 helper di
tipo 2 (TH-2), a innescare il processo anticorpale, in
realtà questo compito toccherebbe a una quinta
varietà di cellule T-helper CD4, chiamata TFH.
Attivando Il gene BCL6 si ottengono molte più cellule
di questo tipo, in grado a loro volta di comunicare alle
cellule B di produrre anticorpi. Silenziando
sperimentalmente il BCL6, si interrompe la produzione
di anticorpi con possibili ripercussioni sulle malattie
autoimmuni.