1. Richiami di Termodinamica
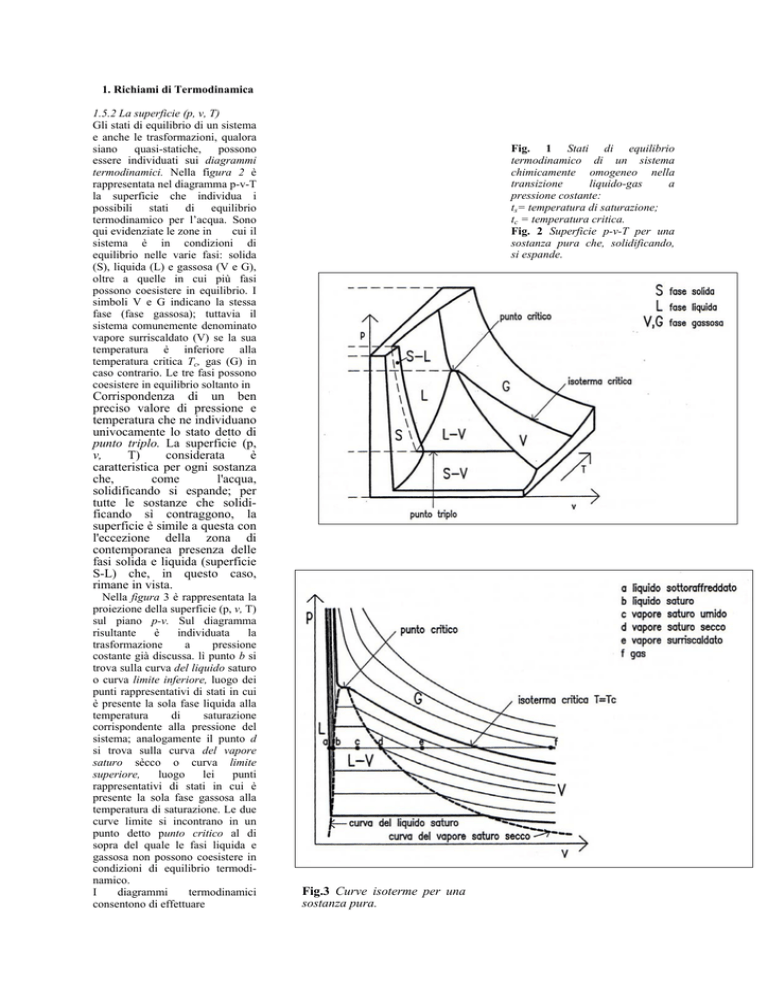
1.5.2 La superficie (p, v, T)
Gli stati di equilibrio di un sistema
e anche le trasformazioni, qualora
siano quasi-statiche, possono
essere individuati sui diagrammi
termodinamici. Nella figura 2 è
rappresentata nel diagramma p-v-T
la superficie che individua i
possibili stati di equilibrio
termodinamico per l’acqua. Sono
qui evidenziate le zone in
cui il
sistema è in condizioni di
equilibrio nelle varie fasi: solida
(S), liquida (L) e gassosa (V e G),
oltre a quelle in cui più fasi
possono coesistere in equilibrio. I
simboli V e G indicano la stessa
fase (fase gassosa); tuttavia il
sistema comunemente denominato
vapore surriscaldato (V) se la sua
temperatura è inferiore alla
temperatura critica Tc, gas (G) in
caso contrario. Le tre fasi possono
coesistere in equilibrio soltanto in
Fig. 1 Stati di equilibrio
termodinamico di un sistema
chimicamente omogeneo nella
transizione
liquido-gas
a
pressione costante:
ts= temperatura di saturazione;
tc = temperatura critica.
Fig. 2 Superficie p-v-T per una
sostanza pura che, solidificando,
si espande.
Corrispondenza di un ben
preciso valore di pressione e
temperatura che ne individuano
univocamente lo stato detto di
punto triplo. La superficie (p,
v,
T)
considerata
è
caratteristica per ogni sostanza
che,
come
l'acqua,
solidificando si espande; per
tutte le sostanze che solidificando sì contraggono, la
superficie è simile a questa con
l'eccezione della zona di
contemporanea presenza delle
fasi solida e liquida (superficie
S-L) che, in questo caso,
rimane in vista.
Nella figura 3 è rappresentata la
proiezione della superficie (p, v, T)
sul piano p-v. Sul diagramma
risultante
è
individuata
la
trasformazione
a
pressione
costante già discussa. lì punto b si
trova sulla curva del liquido saturo
o curva limite inferiore, luogo dei
punti rappresentativi di stati in cui
è presente la sola fase liquida alla
temperatura
di
saturazione
corrispondente alla pressione del
sistema; analogamente il punto d
si trova sulla curva del vapore
saturo sècco o curva limite
superiore,
luogo
lei
punti
rappresentativi di stati in cui è
presente la sola fase gassosa alla
temperatura di saturazione. Le due
curve limite si incontrano in un
punto detto punto critico al di
sopra del quale le fasi liquida e
gassosa non possono coesistere in
condizioni di equilibrio termodinamico.
I
diagrammi
termodinamici
consentono di effettuare
Fig.3 Curve isoterme per una
sostanza pura.
R (R = 8,3143 :J/(kmol K)) e la
°
°
massa molare dello tesso; valori
Tab. 2 Massa molare M e costante
specifica R di alcuni gas
M (k mol/k g)
R (kJ/(kg Kq)
Aria secca
29
0,287
N2
28
0,297
02
C02
32
44
0,260
0,189
che si presentano
nella
tecnica.
Spesso, anziché
diagrammi, sono
disponibili tabelle
in
cui
sono
riportati i valori
numerici
delle
proprietà della sostanza in diversi
stati di equilibrio;
un esempio, per
l'acqua satura, è
fornito alla tabella
1.
1.5.3 I gas perfetti
particolari stati, come per T>2 Tc
oppure per valori di p e di v
rispettivamente molto piccoli e
molto grandi, in confronto ai
rispettivi valori del punto critico, i
gas tendono a comportarsi secondo
un
modello
particolarmente
semplice, noto come gas perfetto o
'idéale.
L'utilità dell'ipotesi di gas perfetto
consiste nel fatto che per questo
esiste una semplice relazione che
lega le proprietà di stato p, v, T,
nota appunto come equazione di
stato dei gas perfetti:
pv=RT
(1)
dove R è la costante specifica per
il par[colare gas considerato,
rapporto tra la costante universale
della massa molare e della 'stante
specifica per alcuni gas sono
riportati nella tabella 2.
La relazione (1) è poi estendibile
anche a miscele di gas perfetti
quale, per esempio, è l'aria nelle
normali condizioni di pressione e
temperatura, costituita da una
miscela di gas incondensabili e
da vapore d'acqua tutti verificanti,
con buona approssimazione, le
ipotesi del modello di gas perfetto.
1.6
Miscele di aria e
vapore d'acqua
1.6.1
Definizioni fondamentali
Questa particolare miscela di gas
perfetti
riveste
notevole
importanza nel settore del
controllo ambientale; la disciplina
che ne studia le proprietà
termodinamiche
è
detta
psicrometria.
Si
consideri
un
recipiente
cilindrico racchiuso da un pistone
mobile. All'interno sia contenuta
aria
secca
alla
pressione
atmosferica (101,325 kPa) e alla
temperatura di 20 °C. Se
all'interno del recipiente viene
nebulizzata una piccola quantità di
acqua, essa vaporizza completamente. Ciò accade fino a una
certa quantità limite, oltre la quale
l'acqua introdotta rimane allo stato
liquido. In queste condizioni la
miscela di aria e vapore d'acqua si
dice satura, e il corrispondente
valore di temperatura è definito
temperatura di saturazione o di
rugiada per quella particolare
miscela. Se, a partire da questo
stato, la temperatura della miscela
viene innalzata, l'acqua presente
sotto forma di liquido ricomincia a
vaporizzare; se invece, a partire
dalla miscela satura, la temperatura viene diminuita, parte
dell'acqua presente sotto forma di
vapore condensa portandosi allo
stato di liquido. Dunque una
miscela di aria e vapore d'acqua
può contenere una quantità massima di vapore che aumenta con la
temperatura.
Là quantità di vapore contenuta
nella miscela è individuata dal
titolo x, rapporto tra la massa di
vapore e la massa di aria secca
presenti nell'unità di volume di
miscela; solitamente tale rapporto
è espresso in grammi di vapore su
chilogrammi di aria secca. Spesso
la composizione della miscela
viene
individuata
mediante
l'umidità relativa o grado igrometrico φ, definito come
rapporto tra la massa di vapore
presente nell'unità di volume di
miscela e quella che renderebbe
satura la miscela allo stesso valore
di temperatura. Si definisce poi
grado di saturazione Ψ il rapporto
tra il titolo della miscela e il valore
che lo stesso assumerebbe alla
saturazione. Questi ultimi due
parametri possono variare tra i
valori
0
e
1,il
primo
corrispondente ad aria secca e il
secondo a miscela satura; il titolo,
invece, può variare tra i valori 0 e
xs , essendo quest'ultimo il valore
s
che il titolo assume alla
saturazione, in funzione della
Fig. 4 Diagramma psicrometrico.
.
temperatura.
Si definisce temperatura di bulbo
bagnato della miscela il valore di
temperatura misurato da un
termometro il cui elemento
sensibile, mantenuto bagnato
mediante una garza umida, è
immerso
in una corrente della miscela
stessa;
analogamente,
con
temperatura di bulbo asciutto si
indica il valore di temperatura
della miscela comunemente inteso
e misurato, appunto, mediante un
termometro il cui elemento
sensibile è mantenuto asciutto. La
temperatura di bulbo bagnato è
sempre inferiore a quella di bulbo
asciutto, uguagliando questa, come
valore massimo, solo se la miscela
è satura.
1.6.2 Il diagramma psicrometrico
Le trasformazioni termodinamiche
che riguardano le miscele di aria e
vapore
d'acqua
sono
dette
trasformazioni psicrometriche. Per
il loro studio è particolarmente
utile il diagramma psicrometrico1
riportato nella figura 4. Su di esso
sono rappresentati gli stati di
equilibrio della miscela in
corrispondenza di una pressione
totale pari alla pressione atmosferica e approssimativamente
per valori di pressione vicini a
questa. È
altresì possibile
evidenziare su di esso tutte le
possibili trasformazioni psicrometriche
quasi-statiche
e
determinare i valori delle proprietà
termodinamiche precedentemente
definite. A titolo di esempio, sul
diagramma è rappresentata la
trasformazione psicrometrica già
descritta: inizialmente il sistema si
trova nello stato 1; quindi, a
temperatura
costante,
viene
immessa acqua nella miscela fino
allo stato individuato dal punto 2;
in questo stato la miscela è satura.
lì punto 2 si trova sulla curva di
saturazione, luogo dei punti
rappresentativi di stati di miscela
satura. Se poi, a partire da 2, viene
innalzata la temperatura della
miscela, il sistema si porta in 3' da
cui, non essendo più la miscela
satura, è possibile incrementare
ancora il contenuto di vapore
d'acqua, mantenendo costante la
temperatura. Se, invece, a partire
da 2 la temperatura viene diminuita, lo stato del sistema si sposta
lungo la curva di saturazione fino
al punto 3"; durante questa
trasformazione parte del vapore
d'acqua contenuto nella miscela
condensa: la massa di acqua condensata
può
essere
letta
direttamente sull'asse x come
differenza tra i valori iniziale e
finale.
Alcune tra le più comuni
trasformazioni
psicrometriche
sono rappresentate nella figura 5.
Un'altra comune trasformazione è
la miscelazione senza scambio di
calore (adiabatica) di due correnti
di aria umida, rappresentata sul
diagramma psicrometrico nella
figura 6.
1.6.3
Misura
del
grado
igrometrico
Esistono molti strumenti che
consentono la misura del grado
igrometrico di una miscela di aria
e vapore d'acqua. Fra questi, il più
diffuso e affidabile è lo
psicrometro o igrometro di
Assmann. .
4