Applicazione a problemi chimici dei principi della meccanica quantistica
1. Funzione d’onda di un sistema chimico
La meccanica quantistica descrive ogni possibile sistema chimico (atomo, molecola, insieme
di molecole) mediante una funzione matematica (detta funzione d’onda) che viene costruita
ipotizzando i nuclei degli atomi costitutivi del sistema collocati in posizioni fisse nello spazio e gli
elettroni liberi di muoversi. Internamente ad essa ciascun elettrone j degli N totali appartenenti al
sistema trova riscontro attraverso una propria terna di coordinate cartesiane (xj, yj, zj) o sferiche (rj,
j, j):
Alla funzione d’onda e’ richiesto il rispetto del principio d’indeterminazione, enunciato da
Heisenberg e volto ad ipotizzare una conoscenza solo probabilistica per le distribuzioni spaziali di
particelle mobili (in questo caso gli elettroni). Ne consegue che il prodotto:
* dV1 dV2 ... dVN
(2)
misura la probabilita’ simultanea (anziche’ la certezza) di trovare l’elettrone 1 nel volume
infinitesimo dV1 in cui e’ racchiuso il punto dello spazio individuato dalle coordinate dell’elettrone
1, l’elettrone 2 nel volume infinitesimo dV2 in cui e’ racchiuso il punto dello spazio individuato
dalle coordinate dell’elettrone 2, ...
Compare l’asteriscazione, simbologia correntemente usata per intendere il complesso
coniugato del termine accanto al quale la si incontra. Implica il cambiamento del segno algebrico
che precede la costante immaginaria i e non ha quindi alcun effetto sulle quantita’ reali, categoria
cui appartengono quasi sempre le funzioni d’onda. Gli elementi di volume infinitesimi vanno
espressi in coordinate cartesiane o sferiche, secondo che si sia scelto di operare con le une o con le
altre:
dx j dy j dz j
dV j 2
rj sin j drj d j d j
coordinate cartesiane
coordinate sferiche
j 1, 2, ..., N
(3)
Integrando il fattore probabilistico (2) sull’intero spazio si ottiene la somma tra le
probabilita’ di tutte le possibili distribuzioni elettroniche e tale somma deve necessariamente
produrre un risultato unitario:
dV dV ... dV
1
2
N
1
(4)
1
Vanno utilizzati estremi d’integrazione resi idonei ad includere in maniera completa gli
intervalli su cui corrono le coordinate di tipo cartesiano o sferico cui si sta facendo ricorso:
x j
0 rj
y j
0 j
z j
0 j 2
j 1, 2, ..., N
(5)
Gli integrali che come quello appena riportato saturano totalmente la variabilita’ spaziale di
tutte le coordinate vengono di solito simboleggiati utilizzando una notazione piu’ compatta detta
“braket”:
(6)
La barra verticale posta a dividere l’elemento di sinistra (“bra”) dall’elemento di destra
(“ket”) rammenta l’asteriscazione cui va sottoposto il contenuto del “bra”.
Per il fatto di dare origine ad un valore finito quando si integra sull’intero spazio il suo
prodotto quadratico la funzione d’onda appartiene alla tipologia delle funzioni matematiche dette
normalizzate.
2. Operatori
Poiche’ la funzione d’onda descrive fedelmente il sistema cui e’ riferita si deve poterla
utilizzare per dedurre il valore di ogni osservabile fisica del sistema stesso (ossia di ogni parametro
che possa essere sottoposto a misura: energia, momento dipolare, polarizzabilita’ elettrica, ...).
Si impiegano allo scopo opportuni operatori matematici che agiscono sulla funzione d’onda
(un operatore compie specifiche azioni sulla funzione cui viene volta per volta applicato:
l’operatore /x trasforma la funzione nella sua derivata parziale rispetto alla coordinata cartesiana
x, l’operatore – ln ne ricava il logaritmo naturale e gli cambia poi il segno, ...).
Ad ogni osservabile fisica u corrisponde un operatore U, costruito utilizzando regole che
esistono ben codificate, ed il valore di u pertinente al sistema descritto dalla funzione d’onda e’
fornito da un integrale su tutto lo spazio:
u U
(7)
Si applica cioe’ l’operatore alla funzione d’onda, si moltiplica poi quanto si e’ ottenuto per il
complesso coniugato della stessa ed infine si integra. L’integrale copre la totalita’ delle dimensioni
spaziali e produce quindi un risultato che riflette i contributi opportunamente pesati di tutti i modi in
cui gli elettroni possono distribuirsi.
Tra gli operatori quantistici ha particolare rilevanza H, operatore detto hamiltoniano e
collegato all’energia totale E del sistema. L’energia E ottenuta applicando H alla funzione d’onda
propria di un sistema chimico somma l’energia cinetica degli elettroni alle energie elettriche
attrattive e repulsive tra elettroni e nuclei atomici, tra elettroni ed elettroni, tra nuclei atomici e
nuclei atomici. Rimane esclusa solo l’energia cinetica dei nuclei atomici, perche’ si e’ ipotizzato di
procedere considerandoli immobili in posizioni note. La si dovra’ valutare eventualmente a parte, se
interessa conoscerla, per poi addizionarla ad E.
3. Equazione di Schrödinger
Per ottenere la funzione d’onda propria di un qualsiasi sistema (chimico ma anche, piu’ in
generale, non chimico) occorre dapprima costruire l’operatore hamiltoniano H che corrisponde al
2
sistema medesimo. Va poi risolta la seguente equazione, dedotta da Schrödinger, dove solo
l’operatore H e’ inizialmente noto in maniera esplicita:
H E
(8)
L’equazione di Schrödinger stabilisce che puo’ essere funzione d’onda del sistema ogni
funzione normalizzata sulla quale l’intervento dell’hamiltoniano H comporti il medesimo effetto
del prodotto per una costante (il cui valore esprime la corrispondente energia totale E). Nel
linguaggio matematico tali funzioni vengono dette autofunzioni dell’operatore mentre le costanti
moltiplicative sono i suoi autovalori.
Risolvendo un’equazione di Schrödinger si individuano infinite funzioni d’onda in grado di
soddisfarla. Infatti accanto alla funzione d’onda riferita allo stato fondamentale del sistema (e’
quella contraddistinta dal valor minimo dell’energia E) appaiono le funzioni di tutti i possibili stati
eccitati, con energie via via in crescita.
A causa della sua elevata complessita’ l’equazione di Schrödinger si riesce pero’
concretamente a risolvere solo per sistemi molto semplici. Tra i sistemi chimici rientrano in questa
categoria gli atomi idrogenoidi (atomi comprendenti un nucleo con Z protoni ed un unico elettrone:
H, He+, Li++, Be+++, ...).
Anche quando e’ riferita ad un sistema chimico che possieda una struttura estremamente
semplice, come accade per gli atomi idrogenoidi, l’equazione di Schrödinger coinvolge tuttavia piu’
dimensioni spaziali e costituisce un problema alquanto difficile da affrontare.
Puo’ essere allora utile, prima di presentare i risultati ottenibili trattando sistemi idrogenoidi
ed altri sistemi chimici ancor piu’ complessi, soffermarsi su cio’ che accade quando si fa ricorso ai
metodi propri della meccanica quantistica per descrivere situazioni, sia pur non strettamente
chimiche, nelle quali la coordinata da considerare risulti pero’ essere una soltanto.
Sono sistemi che presentano caratteristiche di unidimensionalita’ la particella nella scatola di
potenziale e l’oscillatore armonico.
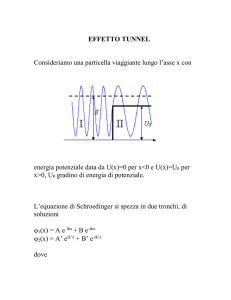
4. Particella nella scatola di potenziale
Assume questa denominazione un sistema costituito da una particella in movimento lungo
un’unica coordinata x e soggetta ad un potenziale che e’ nullo per valori di x compresi tra 0 ed un
estremo superiore L, mentre assume un ammontare infinito altrove:
La particella puo’ dunque muoversi liberamente nel tratto dell’asse cartesiano delimitato dai
valori 0 ed L, ma non le e’ possibile varcare questi confini.
Un caso reale assimilabile a questo modello si incontra quando viene preso in esame un
elettrone racchiuso entro un conduttore metallico. L’elettrone puo’ spostarsi senza particolari
impedimenti all’interno del metallo, ma non riesce a fuoriuscire: e’ trattenuto da una barriera di
energia potenziale invalicabile. E’ evidente che il problema dell’elettrone nel conduttore ha un
3
carattere tridimensionale, ma si puo’ trattarlo rimanendo nella pura unidimensionalita’ qualora si
faccia riferimento ad un moto lungo un filo metallico sottilissimo.
Se la situazione di una particella confinata entro una scatola da un potenziale insormontabile
viene descritta utilizzando i metodi della meccanica classica si arriva a concludere che:
a) tutti i possibili posizionamenti della particella nel tratto delimitato dalle pareti del potenziale
sono tra loro equiprobabili;
b)
e’ ammesso per l’energia della particella ogni qualsiasi valore.
Se lo stesso problema va affrontato avvalendosi delle metodologie proprie della meccanica
quantistica occorre risolvere l’equazione di Schrödinger che gli corrisponde.
Poiche’ e’ cinetico l’unico tipo di energia che puo’ caratterizzare la particella nel suo moto
entro il tratto dove viaggia liberamente, l’operatore hamiltoniano deve includere soltanto la
trascrizione operatoriale del medesimo termine. Assume pertanto questo aspetto:
2 d 2
H
2 m dx 2
(10)
dove:
m = massa della particella
(11)
= h/(2) = 1.05457 x 10
-34
Js
essendo h la costante quantistica di Planck:
h = 6.62608 x 10-34 J s
(12)
L’equazione di Schrödinger da risolvere si presenta allora cosi’:
2 d 2ψ
E
2 m dx 2
(13)
ed e’ questa la forma generale che spetta ad una funzione d’onda appropriata per soddisfarla:
2m E
C cos
2mE
x D sin
x
(14)
con C e D cui corrispondono costanti del tutto arbitrarie, perche’ l’equazione (13) risulta comunque
soddisfatta per qualsiasi scelta dei valori assegnati. Si procede verso l’esplicitarle in maniera
univoca imponendo che ogni funzione d’onda fisicamente accettabile debba azzerarsi quando x = 0
ed x = L, perche’ la probabilita’ di trovare la particella in tali collocazioni (ed anche al di fuori
dell’intervallo da esse delimitato) puo’ essere soltanto nulla, a causa dell’ostacolo rappresentato
dalla brusca ed illimitata crescita del potenziale. Nasce in tal modo una coppia di condizioni:
4
C cos 0 D sin 0 0
2m E
2m E
C
cos
L
D
sin
L 0
(15)
da cui traggono origine due vincoli:
C 0
2 m E L n
(16)
E’ apparso n, un numero quantico che con i suoi valori interi assicura l’azzeramento
richiesto quando x = L e che condiziona le valutazioni prevedibili per l’energia. Si ha infatti,
indicando con En l’ammontare energetico collegato al valore specifico assunto volta per volta dal
numero quantico:
n2 h2
En
8 m L2
n 1, 2,...
(17)
e con n la corrispondente funzione d’onda:
n
L
x
n Dn sin
n 1, 2,...
(18)
Il primo valore ammissibile per n e’ unitario e non nullo, perche’ l’azzerarsi del numero
quantico comporterebbe nullita’ ovunque della funzione d’onda ed il rendere inesistente la
particella.
Alla costante arbitraria Dn ancora presente nelle funzioni d’onda si assegna un valore
esplicito ricordando che deve essere soddisfatto il requisito della normalizzazione.
Dal dover cioe’ essere:
n 1,2,...
n n 1
(19)
consegue una specifica relazione vincolare:
dx
*
n
n D
L
2
n
dx sin
0
2
n
D L
n
2
n
x
L
n
dt sin
2
t
(20)
0
2
n
D L
n
t sin t cos t 0
2 n
Dn2 L
1
2
dalla quale si deduce il valore (indipendente da n) proprio della costante:
5
Dn
2
L
(21)
Diventa in tal modo completamente esplicito l’aspetto delle funzioni d’onda:
n
2
n
sin
L
L
x
n 1, 2,...
(22)
E’ agevole verificare che le funzioni dedotte vanno a costituire un insieme dotato di
ortonormalita’, un insieme cioe’ dove l’integrale esteso su tutto lo spazio del prodotto tra due
termini assume valore unitario se i due termini sono identici, mentre si annulla ogni volta in cui i
due termini non coincidono:
n n'
dx
*
n
n'
2
n
dx sin
L0
L
L
2
1
n'
x sin
L
x
dt sin n t sin n' t
23
0
dt cos n n' t
0
1
dt cos n n' t
0
sin n n' t 0
1
1
t
1
0
n n'
1 sin n n' t 0 1 sin n n' t 0
0
n n'
n n'
n n'
n n'
I grafici delle funzioni d’onda ottenute per la particella nella scatola sono caratterizzati da
andamenti sinusoidali:
6
Non e’ difficile giungere a stabilire che la generica funzione n deve azzerarsi ogni volta in
cui risulti soddisfatto il vincolo:
n
x k
L
k 0,1,...,n 1,n
(25)
dal quale vengono individuati n + 1 valori della coordinata x:
x
k 0,1,... ,n 1,n
k
L
n
(26)
I punti dove una funzione d’onda si azzera sono detti nodi ed evidenziano configurazioni del
sistema descritto la cui probabilita’ di manifestarsi concretamente e’ da ritenere nulla.
Poiche’ il numero dei nodi cresce se cresce il valore assunto dal numero quantico n, proprio
come accade per l’energia, un elevato numero di nodi reperibile in una funzione d’onda e’ indizio
che essa si riferisce ad un assetto con alto contenuto energetico del corrispondente sistema.
La separazione tra i livelli energetici consecutivi cui la particella puo' accedere cresce
all’aumentare del numero quantico che contraddistingue lo stato nel quale si trova il sistema.
Avvalendosi della relazione (17) diventa infatti immediato dedurre che deve aversi:
En1 En
n 12 h2 n2 h2
8 m L2
8 m L2
2 n 1h2
n 1,2,...
8 m L2
(27)
Se alla massa m della particella competono valutazioni elevate la differenza energetica tra
ogni livello ed il precedente si assottiglia, fino ad azzerarsi di fatto quando si raggiungono valori
molto consistenti. Da un succedersi quantizzato, ossia discontinuo, delle energie, si arriva dunque
alla sequenza continua propria dei sistemi che presentano dimensioni non ridottissime. Questo
conferma che la meccanica quantistica, indispensabile per descrivere i comportamenti quantizzati di
una particella ultramicroscopica quale e’ un elettrone, riesce a fornire risultati realistici,
riproducendo gli esiti cui perviene la meccanica classica, quando deve far riferimento a sistemi
macroscopici.
Avendo risolto l'equazione di Schrödinger per la particella nella scatola, ossia disponendo
delle funzioni d’onda pertinenti ai suoi possibili stati energetici, si riesce a valutare ogni altra
osservabile fisica del sistema. Occorre volta per volta far ricorso all'operatore appropriato e
compiere l’integrazione prescritta dall'identita’ (7).
Esercizio
Si valuti il risultato prevedibile per una misura volta ad identificare dove possa trovarsi una
particella di massa m posta in una scatola monodimensionale che le rende possibile spostarsi solo
nell’intervallo delimitato dai valori 0 ed L della coordinata x.
7
L’operatore da utilizzare coincide con la coordinata stessa, mentre la relazione (22) del testo
riproduce la struttura delle funzioni d’onda che descrivono gli stati accessibili alla particella.
***
Indicando con xn il valore atteso da una misura che punti a stabilire il posizionamento della
particella quando si trova nello stato descritto dalla funzione d’onda n si esprime cosi’ il risultato
atteso:
xn n x n
dx
*
n
x n
2
n
dx sin
L0
L
2
n
dx x sin 2
L0
L
L
n
x x sin
L
L
2L
2 2
n
2L
2 2
n
x
x
n
dt t sin
2
t
0
t sin t cos t n 1 n
t dt t sin t cos t
2
0 2 0
n
t2
sin 2 t
L
2 2 t sin t cos t
n 2
2 0
2
L
4. Oscillatore armonico
Ha il comportamento di un oscillatore armonico un sistema nel quale due particelle, le cui
masse siano m1 ed m2, risultino collegate da una molla che abbia massa trascurabile. Le due
particelle si allontanano e si accostano in maniera ripetitiva, per effetto del contrarsi e
dell’estendersi della molla.
Puo’ essere ritenuta un esempio di oscillatore armonico una molecola biatomica, perche’ i
nuclei dei due atomi costitutivi, cui l’esistere del legame chimico impedisce la separazione, vibrano
distanziandosi e riavvicinandosi.
Se si indica con x la differenza tra la lunghezza della molla nell’istante via via considerato
e la sua lunghezza a riposo 0:
x 0
(28)
diventa possibile esprimere cosi’ l'energia potenziale V cui e’ soggetto il sistema complessivo,
costituito oltre che dalla molla anche dalle due particelle:
V
1 2
kx
2
(29)
Il simbolo k identifica la costante di forza della molla, che ha come dimensioni il rapporto
tra una massa ed un tempo al quadrato.
8
L'energia potenziale ha un andamento parabolico, con un valor minimo nullo corrispondente
alla posizione di riposo della molla (x = 0).
All'energia potenziale e’ collegata la forza F che agisce sulle particelle:
F
dV
k x
dx
(30)
La presenza del segno algebrico negativo conferisce alla forza il corretto comportamento
che deve manifestare: risulta infatti negativa e tende quindi a contrarre la molla quando x assume
valori positivi ( > 0), diventa positiva per espanderla se il valore di x risulta negativo ( < 0). Si
tratta cioe’ di una forza che sollecita il ripristino della posizione a riposo.
Se il sistema viene esaminato avvalendosi dei principi della meccanica classica si deve
ammettere che la sua energia complessiva E (somma tra l’energia cinetica delle particelle e
l’energia potenziale) puo' assumere qualsiasi valore non negativo.
Il valore assunto dall’energia E limita l’espandersi ed il contrarsi della molla. La massima
espansione e la massima contrazione sono individuate dai valori della coordinata x in
corrispondenza dei quali l'energia potenziale coincide con l’energia complessiva:
x
2E
k
(31)
Sono simmetrici rispetto alla posizione di riposo ed implicano azzeramento dell’energia
cinetica (valutata dalla differenza tra E e V).
L'energia cinetica diventa invece massima, e pari ad E, quando la coordinata x identifica,
azzerandosi, la posizione a riposo (in cui e’ l’energia potenziale ad annullarsi).
Le particelle sono dunque soggette ad un continuo moto vibratorio, nel quale la velocita’ si
azzera quando la coordinata x raggiunge uno dei suoi valori estremi fissati dal vincolo (31), cui
corrisponde l’invertirsi della direzione che caratterizza lo spostamento. Il valor nullo della
coordinata comporta invece velocita’ massima.
Risulta conseguentemente massima la probabilita’ di trovare le particelle nelle posizioni
estreme raggiunte dalla molla nel suo espandersi e contrarsi, perche’ ivi il valor minimo della
velocita’ comporta un piu’ accentuato stazionamento. La probabilita’ minima compete invece alla
configurazione a riposo, raggiunta dalle particelle mentre la loro velocita’ e’ massima.
Se si fa ricorso alla meccanica quantistica per descrivere l’oscillatore armonico occorre
innanzi tutto costruire l’operatore hamiltoniano che compete al sistema. E’ un operatore in cui
devono trovar riscontro, in forma sommata, le due energie, cinetica e potenziale, che concorrono a
determinare l’energia complessiva. Ha il seguente aspetto:
H
2 d 2 1 2
kx
2 m dx 2 2
(32)
Il termine cinetico coinvolge, insieme ad una derivata seconda, la costante di Planck divisa
per il fattore 2 e la massa ridotta m del sistema, in cui confluiscono le masse m1 ed m2 delle
singole particelle:
m
m1 m2
m1 m2
(33)
9
L’energia potenziale viene invece ad essere rappresentata dalla sua espressione classica, non
soggetta a modificazioni.
Si presenta cosi’ l’equazione di Schrödinger imperniata sull’hamiltoniano dell’oscillatore
armonico:
2 d 2 1 2
k x E
2 m dx 2 2
(34)
E’ possibile risolverla esattamente, ottenendo valori dell’energia totale E cadenzati da un
numero quantico p, che e’ un intero non negativo:
1
k
Ep p
2
m
p 0,1, 2,...
(35)
Ad ogni valore assunto dal numero quantico p e’ collegata una funzione d’onda p,
rappresentativa del corrispondente stato in cui viene a trovarsi il sistema.
Le funzioni d’onda dell’oscillatore armonico formano un insieme ortonormale:
1
0
p p'
p p'
p p'
(36)
e sono caratterizzate dalla presenza di un fattore esponenziale gaussiano, che conferisce ai loro
grafici un caratteristico andamento smorzato:
10
Il valore del numero quantico p individua anche quanti sono i punti nodali della funzione
d’onda volta per volta identificata.
Al crescere del numero quantico crescono quindi sia la presenza di nodi nella funzione
d’onda che l’energia. Il riscontrare molti nodi nel grafico di una funzione d’onda e’ quindi anche
per l’oscillatore armonico una circostanza che presuppone un’elevata energia dello stato
corrispondente in cui si trova il sistema.
L’andamento dei grafici riportati permette di rilevare come nello stato fondamentale (ossia
nello stato dal contenuto energetico minimo, cui compete un valor nullo del numero quantico) abbia
probabilita’ massima l’assetto a riposo dell’oscillatore (x = 0).
Valori piu’ elevati del numero quantico vedono aumentare la probabilita’ di situazioni nelle
quali la molla presenta invece una deformazione (x 0).
Si va quindi in questi casi verso riscontri piu’ conformi alle previsioni della meccanica
classica, le cui elaborazioni portano ad identificare come statisticamente preponderanti lo
stiramento estremo e la compressione massima.
I livelli energetici che la meccanica quantistica ammette possibili per un oscillatore sono
equispaziati. La separazione tra loro valori consecutivi e’ cioe’ costante e non influenzata dal
variare del numero quantico:
3
E p 1 E p p
2
k
1
p
m
2
k
m
k
m
p 0,1,...
(38)
Quando le valutazioni da assegnare alla massa ridotta m diventano elevate, perche’ il
sistema trattato e’ macroscopico anziche’ microscopico, la differenza tra energie contigue tende a
spegnersi. Il susseguirsi discretizzato si trasforma quindi progressivamente in un succedersi
continuo ed i risultati offerti dalla meccanica quantistica vanno correttamente a riprodurre quelli
propri della meccanica classica, del tutto validi su scala macroscopica.
E’ importante osservare come le funzioni d’onda dell’oscillatore armonico non si azzerino
neppure in corrispondenza di valori della coordinata molto diversi, in senso positivo o negativo, dal
valor nullo. Le funzioni d’onda decrescono esponenzialmente ma non si annullano mai. Questo
assegna probabilita’ piccole ma non nulle di sussistere ad assetti vietati dalla meccanica classica, in
11
quanto riferiti a stiramenti e compressioni della molla cui corrispondono valori dell’energia
potenziale che eccedono quelli dell’energia complessiva.
12