TEORIA
Principio zero della termodinamica
Se il corpo A è in equilibrio termico con il corpo C ed anche un altro corpo B è in
equilibrio termico con il corpo C, allora i corpi A e B sono in equilibrio termico
fra di loro
CONSIDERAZIONI PREGRESSE:
Trasformazioni quasistatiche (molto lentamente variabili):
isobàre – isocòre – isoterme
adiabatiche – cicliche
lavoro → W = p ⋅Δ V
chiamando Δh lo spostamento di un pistone che va da h1 ad h2 ossia h2 – h1
W =F ⋅Δ h=( pS) ⋅Δ h=p ⋅(S Δ h)= p ⋅Δ V
Il lavoro termodinamico compiuto dal sistema durante una trasformazione
quasistatica è dato dall'area della parte del piano p-V contenuto fra l'asse dei
volumi ed il grafico della trasformazione stessa.
I principio della termodinamica
UB -UA = ΔU = Q - W
ISOCÒRE → ∆V = 0 → ∆U = Q
ISOBARE → ∆U = Q – p·ΔV
ISOTERME essendo U = (L/2)nRT
ΔT = 0 → ΔU = 0 → W = Q = n·R·T·ln(Vf – Vi)
CICLICHE → ΔU = 0 → W = Q il lavoro (uguale al calore) è la differenza delle
aree sottese dalla curva: positive se la funzione va verso destra e negative se va
verso sinistra → se ne deduce che un ciclo orario da un lavoro positivo e un ciclo
antiorario un lavoro negativo.
ADIABATICHE ( senza scambio di calore: ΔU = - W )
Mentre nei solidi e nei liquidi esiste un solo valore di calore specifico, nei gas ce
L R
n'è uno a volume costante: CV = 2 M ed uno a pressione costante:
CP =
L+ 2 R
dove L è il coefficiente = 3 per i gas monoatomici, 5 per quelli
2 M
biatomici, ecc; R e la costante universale dei gas; M è la massa molare. Per le
adiabatiche è importante il rapporto fra questi due calori specifici:
γ=
CP L + 2
=
ossia
CV
L
5
per i monoatomici,
3
7
per i biatomici, ecc.
5
La formula fondamentale delle adiabatiche è p·V
(γ−1)
T =(
V0
)
V
T 0 e la
Tp
1−γ
( γ )
1−γ
( γ )
=T 0 p 0
γ
= cost da cui derivano:
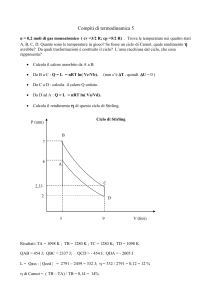
esercizio n° 23 pagina 453
Un sistema termodinamico compie la
trasformazione ciclica rappresentata nella
figura.
• Individuare il tipo di trasformazione
relativa a ciascun tratto del grafico.
• In quali di queste trasformazione si
compie lavoro non nullo ?
• Calcolare il lavoro complessivo prodotto
nella trasformazione ciclica.
[AB=CD: trasformazione isòbara ; BC=DA:
trasformazione isocòra ; AB e CD ; 8,0·104 J]
AB e CD : isòbare BC e DA : isocòre
W = p ⋅Δ V =Δ p ⋅Δ V =[(100−80) ⋅103 ](5,0−1,0)=8,0 ⋅104 J
esercizio n° 24 pagina 454
Esaminare la trasformazione ciclica
rappresentata nella figura.
• Calcolare il lavoro compiuto, la
variazione di energia interna e il calore
assorbito.
2
[2·10 J ; 0 J ; 2·102 J]
W = p ⋅Δ V =Δ p ⋅Δ V =(2−1) ⋅105 ⋅(3−1) ⋅10−3 =2 ⋅102 J
esercizio n° 2 pagina 456
Un contenitore di forma cilindrica con una base mobile di sezione S = 120 cm2,
racchiude un gas alla pressione di 1,00 atm. Il gas riceve una quantità di calore Q =
480 cal e si espande a pressione costante per un tratto di 25,0 cm.
• Calcolare la variazione della energia interna del gas
[1,63 · 103 J]
Δ U =Q−p ⋅Δ V =Q−p ⋅S ⋅Δ h =480 ⋅4,186−1,00 ⋅1,013 ⋅105 ⋅0.0150 ⋅0,250=1,63 ⋅103 J
esercizio n° 4 pagina 456
Un gas perfetto è contenuto in un recipiente ermeticamente chiuso. Il gas occupa
inizialmente il volume del recipiente alla pressione di 105 Pa ed alla temperatura di
300 K. Il gas subisce una trasformazione a volume costante passando da stati
successivi in cui la pressione vale 2,0·105 Pa,
3,0·105 Pa, 4,0·105 Pa.
• Calcolare la temperatura del gas in questi tre stati
[6,0·102 K ; 9,0·102 K ; 1,2·103 K ]
pf
pi
p1
2,0 ⋅105
T 1 =T 0 =300
=6,0 ⋅102 K
5
p0
10
p2
3,0 ⋅105
2
T 2 =T 0 =300
=9,0 ⋅10 K
5
p0
10
p
4,0 ⋅105
T 3 =T 0 3 =300
=1,2 ⋅103 K
5
p0
10
T f =T i
esercizio n° 5 pagina 456
Tre moli di gas biatomico si trovano ad una temperatura iniziale di 300 K.
Successivamente vengono riscaldate a pressione costante e si espandono, occupando
un volume pari a 5/2 di quello iniziale. Calcolare:
• il valore della temperatura finale del gas;
• il calore fornito durante la trasformazione;
• la variazione di energia interna.
[750 K ; 3,39·104 J ; 2,81·104 J]
5
V
V1
2 0 5
5
T 1 =T 0
=T 0
= T 0 = 300=750 K
V0
V0
2
2
5
da Δ U =Q−W =Q−p ⋅Δ V =Q −n ⋅R ⋅Δ T ed essndo Δ U = 2 n R Δ T si ha:
Q=Δ U + n R Δ T =
5
7
7
n R Δ T + n R Δ T = n R Δ T = 3,00 ⋅8,3145( 750−300)=3,93 ⋅104
2
2
2
5
5
Δ U = n R Δ T = 3,00 ⋅8,3145 ⋅(750−300)=2,81 ⋅104 J
2
2
esercizio n° 7 pagina 457
Un serbatoio metallico cubico ha pareti sottili, con spigolo di lunghezza 10 cm, esso
contiene un gas monoatomico, assimilabile ad un gas perfetto, alla pressione di 1,5
atm ed alla temperatura di 10° C. Posto all'aperto, per prolungata esposizione al sole,
l'intero sistema si porta alla temperatura di 65°C. Il volume del serbatoio durante il
riscaldamento non viene modificato in modo sensibile. Calcolare:
• la pressione finale del gas (in Pa);
• la variazione della energia interna del gas;
• la quantità di calore assorbita dal gas.
[1,8·105 Pa ; 44 J ; 44 J]
pf T f
Tf
5 65+ 273
5
=
pf =p i =1,5 ⋅1,013 ⋅10
=1,8 ⋅10 Pa
→
pi T i
Ti
10+ 273
pV
p V =n R T → n R=
→
T
3
3 pi V
3 1,5 ⋅1,013 ⋅105 ⋅10−3
ΔU= n R ΔT =
ΔT=
⋅55=44 J
•
2
2 Ti
2
283
Q=Δ U= 44 J
•
•
p V =n R T →
TEORIA
II principio della termodinamica
Primo enunciato di lord Kelvin
1) É impossibile realizzare una
trasformazione il cui unico risultato sia
quello di assorbire una determinata
quantita di calore da un'unica sorgente
e trasformarla integralmente in lavoro
Secondo enunciato di Rudolf Clausius
2) È impossibile portare calore da
bassa ad alta temperatura senza che
intervenga del lavoro esterno a
consentirlo
Terzo enunciato del rendimento
3) dal 1° enunciato si trae che Q2 = W + |Q1| e quindi che W = Q2 - |Q1| ed
Q −|Q |
|Q |
W
2
1
1
essendo η= Q = Q =1− Q da cui la definizione: é impossibile progettare
2
2
2
una macchina tecnica che abbia un rendimento uguale ad 1.
TRASFORMAZIONI REVERSIBILI
Una trasformazione è reversibile se è possibile riportare sia il sistema, sia
l'ambiente esterno nello stato iniziale, ripercorrendo la trasformazione a ritroso.
Per questo la trasformazione deve essere "lenta" ed omogenea.
TEOREMA DI CARNOT: il rendimento ηR di una macchina reversibile è
sempre maggiore o uguale del rendimento ηS di un altra macchina, ed i due
rendimenti sono uguali soltanto se anche la macchina S è reversibile.
CICLO DI CARNOT: è costituito da 4 fasi consecutive che in sequenza sono:
un'espansione isoterma - un'espansione adiabatica - una compressione isoterma
una compressione adiabatica.
Dal fatto che i rapporti di compressione ed espansione dei volumi nelle isoterme
sono identici si ricava che:
η=1−
|Q 1|
T1
=1−
Q2
T2
CICLO OTTO E DIESEL
Si noti in questo ciclo l'improvviso
aumento della pressione fra gli stati C
e D dovuto all'esplosione innescata
dalla scintilla della candela. Il volume
non ha il tempo di cambiare che tutto il
combustibile è stato bruciato.
In questo caso la combustione si
autoinnesca a causa del fatto che la
pressione arriva ad un punto limite.
Qui il passaggio C → D è verticale
perchè come conseguenza della
combustione il volume ha il tempo di
espandersi.
Si nota una diminuzione del
rendimento essendo l'area compresa
nel ciclo (che corrisponde al lavoro
svolto) minore.
CICLO FRIGORIFERO
Conseguenza diretta dell'enunciato di Clausius. Non si parla più di rendimento
come per le macchine termiche convenzionali. Qui l'effetto utile è il
prelevamento di una quantità di calore a bassa temperatura e quello che si è
obbligati ad introdurre per poterlo ottenere è lavoro, quindi il coefficiente di
prestazione è:
COP =
Q1
|W |
i suoi valori sono normalmente compresi fra 2 e 6.
CONDIZIONATORE
Il principio ed il rendimento sono identici a quelli dell'impianto frigorifero solo
che qui l'interno del frigorifero è sostituito dalla stanza che si vuole refrigerare e
l'esterno del frigorifero con dispersori di calore è l'ambiente esterno alla stanza.
POMPA DI CALORE
Serve per riscaldare la stanza. Funzione al contrario del frigorifero. Qui si ha il
coefficiente di guadagno:
K=
|Q 2|
|W |
ed i suoi valori sono normalmente compresi fra 5 e 6.
esercizio n° 1 pagina 495
Un braccio meccanico, che consente di sollevare dei pesi, viene alimentato con
benzina il cui potere calorifico è 0,460·108 J/kg. Per sollevare 500 kg fino ad una
altezza di 16,0 m si bruciano 5,17·10-3 kg di benzina.
• Qual è il rendimento della macchina in percentuale?
[33,0%]
η=
W mgh
500 ⋅9,80 ⋅16,0
=
=
=0,32966 → 33,0 %
8
−3
Q
Q
0,460 ⋅10 ⋅5,17 ⋅10
esercizio n° 2 pagina 495
Una valvola termoionica eroga una potenza (P) pari a 2,0·104 W con un rendimento
del 65%. Il sistema di raffreddamento per mantenere l'efficienza è ad acqua.
L'incremento di temperatura dell'acqua del sistema di raffreddamento non deve
superare i 10 °C.
• Calcolare la portata dell'acqua.
[2,6·10- 4 m3/s]
W
W
Dalla Q1 =c m Δ T =Q 2 −W = η −W = η (1−η)
m =d ⋅V
W
Q 1 =c ⋅d ⋅V ⋅Δ T = η (1−η) da cui in per ogni secondo:
W (1−η)
2,0 ⋅104 (1−0,65)
m3
V=
=
=2,6 ⋅10−4
η ⋅c ⋅d ⋅Δ T 0,65 ⋅4186 ⋅1000 ⋅10
s
SPIEGATO PIÙ APPROFONDITAMENTE:
Per poter spiegare, con una descrizione meno sintetica, quello che avviene veramente
e motivare l'utilizzo di certe formule, abbandoniamo la simbologia collegata al lavoro
utile svolto di W (dall'inglese) usata anche per evitare confusioni con il momento
angolare che, a suo tempo, abbiamo indicato con L ed usiamo, invece quest'ultimo
simbolo per il lavoro. Così facendo evitiamo confusione anche fra la grandezza
lavoro e l'unità di misura della potenza che viene utilizzata nel problema proposto.
In ingresso si ha la quantità di calore totale fornita Q2 che deve considerarsi il 100 %.
Di essa il 65% dà il lavoro utile L ed il restante 35% è Q1 necessariamente
(II principio) viene sprecato ed è necessario smaltirlo.
Si definisce rendimento percentuale la frazione costituita da:
1. un numeratore in cui è presente il lavoro utile ed
2. un denominatore che rappresenta il totale dell'energia fornita
3. il tutto moltiplicato 100.
L
Quindi il rendimento percentuale è η% = Q x 100 che nel nostro caso vale al 65 %.
2
É ovvio però che, per effettuare i conti non serve il rendimento percentuale ma quello
rappresentato dalla semplice frazione ossia il rendimento percentuale diviso 100 che
d'ora in poi chiameremo semplicemente η.
L
L
Q2=
e per passare da Q2
Q 2 Quindi per passare dal lavoro a Q2 si deve fare
η
1−η
a Q1 si deve fare Q 1 =(1−η) Q 2 = η L Si poteva fare anche con le proporzioni
1−η
L : 0,65 =Q 1 : 0,35 o anche L : η=Q 1 : (1−η) da cui Q 1 =
L (A)
ossia
η
η=
Ma se L deve essere smaltito ogni secondo (dal problema viene fornita la potenza in
Watt = J/s) anche Q1 quindi si intende al secondo. Questo calore viene ceduto
all'acqua di raffreddamento e la quantità di calore ceduto all'acqua si può calcolare
anche (vedi primo volume studiato all'inizio dell'anno) come:
Q 1 =c ⋅m ⋅Δ T (B)
J
dove c = 4186 kg ⋅K è il calore specifico dell'acqua, m è la massa in kg dell'acqua
e ΔT = 10 °C è l'incremento massimo di temperatura che deve avere l'acqua.
Uguagliando i due valori di Q1 (A) e (B) si ha:
1−η
L = c ⋅m ⋅Δ T
η
risolvendolo rispetto ad m si ottiene la portata massica (kg/s). Ma il problema
chiedendo la portata senza specificarne la tipologia, intende quella volumica.
Vedi le possibili tipologie:
• Portata ponderale (espressa in Newton al secondo)
• Portata massica (espressa in chilogrammi al secondo)
• Portata molare (espressa in moli al secondo)
• Portata volumetrica (espressa in metri cubi al secondo)
ed essendo la densità
ρ=
m
V
quella dell'acqua è ρ=1000
[rò = massa (kg) diviso Volume (m3)]
kg
3 .
m
si ha V = m
ρ (volume per unità di tempo quindi portata volumica o volumetrica) si
ha la formula finale: dove occorre usare la potenza P (lavoro per unità di tempo) al
posto del lavoro e si è usato il simbolo ρ al posto di d.
V=
1−η
1
0,35
1
m3
P ⋅
2,0 ⋅10 4
=2,6 ⋅10−4
=
η
c ⋅Δ T ⋅ρ
0,65
4186 ⋅10 ⋅1000
s
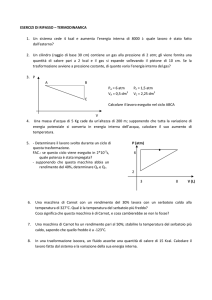
esercizio n°3 pagina 495
Un frigorifero compie cicli reversibili, operando tra due sorgenti termiche, una alla
temperatura di t1 = -15 °C, l'altra a t2 = 20 °C, per produrre ghiaccio. L'acqua si trova,
inizialmente, alla temperatura di 20 °C e il calore latente di fusione dell'acqua è
3,35·105 J/kg. A ogni ciclo il frigorifero compie un lavoro (negativo) pari a 100J.
• Quanti cicli sono necessari per trasfomare in ghiaccio almento 10,0 g d'acqua?
[6]
T 0 =273 K
T 1 =t 1 + T 0 =258 K
T 2 =t 2 + T 0 =298 K
Δ T r =T 2 −T 0 =20 K
Δ T 21 =T 2 −T 1 =35 K
T 2 −Δ T 12=T 1
T 1 T 2 −T 1 Δ T 12
=
=
→
T2
T2
T2
W
W Q 2−Q 1
η=
=
Q2 =
Q2
Q2
η
η=1−
T2
1
=
η Δ T 12
m (L f + c Δ T r )
Q1
T2
W
1
ed essendo Q 1 =Q 2 −W = η −W =W ( η −1)=W ( Δ T −1) percui x diventa:
12
m (Lf + c Δ T ) m (L f + c Δ T ) Δ T 12 m (Lf +c Δ T ) Δ T 12
x=
=
=
T2
W (T 2 −Δ T 12)
W ⋅T 1
=
W(
−1)
Δ T 12
−3
5
10,0 ⋅10 (3,35 ⋅10 + 4186 ⋅20)35
=5,68 → 6 cicli
100 ⋅258
Q tot = x ⋅Q 1 =m (Lf + c ⋅Δ T r )
→
x=
SPIEGATO PIÙ APPROFONDITAMENTE: (torniamo ad usare W per il lavoro)
Si lavora operando fra due temperature T 1 =t 1 + T 0 =258 K e T 2 =t 2 + T 0 =293 K e
T
T −T
1
2
1
quindi nel ciclo di Carnot si ha un rendimento η=1− T = T
.
2
2
Questo rendimento esprime anche il rapporto fra il lavoro W e la quantità (ceduta) ad
W
alta temperatura Q2. Ossia: η= Q (qui il lavoro W<0 : bisogna fornire lavoro al
2
sistema ed il calore ceduto ad alta temperatura Q2 < 0 ed il loro rapporto é > 0).
W
W
Si desume che Q 2 = η ed essendo ad ogni ciclo Q1 = Q 2 −W = η −W .
Q1 totale è la somma di due quantità di calore:
Quella necessaria a portare i 10,0 grammi di acqua da 20 °C a 0 °C Q A=c ⋅m ⋅Δ T
e quella necessaria per il passaggio di stato da liquido a ghiaccio QB =Lf ⋅m .
Ossia Q 1 =Q A + QB =m (c ⋅Δ T +L f ) .
Per trovare il numero di cicli (N) è necessario dividere la quantità totale di calore che
occorre prelevare a bassa temperatura per quanta se ne può prelevare ad ogni ciclo.
N=
m (c ⋅Δ T + Lf ) m (c ⋅Δ T + Lf ) 0,01 ( 4186 ⋅20+ 3,35 ⋅105 )
=
=
= 5,68 ≈6 cicli
W
W ⋅T 2
100 ⋅293
−W
−100
−W
η
293−258
T 2 −T 1