REGIONE LIGURIA
LINEEGUIDASANITÀ
Progetto
Li.Gu.Med.
P roduzione e Implementazione,
D i ffusione e Applicazione di Linee Guida
in Medicina Interna Generale e Specialistica
Unità Operativa N° 4
MALATTIE GASTROENTERICHE E DEL FEGATO
Responsabile: Giorgio Marenco
LINEA GUIDA SU:
NEOPLASIE DEL COLON
Coordinatori:
F. Boccardo, L. De Salvo, R. Fiocca, A. Gramegna,
G. Menardo, V. Savarino, V. Vitale
Estensori:
V. Bachi, F. Boccardo, A. Canepa, L. De Salvo, R. Fiocca,
A. Giacosa, A. Gramegna, C. Mareni, F.P. Mattioli, P. Michetti,
G.A. Rollandi, V. Savarino, V. Vitale
Le linee guida sono raccomandazioni di comportamento clinico,
prodotte allo scopo di assistere medici e pazienti nel decidere quali
siano le modalità di assistenza più appropriate in specifiche circostanze cliniche.
Sviluppare processi che migliorino la qualità dell’assistenza utilizzando
al meglio le risorse disponibili, informare il personale sanitario e i pazienti sulle diverse possibilità di diagnosi e cura: questi i principali obiettivi che
l’esperienza di altri paesi europei ha dimostrato essere effettivamente conseguibili.
Il progetto Li.Gu.Med. promosso dalla Regione Liguria d’intesa con il
Ministero della Sanità in collaborazione con l’Università di Genova –
Dipartimento di Medicina Interna e Specialità Mediche, l’Azienda
Ospedaliera Ospedale San Martino di Genova e Cliniche Universitarie
Convenzionate e l’Azienda Ospedaliera Ospedale Santa Corona di Pietra
Ligure, si propone di raggiungere questi obiettivi nei confronti degli utenti, del personale sanitario e degli amministratori sanitari, coinvolgendo
anche il mondo dell’informazione per accrescerne l’obiettività e la completezza nella comunicazione.
La presenza di esperti autorevoli – alcuni dei quali con esperienza specifica nell’elaborazione di linee guida in ambito nazionale ed internazionale – ne assicura la qualità clinica e scientifica. La collaborazione attiva
dei medici di famiglia garantisce la diffusione e l’attuazione delle linee
guida sul territorio. Inoltre, viene dato ampio spazio al coinvolgimento e
al consenso di amministratori, operatori sanitari, associazioni di pazienti,
ordini professionali, società scientifiche.
Nello sviluppo del progetto, ha un ruolo determinante la medicina “basata sull’evidenza”, cioè fondata su procedure diagnostiche e terapeutiche
ritenute ottimali sulla base di studi clinici convalidati dalla letteratura scientifica internazionale.
Articolato in 6 unità operative che agiscono parallelamente per raggiungere gli obiettivi prefissati, il progetto ha previsto in una prima fase la ste sura di linee guida diagnostiche e terapeutiche relative ad alcune tra le
patologie più rilevanti in Liguria; di tali linee guida si intende poi incoraggiare la diffusione e l’utilizzo. Il conseguimento degli obiettivi viene valutato mediante indicatori specifici per ciascuna linea guida.
Responsabile del Progetto è il Dott. Sergio Vigna della Regione Liguria,
responsabile scientifico è il Prof. Giacomo Deferrari dell’Università di
Genova; il Gruppo di Coordinamento del progetto è inoltre costituito dai
responsabili delle unità operative, da esperti di statistica , comunicazione
ed economia sanitaria e da rappresentanti dei Medici di Medicina Generale
e dell’Ordine dei Medici, e delinea le tappe di svolgimento dell’attività e
ne cura la corretta diffusione.
1. Premesse
Le evidenze scientifiche sulle quali sono formulate le presenti linee
guida sono classificate sulla base del tipo di studio da cui sono ricavate e
pertanto sulla loro "forza" di indicazione, secondo la classificazione presentata nella Tabella 1.
Tabella 1.CATEGORIE DI EVIDENZA E FORZA DELLA RACCOMANDAZIONE
Categoria di evidenza *
I. 1 o più trials clinici randomizzati ben disegnati o metanalisi
II. 1 o più studi controllati non randomizzati o altri studi che non raggiungano il livello I
III.studi non sperimentali descrittivi o di casistica (studi comparativi, studi
di correlazione, studi caso-controllo) o analisi di sottogruppi di trials
randomizzati
IV. rapporti di esperti o su pochi casi (< 10)
Forza della raccomandazione
A. Basata direttamente su evidenze di cat. I
B. Basata direttamente su evidenze di cat. II e/o raccomandazioni estrapolate da evidenze di cat. I
C. Basata direttamente su evidenze di cat. III e/o raccomandazioni estrapolate da evidenze di cat. I o II
D. Basata direttamente su evidenze di cat. IV e/o raccomandazioni estrapolate da evidenze di cat. I, II o III
*
-
Modificato da:
Canadian Task Force on the Periodic Health Examin., 1979
US Department of Health and Human Services, 1992
Canadian Hypertension Society Consensus Conference, 1993
Shekelle PG, Woolf SH, Eccles M, Grimshaw J, BMJ, 1999
2. Screening, diagnosi e sorveglianza del cancro del colon e del retto (CCR)
Esistono sicure evidenze che è possibile ridurre la mortalità da CCR con l’identificazione e il trattamento del cancro in fase precoce e con l’identificazione e la rimozione dei polipi adenomatosi che sono i precursori del CCR.
2.1. Impatto della malattia
Il carcinoma del grosso intestino rappresenta una delle principali cause
di morte da neoplasia nei Paesi occidentali. In Italia si ammalano di CCR
da 20 a 30 mila persone ogni anno, circa la metà muore per questa malattia. L’incidenza è di 30 - 50 nuovi casi per anno per 100.000 abitanti.
2.2. Fattori di rischio
I fattori di rischio per il CCR sono: età oltre i 50 anni, storia familiare di
neoplasia del colon-retto, storia personale di pregressa resezione di CCR o
di polipi adenomatosi o di lunga storia di colite ulcerosa o di colite di Crohn.
2.3. Basi molecolari dei tumori del colon-retto
Gli studi attuali riguardanti l’epidemiologia e l’eziologia del CCR sono volti
soprattutto a individuare soggetti ad alto rischio che possano beneficiare di
un programma di prevenzione e di diagnosi precoce; un notevole contributo è stato dato dalla genetica molecolare; una frazione di carcinomi si sviluppa certamente per predisposizione genetica: non è chiaro quale sia la
quota di tumori ereditari, ma si pensa che nell’1-10% dei CCR siano coinvolti
geni di suscettibilità. Fra le sindromi caratterizzate da tale predisposizione
una delle più frequenti è il CCR ereditario senza poliposi (HNPCC).
Tale sindrome presenta una trasmissione autosomica dominante ed è
caratterizzata dallo sviluppo di tumori del colon-retto che insorgono solitamente prima dei 50 aa, ma anche da tumori dell’endometrio, stomaco,
tenue, sistema biliopancreatico e urinario. E’ impossibile distinguere sulla
base delle sole caratteristiche cliniche pz con CCR sporadico dai pz
HNPCC con CCR. La sindrome viene diagnosticata in base alla storia familiare. Allo scopo di uniformare la diagnosi sono stati identificati criteri,
cosiddetti di Amsterdam, secondo i quali viene definita HNPCC una famiglia in cui: 1) il CCR compare in almeno 3 individui uno dei quali è parente di primo grado degli altri 2; 2) sono coinvolte almeno due generazioni;
3) il CCR viene diagnosticato in uno dei pz prima dei 50 anni.
La malattia è determinata da mutazioni germinali in geni del sistema di
correzione di appaiamenti sbagliati che avvengono tra le basi costitutive del
DNA durante la replicazione. Questi geni detti del mismatch repair (MMR)
sono: hMSH2, hMLH1, hPMS1, hPMS2 e hMSH6. Nelle famiglie HNPCC si
trova mutazione dei geni MMR in circa 50% dei casi. Il difetto dei geni MMR
conferisce al tessuto neoplastico una caratteristica particolare: l’instabilità di
sequenze del DNA dette microsatelliti (MSI). La MSI può essere considerata come la traccia di un fenotipo mutatore, caratterizzata cioè da una
aumentata instabilità genetica ed aumentata mutabilità del genoma.
La diagnosi di HNPCC basata sulla storia familiare è spesso incompleta per
difficoltà delle verifiche anamnestiche o per la presenza di piccoli nuclei
familiari per cui in mancanza di una storia familiare sicura, per la diagnosi
di eventuale HNPCC si possono considerare due elementi: l’età di insorgenza precoce (< 45 anni) e la presenza di tumori sincroni e/o metacroni.
2.4. Fattori ambientali
I Paesi con alta incidenza di CCR (USA, Canada, Europa occidentale,
Uruguay, Australia, Nuova Zelanda e Argentina) hanno in comune una dieta
ricca di grassi animali, di proteine e relativamente povera di frutta e verdura. Gli emigranti da Paesi a bassa incidenza di CCR come il Giappone che si
trasferiscono negli Stati Uniti, nel giro di una generazione diventano a rischio
come i residenti dai quali hanno assunto le abitudini alimentari. Altri fattori
di rischio sono l’obesità, il fumo e l’alcool assunto in quantità elevata.
Studi epidemiologici, esperimenti su animali e alcuni studi di prevenzione suggeriscono che un certo numero di alimenti e di farmaci abbiano un
ruolo protettivo nei confronti del CCR, fra questi: le vitamine antiossidanti A, E, C, l’acido folico, la vitamina D, il calcio, il selenio, l’aspirina e altri
FANS e la terapia ormonale sostitutiva nelle donne in menopausa.
2.5. Polipi colorettali e prevenzione
Quasi tutti i CCR si sviluppano su polipi benigni adenomatosi che nascono e crescono nel colon per anni prima di diventare cancri. I polipi solo
occasionalmente danno sintomi, generalmente un sanguinamento, la maggior parte sono silenti e vengono scoperti durante uno screening o in
corso di un esame dell’intestino fatto per altri motivi. Questa sequenza
adenoma→carcinoma offre una opportunità unica di prevenzione secondaria che non è possibile nella maggior parte delle altre neoplasie. Studi
clinici controllati dimostrano che la ricerca e l’asportazione di questi polipi precancerosi riduce l’incidenza di CCR.
2.6. Perché lo screening
La maggior parte dei polipi e dei cancri in fase precoce sono asintomatici e devono essere cercati mediante screening.
Le persone con sintomi che fanno sospettare CCR o polipi devono avere
una adeguata valutazione diagnostica. I candidati allo screening dovrebbero avere adeguate informazioni su rischi e benefici delle procedure stesse.
Raccomandazione A:
Lo screening per il CCR e per i polipi deve essere proposto a tutti,
uomini e donne senza fattori di rischio, a cominciare dall’età di 50 anni.
Una sorveglianza adeguata dovrebbe essere attuata dopo il trattamento
di CCR o dopo l’asportazione di polipi adenomatosi o se il pz è affetto
da condizioni precancerose come le malattie croniche infiammatorie
del colon.
2.6.1. Ricerca del sangue occulto
La ricerca annuale del sangue occulto su due campioni di feci raccolti
nel corso di 3 defecazioni consecutive seguita da colonscopia in caso di
positività del test del sangue occulto, ha dimostrato in tre studi clinici controllati di ridurre la mortalità per CCR. Gli svantaggi di questa strategia
sono che i test disponibili non sono in grado di svelare molti polipi e alcuni cancri e d’altra parte alcune persone con il test per la ricerca del sangue occulto positivo si dovranno sottoporre inutilmente ad una colonscopia in assenza di CCR e di polipi adenomatosi.
Il test per il sangue occulto deve essere fatto ogni anno perché, studi clinici controllati, hanno dimostrato che se fatto una volta ogni 2 anni è meno
efficace. La reidratazione (delle feci) accresce la sensibilità a spese della
specificità. Una dieta speciale può ridurre i falsi positivi. I test di nuova
generazione possono aumentare la sensibilità con perdite minime della
specificità.
2.6.2. Procedura diagnostica in caso di sangue occulto positivo
Raccomandazione A:
Le persone a basso rischio con test positivo (anche in un solo campione di feci) dovrebbero essere incoraggiate a sottoporsi ad un
esame completo dell’intero colon e del retto mediante colonscopia.
Un’alternativa è il clisma opaco a doppio contrasto, preferibilmente con rettosigmoidoscopia.
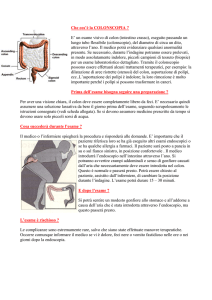
La colonscopia può esaminare l’intero colon con pochi falsi negativi o
falsi positivi e permette contemporaneamente il trattamento definitivo dei
polipi e di alcuni cancri. L’efficacia della colonscopia diagnostica abbinata
allo screening della ricerca del sangue occulto nelle feci è stabilita da tre
studi clinici randomizzati e da uno non randomizzato.
Anche il clisma opaco a doppio contrasto consente di esaminare l’intero
colon con buona sensibilità e specificità per i grossi polipi (> 1 cm) e per i
cancri. Il clisma opaco è meno rischioso e meno costoso della colonscopia,
ma è meno utile come riportato successivamente. Aggiungendo al clisma
opaco la rettosigmoidoscopia con endoscopio flessibile si raggiungono sensibilità diagnostiche simili a quelle della colonscopia. Bisogna sempre ricordare che entrambe le procedure risentono dell’abilità degli operatori.
2.6.2.1. Sigmoidoscopia con endoscopio flessibile
Raccomandazione A:
Offrire una rettosigmoidoscopia con endoscopio flessibile ogni 5 anni.
I polipi < 1 cm devono essere asportati. Se si trovano polipi adenomatosi di > 1 cm o cancri, il pz deve essere invitato a sottoporsi a pancolonscopia per rimuovere i polipi, biopsiare i cancri ed esplorare il
resto dell’intestino.
Due studi clinici controllati hanno dimostrato una riduzione della mortalità da CCR in pz sottoposti a screening e nei quali i polipi erano stati
rimossi. Peraltro la sigmoidoscopia da sola scopre solo metà dei cancri e
dei polipi. Un intervallo di 5 aa fra una sigmoidoscopia e la successiva
deriva dalla evidenza basata su studi randomizzati che la colonscopia ha
la stessa efficacia se fatta ogni anno o ogni 3 aa e che i polipi per cresce-
re e trasformarsi in cancri hanno bisogno di almeno 5 aa.
Raccomandazione A:
Offrire uno screening che comprenda contemporaneamente la
ricerca del sangue occulto nelle feci e la sigmoidoscopia.
La combinazione dei due metodi può correggere le limitazioni insite in
ognuno dei due usati da soli.
2.6.2.2. Ruolo del clisma opaco a doppio contrasto
Raccomandazione D:
Proporre un clisma opaco a doppio contrasto ogni 5-10 anni.
Non ci sono studi controllati che abbiano valutato se lo screening con
clisma opaco a doppio contrasto possa ridurre la mortalità da CCR in pz a
basso rischio di malattia. Questa strategia si basa sull’evidenza che lo
screening con clisma opaco può visualizzare l’intero colon e scoprire cancri e polipi di grosse dimensioni altrettanto bene che la colonscopia e
meglio della ricerca del sangue occulto e della sigmoidoscopia. Questa
metodica è probabilmente più sicura dell’endoscopia, ma può non visualizzare polipi di piccole dimensioni, non permette la rimozione dei polipi
o la biopsia dei cancri e più facilmente della colonscopia dà falsi positivi
(artefatti o residui fecali) obbligando il pz ad una successiva colonscopia.
L’aggiunta al clisma opaco a doppio contrasto della sigmoidoscopia
aumenta la sensibilità, ma non è facilmente accettata.
2.6.2.3. Colonscopia
Raccomandazione C:
Proporre una pancolonscopia ogni 10 anni.
Razionale:
1) Non ci sono studi che valutino la capacità della colonscopia da sola di
ridurre la mortalità da CCR in pz a basso rischio.
2) La colonscopia era parte integrante degli studi controllati sulla ricerca del sangue occulto che hanno dimostrato una ridotta mortalità nei
pz scrinati.
3) La colonscopia, che può visualizzare tutto il colon, è simile nei risultati alla sigmoidoscopia la quale si è dimostrata in grado di ridurre la
mortalità da CCR.
4) La colonscopia si è dimostrata in grado di ridurre l’incidenza del CCR
in una coorte di persone con polipi adenomatosi.
La colonscopia comporta più rischi e disagi della sigmoidoscopia e non
tutti gli esami consentono di visualizzare tutto il colon.
2.6.3. Pz a rischio aumentato di CCR
Raccomandazione A:
Ai soggetti con parenti di I° grado (genitori, fratelli o figli) con cancro
o polipi adenomatosi del colon dovrebbe essere raccomandato uno
screening come ai soggetti a basso rischio, ma cominciando a 40 aa.
Razionale: vi sono evidenze, derivanti da studi di coorte e da studi caso
controllo, che i parenti di I° grado di pz affetti da CCR hanno un rischio
aumentato di sviluppare un CCR e presentano la malattia in età più giovane delle persone senza una storia famigliare di CCR. Nelle persone con un
solo famigliare di I° grado malato, l’incidenza del cancro a 40 aa è simile
a quella delle persone senza storia famigliare di CCR a 50. Vi sono evidenze che le persone con un parente di I° grado che ha presentato polipi
prima dei 60 aa sono ad aumentato rischio di CCR. Le persone con parenti di I° grado affetti da CCR o da polipi in giovane età dovrebbero avere
una valutazione periodica del colon anche se non disponiamo di studi che
avvalorano questa strategia.
2.6.3.1. Persone con storia di poliposi adenomatosa famigliare (FAP)
Raccomandazione A:
1) Le persone con storia famigliare di FAP devono sottoporsi a studio genetico per valutare se sono portatori del gene poiché la
malattia è ereditaria e trasmessa come carattere autosomico
dominante. Sono disponibili studi genetici in grado di stabilire se
un pz è portatore del gene. Gli individui a rischio sono riconosciuti e definiti tali in seguito ai risultati dei tests genetici oppure
dopo esame del pedigree famigliare correttamente ricostruito.
2) Individui portatori del gene si devono sottoporre a sigmoidosco pia flessibile a cominciare dai 10-15 aa ogni 1 o 2 aa fino a comparsa degli adenomi e al momento dell’intervento chirurgico
(Colectomia totale). Individui a rischio determinato dal pedigree
devono sottoporsi a sigmoidoscopia flessibile a cominciare dai
10-15 aa ogni 1 o 2 aa sino a 30 aa, quindi ogni 3-5 aa sino a 40
aa. Oltre i 40 aa la frequenza può essere allungata o può essere
prevista l’interruzione in base alla storia familiare. Le persone
con FAP hanno il 100% di possibilità di sviluppare un CCR.
3) Poiché i polipi adenomatosi si sviluppano in tutto il colon e precedono il cancro, la sorveglianza endoscopica con sigmoidoscopia nei portatori del gene è sufficiente per scoprire se il pz sviluppa la sindrome. La colectomia totale è la sola prevenzione
possibile del cancro e deve essere fatta il più presto possibile non
appena la sindrome viene confermata.
2.6.3.2.Persone con storia famigliare di CCR ereditario senza poliposi
(HNPCC)
Raccomandazione C:
1) Le persone con storia famigliare di CCR in diversi parenti di I°
grado e in generazioni diverse, specie se i cancri si sono sviluppati in età giovanile dovrebbero ricevere una valutazione genetica e prendere in considerazione l’esecuzione di test genetici per
HNPCC. A questi pz deve essere proposta un’esplorazione dell’intero colon ogni 1-2 aa cominciando tra i 20 e i 30 aa.
L’esplorazione del colon deve diventare annuale dopo il 40° anno.
2) Data la localizzazione di queste lesioni, la sorveglianza deve essere fatta con colonscopia. La sigmoidoscopia è insufficiente e la
ricerca del sangue occulto nelle feci ha una sensibilità troppo
bassa per i polipi precancerosi.
Razionale: i cancri sono preceduti da polipi adenomatosi e sia i cancri
che i polipi sono prevalentemente prossimali alla flessura splenica. Il
rischio di cancro in queste famiglie è aumentato dopo i 21 anni e diventa
molto elevato dopo i 40. Gli individui sono identificati sulla base dell’anamnesi famigliare e i test genetici sono positivi solo nel 50% di queste
famiglie. Poiché i criteri di Amsterdam sono molto stretti e possono essere falsamente negativi in alcune famiglie, i medici dovrebbero valutare
attentamente e testare geneticamente anche le famiglie che non hanno tutti
i criteri di Amsterdam.
Gli intervalli tra le endoscopie devono essere più brevi che per le persone a basso rischio in quanto ci sono evidenze che i polipi si possono
formare e diventare cancri rapidamente nelle persone con HNPCC. Non ci
sono studi che indichino con precisione l’intervallo tra un’endoscopia e
l’altra in questi casi.
2.6.3.3. Persone con una storia di polipi adenomatosi
Raccomandazione A:
I pz nei quali sono stati asportati durante colonscopia un polipo
grande ( > 1 cm) o polipi multipli dovrebbero sottoporsi ad un
esame del colon 3 aa dopo la prima colonscopia. L’intervallo tra i
successivi esami dipende dal tipo dei polipi che sono stati trovati. Se
il primo controllo è normale o viene trovato un singolo, piccolo,
adenoma tubulare, il prossimo esame può essere fatto dopo 5 aa. In
circostanze speciali (polipi con cancro invasivo, grossi polipi adenomatosi sessili o numerosi adenomi), un intervallo più breve può
essere necessario, valutati il giudizio del medico e i desideri del pz.
Razionale: la polipectomia endoscopica e la sorveglianza hanno dimostrato di essere in grado di ridurre la successiva incidenza di CCR. Vi sono
forti evidenze, derivanti da studi clinici randomizzati, che lo sviluppo di
adenomi con alterazioni patologiche importanti dopo una polipectomia è
lento negli anni e che non esiste vantaggio a controllare i pz dopo 1 e 3
aa rispetto a un solo controllo dopo 3 aa.
2.6.3.4. Persone con storia personale di CCR
Raccomandazione A:
1) I pz con CCR che hanno subito una resezione con intenti curativi (ma che non hanno avuto una completa e adeguata colonscopia prima o durante l’intervento) dovrebbero avere un esame
completo del colon entro 1 anno dalla resezione del tumore. Se
la pancolonscopia eseguita prima dell’intervento o quella eseguita entro 1 anno dopo sono normali, il successivo esame del colon
dovrebbe essere fatto dopo 3 aa, e se normale, ogni 5 aa.
2) La decisione sull’opportunità di seguire questi pz ad alto rischio
con clisma opaco a doppio contrasto o colonscopia deve essere
presa tenendo conto delle diverse possibilità diagnostiche e terapeutiche delle due metodiche.
3) L’esecuzione contemporanea di rettosigmoidoscopia con strumento flessibile più clisma a doppio contrasto aumenta la sensibilità, ma non è facilmente accettata. Bisogna utilizzare la tecnica endoscopica che permetta la visualizzazione dell’anastomosi
del precedente intervento di resezione.
Razionale: vi è buona evidenza che l’incidenza del CCR è aumentata dopo
un primo cancro (a parte la recidiva del primo). I cancri successivi, come del
resto il primo, sono preceduti da polipi adenomatosi che si sviluppano con
frequenza superiore alla norma. Non ci sono evidenze che facciano pensare che questi polipi, che si sviluppano su un intestino precedentemente operato di cancro, diventino maligni più rapidamente dei polipi che si sviluppano su persone che non hanno precedentemente avuto un cancro.
2.6.3.5. Persone con malattie croniche infiammatorie dell’intestino
Raccomandazione A:
1) Nei pz con malattie croniche infiammatorie del colon estese e
che durano da lungo tempo la sorveglianza endoscopica diretta
alla ricerca di displasia quale marcatore di rischio di CCR deve
essere presa in considerazione a seconda della estensione e della
durata della malattia.
2) E’ pratica comune fare una sorveglianza mediante colonscopia
ogni 1-2 aa cominciando dopo 8 aa di malattia nei pz con pancolite o dopo 15 aa di malattia nei pz con colite sinistra.
Razionale: ci sono sicure evidenze che dimostrano un’aumentata incidenza di CCR nei pz con malattie croniche infiammatorie dell’intestino.
L’aumentata incidenza di cancro è proporzionale alla durata e alla estensione della malattia. L’aumentata frequenza nelle endoscopie di sorveglianza deriva dalla difficoltà di evidenziare il cancro o la displasia in ogni
singolo esame, tuttavia non vi è evidenza diretta che questa pratica riduca
la mortalità CCR in questi pz.
2.7. Raccomandazioni conclusive per i pz ad aumentato rischio di CCR
STORIA PERSONALE
Pregresso CCR
RACCOMANDAZIONI
Colonscopia 3 aa. dopo la resezione e poi ogni 35 aa.
N.B.: la presenza di un “colon pulito” cioè senza altre
lesioni deve essere accertata mediante colonscopia
prima, durante o dopo l’intervento (entro 1 anno).
Pregresso adenoma
Colonscopia ogni 3-5 aa. N.B.: si deve partire
da un “colon pulito” senza altre lesioni che se
presenti saranno prima bonificate.
Colite ulcerosa (>8 aa) estesa a Colonscopia ogni 1-2 aa con biopsie sistematutto il colon
tiche per ricerca della displasia
Colite ulcerosa sinistra (>15 aa)
STORIA FAMIGLIARE
RACCOMANDAZIONI
FAP
Nel sospetto di FAP il pz deve essere avviato ad
un centro di riferimento regionale per consulenza genetica e per l’esecuzione del test molecolare per la ricerca di mutazioni del gene APC.
HNPCC
Nel sospetto di HNPCC il pz deve essere avviato
ad un centro di riferimento regionale per consulenza genetica e per esecuzione del test molecolare per la ricerca di mutazioni nei geni MMR.
Sorveglianza endoscopica: Colonscopia ogni 2
aa a partire da 25 aa, oppure 5 aa prima dell’età
di insorgenza del cancro nel parente che nella
famiglia si è ammalato in più giovane età.
Colonscopia ogni anno dopo i 40 aa.
Parenti di I° grado con CCR Colonscopia ogni 3-5 aa cominciando 10 aa
sporadico o con adenoma prima dell’età del parente che ha avuto il cancro
prima di 60 aa.
in giovane età.
Più parenti di I° grado con CCR
o con adenomi.
2.8. Quando interrompere lo screening
I polipi impiegano circa 10 anni per diventare cancri, non vi è quindi nessun vantaggio a trovare polipi nelle persone la cui speranza di vita è inferiore al tempo che un polipo impiegherebbe per trasformarsi in cancro.
Non ci sono sicure evidenze sul tempo al quale interrompere la sorveglianza e lo screening, ma le considerazioni dette sopra sembrano ragionevoli anche tenendo conto del fatto che lo screening e i test diagnostici
ad esso connessi sono mal sopportati dalle persone anziane affette da altre
patologie concomitanti.
2.9. Bibliografia
1. Winawer SJ, Fletcher RH, Miller L, et al. Colorectal cancer screening:
Clinical guidelines and rationale. Gastroenterology 1997; 112:594-642.
2. Byers T, Levin B, Rothenberger D, et al: American Cancer Society
Guidelines for Screening and Surveillance for Early Detection of colorectal Polyps and Cancer: Update 1997. CA-A Cancer J Clin 1997;
47:154-160.
3. Lang CA, Ransohoff DF. Defining risk for colorectal cancer. In:Young G,
Levin B, Rozen A, eds. Prevention and Early Detection of Colorectal
Cancer.
4. Vogelstein B, Fearon ER, Hamilton SR, et al: Genetic alterations during
colorectal tumor development. N Engl J Med 1988; 319:525-532.
5. Shike M, Winawer SJ, Greenwald PH, et al: Primary prevention of colorectal cancer. Bull WHO 1990; 68:377-385.
6. Winawer SJ, Zauber AG, Ho MN, et al: Prevention of colorectal cancer
by colonscopic polypectomy. N Engl J Med 1993; 329:1977.
7. Rex DK, Rahmani EY, Haseman JH, et al. Relative sensitivity of colonscopy and barium enema for detection of colorectal cancer in clinical
practice. Gastroenterology 1997; 112:17-23.
8. DeRoos A, Hermans J, Shaw P, et al: Colon polyps and carcinomas:
Prospective comparison of the single-and double-contrast examination
in the same patients. Radilogy 1985; 154:11-13.
9. Kronborg O, Fenger C, Olsen J, et al Randomised study of screening for
colorectal cancer with faecal-occult-blood test. Lancet 1996; 348:14671471.
10. Hardcastle JD, Chamberlain JO, Robinson MHE, et al. Randomised controlled trial of faecal-occult-blood screening for colorectal cancer.
Lancet 1996; 348:1472-1477.
11. Mandel JS, Bond JH, Church TR, et al. Reducing mortality from colorectal cancer by screening for fecal occult blood. N Engl J Med 1993;
328:1365.
12. Winawer SJ, Flehinger BJ, Schottenfeld D, et al. Screening for colorectal cancer with fecal occult blood test and sigmoidoscopy. J Natl Cancer
Inst 1993; 85:1311-1318.
13. Kewenter J, Engaras B, Haglind E, et al. Value of retesting subjects with
a positive Hemoccult in screening for colorectal cancer. Br J Surg 1990;
77:1349.
14. Selby JV, Friedman GD, Quesenberry CP Jr, et al: A case-control study
of screening sigmoidoscopy and mortality from colorectal cancer. N
Engl J Med 1992; 326:653-657.
15. Levin B, Bond JH. Colorectal cancer screening: Recommendations of
the U.S. Preventive Services Task Force. Gastroenterology 1996;
111:1381-1384.
16. Lynch HT, Smyrk TC, Watson P, et al. Genetics, natural history, tumor
spectrum and pathology of hereditary nonpolyposis colorectal cancer.
Gastroenterology 1993; 104:1535-1549.
17. Fuchs CS, Giovannucci EL, Colditz GA, et al. A prospective study of
familial history and the risk of colorectal cancer. N Engl J Med 1994;
331:1669-1674.
18. Winawer SJ, Zauber AG, Gerdes H. Risk of colorectal cancer in the
families of patients with adenomatous polyps. N Engl J Med 1996;
334:82- 87.
19. Stryker SJ, Wolff BG, Culp CE, et al. Natural history of untreated colonic polyps. Gastroenterology 1987; 93:1009-1113.
20. Winawer SJ, Zauber AG, O’Brien MJ, et al: Randomized comparison of
surveillance intervals after colonscopic removal of newly diagnosed
adenomatous polyps. N Engl J Med 1993; 328: 901-906.
21. Lennard-Jones JE. Prevention of cancer mortality in inflammatory bowel
disease. In: Prevention and Early Detection of Colorectal cancer. GP
Young, P Rozen, B Levin (eds). WB Saunders, London, 1996, pp. 217-238.
3. Criteri per la diagnosi istopatologica
Vengono qui considerati i criteri di campionamento e di diagnosi istopatologica relativi a polipectomia e resezione chirurgica che fanno riferimento alle linee guida recentemente edite dal GIPAD (Gruppo Italiano
Patologi dell'Apparato Digerente, operante nell’ambito della Società
Italiana di Anatomia Patologica e Citologia Diagnostica) e recentemente
pubblicate (25).
3.1 Adenomi del retto-colon
Nelle polipectomie endoscopiche i requisiti minimi della diagnosi istopatologica sono:
a) la definizione di istotipo: distinguere gli adenomi dai polipi iperplasti-
ci, infiammatori, amartomatosi etc.
b) negli adenomi, caratterizzare: gli aspetti macroscopici (sessile, peduncolato, piatto); il tipo istologico architetturale (tubulare, villoso, tubulovilloso); il grado di displasia; la presenza di carcinoma (adenoma cancerizzato), specificando i fattori predittivi di metastatizzazione; lo stato
del margine di resezione.
3.1.1. Esame macroscopico
L’asportazione completa della lesione è essenziale per una corretta valutazione istopatologica. Prelievi bioptici, anche multipli, della testa del polipo non consentono la definizione del tipo istologico e del grado di displasia e, soprattutto, la sicura esclusione di una componente carcinomatosa.
Nota: In questi casi il giudizio diagnostico dovrà forzatamente essere limitato ad
elementi descrittivi dei campioni in esame (es.: "Frammenti di tessuto adenomatoso, ad architettura tubulare, con displasia lieve")
3.1.1.1. Rilievi macroscopici:
a. dimensioni: vengono definite dal maggior diametro e, se significativi,
dai due diametri minori, escludendo dalle misurazioni i segmenti di
pertinenza del peduncolo, ove macroscopicamente identificabili.
b. estrinsecazione: presenza (misurazione di lunghezza e diametro) /
assenza di peduncolo.
c. margine di resezione endoscopica. La sua identificazione, agevole nelle
lesioni peduncolate appena resecate, può diventare problematica dopo
fissazione in formalina. E' auspicabile che la marcatura (con colorante
vitale o idoneo repere) venga effettuata dall'endoscopista prima della
fissazione.
Il campionamento, preferibilmente sulla lesione fissata, deve consentire
la valutazione di:
a. margine di resezione
b. rapporti tra epitelio ed asse stromale. Il metodo più sicuro consiste nella separazione delle due calotte laterali del polipo dalla porzione centrale. Le sezioni istologiche di quest'ultima porzione, che inizialmente si avvicineranno sempre più al centro dell'asse stromale, garantiscono che l'interfaccia epiteliostroma sia valutata su una ampia superficie. Ulteriori sezioni parallele al taglio
sagittale sono auspicabili per i polipi di diametro trasversale superiore ai 2 cm.
La settorializzazione della sezione medio-sagittale è prevista per polipi di
dimensioni tali da non potere essere inclusi in un unico blocchetto.
3.1.2. Esame microscopico
I criteri di riferimento sono quelli proposti nella seconda edizione del
fascicolo WHO "Histological Typing of Intestinal Tumors".
3.1.2.1. Tipo istologico dell'adenoma
La rigorosa valutazione degli aspetti istologici architetturali è finalizzata
al riconoscimento di una significativa componente villosa, essendo tale
tipo di architettura correlata al potenziale di trasformazione maligna del
polipo e, soprattutto, di sviluppo di lesioni adenomatose colorettali sincrone e/o metacrone.
a. Tubulare: > 80% architettura tubulare.
b. Villoso: > 80% architettura villosa.
c. Tubulo-villoso: due componenti, ciascuna<80%.
Istotipi infrequenti derivano dalla commistione, in una singola formazione poliposa, di componenti adenomatose con cripte iperplastiche (polipi
misti iperplastico/adenomatosi) o da aspetti architetturali di tipo iperplastico associati a caratteristiche cito-cariologiche tipicamente displastiche
(c.d. adenomi serrati).
3.1.2.2. Grading della displasia
Negli adenomi colorettali la displasia è graduata in lieve, moderata e
grave. L'accorpamento dei vari gradi in due sole categorie, "basso grado"
(lieve e moderata) ed "alto grado" (grave) trova tuttavia ragione in considerazione della scarsa riproducibilità della distinzione tra lieve e moderata. Allo stato attuale delle conoscenze non appare fondata la ponderazione differenziata dei parametri architetturali della displasia (ramificazioni e
gemmazioni delle cripte, back-to-back, crescita intraghiandolare) rispetto a
quelli cito-cariologici (stratificazione, ipercromasia, perdita di polarità
nucleare, mitosi atipiche, alterazioni della differenziazione etc.): di conseguenza tutti i parametri vengono considerati cumulativamente nel grading.
a. Displasia lieve. Architettura generale relativamente conservata, con tubuli
ghiandolari solo lievemente allungati o tortuosi ed iniziali accenni alla gemmazione; perdita del gradiente di differenziazione cellulare dalla base della
cripta alla superficie. Nuclei allungati, ingranditi, polarizzati e stratificati.
b. Displasia moderata. Le caratteristiche morfologiche sono intermedie tra
quelle della lieve e della grave.
c. Displasia grave. Cripte con ramificazioni e gemmazioni irregolari, variamente coalescenti. Nuclei francamente ipercromici, tondeggianti od ovali,
marcatamente ingranditi, nucleolati, per lo più privi di orientamento polare. Le cellule, stratificate, hanno citoplasma omogeneamente denso, senza
differenziazione mucipara. Strutture epiteliali complesse (aspetti cribriformi, crescita back-to-back) costituite da cellule meno differenziate e più
polimorfe di quelle della displasia grave sono spesso riportate come
"Carcinoma in situ". Sicura infiltrazione neoplastica limitata alla tonaca
propria o che dissocia, ma senza superarla, la muscolaris mucosae viene
spesso riferita come "Carcinoma intramucoso del colon". Dal punto di
vista istologico entrambe le definizioni sono corrette, ma siccome il carcinoma in situ e nel grosso intestino anche il carcinoma intramucoso, sono
privi di potenzialità metastatica, se ne sconsiglia l'uso nel referto finale,
comprendendo entrambe le lesioni nella dizione di displasia grave. In
alternativa, l'utilizzo dei termini "Carcinoma in situ" o "Carcinoma intramucoso" dovrebbe sempre essere accompagnato dal commento: "Lesione
priva di malignità biologica: non necessita di ulteriore trattamento".
E' comune identificare differenti gradi di displasia nel contesto di un singolo adenoma: il grado diagnostico è basato sulla componente più altamente displastica osservabile, indipendentemente dalla sua estensione nel
tessuto adenomatoso.
3.1.2.3. Adenoma cancerizzato
Adenoma comprendente area di carcinoma invasivo che supera la
muscolaris mucosae e si estende alla tonaca sottomucosa*; costituisce la
forma più precoce di carcinoma, dotato di potenzialità metastatiche. Il
rischio di metastasi linfonodali è complessivamente del 10%. Si possono
tuttavia, sulla base delle caratteristiche patologiche, suddividere due gruppi: uno a basso rischio ed uno ad alto rischio. Tale distinzione è utile al
fine di programmare le successive scelte terapeutiche (resezione chirurgica vs follow-up clinico-endoscopico).
I parametri istologici maggiormente predittivi del rischio di metastasi linfonodali e che definiscono un adenoma cancerizzato “ad alto rischio” sono:
a. Stato del margine di resezione endoscopica: specificare se indenne, adenomatoso o carcinomatoso. Quest'ultima evenienza si realizza effettivamente quando si identifichino cellule carcinomatose a meno di 1 mm
dal margine, oppure nel contesto della banda di diatermocoagulazione.
b. Grado istologico di differenziazione del carcinoma (Grado I e II versus
III; il carcinoma a cellule ad anello con castone è equiparato al Grado
III); segnalazione di eventuale componente anaplastica, anche minima.
c. Embolizzazione neoplastica (linfatica e/o venosa).
Di minore rilevanza prognostica devono considerarsi:
a. Il livello di infiltrazione del peduncolo: terzo superficiale, medio e pro* Nota: A seguito di ripetute torsioni cui vanno incontro, prevalentemente ma non
esclusivamente, gli adenomi con lungo peduncolo può verificarsi la dislocazione o la
erniazione nella sottomucosa di isole di tessuto displastico (c.d. Pseudoinvasione). Se
il tessuto distopico è ad alto grado di displasia la diagnosi differenziale con il carcinoma invasivo è piuttosto impegnativa. Caratteristiche a favore della pseudoinvasione sono: assenza di reazione desmoplastica nello stroma, stroma con le caratteristiche
della lamina propria attorno alle ghiandole displastiche, depositi emosiderinici.
fondo (per definizione il livello negli adenomi cancerizzati ad estrinsecazione sessile è da considerarsi "profondo").
b. Il rapporto quantitativo Tessuto Adenomatoso/Carcinoma. Lesioni con
piccoli focolai di carcinoma invasivo hanno un potenziale metastatico
più basso dei polipi costituiti in prevalenza da carcinoma invasivo.
Una lesione poliposa costituita interamente da carcinoma infiltrante la
sottomucosa in assenza di residui di tessuto adenomatoso viene classifica ta come "Carcinoma polipoide": la terapia ed il follow-up dipendono dagli
stessi parametri prognostici dell'adenoma cancerizzato.
3.2. Carcinoma del retto-colon (CRC)
3.2.1. Descrizione delle procedure chirurgiche
Tipo di resezione: emicolectomia destra, colectomia trasversa, emicolectomia sinistra, sigmoidectomia, resezione anteriore del sigma-retto, resezione addomino-perineale, colectomia totale o subtotale.
3.2.2 Esame Macroscopico
3.2.2.1. Pezzo operatorio
a. specificare come è stato inviato: fresco, fissato, chiuso, aperto, e l'orientamento indicato dal chirurgo.
b. identificare e misurare (lunghezza e diametro) il segmento di colon resecato ed eventuali altri segmenti intestinali (ultima ansa ileale, appendice e canale anale) od organi (utero, vescica etc.), indicando se escissi in
blocco o separatamente e distinguendo: 1) colon destro, costituito da:
cieco, ascendente, trasverso; 2) colon sinistro, costituito da: discendente; sigma; 3) retto, inizia alla fine del mesosigma e misura circa 16 cm.
c. descrivere la superficie esterna segnalando l'aspetto della sierosa.
d. segnalare la presenza di ostruzione, dilatazione a monte di un tratto
stenotico.
e. segnalare la presenza di perforazioni.
f. aprire il segmento inviato, evitando quando possibile di sezionare la
lesione, identificandola palpatoriamente e poi sezionando il segmento
nel versante opposto alla neoplasia.
3.2.2.2. Tumore
a. localizzazione: specificando le varie sedi, la distanza da punti di repere anatomici quali la linea pettinata e la valvola ileo-ciecale.
b. configurazione: vegetante (polipoide o sessile), ulcerato, a placca, ad
anello o a manicotto (stenosante), tipo linite plastica.
c. dimensioni: se possibile tre (longitudinale, trasversale, spessore), altrimenti il diametro maggiore.
d. distanza dai margini di resezione distale, prossimale, radiale.
e. livello di infiltrazione della parete, ed i rapporti con la sierosa e con
altri organi o strutture asportate.
Note:
- Neoplasie multiple devono essere singolarmente descritte.
- Per margine radiale (o circonferenziale o laterale) si intende nel retto il piano dei
tessuti molli perirettali in cui è stata effettuata la resezione chirurgica. Un margine di resezione radiale è identificabile anche nei segmenti colici solo parzialmente rivestiti dalla sierosa peritoneale (ad esempio colon ascendente e discendente). Nei segmenti colici completamente rivestiti da sierosa, si riconosce invece un margine di resezione mesiale, che è in genere a notevole distanza dalla
neoplasia e di scarsa rilevanza clinica.
- Può essere utile la marcatura dei margini di resezione con inchiostro di china. In
particolare si raccomanda questa procedura per la valutazione del margine radiale nei tumori r ettali.
3.2.2.3. Colon non-carcinomatoso
Descrivere altri processi patologici eventualmente presenti, quali polipi,
colite cronica, diverticoli, stenosi, ulcere.
3.2.2.4.Linfonodi periviscerali
Descrivere dimensioni, numero e aspetto dei linfonodi periviscerali.
3.2.2.5.Altri organi asportati
Valutare la presenza di metastasi o di altri tipi di patologia.
3.2.3.Campionamento
3.2.3.1.Tumore
Almeno due sezioni che comprendano il livello di massima infiltrazione
(con l'eventuale sierosa) e la transizione tumore/mucosa normale.
3.2.3.2. Margini
- distale e prossimale solo se distano <2.5 cm dalla neoplasia (con prelievo
longitudinale se la neoplasia è vicina al margine, tangenziale se più distante)
- radiale: nel retto è necessario effettuare un prelievo che comprenda la
zona in cui il tumore arriva più vicino al margine di resezione; negli altri
distretti solo quando l'infiltrazione tumorale si estende sino in prossimità del margine di resezione.
3.2.3.3.Linfonodi
Tutti i linfonodi reperiti.
3.2.3.4.Altri processi patologici colorettali
Polipi, diverticoli, anomalie mucose tipo malattie infiammatorie croniche etc.
3.2.3.5.Mucosa apparentemente sana
Non indispensabile.
3.2.4. Esame microscopico
3.2.4.1. Tumore
a. Tipo istologico (sec. WHO)
- Adenocarcinoma, non altrimenti specificato (NAS)
- Adenocarcinoma mucoide (o mucinoso), quando la componente
mucoide costituisce più del 50% del tumore
- Carcinoma a cellule ad anello con castone (disperse mucosecernenti,
signet ring cell carcinoma), quando la componente a cellule ad anello
con castone costituisce più del 50% del tumore
- Carcinoma squamoso
- Carcinoma adenosquamoso, quando sono presenti una componente
adenocarcinomatosa ed una a cellule squamose. Adenocarcinomi con
focali aspetti di differenziazione squamosa sono classificati adenocarcinomi NAS.
- Carcinoma a piccole cellule, con caratteristiche istologiche simili a
quelle del carcinoma a piccole cellule del polmone
- Carcinoma indifferenziato
- Altri tipi: specificare
La grande maggioranza dei CCR sono adenocarcinomi NAS, circa il 10%
adenocarcinomi mucoidi, mentre gli altri istotipi sono molto rari. I carcinomi a cellule ad anello con castone ed i carcinomi a piccole cellule
hanno prognosi sfavorevole. Gli adenocarcinomi mucoidi hanno un comportamento clinico sostanzialmente simile agli adenocarcinomi NAS, pur
differenziandosi da questi per numerose caratteristiche patologiche, biologiche, genetiche.
b.Grado di differenziazione. Secondo i criteri di Jass gli adenocarcinomi
NAS vengono classificati in:
- Ben differenziati: costituiti da ghiandole semplici o complesse, regolari, con polarità nucleare conservata e nuclei di dimensioni uniformi.
- Moderatamente differenziati: costituiti da ghiandole semplici o complesse, regolari o modicamente irregolari, con polarità nucleare parzialmente conservata o assente.
- Scarsamente differenziati: con ghiandole marcatamente irregolari o
senza formazione di strutture ghiandolari; polarità nucleare assente.
Dal momento che le indicazioni prognostiche derivano principalmente
dalla individuazione della categoria degli adenocarcinomi scarsamente differenziati, è possibile utilizzare, come suggerito anche dalla WHO, una
suddivisione in due sole classi: adenocarcinomi bene o moderatamente
differenziati (basso grado) ed adenocarcinomi scarsamente differenziati
(alto grado).
Note: Quando sono presenti aree con diverso grado di differenziazione, il tumore
viene classificato in base alle caratteristiche dell'area peggiore, cioè con il minor
grado di differenziazione. Tuttavia, la presenza di ghiandole disorganizzate al margine di infiltrazione non comporta una classificazione di scarsa differenziazione.
c.Livello di infiltrazione. Determinato secondo la classificazione TNM.
pTis: adenocarcinoma non infiltrante o con infiltrazione della tonaca
propria della mucosa o della muscolaris mucosae*
pT1: infiltrazione della sottomucosa
pT2: infiltrazione della tonaca muscolar e
pT3: infiltrazione a tutto spessore della tonaca muscolare ed invasione
della sottosierosa o del tessuto adiposo pericolico o perirettale non
rivestito da sierosa
pT4: infiltrazione della sierosa e/o di altri organi e strutture. Particolare
attenzione deve essere posta all’individuazione dell’infiltrazione
della sierosa peritoneale, che è un importante fattore prognostico
sfavorevole.
d.Invasione vascolare. E' soprattutto la invasione delle vene extramurali
che va attentamente ricercata, perché significativa per la prognosi.
e. Tipo di crescita. Viene classificata come:
1. espansiva, quando il margine di infiltrazione tumorale è regolare, ben
demarcato o solo lievemente irregolare.
2.infiltrativa, quando i margini di infiltrazione sono marcatamente irregolari e non ben identificabili. Caratteristica è la presenza di elementi
ghiandolari, o aggregati di cellule tumorali isolati nel tessuto adiposo
periviscerale, spesso localizzati in sede perivascolare o perineurale. La
crescita infiltrativa si associa a prognosi peggiore.
f. Infiltrazione linfocitaria peritumorale. Si distinguono:
- Infiltrazione linfocitaria al bordo di invasione tumorale. Viene classificata
come marcata quando si osserva un significativo numero di linfociti ed
altre cellule infiammatorie. Negli altri casi o quando è evidente solo in
una parte del tumore viene classificata come moderata, scarsa o assente.
- Infiltrazione linfocitaria "tipo Crohn". Intensa: numerosi e voluminosi
aggregati linfocitari, spesso con centro germinativo, situati alla periferia del tumore, principalmente localizzati al margine esterno della
tonaca muscolare. Lieve: occasionali aggregati linfocitari, prevalentemente di piccole dimensioni e senza centri germinativi. Assente: aggre* Nota: Sebbene la stadiazione TNM preveda questa categoria, come precedentemente puntualizzato, si sconsiglia l'uso dei termini carcinoma in situ e carcinoma
intramucoso comprendendo entrambe le lesioni nella dizione di displasia grave, in
accordo con le raccomandazioni dell'Association of Directors of Anatomic and
Surgical Pathology.
gati linfocitari molto rari e di piccole dimensioni o completamente
assenti.
Entrambi i tipi sono fattori prognostici favorevoli, purché l'infiltrazione
linfocitaria sia marcata.
3.2.4.2. Margini di resezione
Specificare la adeguatezza dei margini di resezione prossimale, distale e
radiale. In particolare è fondamentale la valutazione del margine radiale
nel carcinoma del retto, essendo un importante fattore predittivo di recidiva locale. Nelle neoplasie rettali è opportuno in tutti i casi riportare la
distanza minima del tumore da questo margine di resezione.
3.2.4.3. Linfonodi regionali
Specificare il numero di linfonodi esaminati ed il numero di linfonodi
metastatici. L'esame istologico dovrebbe comprendere almeno 12 linfonodi regionali: la più recente classificazione TNM (1997) indica che 12 o più
linfonodi devono essere esaminati per classificare un tumore come pN0.
Lo stato linfonodale ha una notevole importanza nella pianificazione terapeutica postoperatoria del pz ed anche il numero di linfonodi metastatici
è un rilevante fattore prognostico. Secondo la classificazione TNM, i noduli tumorali nel tessuto adiposo pericolico e perirettale di dimensioni > 3
mm senza evidenza istologica di residue strutture linfonodali devono essere classificati come linfonodi metastatici; se < 3 mm devono essere considerati come estensione in discontinuità della neoplasia.
3.2.4.4. Metastasi a distanza
Specificare gli organi interessati.
3.2.4.5. Altri processi patologici colorettali
Riportare la presenza di polipi (e il tipo) se la neoplasia è insorta nel contesto di una colite ulcerosa o morbo di Crohn, o altre patologie di rilievo.
3.2.5. Stadiazione
L'applicazione di uno specifico sistema di stadiazione tumorale è facoltativa. E’ importante che il referto fornisca dati sufficienti per l'applicazione
dei sistemi di stadiazioni più utilizzati e che il sistema di stadiazione eventualmente impiegato sia specificato con esattezza dal patologo. E' tuttavia
da rilevare la sempre più ampia diffusione del sistema di stadiazione TNM,
di cui si raccomanda l'utilizzo. In aggiunta, è possibile stadiare i CCR secondo i criteri di Dukes (1) e classificarli secondo i gruppi proposti da Jass (13).
3.2.6. Criteri Diagnostici Minimi
Sono da considerarsi criteri diagnostici minimi, cioè parametri che devono essere sempre riportati nella refertazione di resezioni chirurgiche per
CCR:
- istotipo
- grado di differenziazione
- livello di infiltrazione della parete e della sierosa e/o di altri organi e
strutture
- adeguatezza dei margini di resezione prossimale, distale e radiale (nel
retto)
- numero di linfonodi metastatici e di linfonodi esaminati.
Altri parametri che dovrebbero essere compresi nel referto sono:
- dimensioni (diametro maggiore)
- presenza di perforazione macroscopica
- distanza dal margine di resezione prossimale o distale più vicino
- distanza dal margine di resezione radiale (nel retto)
- stadiazione patologica (TNM o altro sistema specificato).
3.4. Bibliografia
1. Astler WB, Coller FA. The prognostic significance of direct extension of
the carcinoma of the colon and rectum. Ann Surg 1954; 139: 846-851.
2. Adam IJ, Mohamdee MO, Martin IG, et al. Role of circumferential margin involvement in the local recurrence of rectal cancer. Lancet 1994;
344: 707-711.
3. Association of Directors of Anatomic and Surgical Pathology.
Recommendations for the reporting of resected large intestinal carcinomas. Am J Clin Pathol 1996; 106: 12-15.
4. Bull AD, Biffin AHB, Mella J, et al. Colorectal cancer pathology reporting: a regional audit. J Clin Pathol 1997; 50: 138-142.
5. Compton CC, Henson DE, Hutter RVP, et al., for Members of the Cancer
Committee College of American Pathologists. Update protocol for the
examination of specimens removed from patients with colorectal carcinoma. A basis for checklists. Arch Pathol Lab Med 1997; 121: 1247-1254.
6. Cooper HS, Deppish LM, Gourley WK, et al. Endoscopically removed
malignant colorectal polyps: clinicopathologic correlations.
Gastroenterology 1995; 108: 1657-1665.
7. Cooper HS, Ludwig MD, Kahn EI, et al. Pathology of the malignant
colorectal polyp. Hum Pathol 1998; 29: 15-26.
8. Coverlizza S, Risio M, Ferrari A, et al. Colorectal adenomas containing
invasive carcinoma: pathological assessment of lymph node metastatic
potential. Cancer 1989; 64: 1937-1947.
9. Fenoglio-Preiser CM. Polyps and the subsequent development of carcinoma of the colon and rectum: definitions and hints on tissue handling.
In:Fenoglio-Preiser CM, Rossini FP (Eds.). Adenomas and adenomas
containing carcinoma of the large bowel. Cortina International, Verona,
1985. pp 15-29.
10. Graham DM, et al. Crohn's-like lymphoid reaction and colorectal carcinoma: a potential histologic prognosticator. Modern Pathol 1990; 3:
332-335.
11. Haggitt RC, Glotzbach RE, Soffer EE, Wruble LD. Prognostic factors in
colorectal carcinomas arising in adenomas: implications for lesions removed by endoscopic polypectomy. Gastroenterology 1985; 89: 328-336.
12. Jass JR, Atkins WS, Cuzick J, al et. The grading of rectal cancer: historical perspectives and a multivariate analysis of 447 cases.
Histopathology 1986; 10: 437-459.
13. Jass JR, Love SB, Northover JMA A new prognostic classification of rectal cancer. Lancet 1987; i: 1303-1306.
14. Jass JR, Sobin LH Histological typing of intestinal tumors: World Health
Organization. 2nd edition, New York, NY. Springer-Verlag NY Inc, 1989.
15. Kim H, Jen J, Vogelstein B, Hamilton S R. Clinical and pathological characteristics of sporadic colorectal carcinomas with DNA replication
errors in microsatellites sequences. Am J Pathol 1994; 145: 148-156.
16. Lanza G, Maestri I, Dubini A, et al. p53 expressionin colorectal cancer:
relation to tumor type, DNA ploidy pattern, and short-term survival. Am
J Clin Pathol 1996; 105: 604-612.
17. Longacre TA, Fenoglio-Preiser CM. Mixed iperplastic adenomatous
polyps/serrated adenomas. A distinct form of colorectal neoplasia. Am
J Surg Pathol 1990; 14: 524-537.
18. Morson BC, Whiteway JE, Jones EA, et al. Histopathology and prognosis of malignant colorectal polyps treated by endoscopic polypectomy.
Gut 1984; 25: 437-444.
19. Risio M, Reato G, Francia di Celle P, et al. Microsatellite instability is
associated with histological features of the tumor in nonfamilial colorectal cancer. Cancer Res 1996; 56: 5470-5474.
20. Ruschoff J, Dietmaier W, Luttges J, et al. Poorly differentiated colonic
adenocarcinoma, medullary type: clinical, phenotypic, and molecular
characteristics. Am J Pathol 1997; 150: 1815-1825.
21. Sheffield JP, Talbot IC. Gross examination of the large intestine. J Clin
Pathol 1992; 45: 751-755.
22. Shepherd NA, Baxter KJ, Love SB. The prognostic importance of peritoneal involvement in colonic cancer: a prospective evaluation.
Gastroenterology 1997; 112: 1096-1102.
23. Sobin LH, Wittekind CH. TNM classification of malignant tumours. Fifth
Edition. New York: Wiley-Liss, 1997.
24. Winawer SJ, Zauber AG, O'Brien MJ, et al. The National Polyp Study:
designs, methods, and characteristics of patients with newly diagnosed
polyps. Cancer 1992; 70: 1236-1245.
25. Zamboni G, Lanza G, Risio M. Adenoma-carcinoma del retto-colon.
Linee guida e criteri diagnostici minimi. Patologica 1999; 91: 286-294.
4. Terapia Chirurgica del CCR
4.1. Preparazione (EVIDENZA B)
La preparazione intestinale è indispensabile alla buona riuscita dell’intervento.
Essa può essere ottenuta tramite lavaggio osmotico (PEG) oppure tramite
somministrazione di fosfato di sodio, o con sennosidi con risultati paragonabili.
4.2. Cancro del colon
4.2.1. Tecnica e tattica chirurgica generale
Resezione radicale: asportazione del tumore con margine adeguato di
colon normale col peduncolo vascolare e le strutture linfatiche corrispondenti. L’estensione della demolizione è determinata dalle legature vascolari (EVIDENZA C).
Resezione palliativa: asportazione della neoplasia limitata al colon o
eventuale by pass che si esegue quando sono presenti metastasi epatiche
multiple (> 3) e/o bilaterali, peritoneali e polmonari (EVIDENZA C).
La no touch tecnique non migliora significativamente sopravvivenza e
incidenza di ripresa della malattia, pur essendo riportata una minore e più
tardiva insorgenza di metastasi a distanza, tanto che alcuni ne consigliano
l'adozione (EVIDENZA B).
La resezione en bloc di tutte le strutture aderenti alla neoplasia migliora la sopravvivenza dei pz (EVIDENZA C).
4.2.2. Colon destro
La resezione comprende l'asportazione del tumore con un margine adeguato di colon (10 cm) con peduncoli vascolari e strutture linfatiche corrispondenti. Studi retrospettivi sembrano suggerire un beneficio dalla linfoadenectomia estesa (EVIDENZA C).
4.2.3. Sigma
Non c’è differenza prognostica fra EMI SN e resezione di sigma, pur
essendo state documentate metastasi nei linfonodi all'origine dell'arteria
mesenterica inf. nel 14-22% dei casi (EVIDENZA C).
EMI SN = legatura alta della mesenterica inferiore, all’origine (EVIDENZA A).
RESEZIONE DI SIGMA= legatura bassa della mesenterica inferiore, dopo
l’origine della colica sn. (EVIDENZA A).
4.2.4. Occlusione colica sin. (EVIDENZA C)
La più elevata morbilità e mortalità complessiva degli interventi chirurgici sequenziali (in due o più tempi), la necessità di ripetute ospedalizzazioni e la significativa percentuale dei pz che non completano l'iter chirurgico, consigliano l'esecuzione di anastomosi primaria anche in condizioni di urgenza. Le opzioni chirurgiche sono il lavaggio colico intraoperatorio, oppure la colectomia subtotale in caso di lesioni diastasiche del
cieco, di tumori sincroni o di lesioni ischemiche. Controindicazioni all'anastomosi primaria sono esclusivamente la presenza di una peritonite diffusa o le gravi condizioni cardiache o respiratorie del pz.
4.3. Cancro del retto
4.3.1. Sede della neoplasia
- Retto alto (sopra la riflessione peritoneale) = come per il COLON.
- Retto basso (sotto la riflessione peritoneale).
Sarebbe opportuno osservare una distanza di 5 cm dal margine distale
della neoplasia. Qualora ciò comportasse la resezione degli sfinteri, si può
scendere a 2 cm di margine (EVIDENZA A).
4.3.2. Tecnica e tattica chirurgica
Se il tumore non invade lo sfintere e/o se non è fisso, si può procedere
ad un intervento di Sphincter Saving Procedure (S.S.P.). Alcuni autori
ritengono che anche un margine di 1 cm. sia sufficiente, soprattutto dopo
terapia neoadiuvante. Le S.S.P. vanno attuate in pz non incontinenti (utile
una accurata esplorazione rettale o una manometria prima dell’intervento)
(EVIDENZA B).
La Total Mesorectal Excision (TME) con anastomosi ultrabassa, a livello degli elevatori, è in grado di aumentare la radicalità chirurgica (EVIDENZA A). Essendo stata dimostrata la diffusione tumorale in senso distale per 4 cm nel grasso del mesoretto, la TME è indicata sempre nei tumori
del retto basso, anche quando l'anastomosi viene effettuata al di sopra del
livello degli elevatori. Nei tumori del retto alto ciò comporta una resezione
di mesoretto distale per almeno 5 cm dalla neoplasia (EVIDENZA C). In
caso di anastomosi ultrabassa è raccomandata una stomia di protezione. Il
rinforzo dell’anastomosi con omento non sembra aumentare la sicurezza o
ridurre il numero della deiscenza delle anastomosi colo-rettali. La radicalità
locale è assicurata da un margine circonferenziale (o radiale) libero di
almeno 1 cm. Ciò comporta una resezione più ampia della TME qualora
la neoplasia superi il foglietto viscerale della fascia pelvica che delimita il
mesoretto (EVIDENZA C). La TME comporta una dissezione con tecnica
“nerve sparing” nei tumori che non superino la fascia mesorettale, anche in
pz anziani (EVIDENZA B).
L’escissione transanale con metodica tradizionale o TEM può essere
indicata nelle neoplasie mobili, occupanti meno di un terzo della circonferenza rettale, di diametro inferiore a 3cm, altamente/moderatamente differenziate, con stadiazione T1 (eco endoanale). L’estensione alle neoplasie
T2, associata alla radioterapia adiuvante, necessita di ulteriori validazioni
(EVIDENZA C).
Anastomosi coloanale: i risultati funzionali, soprattutto nei primi due
anni, sono migliori dopo anastomosi colo-anale su J pouch rispetto all’anastomosi colo-anale diretta, rispetto alla frequenza delle evacuazioni,
all’urgenza, al soiling notturno e alla necessità di un trattamento farmacologico antidiarroico. Probabilmente il volume ottimale della tasca colica è
di circa 8 cm (EVIDENZA B).
4.3.3. Terapia neoadiuvante
E' stato proposto trattamento radiante (RTX) preoperatorio (neoadiuvante) nei tumori rettali, stadio clinico-radiologico Dukes B-C o II-III del TNM,
con aumento della sopravvivenza e riduzione delle recidive locali (EVIDENZA A).
E' stato anche proposto trattamento neoadiuvante RXT+CHT con risultati incoraggianti -risposte complete- (EVIDENZA C).
4.4. Metastasi epatica
E’ possibile procedere ad una resezione sincrona di 1 – max 3 metastasi superficiali in un unico lobo epatico (EVIDENZA B).
4.5. Raccomandazioni generali (UKCCR, 1996)
4.5.1. Criteri preoperatori:
1. Determinare la distanza tra la neoplasia e il margine anale mediante
colonscopio rigido.
2. Interessamento circonferenziale: si dovrebbero sempre indicare il
numero e la posizione dei quadranti del lume intestinale interessati
dalla neoplasia.
3. Fissità: descrivere la mobilità della neoplasia secondo i seguenti criteri:
a) mobile (neoplasia limitata alla parete intestinale); b) ipomobile
(affiorante la sierosa e parzialmente fissa); c) fissa (adesa alle strutture
circostanti).
4. Istologia: definire la natura ed il grado di differenziazione della neoplasia tramite biopsie endoscopiche.
5. Escludere radiologicamente la presenza di eventuali secondarietà polmonari.
6. Valutare la presenza di metastasi epatiche tramite: TC addome, RMN
addome. Se non disponibili tali metodiche eseguire Etg addome. In
seguito classificare il pz secondo i seguenti criteri: a) presenza di metastasi epatiche; b) dubbio sulla presenza di metastasi epatiche; c) assenza di metastasi epatiche.
7. Valutare la concentrazione ematica del CEA: valori > 50ng/ml sono suggestivi di malattia metastatica, anche in casi di negatività radiologica.
8. Escludere la presenza di lesioni sincrone tramite: a) colonscopia, se tecnicamente possibile (neoplasia valicabile dallo strumento); b) clisma
d.m.c. nei casi in cui non sia tecnicamente possibile eseguire colonscopia; c) palpazione intraoperatoria del colon o colonscopia postoperatoria o clisma d.m.c. dopo 6 mesi dall’intervento, nei casi di neoplasia invalicabile.
4.5.2. Criteri intraoperatori
Il chirurgo dovrebbe sempre descrivere le seguenti condizioni:
1. Definire il regime dell’intervento: a) elezione; b) urgenza.
2. Posizione della neoplasia; nel caso di neoplasie del retto descrivere se
è localizzata prima o dopo la riflessione peritoneale.
3. Grado di fissità della neoplasia: mobile, ipomobile, fissa. Negli ultimi
2 casi descrivere a quali organi o strutture è adesa. In biopsie intraoperatorie specificare se il materiale proviene dall’area di infiltrazione o
di aderenza della neoplasia.
4. L’eventuale associazione della neoplasia ad: a) ascessi locali; b) perforazioni iatrogene della stessa; c) ascite.
5. Presenza di carcinosi peritoneale. Se esiste il sospetto, eseguire una
biopsia.
6. Aumento di volume dei linfonodi pre-aortici o di altri linfonodi.
Eseguire una biopsia se tali linfonodi non sono inclusi nella resezione.
7. Metastasi epatiche: stabilire numero e localizzazione ed eseguire biopsie.
8. Descrivere l’interessamento di altri organi e se si esegue la loro parziale o totale resezione.
9. Descrivere l’intento dell’intervento: curativo o palliativo. Nei casi di
intervento palliativo eseguire biopsie sull’area residua interessata dalla
neoplasia.
10.Il numero dei flaconi di sangue trasfuso durante l’intervento.
4.6. Bibliografia
1. Adler M., Quendeon M., Evenadin D. et al. “whole gut lavage for colonoscopy. A comparison between two solution” Gastrointest Endosc
1984; 30: 65- 67.
2. Thomson A., Naidoo P., et al. “Bowel preparation for colonoscopy: a
randomized prospective trial comparing sodium phosphate and polye-
tilene glicol in a predominantly elderly population.” J. Gastroenterol
Hepatol 1996; 11: 103-107.
3. Baigrie R.J. and Berry A.R.: “Management of advanced rectal cancer”
Br.J.Surg 1994; 81: 343-352.
4. Wigger T., Jeckel J., et al. “No touch isolation technique in colon cancer: a controlled prospective trial” Br. J. Surg 1988; 75: 409- 415.
5. Durdey P., Williams N.S. “The fact of malignant and inflammatory fixation of rectal carcinoma on prognosis after rectal excision” Br.J.Surg
1984; 71: 787-790.
6. Morikawa et al. Distribution of metastatic lynph nodes in colorectal cancer by the modifiedclearing method. Dis Colon Rect 1994; 37 :219-23.
7. Toyota et al. Rationale for extent lynph node dissection for right colon
cancer. Dis. Col. Rect 1995;38:705-11.
8. Pezim M.E., Nicholls R.J. “Suvival after high or low ligation of the inferior mesenteric artery during curative surgery for rectal cancer.” Ann.
Surg 1984; 200: 729 - 733.
9. Rouffet F., Hay J.M., Vacher B.: “Curative resection for left colonic carcinoma: hemicolectomy versus segmental colectomy. A controlled prospective multicentric trial for the French Ass. for Surgical Research”. Dis.
Colon Rectum 1994; 37: 651- 659.
10. Sugarbaker PHet al Influence of surgical tecniques on survival in
patients with colorectal cancer. A rewiew. Dis.Col. Rect 1982; 25: 545557.
11. Thomson WHF et al. On table lavage to achieve safe restorative rectal
and emergency left colonic resection without covering colostomy. Br J
Surg 1986; 73: 61–3.
12. Konishi F.: Intra-operative irrigation and primary resection for obstructive lesions of the left colon. Int J colorectal Dis 1988; 3: 204-6.
13. Morgan WP et al: Management of obstructing carcinoma of the left
colon by extended right hemicolectomy. Am J Surg 1985; 149: 319-27.
14. Koruth NM et al: Immediate resection in emergency large bowel surgery: a 7 years audit. Br J Surg 1985; 72: 703-7.
15. Keighley M.R., Williams N.S. Meta analisi su Surgery of anus rectum and
colon II edn vol.I Saunders - London 1997.
16. Shirozu K et al: Distal spread of rectal cancer and optimal distal margin
of resection for sphincter-preserving surgery. Cancer 76: 388-92.
17. Vernava III AM et al: A prospective evaluation of distal margins in carcinoma of tha rectum. Sug Gynecol Obstet 175: 333-36.
18. Pollet WG et al: The relationship between the extent of distal clearance and survival and local recurrence rates after curative anterior resection for carcinoma of rectum. Ann Surg 198: 159-63.
19. Mc Call J.L., Cox M.R., Wattchow D.A. Analysis of local recurrence after
surgery for rectal cancer. Int.J.colorect Disease 10.
20. Herald RJ et al: The Mesorectum in rectal cancer surgery; the clue of
pelvic recurrence? Br J Surg 69: 613-16.
21. Mc Farlane et al: Mesorectal excision for rectal cancer. Lnacet 341: 457460.
22. Quircke P et al: Local recurrence of rectal adenocarcinoma due to inadequate surgical resection. Lancet 2: 996-99.
23. Hermaneck P., Wiebelt H., Stainmer D. et al.: “Prognostic factors of rectal carcinoma: experience of the German multicenter study” S.G.C.R.C.
Tumori 1995; 81 (suppl): 60 – 64.
24. Istvan et al: Préservation de l’innervation sexuelle dans la chirurgie du
cancer du rectum. Ann. Chir 1997; 51: 678-81.
25. Buess G et al: Clinical results of transanal endoscopic microsurgery.
Surg Endosc 1988; 2: 235-50.
26. Buess et al: Technique and results of transanal endoscopic microsurgery in early rectal cancer. Am J Surg 1992; 163: 63-70.
27. Lazorthes F et al: Late clinical outcome in a randomized prospective
comparison of colonic J Pouch and straight colo-anal anastomosis. Br J
Surg 1997; 84: 1449-51.
28. Seow-Choen F et al: prospective randomized trial comparing J pouchanal anastomosis and straight colo-anal anastomosis. Br J Surg 1995;
82:608-10.
29. Stockholm Rectal cancer Study Group. Preoperative short-term radiation therapy in operable rectal carcinoma. Cancer 1990; 66: 49-55.
30. Swedish Rectal Cancer Trial. Local recurrence rate in a randomized multicentre trial ofpreoperative radiotherapy compared to surgery alone in
resectable rectal carcinoma. Eur J Surg 1996 ; 162 : 397-402.
31. Swedish Rectal Cancer Trial. Improved survival with preoperative radiotherapy in resectable rectal carcinoma. N Eng J Med 1997; 336: 980-7.
32. HabrGma A: preoperative treatment of low rectal Cancer with combined chemotherapy and radiation therapy. Colorectal Cancer Session at
the American Society of Colorectal Surgery.
33. Grann A et al: Preliminary results of preoperative 5FU, low-dose leucovorin and concurrent radiation therapy for resectable T3 rectal cancer. Dis Colon Rectum 1997; 40:515-522.
34. Goligher J.C.:”Surgery of the anus rectum and colon” 4th edn London
Bailliere – Tindall.
5. Terapia adiuvante e palliativa
5.1 Terapia adiuvante del carcinoma del colon
5.1.1. Storia naturale
Circa il 35% dei pz operati radicalmente sviluppa una ripresa di malattia e
la stragrande maggioranza di essi muore per estesa diffusione metastatica. Il
rischio di recidiva e di morte è funzione dello stadio patologico. Infatti, la
sopravvivenza a 5 aa scende dal 90% negli stadi A e B1 di Dukes (pT1-pT2,
pN0, M0) al 40-50% nello stadio C (qualunque T, pN1-pN3, M0). Anche le
caratteristiche istopatologiche (grading, invasione vascolare e linfatica, istotipo) del tumore e la presentazione clinica (occlusione o perforazione) sono
correlate alla prognosi. Recentemente è stato evidenziato il possibile ruolo
prognostico di alcuni fattori biologici legati al cariotipo e all’attività proliferativa della neoplasia, nonché all’espressione di alcune oncoproteine (come
la proteina p53), ovvero ad alcune attività enzimatiche come la timidilatosintetasi. Tuttavia, il significato prognostico di questi fattori è oggetto di controversia e il ruolo nella pratica clinica ancora da definire.
5.1.2. Stato dell’arte
Nel 1990 una Consensus Conference promossa dall’NIH di Bethesda ha
raccomandato l’impiego della combinazione 5-fluorouracile (5-FU) più
levamisolo (LEV) come trattamento di scelta per i pz allo stadio C. Questa
raccomandazione era basata sui risultati di tre studi clinici randomizzati
che avevano dimostrato come questo regime terapeutico fosse in grado di
ridurre del 41% l’incidenza delle recidive e del 33% la mortalità.
L’utilizzo del 5-FU e dell’acido folinico (AF) in adiuvante trova un razionale nella maggior efficacia di questa combinazione rispetto al 5-FU da
solo anche nella malattia metastatica. Tre studi collaborativi (IMPACT,
INTERGROUP-USA e NSABP C-03) hanno dimostrato come la combinazione 5-FU/AF sia in grado di ridurre significativamente la recidività e la
mortalità dopo chirurgia. I risultati di questi studi sono comparabili, nonostante i diversi schemi del 5-FU e dell’AF. Lo studio NSABP C-03 ha infatti utilizzato uno schema settimanale di 5-Fu 500 mg/m2 e AF 500 mg/m2
per 12 mesi , lo studio INTEGROUP ha utilizzato il 5-FU 425 mg/m 2 e l’AF
20 mg/m2 per 5 giorni ogni 4 settimane per 6 mesi e, infine, gli studi
IMPACT hanno utilizzato il 5-FU 370-400 mg/m2 e l’AF 200 mg/m2, sempre
per 5 giorni ogni 4 settimane per 6 mesi. Lo schema con AF a basse dosi
ha comportato una maggiore incidenza di stomatite e granulocitopenia, ma
è più maneggevole rispetto alla schedula settimanale e meno costoso
rispetto allo schema che impiega dosi intermedie di AF.
Una generazione successiva di studi controllati (NSABP C-04,
NCI/NCCTG) ha confrontato gli schemi 5-FU/AF (sia nella schedula settimanale che nello schema con AF a basse dosi) con lo schema 5-FU/LEV o
con la combinazione 5-FU/LEV/AF. I risultati preliminari di questi studi
sembrano indicare che la combinazione 5-FU/AF è superiore allo schema
5-FU/LEV e che il ruolo del LEV, quando impiegato insieme a 5-FU e AF, è
trascurabile. Pertanto, sei mesi di terapia con la combinazione 5-FU/AF
sono sufficienti e comparabili, in termini di efficacia, ai trattamenti protratti per 12 mesi.
Poiché il fegato rappresenta la sede più frequente di metastasi nei pz con
CCR, numerosi studi hanno valutato l’utilità della somministrazione intraportale del 5-FU, associato o meno ad altri farmaci citotossici. Una recente metanalisi tuttavia, non sembra dimostrare un vantaggio significativo di
questo approccio.
Negli ultimi anni sono stati introdotti nella pratica clinica nuovi agenti
antitumorali (raltitrexed, irinotecan, oxaliplatino, anticorpi monoclonali)
che, almeno nella malattia avanzata, hanno dato interessanti risultati in termini di efficacia. Circa nuove modalità di somministrazione dei farmaci,
rispetto al tradizionale bolo, è anche da segnalare il trial randomizzato intergruppo di fase III EORTC-GITCCG 40963: PETACC 2 che confronta, sempre
in adiuvante, schemi infusionali diversi di 5-FU associati o meno al leucovorin vs lo standard FU/AF. Tuttavia, nessuno di questi farmaci o di queste
nuove modalità di somministrazione può essere oggi proposto in fase adiuvante nella pratica clinica, alla luce anche dei maggiori costi e soprattutto
perché nessuno studio ha ancora dimostrato la loro equivalenza o superiorità rispetto agli schemi tradizionali basati sull’uso del 5-FU ‘a bolo’. Le stesse raccomandazioni valgono per l’uso di questi farmaci in combinazione
con gli schemi tradizionali. Le stesse riserve valgono per l’uso in adiuvante
di altre forme di immunomodulazione, nonostante i risultati a lungo termine ottenuti con il BCG in uno studio francese, soprattutto nei pz allo stadio
C, nei quali il trattamento immunomodulante è risultato in grado di ridurre
sensibilmente il rischio di recidiva e la sopravvivenza dei pz.
Come si è visto precedentemente, la maggior parte degli studi con 5FU/LEV o 5-FU/AF ha dimostrato un vantaggio per la chemioterapia solo
nei pz allo stadio C. Tuttavia, l’analisi combinata dei 4 studi clinici condotti
dal NSABP (C-01, C-02, C-03, C-04) ha documentato un beneficio sovrapponibile per lo stadio B e C.
Raccomandazioni:
1) Il trattamento adiuvante postchirurgico deve essere considerato
elettivo nei pz allo stadio C, purché non esistano controindicazioni legate all’età o allo stato di salute del pz (A).
2) Nella pratica clinica, al di fuori di studi controllati, l’indicazione
al trattamento adiuvante può essere estesa anche ai pz in stadio
B2-B3 (pT3, pT4) con caratteristiche prognostiche sfavorevoli (elevati valori preoperatori di CEA, presenza di componente mucinosa, basso grado di differenziazione = G3, aneuploidia, elevato
indice di proliferazione, perdita di alleli dei cromosomi 5, 17 e 18,
elevati livelli di timidilato-sintetasi, perforazione colica) che tuttavia devono essere correttamente informati sui potenziali rischi
e sul fatto che il grado di evidenza scientifica è inferiore (B).
3) 6 mesi di trattamento con 5-FU/AF sono sufficienti. Questi schemi sembrano essere superiori rispetto allo schema tradizionale
con 5-FU/LEV per 12 mesi e la compliance sembra essere superiore, anche per la minore durata del trattamento. Lo schema
con 5-FU e AF a basse dosi della Mayo Clinic (5-FU: 425 mg/m 2 ev
gg 1-5/AF: 20 mg/m 2 ev gg 1-5: ogni 4 settimane) fornisce risultati sostanzialmente comparabili allo schema tipo “Machover” (5FU: 370-400 mg/m 2 ev gg 1-5/AF: 200 mg/m 2 ev gg 1-5: ogni 4 settimane) anche se la tossicità è diversa. Entrambi questi schemi
sono in grado infatti di ridurre il rischio di mortalità del 30% (A).
5.2. Terapia adiuvante del carcinoma del retto
5.2.1. Storia naturale
La diversa storia naturale del carcinoma del retto giustifica un differente
approccio nel trattamento postchirurgico di tale neoplasia. In particolare,
il riscontro di una recidiva locale della malattia è una evenienza che si
manifesta molto più frequentemente per i tumori a partenza dal retto, con
un rapporto di 3 a 1 rispetto a quelli di derivazione dal colon. Questa
diversa evoluzione della malattia comporta la necessità di prendere in considerazione l’inserimento di un trattamento radiante allo scopo di meglio
controllare localmente la malattia.
Il fattore prognostico più importante è sicuramente lo stadio della malattia. L’insorgenza di una recidiva locale è strettamente correlata allo stadio
iniziale della malattia, aggirandosi per lo stadio A di Dukes (I stadio TNM)
intorno al 5-10%, per lo stadio B (II stadio TNM) intorno al 25-30% e per
lo stadio C (III stadio TNM) intorno al 50%. L’istotipo muciparo della neoplasia, la grandezza del tumore e la sua distanza dal margine anale (maggiore è la distanza, minori sono le recidive) sono fattori prognostici predittivi di recidiva altrettanto importanti. Non meno significativa è la corretta e completa exeresi chirurgica del tumore primitivo e del mesoretto. Gli
stessi fattori di ordine biologico citati per il carcinoma del colon sono in
corso di migliore definizione anche in questa patologia.
5.2.2. Stato dell’arte
È noto che la radioterapia effettuata dopo trattamento chirurgico radicale è in grado di ridurre l’incidenza di recidive locali, anche se purtroppo
nessuno studio clinico controllato ha fino ad oggi dimostrato in modo inequivocabile che ciò si traduca anche in un aumento della sopravvivenza
globale. Come trattamento complementare postoperatorio negli stadi
B2/B3 e C infatti, la radioterapia è in grado di dimezzare il tasso delle recidive pelviche attese dopo la sola chirurgia radicale (valutabili intorno al
30%); con la tecnica a campi multipli, alla dose di 45-55 Gy in 5 settimane entro 1-3 mesi dall’intervento chirurgico, rappresenta pertanto nel suddetto sottogruppo di pz uno degli standard terapeutici.
L’associazione della chemioterapia alla radioterapia nei medesimi stadi
di malattia è pertanto stata proposta con la duplice finalità di aumentare
l’effetto locale della radioterapia e di ridurre il rischio di metastasi a
distanza. In particolare, l’utilizzo di schemi contenenti 5-FU (somministrato in bolo prima e durante la radioterapia) ha determinato negli stadi B2
e C una riduzione del rischio di recidiva locale pari al 46%, del rischio di
metastasi a distanza del 37% e della mortalità globale del 29%.
Impiegando inoltre l’infusione continua del 5-FU per tutta la durata della
radioterapia, a sua volta preceduta e seguita da somministrazioni settimanali di 5-FU in bolo, si sono ottenuti risultati migliori, con un vantaggio a
4 anni di follow-up pari a circa il 10% sia in termini di sopravvivenza libera da malattia (63% vs 53%) sia di sopravvivenza globale (70% vs 60%), a
prezzo peraltro di una maggiore tossicità.
L’utilizzo della radioterapia pre-operatoria ha visto negli ultimi anni un
crescente interesse. Alcuni studi hanno infatti evidenziato un vantaggio
nell’impiego di tale modalità terapeutica in termini di riduzione delle recidive locali e uno studio svedese anche in termini di sopravvivenza globale. I potenziali vantaggi della radioterapia preoperatoria consistono
nella possibilità di ridurre il volume tumorale e migliorare la resecabilità.
Inoltre, il trattamento preoperatorio è in grado di diminuire la vitalità delle
cellule tumorali eventualmente disseminate al momento dell’intervento,
nonché l’incidenza delle complicanze aderenziali e dei danni tardivi intestinali, che nel caso della radioterapia postoperatoria sono legati alla fissità delle anse intestinali. Non ancora ben definito è invece il ruolo della
chemioterapia neoadiuvante che, in associazione alla radioterapia, è
attualmente oggetto di studi clinici controllati.
Raccomandazioni:
1) Il trattamento adiuvante postchirurgico deve essere considerato
elettivo nei pz allo stadio B2-B3 e C (pT3, pT4, qualunque T in pre-
senza di metastasi linfonodali), purché non esistano controindicazioni legate all’età o allo stato di salute del pz (A).
2) Lo standard terapeutico è rappresentato dall’associazione della
radioterapia (45-55 Gy in 5 settimane) con gli schemi di chemioterapia a base di 5-FU comunemente impiegati nel carcinoma del
colon (A).
3) La chemioterapia e la radioterapia devono essere iniziate entro 310 settimane dall’intervento chirurgico. Alcuni schemi prevedono l’uso del 5-FU, a bolo o in infusione continua, in concomitanza con la radioterapia (A).
4) Anche se uno studio randomizzato ha evidenziato un impatto
favorevole della radioterapia preoperatoria sulla sopravvivenza,
il grado di evidenza a supporto di questa tecnica è probabilmente
inferiore rispetto a quello relativo alle combinazioni chemioradioterapiche postchirurgiche. Tale tecnica non appare pertanto
raccomandabile come “standard terapeutico”. Tuttavia, nei Centri
dove esista una adeguata esperienza, la radioterapia preoperatoria può essere un’alternativa alla radioterapia postoperatoria. In
questo caso è raccomandata una stadiazione clinica quanto più
possibile esauriente, perché la stadiazione patologica all’intervento potrebbe portare ad una sottovalutazione dello stadio all’esordio. Il volume irradiato comprende il retto e le stazioni linfonodali pelviche con schermatura per quanto possibile della vescica. Il regime di irradiazione può essere ipofrazionato, con intervento precoce, o simile a quello suggerito in postoperatoria, con
intervento 4 settimane dopo la fine della irradiazione (B).
5.3. Terapia palliativa del CCR
5.3.1. Storia naturale
In generale, la sopravvivenza mediana dei pz con CCR avanzato è intorno ai 10-12 mesi e l'impatto della chemioterapia sulla prognosi è da molti
considerato irrilevante. Infatti, nella maggior parte degli studi la percentuale di risposte complete è risultata intorno al 5%, con il 20% di risposte
parziali ed un altro 30% di stabilizzazioni. La durata delle risposte è pure
risultata limitata a 4-6 mesi, ed il tempo a progressione è anch'esso intorno ai 4 mesi.
Tuttavia, in 3 studi randomizzati, la sopravvivenza mediana dei pz non
trattati è stata la metà circa di quella dei pz sottoposti a chemioterapia palliativa; inoltre il trattamento ha indotto una risposta soggettiva nel 50% dei
casi circa, prolungando la sopravvivenza libera da sintomi e consentendo ai
pz asintomatici di mantenere più a lungo una normale qualità di vita.
Pertanto, se da un lato è bene non dimenticare che la chemioterapia
della malattia in fase avanzata ha solo un intento palliativo, dall'altro va
tenuto ben presente che quando ci si astiene dal trattare il pz si rinuncia
alla possibilità di raddoppiare la sopravvivenza attesa e di assicurare un
beneficio clinico concreto.
In generale, i pz con malattia massiva, metastatica a più organi, condizioni generali scadenti (basso PS), sintomatici, con elevati livelli basali di
CEA, LDH e globuli bianchi hanno ben poche possibilità di trarre beneficio dalla chemioterapia palliativa. In queste condizioni è ben difficile ottenere più del 5-10% di risposte, mentre la probabilità di gravi effetti collaterali è molto elevata, intorno al 40-50%. La situazione opposta ribalta il
rapporto efficacia/tossicità: a fronte di concrete possibilità di ottenere una
buona palliazione (50% circa), il rischio di effetti collaterali gravi è modesto (10% circa). I problemi decisionali più complessi riguardano ovviamente i casi intermedi.
5.3.2. Stato dell’arte
5.3.2.1. Terapia di prima linea
Al momento, la combinazione 5-FU/AF rappresenta la chemioterapia di
prima linea più comunemente utilizzata. In una serie di studi clinici l'aggiunta di leucovorin al FU sembra aumentare la risposta dal 10-20% al 2040%, sebbene non venga aumentata in modo significativo la sopravvivenza mediana raggiunta dal FU da solo (Advanced Colorectal Cancer MetaAnalysis Project, 1992).
La modalità più comune di somministrazione del FU è quella endovenosa in bolo, in combinazione con il leucovorin. Il trattamento in bolo o
in infusioni di breve durata dovrebbe essere somministrato in regime
ambulatoriale, eccetto che nei pz in fase postoperatoria precoce o, quando sia necessario monitorare la reazione del pz agli effetti collaterali, all'inizio del trattamento.
Alcuni regimi terapeutici, basati sulla infusione continua, possono richiedere la ospedalizzazione ad intervalli regolari. L'infusione continua può
essere presa in considerazione all'interno di studi clinici o in pz nei quali
il rischio di tossicità rappresenta una particolare preoccupazione. Va tenuto presente che le considerazioni tecniche riguardo all'infusione continua
possono rendere difficile l'applicazione di questa modalità di somministrazione. Complessivamente sembra che le risposte obiettive siano superiori
impiegando le alte dosi infusionali.
Il raltitrexed può essere considerato una alternativa alla combinazione 5FU/AF. Raltitrexed ha una maggiore specificità per la timidilato-sintetasi
rispetto al 5-FU. Studi clinici controllati con raltitrexed hanno evidenziato
percentuali di risposta obiettiva confrontabili con quelle ottenute con
FU/AF, e una sopravvivenza mediana compresa tra 9,7 e 11,2 mesi.
Al momento attuale non esistono dati che supportino un vantaggio di
nuovi farmaci antitumorali in monochemioterapia rispetto al 5-FU/AF.
Peraltro, uno studio randomizzato recente ha dimostrato che la combinazione di 5-FU/AF infusionale ad alte dosi settimanale o quindicinale con
irinotecan è significativamente superiore al medesimo regime con 5-FU/AF
sia in termini di risposte obiettive (49% verso 31%) che in termini di
sopravvivenza, durata della risposta e stabilizzazione di malattia. Questo è
il primo studio che mostra un regime chemioterapico più attivo ed efficace in prima linea nella situazione metastatica rispetto ad un regime con
solo 5-FU o 5-FU/AF. Studi sono in corso con la combinazione 5-FU e oxaliplatino, raltitrexed ed irinotecan ed i risultati definitivi saranno disponibili a breve termine. Analogamente, sono in corso studi di combinazione
di nuovi farmaci che rappresentano pro-farmaci del 5-FU (capecitabina,
UFT, eniluracile) con il vantaggio della somministrazione con irinotecan e
oxaliplatino; perlatro, esistono già studi controllati che hanno dimostrato
eguale attività ed efficacia di tali profarmaci vs. la combinazione 5-FU/AF.
5.3.2.2. Terapia di seconda linea
Le possibili scelte chemioterapiche di seconda linea dipendono sostanzialmente da due fattori: la chemioterapia impiegata in prima linea e le
condizioni generali (performance status).
Il performance status di per sé può rappresentare il fattore decisionale
più importante: infatti un trattamento chemioterapico di seconda linea può
essere dannoso qualora le condizioni generali del pz siano particolarmente precarie.
Per quanto concerne il trattamento in prima linea, è opportuno ricordare che il 5-FU può avere differente meccanismo biochimico d'azione a
seconda della modalità di modulazione scelta (AF, Methotrexate) e della
modalità di somministrazione (bolo, infusione continua); è quindi possibile ottenere una seppur bassa percentuale di risposte cambiando la modalità di modulazione del 5-FU.
Sicuramente i nuovi farmaci che agiscono con meccanismi d'azione completamente differenti rappresentano una seconda linea chemioterapica
consigliabile. Promettenti sono anche i dati relativi alla combinazione di
FU infusionale con la mitomicina C e con l'oxaliplatino. Anche se i dati
sono preliminari, suscitano grande interesse gli studi con fluoropirimidine
somministrabili oralmente, per la potenziale assimilabilità ai regimi infusionali.
La cronomodulazione, nella quale la somministrazione dei farmaci viene
aggiustata secondo il ritmo circadiano del metabolismo dei farmaci e della
sintesi del DNA delle mucose e del midollo osseo, può aumentare l'attività dei farmaci e ridurne la tossicità. Gli schemi terapeutici di terapia cronomodulata contenente FU, oxaliplatino e acido folinico hanno riportato
una percentuale di risposta superiore al 50%, permettendo una resezione
chirurgica curativa di metastasi considerate non resecabili nel 13-25% dei
pz. Al momento comunque, la cronomodulazione rimane una tecnica da
riservare a studi clinici.
5.3.2.3. Irinotecan
Il farmaco è registrato come terapia di seconda linea dopo progressione
al 5-FU. Sono state riportate percentuali di risposta del 17-20% anche in
caso di malattia resistente al 5-FU e studi recenti riportano un incremento
statisticamente significativo della sopravvivenza rispetto alla "best supportive care". Il beneficio clinico sembra essere consistente, nonostante il farmaco sia gravato da importanti effetti collaterali quali diarrea di grado IIIIV nel 22-24% dei casi e una analoga percentuale di neutropenia grave.
5.3.2.4. Chemioterapia locoregionale
Le metastasi epatiche rappresentano una delle principali cause di morbidità e di morte nei pz affetti da CCR; per tale motivo le lesioni possono
essere aggredite con efficacia attraverso una chemioterapia locoregionale,
utilizzata da sola o in combinazione con schemi di terapia sistemica. Al
momento tuttavia, si è ancora in attesa di risultati definitivi da studi clinici
sull'efficacia e l'ottimale disegno di regimi di chemioterapia locoregionale.
La terapia intrarteriosa necessita di un intervento per il posizionamento del
catetere e può essere gravata da sequele chirurgiche e da complicanze correlate al catetere stesso: pertanto questa metodica non è giustificata in tutti
i pz portatori di metastasi epatiche. In ogni caso, se un pz viene operato
con intento palliativo o per un tentativo di resezione chirurgica di metastasi epatiche che siano poi non resecabili, il posizionamento rappresenta
probabilmente il miglior approccio terapeutico.
Raccomandazioni
1) Soprattutto se il pz è anziano ed asintomatico, la decisione di
attendere alcuni mesi e di iniziare la chemioterapia quando la
malattia divenga sintomatica, può essere la scelta migliore (A).
2) Il trattamento chemioterapico dovrebbe essere somministrato inizialmente per alcuni mesi e continuato fino a progressione di
malattia, con adattamento della posologia alla tolleranza del pz (A).
3) La combinazione 5-FU/AF rappresenta la modalità più comune di
trattamento. L'uso del 5-FU per infusione continua dovrebbe
essere riservato ai pz a rischio di tossicità. In ragione del maggiore costo, l’altitrexed dovrebbe essere riservato ai pz non candidabili al 5-FU. L'uso della chemioterapia locoregionale dovrebbe essere riservato ai pz con sole localizzazioni epatiche e solo a
casi selezionati (A).
4) Il trattamento di seconda linea dovrebbe essere subordinato alle
condizioni cliniche del pz e alle sue attese. Le opzioni terapeutiche vanno adattate alle singole situazioni cliniche e devono avere
come obiettivo primario il mantenimento di una buona qualità
della vita. Se è indicato un trattamento, va tenuto presente che il
5-FU può avere differente meccanismo biochimico d'azione a
seconda delle modalità di modulazione (AF, methotrexate) e di
somministrazione (bolo, infusione continua); è quindi possibile
ottenere una seppur bassa percentuale di risposte cambiando la
modalità di modulazione del 5-FU. I nuovi farmaci che agiscono
con meccanismi d'azione complementare differenti rappresentano una seconda linea chemioterapica consigliabile (A).
5.4. Bibliografia
1. AA.VV. La terapia adiuvante dei tumori del colon-retto. Lettera
Terapeutica 9 (Suppl), 1998.
2. AA. VV. Colon cancer adjuvant therapy. Ca Cancer J Clin 47: 243-256,
1997.
3. AA.VV. Il trattamento del paziente affetto da carcinoma del colon-retto.
Tumori 84 (Suppl 1), 1998.
4. AA.VV. Trattamento adiuvante del carcinoma del colon. Stato dell’arte
e prospettive future. Tumori 85: A1-A6, 1999.