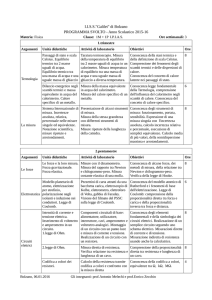
RELAZIONE DI LABORATORIO
Nome: Marco
Cognome: Giaquinto
Disciplina: Chimica
Classe: 2^Atg
Docenti Prof: Filomena Velleca
Data: 18/02/2014
Numero relazione: n 4
TITOLO DELL’ESPERIENZA: Misura del calore di reazione
OBIETTIVO: Calcolare il calore di reazione
ASPETTI TEORICI:
Dal punto di vista degli scambi di calore si possono avere tre tipi di reazione: reazioni esotermiche, reazioni
endotermiche e reazioni termoneutrali.
Le reazioni esotermiche sono le reazioni che comportano un trasferimento di calore dal sistema
all’ambiente, come nel caso della combustione del carbonio.
Le reazioni endotermiche sono le reazioni che avvengono con trasferimento di calore dall’ambiente al
sistema. Un esempio di reazione endotermica è la reazione tra carbone e vapor d’acqua, che produce una
miscela usata come combustibile, il gas d’acqua.
Le reazioni termoneutrali sono le reazioni non accompagnate da effetti termici apprezzabili.
Il calorimetro è un dispositivo utilizzato in calorimetria per misurare il flusso di calore durante una
trasformazione, come calori specifici, calori latenti di fusione/ebollizione e calori di reazione.
L’energia rilasciata da un alimento si può misurare con uno strumento chiamato “bomba calorimetrica”.
L’alimento viene pesato e quindi posto nel calorimetro in un contenitore, insieme a una certa quantità di
ossigeno, a sua volta circondato da acqua. Dall’esterno viene fatta passare nel calorimetro una corrente
elettrica che provoca l’esplosione e la completa combustione dell’alimento con liberazione di calore. Un
termometro misura la variazione di temperatura dell’acqua intorno alla camera di combustione. Poiché il
sistema è isolato, la variazione di temperatura dell’acqua corrisponde all’energia liberata dall’alimento, che
si misura in chilocalorie.
Una chilocaloria (Kcal) è il calore necessario per aumentare di un grado un chilo d’acqua. L’energia liberata
dall’alimento con questo sistema corrisponde a quella liberata nel nostro organismo.
MATERIALI:
Due cilindri graduati, due matracci, calorimetro, becher
STRUMENTI:
Calorimetro, termometro
SOSTANZE USATE:
Idrossido di sodio (NaOH), acido cloridrico (HCl) e acqua (H2O)
PROCEDIMENTO:
Procurarsi due cilindri graduati, versare in uno 100 ml di idrossido di sodio e acqua e in un altro 100 ml di
acido cloridrico e acqua. Rimuovere il coperchio situato sul calorimetro e versare i 100 ml di idrossido di
sodio e acqua contenuti nel primo cilindro nel becher del calorimetro, riappoggiare il coperchio, girare
l’agitatore e attendere 2 minuti. Dopodiché riaprire il calorimetro e annotare la temperatura misurata dal
termometro. Versare subito dopo 100 ml di acido cloridrico e acqua contenuti nel secondo cilindro nel
becher situato nel calorimetro e richiudere. Attendere altri 2 minuti e annotare la temperatura finale.
Ripetere più volte l’esperimento.
DATI SPERIMENTALI
Temperatura iniziale
19°C
Temperatura finale
25°
ΔT
6°C
ELABORAZIONE DATI
Q = Cs x m x ΔT
Q = 1 cal/°C x g x 200g x 6°C = 1200 cal
DISCUSSIONI E CONCLUSIONI:
Così facendo, tramite la legge fondamentale della termologia (Q = Cs x m x ΔT) abbiamo calcolato il calore
emanato dalla reazione esotermica di NaOH + HCl -- > NaCl + H2O che è pari a 1200 calorie.