LICEO NOMENTANO
CLASSE 3M
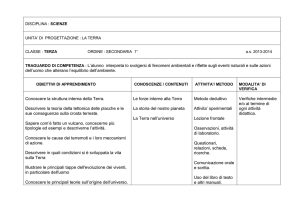
PROGRAMMA SVOLTO DI SCIENZE
ANNO SCOLASTICO 2015/2016
INSEGNANTE: Rosella Ritrovato
TESTI:
CHIMICA:
Valitutti, Falasca, Tifi, Gentile . - CHIMICA, CONCETTI E MODELLI 1 (LDM) - Zanichelli
BIOLOGIA:
Curtis, Barnes, Schnek, Flores - INVITO ALLA BIOLOGIA.BLU PLUS 1 / Biologia Molecolare Genetica, Evoluzione
- Zanichelli
CONTENUTI
-
BIOLOGIA
-
-
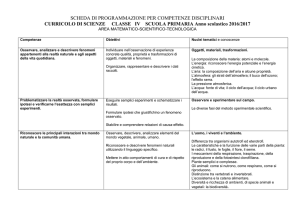
RISULTATI ATTESI
L’allievo dovrà essere in grado di:
- Descrivere a grandi linee struttura e le principali funzioni delle
Ripasso biomolecole:
molecole biologiche: glucidi, protidi, lipidi e acidi nucleici
Glucidi, lipidi, proteine, acidi
- Descrivere le tre leggi di Mendel
nucleici
- Distinguere tra dominante e recessivo, omozigote ed eterozigote,
Genetica classica:
ereditarietà legata al sesso
Gene, allele, genotipo, fenotipo
Risolvere semplici problemi di genetica
Le leggi di Mendel
Descrivere la struttura del cromosoma eucariota e procariota
Il DNA:
evidenziandone analogie e differenze
Il cromosoma procariote ed
- Descrivere il processo di sintesi degli acidi nucleici
eucariote
- Descrivere il processo di sintesi delle proteine nei procarioti e negli
Sintesi del DNA
eucarioti
L’espressione genica :
- Descrivere le funzioni di promotore, operatore e gene regolatore
La sintesi proteica
- Spiegare il funzionamento dell’operone lac
La regolazione genica
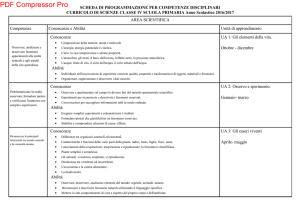
Ripasso anno precedente:
- La materia: Sostanze pure e miscugli
- Gli stati di aggregazione
Leggi ponderali:
- Leggi di Lavoisier, Proust, - Dalton (cenni)
Le particelle subatomiche
CHIMICA
Numero atomico, massa atomica
e unità di massa atomica
La mole
Struttura dell’atomo:
- Modelli atomici
- Configurazione elettronica degli
elementi
Tavola periodica
Le proprietà periodiche
Legami chimici:
- Ionico, metallico, covalente puro e polare, dativo.
- Legami σ e π, singoli o multipli
- Geometria delle molecole:
teoria del VSEPR e del legame
di valenza
- Ibridazione degli orbitali e legami multipli
-
Roma 05 / 06 / 2016
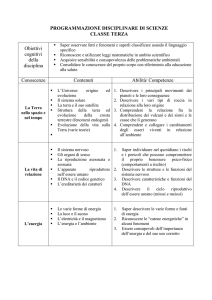
Indicare sostanze pure e miscugli
Definire la concentrazione di una soluzione
Descrivere i passaggi di stato endotermici ed esotermici
Interpretare le leggi ponderali secondo l’ipotesi atomicomolecolare della materia.
Risolvere semplici problemi
Illustrare le particelle subatomiche
Distinguere tra numero atomico, massa atomica e unità di massa
atomica
Definire gli isotopi di un elemento
Individuare la massa atomica e calcolare la massa molecolare
Esprimere il concetto di mole e definire massa la massa molare di
atomi e molecole
Risolvere semplici problemi
Descrivere la struttura atomica secondo i modelli di Thomson,
Rutherford, Bohr.
Descrivere la struttura elettronica a livelli e sottolivelli di energia
dell’atomo
Illustrare il concetto di orbitale e di numeri quantici.
Descrivere la configurazione elettronica di un elemento utilizzando
le “regole di riempimento” degli orbitali, correlandola con la
posizione sulla tavola periodica e le proprietà chimiche
Descrivere la tavola periodica degli elementi esprimendo i concetti
di potenziale di ionizzazione, affinità elettronica e elettronegatività
Descrivere la formazione del legame ionico, metallico e covalente,
prevedendo il tipo di legame che si forma tra due atomi
Classificare i diversi tipi di legame chimico correlandoli con le
proprietà delle sostanze
Spiegare come la forma delle molecole dipende dal tipo di
interazione tra gli atomi.
Chiarire i significato di orbitale ibrido collegandolo con la presenza
di legami multipli
Distinguere i legami σ e π
prof.ssa Rosella Ritrovato