Università degli Studi di Genova
Scuola di Dottorato in Scienze e Tecnologie Biomediche
Corso di Dottorato in Neuroscienze Applicate
Relazione annuale:
(Primo anno – 2007)
Bioenergetica del SNC:
un nuovo ruolo trofico della guaina mielinica
Tutor: Prof. Alessandro Morelli
Dottoranda: Dr. Silvia Ravera
Sommario
ABSTRACT
3
INTRODUZIONE E IPOTESI DI LAVORO
4
IL SISTEMA NERVOSO
STRUTTURA DELLA MIELINA DEL SNC
FUNZIONI DELLA GUAINA MIELINICA
LA PRODUZIONE DI ATP A LIVELLO CELLULARE
BIOENERGETICA DEL SNC: IL PUNTO DELLA SITUAZIONE.
L’IPOTESI.
CARATTERISTICHE DELLE GUAINA MIELINICA CHE SUPPORTANO L’IPOTESI.
4
4
6
7
10
10
11
MATERIALI E METODI
13
MATERIALI
ISOLAMENTO DELLA MIELINA DA CERVELLO BOVINO
PREPARAZIONE DI OMOGENATO DI MITOCONDRI BOVINI
SDS-PAGE E ANALISI MEDIANTE WESTERN BLOT.
ANALISI DENSITOMETRICA DEL SEGNALE OTTENUTO CON WESTERN BLOT
13
13
14
14
16
RISULTATI E DISCUSSIONE
17
SCELTA DEL TRATTAMENTO DEI CAMPIONI PRIMA DELL’SDS-PAGE
17
CARATTERIZZAZIONE DEI CAMPIONI
17
RICERCA DI ALCUNE PROTEINE DELL’ATP SINTASI E DELLA CATENA DI TRASPORTO DEGLI ELETTRONI
20
IN FRAZIONI DI MIELINA.
CONCLUSIONI
22
BIBLIOGRAFIA
24
2
Abstract
Abstract
Il SNC è un distretto dell’organismo con un’alta domanda energetica, tanto da consumare il 20%
dell’ossigeno e il 25 % del glucosio circolanti, anche se la sua densità mitocondriale è inferiore a
quella degli altri organi. Questo fabbisogno energetico è indispensabile per alimentare tutte le
funzioni del SNC, prima fra tutte la conduzione degli impulsi nervosi. La conduzione nervosa è resa
più veloce ed efficiente grazie alla presenza della guaina mielinica, una miscela di proteine e lipidi.
Negli ultimi anni, diversi studi di proteomica hanno evidenziato la presenza di proteine
mitocondriali a livello della guaina mielinica: in particolare sono state descritte moltissime proteine
appartenenti alla catena di trasporto degli elettroni, proteine che nel complesso servono a produrre
ATP.
Perciò, con lo scopo di capire se effettivamente la guaina mielinica possa essere la sede di una
respirazione cellulare e di conseguenza di una massiccia produzione di ATP, in questo lavoro verrà
descritta la ricerca di proteine appartenenti ai complessi respiratori e all’ATP sintasi, in frazioni
isolate di mielina, grazie ad analisi con Western Blot.
I risultati ottenuti, non solo indicano che nella mielina isolata sono presenti queste proteine, ma che
la loro concentrazione aumenta proporzionalmente rispetto all’isolamento del campione,
suggerendo quindi un nuovo ruolo trofico per la guaina mielinica.
3
Introduzione
Introduzione e Ipotesi di lavoro
Il Sistema Nervoso
Il Sistema Nervoso è la sede delle facoltà sensoriali e del pensiero e provvede al controllo delle
funzioni corporee. Per adempiere a questo complesso ruolo funzionale, questo sistema raccoglie le
informazioni di senso da tutto l’organismo e mediante vie nervose le trasmette al midollo spinale e
al cervello [1]. Le informazioni così percepite possono tradursi in una risposta motoria o possono
essere elaborate in ricordi e pensieri, grazie anche ad un confronto con gli stimoli già acquisiti. Il
sistema nervoso adempie così a tre principali funzioni:
-
Funzione motoria
-
Funzione sensoriale
-
Funzione integrativa ( che include i processi della memoria e del pensiero)
Il Sistema Nervoso è suddiviso in Sistema Nervoso Centrale (SNC), costituito da encefalo e midollo
spinale, e Sistema Nervoso Periferico (SNP), costituito da fibre afferenti ed efferenti che
rispettivamente consentono la trasmissione dell’informazione sensoriale al midollo spinale e
all’encefalo e l’invio di impulsi motori dal SNC alla periferia [1].
Il tessuto nervoso, sia quello che costituisce il SNC che il SNP, presenta due tipi fondamentali di
cellule:
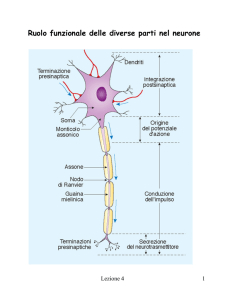
1) Neuroni, cellule deputate alla conduzione nervosa vera e propria. Il neurone è composto da
tre parti principali: il corpo cellulare, che contiene tutti gli organuli cellulari, i dendriti, le
principali strutture afferenti del neurone e l’assone, la struttura efferente del neurone [1].
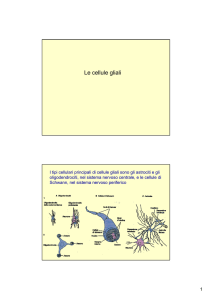
2) Cellule Gliali, cellule deputate al sostegno e al sostentamento del neurone. Nel SNC, in
particolare, ne esitono due tipi: Astrociti e Oligodendrociti. Quest’ultimi hanno la funzione
di produrre una guaina mielinica intorno all’assone per rendere più efficiente e veloce la
conduzione dell’impulso nervoso [1].
Struttura della mielina del SNC
La guaina mielinica è costituita da estese propaggini della membrana plasmatica degli
oligodendrociti, che si avvolgono a spirale attorno agli assoni dei neuroni del SNC [1]. Ogni
oligodendrocita fornisce la mielina per un solo segmento di più assoni e ogni assone è avvolto da
4
Introduzione
segmenti mielinici forniti da oligodendrociti diversi [1]. La guaina mielinica non è continua, infatti,
lungo l'assone ci sono delle interruzioni della guaina, tra un segmento e l'altro, definite nodi di
Ranvier, in cui la membrana assonale eccitabile, ricca di canali per il sodio, è esposta al liquido
extracellulare [1].
La mielina, in vivo, ha un contenuto di acqua di circa il 40%. La massa secca è costituita per il 7085% da lipidi e per il restante 15-30% da proteine [2] Non ci sono lipidi specifici della mielina, ma
il cerebroside è il lipide più tipico. Le proteine maggiormente rappresentate nella mielina sono la
proteina basica della mielina (MBP, 30%), la proteina proteolipidica (PLP, 50%), la 2',3'-nucleotide
ciclico3'-fofodiesterasi (CNPasi), e costituenti minori ma di importante significato funzionale, la
glicoproteina associata alla mielina (MAG) e la glicoproteina oligodendrocitaria della mielina
(MOG) [3].
Al microscopio elettronico (Fig. 1) la mielina appare costituita da strati concentrici di lamelle
lipoproteiche che presentano una tipica alternanza di linee chiare e linee scure, secondo un modello
che si ripete ogni 12- 18 nm e che costituisce il cosiddetto periodo [4]. La linea scura che delimita
ogni periodo è chiamata linea densa maggiore [4]. Lo spazio compreso tra due linee dense maggiori
è costituito da una zona chiara divisa in due da una linea più scura definita linea intraperiodo [4].
L'apposizione delle superfici extracellulari della membrana degli oligodendrociti, forma le linee
intraperiodo; l'apposizione delle superfici citoplasmatiche della membrana degli oligodendrociti
forma la linea densa maggiore.
Figura 1: Immagine al microscopio elettronico di una fibra nervosa mielinizzata
5
Introduzione
Studi immunocitochimici hanno evidenziato la localizzazione delle maggiori proteine della mielina
[5]:
- La PLP è una proteina integrale di membrana, con numerosi domini idrofobici che attraversano il
doppio strato lipidico; si localizza nelle linee intraperiodo.
- La MBP è una proteina estrinseca, localizzata esclusivamente nella superficie citoplasmatica della
membrana, nella linea densa maggiore.
Entrambe le proteine sembrano stabilizzare la struttura multilamellare della mielina.
- La CNPasi è localizzata prevalentemente nell'interfaccia mielina-assone.
- La MAG è una glicoproteina che viene espressa precocemente nei processi periferici delle cellule
mielinizzanti; è una componente minore della guaina mielinica compatta matura. Si localizza
principalmente sulla faccia della guaina mielinica ad immediato contatto con l'assone. La sua
espressione precoce, la localizzazione subcellulare e la somiglianza strutturale con i componenti
della superfamiglia delle Immunoglobuline, suggeriscono che abbia un ruolo nelle fasi precoci della
mielinizzazione, promuovendo l'adesione tra la cellula mielinizzante e l'assone.
- La MOG è stata originariamente identificata come una glicoproteina minore specifica del SNC
[6]. Costituisce lo 0.05% del peso totale. Con la microscopia elettronica la MOG è stata localizzata
nei processi degli oligodendrociti e nella superficie esterna della guaina mielinica del SNC del ratto
adulto [6]. Nei ratti e nei topi, l'espressione di mRNA che codifica per la MOG è massima durante il
picco di mielinizzazione, rimane ad alti livelli durante tutto lo sviluppo e si riduce nel periodo di
vita successivo. L'espressione tardiva e la localizzazione esterna nella superficie mielinica,
suggeriscono che la glicoproteina possa trasdurre il segnale di arresto della mielinizzazione
partecipando al mantenimento e al completamento della guaina mielinica. Recenti studi hanno
ipotizzato che la MOG possa giocare un importante ruolo nella stabilizzazione dei microtubuli
durante i processi di mielinizzazione [7].
Funzioni della guaina mielinica
Quando la fibra nervosa viene eccitata in un punto, si creano circuiti di depolarizzazione che si
propagano passivamente lungo il decorso dell'assone; con la sola propagazione passiva
dell'impulso, il potenziale avrebbe ampiezze diverse, decrescenti dal punto di origine, e si
esaurirebbe in un breve spazio. I circuiti di depolarizzazione sono degli anelli di corrente che
attraversano la membrana cellulare; se l'ampiezza della corrente in uscita supera un determinato
valore soglia, si evoca la produzione attiva di un potenziale d'azione (PdA), mediante apertura di
6
Introduzione
canali ionici voltaggio-dipendenti. Con l'attiva evocazione del PdA, l'impulso propagato ha
ampiezza costante, essendo generato ex novo in frammenti adiacenti di membrana, e può essere
propagato per uno spazio indefinito, ma la velocità di conduzione viene rallentata del tempo
necessario a creare attivamente la depolarizzazione di membrana.
La guaina mielinica aumenta la resistenza elettrica di membrana e, quindi, aumenta la costante di
spazio (distanza alla quale l'ampiezza del potenziale elettrico si riduce ad un terzo del potenziale di
partenza); in questo modo il PdA, propagato passivamente lungo gli internodi, rimane sopra alla
soglia di depolarizzazione per uno spazio maggiore. Il PdA viene attivamente evocato solo a livello
dei nodi di Ranvier, dove la resistenza di membrana è minima, essendo dovuta solo alla resistenza
della membrana dell'assone stesso. Tale meccanismo, definito conduzione saltatoria, riduce la
velocità di conduzione, riducendo i punti in cui il potenziale deve essere creato ex novo [1].
Le fibre mieliniche hanno quindi una velocità di conduzione maggiore delle fibre prive di guaina
mielinica e le lesioni demielinizzanti provocano un rallentamento della conduzione, fino al blocco.
Ad esempio, nella Sclerosi Multipla la demielinizzazione causa da principio un rallentamento nella
conduzione nervosa e con il progredire della malattia una grave sofferenza assonale [8] che si
traduce in sintomi diversi, a seconda delle zone compite dalla malattia [9].
La produzione di ATP a livello cellulare
La molecola di Adenosin-trifosfato (ATP) è alla base del mantenimento omeostatico, dello sviluppo
e della crescita di un organismo vivente. A livello cellulare, la gran parte della produzione di ATP
avviene ad opera di una proteina multimerica chiamata, ATP sintasi, presente nella membrana
interna del mitocondrio [10] (Fig.2).
F1
Fo
Figura 2: Struttura della proteina ATP sintasi
7
Introduzione
Questo enzima è costituito da due parti principali, la porzione F1, che presenta diversi domini in
grado di formare ATP a partire da ADP e fosfato, e la porzione Fo un canale che attraversa la
membrana interna del mitocondrio e che ha funzione di canale per il passaggio dei protoni. Proprio
questo passaggio fornisce la “forza protomotrice” per produrre l’ATP [10] (Fig. 3).
A
B
C
D
Figura 3: Schema della produzione di ATP attraverso l’ATP sintasi. L’ADP e il fosforo si avvicinano alla porzione
F1 della proteina (Panello A), e prendono contatto con la proteina a livello del sito definito open (Panello B). I protoni
passano dalla matrice mitocondriale allo spazio intermembrana attraverso la porzione Fo dell’ATP sintasi (Panello C) e
questo trasporto fornisce l’energia necessaria alla produzione di una molecola di ATP (a livello del sito definito Light)
che viene rilasciata dal sito Teso (Panello D).
I protoni necessari sono il risultato di reazioni di ossido-riduzione che avvengono lungo la catena di
trasporto degli elettroni, situata a monte dell’ATP sintasi, sempre a livello della membrana interna
del mitocondrio. Riassumendo, i trasportatori di elettroni NADH e FADH2 trasferiscono gli
elettroni, accumulati durante la degradazione delle molecole (per glicolisi, ciclo di Krebs, o
metabolismo degli acidi grassi), alla catena di trasporto degli elettroni. Quando gli elettroni passano
lungo la catena di questi accettori-donatori, scendono a stati di energia progressivamente più bassi e
8
Introduzione
l’energia rilasciata in questo processo è usata per pompare ioni H+ attraverso la membrana (dalla
matrice allo spazio intermembrana), generando così un gradiente protonico. Alla fine della catena
gli elettroni avranno come ultimo accettore l’Ossigeno gassoso, che combinandosi con i protoni
presenti nella matrice formerà acqua [11,12] (Fig. 4).
Figura 4: Struttura della Catena di Trasporto degli Elettroni. Gli elettroni passano dal complesso 1 e 2 al
complesso 3 e poi al complesso 4 permettono l’estrusione dei protoni dallo spazio intermembrana alla matrice
mitocondriale, portando alla formazione del gradiente protonico. Quando poi i protoni ritornano allo spazio
intermembrana attraverso la porzione Fo dell’ATP sintasi, si forma ATP a partire da ADP e fosfato.
Perché però possa avvenire questa produzione devono essere soddisfatti alcuni requisiti:
-
Presenza di una membrana impermeabile ai protoni, in modo che si possa creare il gradiente
protonico.
-
Grande sviluppo superficiale per far avvenire il trasporto degli elettroni e l’estrusione dei
protoni, secondo la teoria chemiosmotica di Mitchell [13]. Nel mitocondrio questa
caratteristica è rappresentata dalle creste mitocondriali formate dalla membrana interna.
-
Presenza di un particolare fosfolipide, la Cardiolipina. Questa molecola è indispensabile per
il corretto funzionamento della catena di trasporto degli elettroni; infatti è una componente
integrale dei Complessi III e IV, è indispensabile al funzionamento della Citocromo
ossidasi, ed è ancorata saldamente al Citocromo c [14].
9
Introduzione
Bioenergetica del SNC: il punto della situazione.
Il SNC è un distretto dell’organismo con un’alta domanda energetica. Infatti, nonostante rappresenti
solo il 2% del peso dell’organismo, consuma il 20% dell’ossigeno e il 25 % del glucosio totali,
circolanti. Facendo un rapporto tra peso e consumo di queste molecole si ottiene che il SNC
contribuisce al metabolismo energetico per il 20%, nonostante la densità mitocondriale di questo
distretto è molto inferiore a quella degli altri organi (es: fegato) [15].
Nell’ultimo decennio diversi gruppi di ricerca hanno provato ad individuare i meccanismi di
approvvigionamento energetico delle cellule nervose. La teroria più accreditata è quella di
Magistretti e Pellerin [16] che individuano nell’astrocita il ponte di collegamento tra cellula nervosa
e glucosio presente nel sangue. In breve, questi studiosi asseriscono che il glucosio, trasportato dal
circola sanguigno al SNC, venga captato dell’astrocita che lo trasforma prima in piruvato e poi in
lattato, effettuando la classica fermentazione lattica. Questo prodotto viene poi passato al neurone
che, tramite i suoi mitocondri, ritrasforma il lattato in piruvato per poi utilizzarlo attraverso il
metabolismo aerobico (Ciclo di Krebs e Catena di trasporto degli elettroni). Se fosse realmente così
bisognerebbe prendere in considerazione due problemi:
1) Il cervello presenta una densità mitocondriale rispetto a quella di qualsiasi altro organo: ad
esempio, la superficie occupata dai mitocondri in 5µm2 di fegato è pari al 20 % della superficie
totale, mentre nel cervello è solo il 6% [15]. Ciò indica che il cervello ha pochissimi mitocondri, ed
inoltre questi mostrano creste meno sviluppate. Questo dato, quindi, non giustificherebbe tutto il
consumo di ossigeno e glucosio che avviene a livello cerebrale. Inoltre, bisogna anche considerare
che i mitocondri non hanno una distribuzione uniforme nel neurone, infatti il corpo cellulare
presenta una densità mitocondriale molto più alta di quella dell’assone, dove i mitocondri sono
molto rari e presenti solo nella zona paranodale.
2) E’ raro che in una cellula si possano accumulare enormi quantità di lattato, sia perché il pH della
cellula scenderebbe al di sotto dei valori compatibili con le attività cellulari, sia perché la lattico
deidrogenasi (l’enzima che è in grado di metabolizzare questo composto) è inattivato da grandi
quantità di substrato.
L’ipotesi.
Assodato che il SNC necessita di grandi quantità di energia per generare e sostenere la
propagazione dell’impulso nervoso, è necessario capire quali strutture possano fornire l’ATP
necessario a questa funzione. Come già accennato il numero di mitocondri presenti nel corpo
10
Introduzione
cellulare del neurone e lungo l’assone non sono sufficienti a soddisfare questo fabbisogno. Quindi è
necessario ricercare alter strutture in grado di supplire all’ATP mancante.
La guaina mielinica è una struttura proteo-lipidica, che avvolgendo l’assone, permette che la
conduzione nervosa avvenga più velocemente e in modo più efficace [17]. Quando però gli assoni
sono colpiti da malattie demielinizzanti, non solo rallentano la loro velocità di conduzione, ma a
lungo andare subiscono un danno molto grave ed irreversibile [18], come nel caso della Sclerosi
Multipla. Perciò se la mielina avesse solo un ruolo di isolante, la sua mancanza dovrebbe
comportare solamente un rallentamento della conduzione nervosa; ma se avesse anche un ruolo di
sostegno energetico, si potrebbe giustificare anche il danno assonale.
Perciò, in questo progetto si ipotizza che la Guaina Mielinica sia sede della respirazione e della
conseguente produzione di ATP, grazie alla presenza dell’intera catena di trasporto degli elettroni e
dell’ATP sintasi, indicando un nuovo ruolo trofico della guaina mielinica.
Va infine sottolineato che negli ultimi anni, la presenza della catena di trasporto degli elettroni e
dell’ATP sintasi in altri distretti cellulari, diversi dai mitocondri, è stata descritta diverse volte [19].
Caratteristiche delle guaina mielinica che supportano l’ipotesi.
Molte caratteristiche della guaina mielinica concordano con i requisiti necessari affinché possa
avvenire la respirazione cellulare:
- Un enorme sviluppo superficiale, considerando che la guaina mielinica si avvolge per più strati
intorno all’assone [1].
- La presenza di alcuni componenti della catena di trasporto e dell’ATP sintasi. Nel 2004, Taylor e
coll. hanno infatti individuate diverse subunità dell’ATP sintasi e dei complessi respiratori nella
guaina mielinica [20], attraverso l’utilizzo della gel elettroforesi bidimensionale. Questi dati sono
stati confermati da un altro gruppo, migliorando la tecnica elettroforetica [21].
- L’impermeabilità ai protoni della guaina mielinica [22], un prerequisito fondamentale per la
formazione del gradiente protonico, e quindi per la produzione di ATP.
- La distribuzione uniforme sulla guaina mielinica di “sub-membrane particles”, strutture visibili
con tecniche di microscopia elettronica e freeze-fracture [23,24]. Queste particelle, che non sono
ancora state identificate, presentano una dimensione di 8 nm, la stessa della porzione dell’F1
dell’ATP sintasi [24,25].
- La presenza delle cardiolipina nei fosfolipidi che compongono la mielina. Normalmente questa
molecola è presente solo nella membrana interna del mitocondrio, in una percentuale che varia dal
10 al 20%, e non fa parte del normale corredo lipidico di altre membrane cellulari. È anche
11
Introduzione
interessante segnalare che anticorpi diretti contro la cardiolipina sono prodotti in pazienti affetti da
Sclerosi Multipla [26,27].
- La presenza di gap junction, composte da connessine (Cx) 32 e 43 [28], che permettono la
diffusione di piccole molecole idrofiliche [29]. Il ruolo di queste strutture non è stato ancora
identificato, nonostante siano coinvolte in diverse patologie del sistema nervoso, come la sindrome
di Charcot-Marie-Tooth. Diversi studi hanno comunque dimostrato che questi canali permettono il
passaggio di molecole contenti adenina; ad esempio, attraverso le Cx 34 l’ATP è trasportato 300
volte meglio di altre molecole idrofiliche [30].
Inoltre, in malattie demielinizzanti, alcuni studi hanno evidenziato che i mitocondri vengono
richiamati nella zona di demienilizzazione, coma a voler supplire una funzione svolta in precedenza
da altre strutture, per mantenere il livello di energia necessario al corretto funzionamento
dell’assone [31].
12
Materiali e Metodi
Materiali e Metodi
Materiali
Il cervello e il fegato bovini provengono da un macello locale, e sono stati prelevati dopo due ore
dalla morte dell’animale.
Per questi studi sono stati usati diversi tipi di anticorpi primari:
- anti Myelin Basic Protein (MBP) (monoclonale, prodotto in ratto, gentile regalo del Prof. A.
Schenone, Università di Genova)
- anti Na+/K+ ATPasi (monoclonale, prodotto in topo, SantaCruz Biotechnology Cat. N°: sc-21712)
- anti Adenosin Nucleotide Traslocasi (ANT) (policlonale, prodotto in coniglio, SantaCruz
- anti subunità alfa e beta dell’F1 dell’ATP sintasi (policlonale, prodotto in coniglio, gentile regalo
del Prof. F. Zanotti, Università di Bari)
- anti Citocromo c (monoclonale, prodotto in topo, SantaCruz Biotechnology Cat. N°: sc-13561)
Biotechnology Cat. N°: sc-11433)
- anti Citocromo c Ossidasi (policlonale, prodotto in capra, SantaCruz Biotechnology Cat. N°: sc23983)
- anti NADH-ubiquinone Ossido-reduttasi 4L (ND4L) (policlonale, prodotto in coniglio, SantaCruz
Biotechnology Cat. N°: sc-20665)
Per quanto riguarda invece gli anticorpi secondari sono stati utlizzati:
- anti IgG di topo, coniugato con perossidasi (Sigma)
-anti IgG di coniglio, coniugato con perossidasi (Sigma)
- anti IgG di capra, coniugato con perossidasi (SantaCruz Biotechnology)
I pesi molecolari delle proteine sono stati stimati con l’utilizzo di Marker di peso molecolare
(Fermentas Life Sciences, Hanover, MD, USA, Cat n° SM#1811).
Tute le operazioni sono state condotte a 4°C.
Isolamento della Mielina da Cervello Bovino
Tutte i passaggi di centrifugazione sono avvenuti utilizzando un rotore Beckman FW-27. I tempi di
centrifugazione riportati si riferiscono al periodo di velocità costante e non includono i periodi di
accelerazione e decelerazione.
Per ottenere una frazione isolata di mielina si è utilizzato il metodo di Norton e Poduslo [32], con
alcune modificazioni. Questo metodo prevede una serie di shock osmotici che devono avvenire in
13
Materiali e Metodi
frazioni, isolate grazie a gradienti di saccarosio. In breve, 7-8 g di cervello bovino sono stati
omogenati utilizzando un Potter teflon/vetro, utilizzando, come tampone di omogeneizzazione, 21
ml di una soluzione composta da 0,32 M Saccarosio e 2mM EGTA, in presenza di inibitori delle
proteasi e ampicillina. L’omogenato è stato poi stratificato su 15 ml di una soluzione 0,85 M
Saccarosio e 2mM EGTA, in presenza di inibitori delle proteasi e ampicillina. In seguito è stato
centrifugato a 75000 g per 30 min. Dopo la centrifugazione tra le due soluzioni di Saccarosio si è
formata una frazione di Mielina, definita cruda, perché ancora non propriamente isolata. Questa
frazione è stata prelevata e risospesa in acqua mQ, e questa sospensione è stata nuovamente
centrifugata a 75000 g per 15 min. Il sovranatante è poi stato scartato il pellet è stato risospeso in
acqua mQ e centrifugato a 12000 g per 10 min. Il sovranatante (che appare lattiginoso) è stato
eliminato e il pellet è stato conservato a –80°C.
Preparazione di Omogenato di Mitocondri Bovini
10 g di fegato bovino sono stati omogenati con il sistema di Potter–Elvehjem, utilizzando 20 ml di
tampone per omogenati (0,25 M Saccarosio, 5 mM HEPES, 1mM EDTA pH 7,2).
Per rimuovere i nuclei dall’omogenato di fegato così ottenuto, si è centrifugato il campione a 500 g
per 10 min, in una centrifuga Haereus. Il sovranatante così ottenuto è stato ricentrifugato a 20000 g
per 20 min e il pellet ottenuto è stato risospeso e conservato a -80°C.
La determinazione della concentrazione proteica dei campioni è avvenuta con Metodo di Bradford,
utilizzando la BSA (Bovine Serum Albumine) per la curva di taratura.
SDS-PAGE e Analisi mediante Western Blot.
L’elettroforesi in presenza di SDS (SDS-PAGE) è stata condotta seguendo il metodo di Laemmli
[33], apportando piccole modificazioni.
L’elettroforesi è stata eseguita con l’apparato Mini Protean III (BioRad), in cui entrambi i lati del
gel sono immersi nel tampone di corsa. Il gel utilizzato per separare le proteine è stato preparato
formando un gradiente compreso tra l’8 e il 16% p/v di Acrilammide; il gel conteneva 0.1% p/v di
SDS e aveva pH 8.8. Al contrario lo Stacking gel aveva una concentrazione al 4,8% di Acrilammide
p/v ed aveva un pH di 6.8.
Per ogni campione caricato nel gel sono stati utilizzati 15 µg di proteine totali.
Inizialmente, per migliorare la risoluzione del Pattern proteico del campione, le varie frazioni di
tessuto nervoso sono state tratta in diversi modi:
14
Materiali e Metodi
-
Semplice aggiunta di Sample Buffer (SB), contenente 40% p/v di Saccarosio, 8% p/v di
SDS, 125 mM Tris-HCl (pH 6.8) e 1.25% v/v di beta-mercaptoetanolo, 0,008% di Blu di
Bromofenolo).
-
Aggiunta di 2% di CHAPS oltre al SB
-
Aggiunta di 2% di SDS oltre al SB
-
Precipitazione delle proteine in Etanolo assoluto, e aggiunta di SB. In breve, 15 µg di
campione sono stati miscelati con 200 µl di Etanolo e lasciati over night a -20°C. Il
campione è stato poi centrifugato a 14000 rpm per 2 minuti ed il pellet ottenuto è stato
risospeso in acqua mQ).
-
Precipitazione delle proteine in 6% di Acido Tricloroacetico (TCA) [34], aggiunta di SB. In
breve, 15 µg di campione sono stati addizionati con 135 µl di TCA al 6%
e, dopo
agitazione, sono stati lasciati 30 sec a -20°C. Il campione è stato poi centrifugato a 14000
rpm per 2 minuti e il pellet ottenuto è stato risospeso in acqua mQ addizionata con Tris HCl
pH8 4mM finale per riportare alla neutralità il pH. Infine è stato aggiunto il SB.
-
Precipitazione delle proteine in 6% di Acido Tricloroacetico (TCA) [34], con aggiunta di SB
contenente DTT al posto del beta-mercaptoetanolo. Dopo la preparazione del campione
descritta nel punto precedente sono stati aggiunti 12 µl di una soluzione contenente: 8% p/v
di SDS, 125 mM Tris-HCl (pH 6.8) e 1.25% v/v di DTT, e dopo15 minuti, il campione è
stato bollito per 5 minuti e sono stati aggiunti 4 µl di una soluzione contenente: 40% p/v di
Saccarosio e 0,008% di Blu di Bromofenolo.
Dopo l’aggiunta delle varie miscele denaturanti i campioni sono stati bolliti per cinque minuti e poi
caricati nel gel. La corsa del gel è avvenuta sempre a 70 mA e a 4°C; la corsa veniva fermata
quando la traccia del Blu di Bromofenolo arrivava al fondo del gel. Il tampone di corsa era
composto da: 0.05 M Tris (pH 8.0); 0.4 M Glicina; 1.8 mM EDTA, e 0.1% SDS.
Per visualizzare il pattern proteico direttamente su gel si è utilizzata la colorazione del Coomassie
Colloidale [35].
I campioni separati per gel elettroforesi sono stati trasferiti su una membrana di nitrocellulosa (NC),
con la tecnica dell’elettroblotting, a 400 mA per 1 ora a 4°C, utilizzando un tampone composto da:
50 mM Tris, 380 mM Glicina e 20% Metanolo. Dopo il trasferimento la nitrocellulosa è stata
colorata con Rosso Ponceau, decolorata con PBS e saturata con latte magro al 5% in PBS, over
night in agitazione. Dopo la saturazione e un breve lavaggio in PBS, la NC è stata incubata con uno
dei diversi anticorpi primari, diluiti in PBS, come descritto nella tabella sottostante (Tabella 1), per
1 h in agitazione. Al termine dell’incubazione, sono stati eseguiti tre lavaggi da 5 minuti ciascuno
15
Materiali e Metodi
con PBSt 0,15%. Dopo la NC è stata incubata con l’anticorpo secondario appropriato, diluito in
PBS, per 1 h a temperatura ambiente in agitazione. Infine la NC è stata lavata nuovamente per tre
volte con PBSt 0.15 e sviluppata con il sistema dell’ECL. Il segnale emesso è stato autoradiografato
utilizzando le lastre Hyperfilm ECL (Amersham Pharmacia Biothech).
Tipo di Anticorpo
Diluizione
Primari
Anti MBP
1:400
Anti Na+/K+ ATPase
1:400
Anti ANT
1:400
Anti subunità alfa e beta dell’F1 dell’ATPsintasi 1:5000
Anti Citocromo c
1:400
Anti Citocromo c Ossidasi
1:200
Anti NADH-ubiquinone Ossido-reduttasi
1:200
Secondari
Anti IgG di topo
1:7500
Anti IgG di coniglio
1:5000
Anti IgG di capra
1:7500
Tabella 1: Elenco degli anticorpi, utilizzati per l’analisi in Western Blot
Analisi Densitometrica del Segnale ottenuto con Western Blot
L’analisi
densitometrica
è
stata
condotta
utilizzando
il
programma
Image
J
31v
(http://rsb.info.nih.gov/ij/). Ogni banda è stata convertita in un segnale densitometrico,
calcolandone l’intensità rispetto allo sfondo. Il segnale della singola banda, ottenuta in WB, è stato
comparato con il segnale ottenuto dall’intero pattern proteico colorato con Coomassie Colloidale
[36].
I
risultati
sono
poi
stati
espressi
come
Densità
Ottiche
Relative
(R.O.D.).
16
Risultati e Discussione
Risultati e Discussione
Scelta del trattamento dei campioni prima dell’SDS-PAGE
Innanzitutto era necessario capire quale metodo fosse più adatto per il trattamento del campione
prima della corsa elettroforetica. In Figura 5 è riportato un gel colorato con Blu di Coomassie
Colloidale, che mostra il pattern proteico dei campioni di omogenato di cervello bovino trattati con
le diverse procedure: lane1, semplice aggiunta di SB; lane 2, aggiunta di 2% di CHAPS e SB; lane
3, aggiunta di 2% di SDS e SB; lane 4, precipitazione delle proteine in 6% di TCA e aggiunta di
SB; lane 5, precipitazione delle proteine in 6% di TCA e aggiunta di SB con DTT; lane 6,
precipitazione delle proteine in Etanolo assoluto, e aggiunta di SB.
1
2
3
4
5
6
Figura 5: Gel colorato in Coomassie Colloidale che mostra il pattern proteico dell’omogenato di cervello bovino
trattato in diversi modi prima della corsa elettroforetica
Questo studio si è reso necessario perché i campioni derivati da tessuto nervoso hanno una
percentuale di lipidi molto alta che disturba la separazione delle proteine durante la corsa
elettroforetica. Come si può osservare dalla Figura 5 i lane migliori appaiono il 4 e il 5 ovvero i
campioni trattati con TCA, tra i due poi il migliore è risultato quello trattato con SB con DTT.
Perciò per il resto delle analisi con WB è stato utilizzato questo trattamento per tutti i campioni.
Caratterizzazione dei campioni
Durante le nostre analisi sono stati utilizzati quattro tipi di campioni: Mitocondri di Fegato Bovino,
Omogenato di Cervello Bovino, Mielina Cruda e Mielina Isolata.
17
Risultati e Discussione
In Figura 6 è riportato il pattern proteico di questi campioni visualizzato su un gel colorato con
Coomassie Colloidale. Lane1, Mitocondri; lane 2, Omogenato di cervello bovino; lane 3, mielina
cruda; lane 4, mielina isolata; lane 5, standard di peso molecolare.
66 kDa
45 kDa
21 kDa
16 kDa
1
2
3
4
5
Figura 6: Pattern proteico dei campioni utilizzati per l’analisi in Western Blot. Osservando i lane 2,3,4 si può
notare che il pattern proteico appare sempre più pulito mano a mano che si isola la mielina.
Per caratterizzare questi campioni si sono eseguiti alcuni WB con proteine marker-specifici per i
diversi tipi di campione, come mostrato in Figura 7 A, B e C.
Per analizzare il grado di purezza delle varie frazioni derivate dal cervello bovino, è stato utilizzato
un anticorpo diretto contro la MBP.
MBP
6
5
20 kDa
18 kDa
Mit
Omog Mielina Mielina
Cervello Cruda Isolata
R.O.D. 4
(Relative
3
Optical
Density) 2
20 kDa
18 kDa
1
0
Mit
Omog
Cervello
Mielina
Cruda
Mielina
Isolata
Figura 7 A: Analisi in WB con Anticorpo anti MBP. L’immagine a sx rappresenta il segnale autoradiografato sulla
lastra. Il grafico a dx mostra l’analisi densitometrica del segnale ottenuto. Queste immagini sono il risultato di 5
esperimenti.
Come si può vedere sia dalla lastra che dall’analisi densitometrica, il segnale è completamente
assente nel lane del mitocondrio, che in questo caso rappresentava il nostro controllo negativo, ed
aumenta progressivamente mano a mano che la mielina viene isolata, fino a raggiungere il massimo
18
Risultati e Discussione
nel lane 4. Questo dimostra che il metodo utilizzato ha permesso effettivamente di arricchire sempre
di più il campione in mielina.
Per analizzare ancora meglio il grado di purezza della frazione di mielina isolata abbiamo testato la
presenza di Na+/K+ ATPasi. Infatti, secondo Norton e Poduslo [32], mano a mano che la mielina
viene isolata, i livelli di questa proteina calano, fino a scomparire del tutto nella frazione pura.
Perciò è stata condotta un’analisi in WB con un anticorpo diretto contro la Na+/K+ ATPasi.
6
Na+/K + ATPasi
5
110 kDa
Mit.
Omog Mielina
Cervello Cruda
Mielina
Isolata
R.O.D. 4
(Relative
3
Optical
Density) 2
Na/K ATP
1
0
Mit
Brain
Homog.
Partial
Isolated
Myelin
Isolated
Myelin
Figura 7 B: Analisi in WB con Anticorpo anti Na+/K+ ATPasi. L’immagine a sx rappresenta il segnale
autoradiografato sulla lastra. Il grafico a dx mostra l’analisi densitometrica del segnale ottenuto. Queste immagini sono
il risultato di 5 esperimenti.
Come si può notare dalla figura 7B il segnale è molto evidente sia nel lane del mitocondri che in
quello dell’omogenato di cervello, mentre comincia a diminuire nella frazione di Mielina Cruda, per
essere completamente assente nella frazione della Mielina Isolata.
La presenza di Na+/K+ ATPasi non indica solo che la mielina che si è ottenuta è scarsamente isolata,
ma è anche indice di presenza di altre membrane derivate dal plasmalemma, di cui questa proteina è
un marker. Perciò il fatto che il campione di Mielina isolata non presenti il segnale in WB, indica
che l’isolamento della frazione è avvenuto correttamente e che non ci sono contaminazioni dovute
ad altre tipi di membrana.
Infine per verificare l’assenza di contaminazioni mitocondriali si sono analizzati i campioni con un
anticorpo anti ANT, un marker tipico dei mitocondri che ha la funzione di trasportare l’ATP,
appena prodotto, fuori dal mitocondrio. Come mostrato nella figura sottostante, il segnale di questa
proteina è presente solo nel lane del mitocondrio, usato come controllo positivo. Per cui, grazie a
questo dato, si può escludere la contaminazione da mitocondri delle frazioni di mielina. È
necessario invece un discorso a parte per quanto riguarda l’omogenato di cervello bovino; infatti, in
questo campione si sarebbe dovuto ottenere un segnale, seppure blando, verso l’ANT, ma
19
Risultati e Discussione
probabilmente questa proteina è così poco rappresentata nel campione che non è stato possibile
rilevarla. Questo risultato ancora una volta conferma il dato che, nel cervello, la popolazione
mitocondriale è piuttosto esigua, nonostante sia un organo ad alta richiesta energetica.
0,9
ANT
0,8
0,7
33 kDa
Mit Omog Mielina
Cervello Cruda
Mielina
Isolata
0,6
R.O.D.
(Relative 0,5
Optical 0,4
Density)
0,3
ANT
0,2
0,1
0
Mit
Omog
Cervello
Mielina
Cruda
Mielina
Isolata
Figura 7 C: Analisi in WB con Anticorpo anti ANT. L’immagine a sx rappresenta il segnale autoradiografato sulla
lastra. Il grafico a dx mostra l’analisi densitometrica del segnale ottenuto. Queste immagini sono il risultato di 5
esperimenti.
Ricerca di alcune proteine dell’ATP sintasi e della Catena di Trasporto degli Elettroni in frazioni
di Mielina.
Dopo aver caratterizzato il campione, si è passati all’analisi, con WB, della presenza di alcune
proteine deputate alla respirazione cellulare. In particolare, l’attenzione è stata focalizzata su quattro
proteine:
1) subunità alfa e beta dell’F1 dell’ATP sintasi
2) Citocromo c (proteina di collegamento tra il complesso 3 il complesso 4)
3) Citocromo c Ossidasi (Complesso 4 della catena respiratoria)
4) NADH-ubiquinone Ossido-reduttasi, ND4L (Complesso 1 della catena respiratoria)
I risultati sono riportati nella Figura 6 A,B,C e D.
Come si noterà non solo tutte e quattro le proteine sono presenti nel lane della frazione di Mielina
Pura (lane 4), ma i segnali ottenuti sono anche più intensi rispetto a quelli dell’omogenato di
cervello e della frazione di Mielina Cruda. Questo non solo conferma i dati dell’analisi in 2DPAGE, ma dimostra che queste proteine non dipendono da una contaminazione mitocondriale del
campione. Infatti, se tutto dipendesse da una banale contaminazione, il segnale dovrebbe diminuire
mano a mano che la mielina viene purificata, proprio perché durante i vari passaggi si eliminano
sempre di più i contaminanti. Al contrario, il segnale riscontrato aumenta sempre di più con
l’isolamento del campione, portando quindi all’ipotesi che queste proteine siano effettivamente
residenti sulla guaina mielinica.
20
Risultati e Discussione
Inoltre, in alcuni casi i segnali riscontrati nel lane della Mielina Isolata hanno un’intensità maggiore
rispetto a quelli del lane dei mitocondri. Ciò dimostra, ancora una volta, che la presenza di queste
proteine non è dovuta ad una contaminazione, ma che potrebbe avere un significato biologico ben
preciso: fornire energia all’assone.
6
A
5
α/β ATP Syntyhase
56.28 kDa
54.55 kDa
Mit
Omog Mielina
Cervello Cruda
R.O.D. 4
(Relative
3
Optical
Density) 2
Mielina
Isolata
a ATPsynth.
b ATPsynth.
1
0
Mit
B
11.7 kDa
Omog Mielina
Cervello Cruda
Mielina
Isolata
2,5
Cytocrhome c
Mit
Omog. Mielina
Cervello Cruda
Mielina
Isolata
2
R.O.D.
(Relative 1,5
Optical
1
Density)
0,5
Cit c
0
Mit
Omog. Mielina
Cervello Cruda
Mielina
Isolata
C
Cytocrhome c Oxidase
14
20 kDa
Mit
Omog Mielina
Cervello Cruda
Mielina
Isolata
12
R.O.D. 10
(Relative 8
Optical
6
Density) 4
Cit c Oxidase
2
0
Mit
Omog Mielina Mielina
Cervello Cruda Isolata
D
ND4L
10
39 kDa
35 kDa
Mit
Omog Mielina
Cervello Cruda
Mielina
Isolata
8
R.O.D.
(Relative
Optical
Density)
6
4
Banda
A (Mw :)
39 kDa
2
Banda
B (Mw :)
35 kDa
0
Mit
Omog Mielina
Cervello Cruda
Mielina
Isolata
Figura 8 (A;B;C;D): : Analisi in WB con Anticorpo anti α/β ATP Synthase, Cytochrome c, Cytochrome c
Oxidase and ND4L. Le immagini a sx rappresentano il segnale autoradiografato sulla lastra. I grafici a dx mostrano
l’analisi
densitometrica
del
segnale
ottenuto.
Queste
immagini
sono
il
risultato
di
5
esperimenti.
21
Conclusioni
Conclusioni
In questo lavoro sono state condotte una serie di analisi tramite Western Blot, per individuare la
presenza di alcune proteine della catena di trasporto degli elettroni in frazioni isolate di mielina.
La presenza delle subunità alfa e beta dell’ATP sintasi, dell’enzima Citocromo c ossidasi, del
Citocromo c e di alcune proteine del complesso NADH-ubiquinone Ossidoreduttasi, suggeriscono
che la mielina possa essere sede di respirazione cellulare.
Inoltre, non solo è stata identificata la presenza di queste proteine nella guaina mielinica, ma il
segnale ottenuto aumenta parallelamente con l’isolamento della mielina, indicando che i segnali
identificati non sono imputabili a contaminazioni mitocondriali del preparato, ma ad una vera
presenza di queste proteine nella guaina. Del resto la contaminazione mitocondriale era già stata
esclusa analizzando il campione con un marker mitocondriale, l’ANT, che risultava del tutto assente
nel campione.
Perciò, considerando che:
1) la densità mitocondriale nel SNC è talmente bassa da non giustificare tutto il consumo di
glucosio ed ossigeno necessario alla produzione di energia
2) in caso di perdita di mielina, nella zona interessata vi è un richiamo di mitocondri, quasi
a voler supplire ad una funzione mancante
si può ipotizzare che la mielina sia sede della respirazione cellulare, per supportare energeticamente
la conduzione nervosa, suggerendo un nuovo ruolo trofico per la guaina mielinica.
22
Progetti Futuri
Progetti Futuri
1) Analisi immunoistochimiche per verificare la localizzazione delle proteine mitocondriali a
livello della guaina mielinica.
2) Imaging con sonde fluorescenti specifiche per proteine mitocondriali, in grado di condurre
una respirazione cellulare (Es: Mitotracker)
3) Dosaggi enzimatici per stimare la sintesi di ATP nella frazione isolata di Mielina
23
Bibliografia
Bibliografia
[1] Guyton A.C. Neuroscienze. Basi di neuroanatomia e neurofisiologia. Cap 3, Ed. Piccin-Nuova
Libraria, 1996.
[2] Kursula P. The current status of structural studies on proteins of the myelin sheath. Int J Mol
Med. 2001;8(5):475-9.
[3] Tzakos AG, Troganis A, Theodorou V, Tselios T, Svarnas C, Matsoukas J, Apostolopoulos V,
Gerothanassis IP. Structure and function of the myelin proteins: current status and perspectives in
relation to multiple sclerosis. Curr Med Chem. 2005;12(13):1569-87.
[4] Finean J.B. Electron Microscopy of the Myelin. Proc R Soc Med. 1961; 54(1): 19–26.
[5] Brunner C, Lassmann H, Waehneldt TV, Matthieu JM, Linington. Differential ultrastructural
localization of myelin basic protein, myelin/oligodendroglial glycoprotein, and 2',3'-cyclic
nucleotide 3'-phosphodiesterase in the CNS of adult rats. J Neurochem. 1989;52(1):296-304.
[6] Linington C, Bradl M, Lassmann H, Brunner C, Vass K. Augmentation of demyelination in rat
acute allergic encephalomyelitis by circulating mouse monoclonal antibodies directed against a
myelin/oligodendrocyte glycoprotein. Am J Pathol. 1988;130(3):443-54.
[7] Johns TG, Bernard CC. The structure and function of myelin oligodendrocyte glycoprotein.
J Neurochem. 1999;72(1):1-9.
[8] Martin R, McFarland HF. Immunological aspects of experimental allergic encephalomyelitis
and multiple sclerosis. Crit Rev Clin Lab Sci. 1995;32(2):121-82.
[9] www.aism.it
[10] Boyer PD. The ATP synthase: a splendid molecular machine. Annu Rev Biochem.
1997;66:717-49.
24
Bibliografia
[11] Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P. Molecular Biology of the Cell 4th
edition. Ed. Francis & Taylor 2002.
[12] Boyer PD, Cross RL, Momsen W. A new concept for energy coupling in oxidative
phosphorylation based on a molecular explanation of the oxygen exchange reactions. Proc Natl
Acad Sci U S A. 1973, 70:2837-39.
[13] Mitchell P. Chemiosmotic coupling in oxidative and photosynthetic phosphorylation. Biol.
Rev. Cambridge Phil Soc 1966; 41: 445-502.
[14] Basova LV, Kurnikov IV, Wang L, Ritov VB, Belikova NA, Vlasova II, Pacheco AA, Winnica
DE, Peterson J, Bayir H, Waldeck DH, Kagan VE. Cardiolipin switch in mitochondria: shutting off
the reduction of cytochrome c and turning on the peroxidase activity. Biochemistry.
2007;20;46(11):3423-34.
[15] Veltri KL, Espiritu M, Singh G. Distinct genomic copy number in mitochondria of different
mammalian organs. J Cell Physiol. 1990;143(1):160-4.
[16] Pellerin L, Magistretti PJ. How to balance the brain energy budget while spending glucose
differently. J. Physiol. 2003, 546:325.
[17] Kursula P. The current status of structural studies on proteins of the myelin sheath. Int J Mol
Med. 2001;8(5):475-9.
[18] Smith KJ. Pathophysiology of multiple sclerosis. Rev Prat. 2006; 56:1299-303.
[19] Chi SL, Pizzo SV. Cell surface F1Fo ATP synthase: a new paradigm? Ann Med.
2006;38(6):429-38.
[20] Taylor CM, Marta CB, Claycomb RJ, Han DK, Rasband MN, Coetzee T, Pfeiffer SE.
Proteomic mapping provides powerful insights into functional myelin biology. PNAS
2004;101;4643-4648.
25
Bibliografia
[21] Vanrobaeys F, Van Coster R, Dhondt G, Devreese B, Van Beeumen J.Profiling of myelin
proteins by 2D-gel electrophoresis and multidimensional liquid chromatography coupled to MALDI
TOF-TOF mass spectrometry. J Proteome Res. 2005 Nov-Dec;4(6):2283-93.
[22] Diaz RS, Monreal J. Unusual Low Proton Permeability of Liposomes Prepared from the
Endogenous Myelin Lipids. Journal of Neurochemistry, 1994; 62:2022:2029.
[23] Martinez AM, Canavarro S. Early myelin breakdown following sural nerve crush: a freeze
fracture study. Braz J Med Biol Res. 2000, 33:1477-82.
[24] da Silva PP, Miller RG. Membrane particles on fracture faces of frozen myelin. Proc Natl Acad
Sci U S A. 1975, 72:4046-50
[25] Gabriel G, Thomas PK, King RH, Stolinski C, Breathnach AS. Freeze-fracture observations on
human peripheral nerve.J Anat. 1986;146:153-66.
[26] Garg N, Weinstock-Guttman B, Bhasi K, Locke J, Ramanathan M. An association between
autoreactive antibodies and anti-interferon-beta antibodies in multiple sclerosis. Mult Scler. 2007
Aug;13(7):895-9.
[27] Roussel V, Yi F, Jauberteau MO, Couderq C, Lacombe C, Michelet V, Gil R, Couratier P,
Vallat JM, Preud'homme JL. Prevalence and clinical significance of anti-phospholipid antibodies in
multiple sclerosis: a study of 89 patients J Autoimmun. 2000 May;14(3):259-65.
[28] White TW, Paul DL. Genetic deases and gene knockouts reveal diverse connexin functions.
Annu Rev Physiol. 1999, 61:283-310.
[29] Balice- Gordon RJ, Bone LJ, Scherer SS Functional gap junctions in the schwann cell myelin
sheath. J Cell Biol. 1998;142(4):1095-104.
[30] Goldberg GS, Moreno AP, Lampe PD. Gap junctions between cell expressing commexin 43 or
32 show inverse permselectivity to adenosine and ATP. J Biol Chem. 2002, 277:36725-30.
26
Bibliografia
[31] Mutsaers SE, Carroll WM.Focal accumulation of intra-axonal mitochondria in demyelination
of the cat optic nerve. Acta Neuropathol. 1998 Aug;96(2):139-43.
[32] Norton WT, Poduslo SE. Myelination in rat brain: method of myelin isolation. J. Neurochem.
1973, 21:749-757.
[33] Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage
T4.Nature. 1970 Aug 15;227(5259):680-5.
[34] Panfoli I, Musante L, Morelli A, Thellung S, Cupello A. Ca(2+)-ATPase pump forms and an
endogenous inhibitor in bovine brain synaptosomes. Neurochem Res. 1997 Mar;22(3):297-304.
[35] Candiano G, Bruschi M, Musante L, Santucci L, Ghiggeri GM, Carnemolla B, Orecchia P,
Zardi L, Righetti PG. Blue silver: a very sensitive colloidal Coomassie G-250 staining for proteome
analysis. Electrophoresis. 2004 May;25(9):1327-33.
[36] Ravera S, Calzia D, Panfoli I, Pepe IM, Morelli A. Simultaneous detection of molecular weight
and activity of adenylate kinases after electrophoretic separation. Electrophoresis. 2007
Feb;28(3):291-300.
27