H•
Legame covalente
1s
un protone e un elettrone
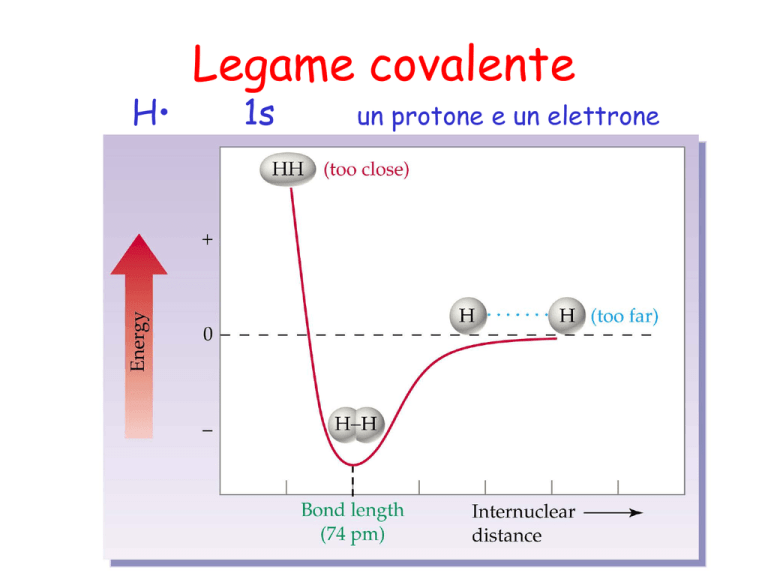
Il legame covalente è formato da una
coppia di elettroni condivisa fra due
atomi.
L’energia richiesta per separare gli
atomi legati è detta
energia di legame.
La localizzazione dei due
elettroni tra i due protoni della
molecola H2 abbassa l’energia
elettrostatica del sistema.
Strutture di Lewis
Gli elettroni del livello energetico principale più esterno
vengono indicati con dei puntini.
Secondo periodo
.
.
.
Li
Be .
B. .
.
.C .
.
.
. N:
.
.
:O:
.
..
:F:
.
..
:Ne:
..
Gli atomi dei non metalli, condividendo elettroni, possono
acquistare una struttura stabile da gas nobile
H
•
•
H••C••H
•
•
H
Intorno ad ogni atomo di
H ci sono 2 elettroni,
intorno al C 8 elettroni.
F
..
: F.
..
.. ..
: F: F:
.. ..
..
:
H:F
..
n. atomico 9
1s22s22p5
Il guscio completo più interno non viene
rappresentato
Nella molecola F2 ogni atomo di fluoro
raggiunge la configurazione elettronica del
gas successivo, Ne, 1s22s22p6.
Nella molecola HF ogni atomo raggiunge
la configurazione elettronica del gas
successivo:
F Ne, 1s22s22p6
H He 1s2.
Una coppia di elettroni condivisa tra due atomi indica
la formazione di un legame covalente
H:H
H H
La coppia di elettroni può anche
essere rappresentata da un trattino.
Una coppia non condivisa (o solitaria), appartenente
interamente ad un atomo, è indicata con una coppia di puntini
sull’atomo.
..
:
H:F
..
Coppie solitarie
Esempi
Esempi
Legami doppi
Legame triplo
La regola dell’ottetto
• Ogni atomo tende a
circondarsi di otto
elettroni con le seguenti
eccezioni.
– Atomi, in alcune molecole,
appartenenti a periodi
successivi al secondo
– Molecole contenenti atomi
elettron deficienti
– Molecole con numero
dispari di elettroni
Ibridi di risonanza
In alcuni casi, la struttura di Lewis non descrive adeguatamente
le proprietà dello ione o della molecola che rappresenta.
..
S
..
S
:O:
..
:O:
:O:
:O
.. :
Sperimentalmente si osserva che i due legami hanno la stessa
lunghezza.
benzene
1. Le forme di risonanza non implicano tipi di
molecole diverse con gli elettroni che oscillano
continuamente tra esse. Esiste un solo tipo di
molecola e la sua struttura è intermedia tra quelle
delle due forme di risonanza.
2. La risonanza si può prevedere quando è possibile
scrivere due o più strutture di Lewis che sono tutte
egualmente plausibili.
3. Le forme di risonanza differiscono solo nella
distribuzione degli elettroni non in quella degli
atomi.
Eccezioni alla regola dell’ottetto: molecole
deficienti di elettroni
Alcune specie non seguono la regola dell’ottetto:
.
.
N
N
.. ..
. N=O :
:O: :O:
:O: :O:
..
..
ossido di azoto
biossido di azoto
NO e NO2 contengono elettroni spaiati e
sono chiamati radicali liberi.
Espansione dell’ottetto
Quella dell'ottetto è comunque una regola che può essere "superata".
Gli elementi del 3° periodo possono formare un numero di legami
superiore a 4 poiché, a differenza degli elementi del 2° periodo, hanno
a disposizione gli orbitali d nei quali possono disaccoppiare elettroni.
Geometria molecolare
Dobbiamo prendere in considerazione gli angoli tra i legami,
gli angoli di legame:
X
Y
X
lineare
angolo XYX = 180°
Y
X
X
piegata
angolo XYX < 180°
Le principali caratteristiche della geometria molecolare
si possono prevedere sulla base di un principio abbastanza
semplice: la
repulsione delle coppie elettroniche.
Teoria VSEPR
(Valence Shell Electron Pair Repulsion theory)
La teoria della repulsione fra coppie elettroniche dello strato di valenza
riesce a prevedere la forma delle molecole poliatomiche.
La disposizione spaziale attorno all’atomo centrale dei legami in una
molecola dipende dal numero totale dei doppietti elettronici nello
strato di valenza, inclusi i doppietti solitari.
Con n atomi X legati all’atomo centrale A con legami singoli e m
doppietti (E) di non legame o solitari abbiamo
n + m doppietti
nello strato di valenza di A.
Se ci sono coppie solitarie :
Ammoniaca, NH3, 3 atomi legati, 1
coppia solitaria, piramide trigonale
Metano: 4 atomi
legati, tetraedrica
Acqua, H2O, 2 atomi
legati, 2 coppie
solitarie, piegata
Gli angoli di legame :
Ammoniaca: angolo HNH 107°
Metano:
angolo HCH
109,5°
Acqua: angolo HOH
105°
La repulsione tra le coppie di legame e le coppie
solitarie :
angolo HCH 109,5°
angolo HOH 105°
angolo HNH 107°
La nube elettronica di una coppa non condivisa è attratta dal
nucleo cui appartiene maggiormente rispetto alle coppie di
legame. La coppia non condivisa occuperà un volume
maggiore di quello di una coppia non legata; le coppie legate
tenderanno ad avvicinarsi riducendo l’angolo di legame.
Le coppie
solitarie:
nella
bipiramide
trigonale
preferiscono
le posizioni
equatoriali
Le coppie solitarie:
nell’ottaedro occupano
posizioni trans
Per ciascun numero di coppie di elettroni da 3 a 6 sono possibili due o più
geometrie molecolari, a seconda del numero dei coppie solitarie
Le specie isoelettroniche hanno la stessa struttura
Consideriamo il composto ClF3:
17Cl
[Ne]3s23p5
9F
[He]2s22p5
Il cloro espande l’ottetto e diventa:
17Cl
[Ne]3s23p43d
Ci sono tre possibili disposizioni delle due coppie solitarie:
La a è favorita
perché massimizza
le distanze tra le
coppie solitarie
Il modello VSEPR si applica bene anche alle molecole
contenenti più di un atomo centrale:
H
C
C
acetilene
H
Ogni atomo di carbonio si
comporta come se fosse
circondato da due coppie di
elettroni !
Ogni atomo di carbonio si
comporta come se fosse
circondato da tre coppie di
elettroni !
H
H
C
C
H
H
etilene
Polarità delle molecole
Le molecola tenute assieme da legami covalenti possono
essere:
• polari, come risultato di una distribuzione asimmetrica di
elettroni. Il legame o la molecola contiene un polo positivo e
uno negativo ed è pertanto un dipolo.
• apolari. Una distribuzione simmetrica di elettroni porta ad
un legame o ad una molecola senza poli negativi e positivi.
Una molecola polare contiene cariche parziali positive e
negative e si orienta in un campo elettrico.
La tendenza di molecole ad orientarsi in un campo elettrico
è una misura del loro momento dipolare.
La geometria molecolare determina la
polarità del legame.
apolari
polari
La freccia è puntata verso la parte negativa del legame polare.
Orbitali atomici e ibridizzazione
Teoria del legame di valenza
Pauling
Un legame covalente consiste in una coppia di elettroni con
spin opposti in un orbitale atomico.
L’atomo di carbonio ha numero atomico 6 e configurazione
elettronica
6C
1s22s22p2
in realtà forma 4 legami uguali !
Teoria del legame di valenza
2 orbitali atomici, contenenti ognuno un elettrone, si sovrappongono
e individuano una regione di spazio fra i 2 nuclei. Si forma
così un orbitale di legame contenente i 2 elettroni a spin
antiparallelo (per il principio di Pauli).
Questa regione è l'area di sovrapposizione. Il legame è
tanto più stabile quanto maggiore è la sovrapposizione fra
gli orbitali atomici.
Il tipo o l'entità della sovrapposizione dipenderà,
ovviamente, dalla forma degli orbitali atomici che possono
interagire; è perciò importante ricordare la forma degli
orbitali di tipo s, dei p, dei d, etc. e la loro simmetria.
Quando la combinazione degli orbitali atomici avviene lungo
un asse, si ha simmetria cilindrica lungo l'asse, sia della
sovrapposizione sia del legame che ne consegue: è un
orbitale σ.
Quando invece avviene lateralmente,
si ha la formazione di un orbitale π.
Teoria del legame di valenza
Fu proposta da Linus Pauling, che vinse il premio Nobel nel 1954, ed usata
ampiamente negli anni 1940-60. Viene ancora utilizzata per descrizioni semplici.
“Gli atomi con elettroni spaiati tendono a combinarsi con altri atomi che pure
hanno elettroni spaiati, in modo che gli elettroni spaiati vengono accoppiati e
tutti gli atomi coinvolti raggiungono una configurazione elettronica stabile
In alcuni casi l’atomo può formare un numero di legami maggiore e ciò avviene
facendo aumentare il numero di elettroni spaiati e quindi il numero di legami che
si possono formare.”
A questi concetti segue l’ibridazione
“L’ibridizzazione si ha quando orbitali atomici, appartenenti allo stesso atomo, si
combinano per produrre nuovi orbitali ibridi, i quali possono sovrapporsi più
efficacemente con orbitali di altri atomi per produrre legami più forti.”
Secondo questa teoria gli orbitali atomici (oppure gli orbitali ibridi)
rimangono tali (atomici) anche quando l’atomo è chimicamente legato in
una molecola.
Ibridizzazione
Dal mescolamento degli orbitali atomici si ottengono gli orbitali ibridi:
un orbitale atomico s + un orbitale atomico p
due orbitali
ibridi sp
un orbitale atomico s + due orbitali atomici p tre orbitali
ibridi sp2
un orbitale atomico s + tre orbitali atomici p quattro orbitali
ibridi sp3
Ibridizzazione
1. In un orbitale ibrido si possono trovare sia le coppie di
elettroni condivise che quelle solitarie.
2. Il numero di orbitali ibridi che si forma è sempre uguale
al numero di orbitali atomici combinati.
3. Le geometrie rispettano la teoria VSEPR.
Legami π
I legami π sono molto importanti per quanto riguarda la struttura spaziale
delle molecole poiché impediscono la rotazione attorno al legame σ, rotazione
che, in loro assenza, è praticamente libera.
Un classico
esempio di
impossibilità di
rotazione è quello
dell'etene (noto
anche come
etilene) H2C=CH2.
Poichè però i π esistono solo se già esiste un σ, la loro presenza darà luogo a
legami totali più forti, e perciò a distanze di legame più corte:
tipo di legame
distanza C-C
orbitali di legame
singolo
1,54 Å
1σ
doppio
1,34 Å
1σ + 1 π
triplo
1,20 Å
1σ+2π
Legami multipli
Le coppie di elettroni extra in un legame multiplo non
sono situate negli orbitali ibridi.
•Tutti i legami singoli sono legami σ.
•In un legame multiplo una delle coppie di elettroni forma un
legame σ, le altre formano legami π.
Legami π
I legami π sono molto importanti per quanto riguarda la struttura spaziale
delle molecole poiché impediscono la rotazione attorno al legame σ, rotazione
che, in loro assenza, è praticamente libera.
Un classico
esempio di
impossibilità di
rotazione è quello
dell'etene (noto
anche come
etilene) H2C=CH2.
Poichè però i π esistono solo se già esiste un σ, la loro presenza darà luogo a
legami totali più forti, e perciò a distanze di legame più corte:
tipo di legame
distanza C-C
orbitali di legame
singolo
1,54 Å
1σ
doppio
1,34 Å
1σ + 1 π
triplo
1,20 Å
1σ+2π
Benzene, C6H6
Ogni atomo di carbonio forma tre legami σ orientati
a 120°, gli altri elettroni formano legami π.
Teoria degli orbitali molecolari
In una molecola si dice che gli elettroni occupano orbitali
molecolari e la funzione d’onda che descrive un orbitale
molecolare può essere ottenuta per:
Combinazione lineare di orbitali atomici (LCAO)
Per due atomi A e B che hanno orbitali atomici descritti
dalle funzioni d’onda ψA e ψB l’orbitale molecolare sarà
ψAB = N(c1 ψA + c2 ψB)
dove N è una costante di normalizzazione scelta in modo
che la probabilità di trovare un elettrone in tutto lo spazio
sia uguale ad 1 e c1 e c2 sono costanti scelte in modo che
ψAB dia il minimo di energia.
Molecola H2
Molecola He2
2 elettroni,
4 elettroni,
σ1s2
σ1s2, σ∗1s2
instabile
Legame ionico
Il legame ionico è il legame che si
instaura tra ioni di carica opposta per
effetto della forza di attrazione
coulombiana.
Il cloruro di sodio
Nel piano
Nello spazio
Ione-ione (Legame ionico)
Interazione elettrostatica
Ogni ione è circondato da ioni di carica
opposta
Onde minimizzare l’energia si realizza
una struttura ordinata detta reticolo
Forma del reticolo
Numero di coordinazione
Il legame a Idrogeno (vedi cap 9)
• Interazione dipolo-dipolo tra molecole contenenti H legato ad
atomi fortemente elettronegativi, F, O, N, Cl. H—X
(X=F,Cl,N,O)
X—H••••X —H
δ+ δ-
• È di natura prevalentemente elettrostatica.
• Sono deboli (20kJ/mol) rispetto ai legami covalenti
(400kJ/mol), ma numerosi ⇒ proprietà dell’acqua e del
legame di catene polipeptidiche nelle proteine.
Ghiaccio e Acqua
• Esistono 9 modificazioni strutturali del
ghiaccio. Quella in equilibrio con l’acqua a
0°C e 1 atm è detta GHIACCIO I:
Normalmente la polarità ha un effetto relativamente piccolo
sul punto di ebollizione.
Quando sono presenti i legami a idrogeno la polarità ha un
effetto di gran lunga maggiore.
L’acido fluoridrico HF, pur avendo una massa molare
piccola (20g/mol), ha il punto di ebollizione più alto di tutti
gli alogeni.
Diagramma delle fasi dell’acqua
Legame di coordinazione o dativo
Quando l'ammoniaca reagisce con un protone si forma lo ione ammonio a
struttura tetraedrica. Il protone presenta un orbitale vuoto, mentre l'ammoniaca
dispone di una coppia di elettroni solitaria. Si può pensare che l'ammoniaca metta
in conpartecipazione con il protone tale doppietto elettronico con la formazione di
un legame covalente dativo.
Una volta che si é formato, non sarà più
possibile distinguere il legame dativo dagli altri, in quanto la carica positiva risulta
equamente delocalizzata nell'intera molecola.
Nel caso in cui la coppia di elettroni comuni è data per intero
da uno solo degli atomi partecipanti al legame, mentre l'altro
mette a disposizione un orbitale vuoto si forma un legame
covalente dativo, o di coordinazione.












