LA TAVOLA PERIODICA
Isaac Asimov racconta nel suo libro “Breve
storia della Chimica” che nel 1830 si
conoscevano già 55 elementi. Il numero
cominciò a sembrare troppo elevato ai
chimici,
dato
estremamente
che
gli
diversi
elementi
ed
essi
erano
non
riuscivano a dare loro un ordine. Il primo a
tentare l’impresa fu il chimico tedesco
Dobereiner con la “teoria delle triadi” :
gruppi
di
tre
elementi
ciascuno
differiscono tra loro per la massa atomica
crescente e dimostrano un comportamento
chimico molto simile. Ma la massa atomica
nella prima metà del XIX secolo non era
presa molto in considerazione, dunque
queste osservazioni non impressionarono i
chimici.
Altri
scienziati
tentarono
con
altre
classificazioni, come quella a spirale : lungo
i raggi della spirale venivano a trovarsi
elementi che differivano tra loro per dieci
unità di massa atomica.
Ma il passo più
significativo verso una
classificazione sistematica venne compiuto
dal
chimico
russo
Dmitrij
Ivanovich
Mendeleev. Egli notò che certi gruppi di
elementi avevano proprietà simili e se essi
venivano
elencati
in
ordine
di
massa
relativa, le proprietà si ripetevano secondo
un ordine regolare. Ciò venne espresso
sinteticamente dal chimico con la legge
periodica:
Quando
gli
elementi
sono
sistemati in ordine di massa relativa
crescente,
alcune
loro
proprietà
si
ripetono periodicamente. Così predispose
un Sistema Periodico in cui le masse
relative aumentavano da sinistra verso
destra e gli elementi con le stesse
proprietà
erano
allineati
nelle
stesse
colonne verticali. Osservando il Sistema
Periodico del chimico nella sua stesura
originale (come comparve su una rivista
tedesca) noteremo che sono stati lasciati
alcuni spazi vuoti. Ciò è stato fatto per
salvaguardare
relative
il
principio
crescenti
e
delle
delle
masse
analoghe
proprietà chimiche degli elementi presenti
in una colonna. Infatti, in base alla
posizione di queste lacune, egli fu in grado
di avanzare valide ipotesi sulle proprietà
chimiche di elementi ancora sconosciuti,
che poi furono confermate al momento
della scoperta. Ad esempio egli aveva
previsto l’esistenza dell’ eka-silicio, che
avrebbe dovuto essere collocato al di sotto
del silicio. Nel 1886 l’eka- silicio fu
scoperto dal chimico tedesco Clemens
Wlinker.
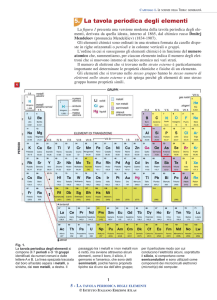
Il
sistema
periodico
degli
elementi,
classico e più completo, tratto dal Sistema
Periodico
di
Mendeleev
presenta
una
suddivisione in periodi e gruppi.
I periodi, da 1 a 7, sono le righe orizzontali
in cui gli elementi si susseguono per
numero atomico crescente (ogni elemento
ha nel suo nucleo un protone in più
dell’elemento che lo precede).
-Il periodo 1: comprende 2 elementi. Il
primo livello energetico (n=1) è saturo con
2 elettroni.
-Il periodo 2: comprende 8 elementi. Il
secondo livello energetico (n=2) è saturo
con 8 elettroni
-Il periodo 3: comprende anch’esso 8
elementi. Il terzo livello energetico (n=3) è
saturo con 8 elettroni
-Il periodo 4 : (n=4) costituisce il primo
grande periodo, completo con 18 elementi,
ma fra essi vi sono 10 elementi chiamati
elementi di transizione che vanno da Sc a
Zn .
-Il periodo 5: (n=5) o secondo grande
periodo, è formato da 18 elementi con 10
elementi di transizione che vanno da Y a Cd
.
-Il
periodo
6: (n=6) o terzo grande
periodo comprende 32 elementi con 10
elementi di transizione che vanno da La a
Hg. Si può notare che sono stati isolati 14
elementi, i Lantànidi, che vengono elencati
fuori dalla Tavola e che formano un’
ulteriore serie di transizione.
-Il periodo 7: (n=7) o
quarto grande
periodo è incompleto perché manca di 14
elementi che formano una seconda serie di
transizione, chiamata degli Attìnidi.
I gruppi, dal I a all’ VIII, sono le colonne
verticali. In ogni colonna sono collocati
elementi con analoghe proprietà chimiche
ad esempio lo stesso numero di elettroni
sul livello più esterno, cioè gli elettroni di
valenza. essi sono importanti perché sono
coinvolti
chimici .
nella
formazione
dei
legami
Nella configurazione elettronica del silicio,
ad
esempio,
sono
presenti
quattro
elettroni di valenza.
Si
1s2 2s2 2p6 3s2 3p2
Elettroni di valenza
Ai gruppi è stata assegnata una doppia
numerazione :
-in numeri arabi, da 1 a 18, suggerita dalla
IUPAC.
-in
numeri
romani,
divisa
in
due
sottogruppi A e B.
-I gruppi A sono 8 e si riferiscono agli
elementi che nel loro assetto elettronico
completano i sottolivelli s e p.
-I gruppi B sono 10 e si riferiscono agli
elementi che nel loro assetto elettronico
completano i livelli d e f.
Gli elementi del gruppo 1A sono chiamati
metalli alcalini e sono molto reattivi.
Gli elementi del gruppo 2A sono chiamati
metalli alcalino-terrosi sono reattivi ma
non tanto quanto i metalli alcalini.
Gli elementi del gruppo 7A sono chiamati
alogeni e sono non metalli molto reattivi.
Gli elementi del gruppo 8A sono chiamati
gas nobili. Con la scoperta dei gas nobili (
He, Ne, Ar, Kr, Xe, Rn ) si dovette creare
un nuovo gruppo che venne chiamato VIII
gruppo. Tutti i gas nobili con l’eccezione
dell’elio possiedono 8 elettroni di valenza
e, quindi, livelli esterni completi per questo
motivo hanno una reattività molto bassa.
Gli
elementi
all’
interno
della
Tavola
Periodica sono divisi in metalli e non
metalli da una linea a “zig zag”, che va dal
boro all’ astato.
- I metalli: occupano il lato sinistro della
tavola periodica e hanno proprietà
simili: sono buoni conduttori di calore
ed elettricità, sono malleabili, duttili e
tendono a perdere elettroni quando
sono coinvolti in una reazione chimica.
-I non metalli: occupano la parte in
alto a destra della tavola periodica.
Le loro proprietà sono diverse : alcuni
sono solidi a temperatura ambiente,
altri sono gassosi. Complessivamente,
comunque, tendono ad essere cattivi
conduttori di calore ed elettricità e
tendono a prendere elettroni nelle
reazioni chimiche.
Gli elementi lungo la line a “zig zag”
sono
detti
semimetalli
perché
possiedono proprietà intermedie. Sono
detti anche semiconduttori perché la
loro conducibilità elettrica può essere
modificata e controllata.
La tavola periodica indica, di ogni
elemento, il simbolo chimico, il nome, il
numero
atomico,
l’elettronegatività…
numero
di
massa,
Il numero atomico: è il numero di
protoni nel nucleo di un atomo e il suo
simbolo è Z.
Il simbolo chimico: è un’abbreviazione
di una o due lettere e che compare nella
tavola sotto il suo numero atomico.
Il numero di massa: è il numero totale
di protoni Z e di neutroni N presenti
nel nucleo di un atomo. A= Z+N