A cura di:
Marco Guzzo, U.O. Otorinolaringoiatria , INT Milano
Andrea Ferrari, U.O. Pediatria, INT Milano
Lorenza Gandola, Dip. di Radioterapia, INT Milano
Referenti:
Marco Guzzo
Tel: 02-23902155
E-mail: [email protected]
Andrea Ferrari
Tel: 02-23902588
E-mail: [email protected]
Versione 1.0 Marzo 2008
TREP – Tumori epiteliali delle ghiandole salivari
Indice
1.0
Generalità
p. 1
1.1
Casistica retrospettiva: esperienza INT Milano 1975-2004
p. 7
2.0
Benigni
p. 8
3.0
Maligni
p. 8
4.0
Linee guida
p. 10
4.1
Campo di applicazione
p. 10
4.2
Classificazione
p. 10
4.3
Stadiazione delle neoplasie epiteliali maligne
p. 10
4.4
Criteri per la diagnosi
p. 10
4.5
Terapia
p. 11
5.0
Follow-up
p. 16
Appendice A
p. 17
Classificazione TNM-UICC Sesta Edizione 2002
Appendice B
p. 19
Classificazione dei tumori epiteliali delle ghiandole salivari
Appendice C
p. 21
Grading
Appendice D
p. 23
Esame macroscopico e campionamento
Appendice E
p. 24
Centralizzazione
6.0
Bibliografia
p. 29
TREP – Tumori epiteliali delle ghiandole salivari
TUMORI EPITELIALI DELLE GHIANDOLE SALIVARI
1.0 GENERALITA’
Lesioni infiammatorie e cisti benigne costituiscono la maggior parte delle
cause di ingrandimento delle ghiandole salivari in età pediatrica.
I tumori pediatrici delle ghiandole salivari sono suddivisi in 2 categorie:
Tumori degli ‘infants’ (fino a 12 mesi di età)
Tumori delle altre fasce di età pediatriche
Tabella 1. I tumori delle ghiandole salivari in età pediatrica.
FASCIA DI ETA’
INFANTS
Spesso tumori
congeniti
-Lesioni vascolari benigne (emangioma,
linfangioma)
Entità morfologiche -Tumori epiteliali della parotide, delle
particolari
ghiandole salivari minori intraorali e
della rinofaringe
-Sialoblastoma
-‘Salivary gland anlage tumor’ di Dehner
ALTRE FASCE DI
Stesse lesioni
ETA’ PEDIATRICHE dell’adulto ma con
-Carcinoma mucoepidermoide, di solito
a basso grado, della parotide e della
differente
ghiandola
sottomandibolare
predominanza di
carcinoma più frequente)
tipi istologici
-Carcinoma adenoide-cistico
Più spesso nella
-Carcinoma a cellule acinari
parotide
-Carcinoma duttale
(è
il
-Adenoma polimorfo
-Carcinoma
ex-adenoma
polimorfo
(estremamente raro)
I tumori epiteliali delle ghiandole salivari sono complessivamente una
patologia poco frequente. Essi rappresentano meno del 3% di tutti i tumori
della testa e collo. Meno del 5% di questi si presentano in pazienti sotto il
diciottesimo anno d’età. La rarità di questa patologia è ben dimostrata dalle
casistiche riportate in letteratura.
1
TREP – Tumori epiteliali delle ghiandole salivari
La distribuzione numerica delle neoplasie maligne e benigne sembrerebbe
mostrare un progressivo aumento proporzionale all’età (1), in particolare,
tutte le serie presentano una concentrazione dei casi oltre i 10 anni.
Eccezionale la presenza già alla nascita (1,2, 3)
Complessivamente sembra esserci una modesta predilezione per il genere
femminile.
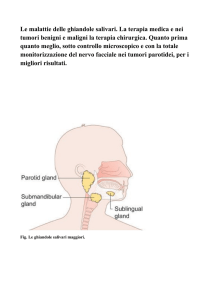
Le ghiandole salivari maggiori sono interessate nella quasi totalità dei casi
ed
in
particolare
la
parotide
costituisce
la
sede
più
tipica
(81%)
conservando rapporti di sicura preminenza (fino a 1:10) anche con la
ghiandola sottomandibolare, che rappresenta la seconda sede in ordine di
frequenza.
Tabella 2. Neoplasie epiteliali ghiandole salivari. Revisione della
letteratura casistiche pediatriche. (Pubblicazioni 1985-2004)
Autori
anni
n. casi casi/anno Maligni
Benigni
Lach EE (1988) (3)
1928-1986
25
0.4
15
10 (40%)
Callender DL (1992) (4)
1944-1987
29
0.7
21
8 (27%)
De Cassia Braga Ribeiro K 1953-1997
38
0.9
27
11 (29%)
(2002) (5)
Shikhani AH (1988) (6)
1955-1985
21
0.7
3
18 (86%)
Baker SH (1985) (7)
1956-1981
13
0.5
13
No dati
Fonseca I (1991) (2)
1959-1989
24
0.8
7
17 (71%)
Orvidas LJ (2000) (8)
1970-1997
43
1.6
16
27 (63%)
Rogers DA (1994) (9)
1973-1992
8
0.4
8
No dati
Ethunandan M (2002) (10)
1974-1999
12
0.5
3
9 (60%)
Kessler A (1994) (11)
1982-1991
15
1.6
8
7 (46%)
Serie INT
1975-2004
52
1.8
15
37 (71%)
Total
280
136(48. 144
6%)
(51.4%)
I dati raccolti mostrano globalmente che la prevalenza mediana delle
neoplasie maligne è del 48.6 %. Ciò appare sensibilmente maggiore a quella
osservata
negli
adulti
(36.8
%)
(19).
Nella
ghiandola
parotide
la
distribuzione degli istotipi benigni e maligni appare praticamente uniforme,
(1,2,4,).
2
TREP – Tumori epiteliali delle ghiandole salivari
Per quanto riguarda la ghiandola sottomandibolare i risultati sono meno
concordanti ma indicano complessivamente una netta prevalenza degli
istotipi benigni.
Nell’adulto la situazione è assai differente, infatti, nella parotide il rapporto
benigni:maligni è di 4:1 mentre nella ghiandola sottomandibolare il rapporto
scende ad 1:1.
Nei bambini sono stati descritti molti degli istotipi presenti nell’ adulto,
tuttavia tra i benigni prevale senza confronti l’adenoma polimorfo (cd.
tumore misto) che in molte serie è l’unico rappresentato (prevalenza
mediana oltre il 70%).
Il più comune tra i maligni è il carcinoma mucoepidermoide (MEC) con
prevalenza dal 50 fino al 100% , seguito a distanza dal carcinoma adenoidocistico e dal carcinoma a cellule aciniche.
In tutte
le
serie
esaminate
il MEC di grado
basso
o intermedio,
complessivamente considerato, raggiunge la quasi totalità dei casi (1-3,5,79). Ciò appare in netto contrasto con l’adulto in cui gli alti gradi
rappresentano
il
44%
dei
MEC
nella
parotide
ed
il
75%
nella
sottomandibolare (12)
3
TREP – Tumori epiteliali delle ghiandole salivari
Tabella
3.
Neoplasie
epiteliali
ghiandole
salivari
casistiche
pediatriche. Distribuzione per sede ed Istotipo °*
Autori
PAROTIDE SMG
n. casi
Ben
Mal
°
*
ALTRO
Ben
Mal
Ben
Mal
2
Lach EE (1988) (3)
25
5
13
4
-
1
Callender DL (1992) (4)
29
6
18
1
3
1
De Cassia Braga Ribeiro K 38
4
20
5
2
2
5
2
1
(2002) (5)
Shikhani AH (1988) (6)
21
14
2
4
1
Baker SH (1985) (7)
13
-
12
-
1
Fonseca I (1991) (2)
24
12
6
3
Rogers DA (1994) (9)
8
-
7
-
1
Orvidas LJ (2000) (8)
43
27
16
ND
ND
ND
ND
Ethunandan M (2002) (10)
12
9
3
ND
ND
ND
ND
Kessler A (1994) (11)
15
6
6
1
2
Series INT (1975-2004)
52
32
9
4
1
1
5
Total
280
115
112
22
11
7
13
PAROTIDE
227 (81%)
51% 49%
SMG
33 (12%)
ALTRO
20
Legenda:
°B:
istotipi
benigni;
*M:
67% 33%
istotipi
maligni;
SMG:
gh.
Sottomandibolare; ND: no dati, solo tumori a sede parotidea.
Autori
n.
PAROTIDE SM
ALTRA
SEDE
casi
Shikhani
AH
(1988) 262/4
(6)
B°
M*
B
M
111
128
21
2
-
-
35**
Rev. English literature
before 1988
PAROTIDE
239
46% 54%
(91%)
SMG
23
91% 9%
4
TREP – Tumori epiteliali delle ghiandole salivari
Legenda: **: 262 casi.con dati disponibili relativi alla sede. 435 neoplasie
epiteliali B+M; B°: istotitpi benigni; M*: istotipi maligni; SMG: gh.
sottomandibolare
Appena un cenno meritano le eccezionali localizzazioni alle ghiandole
sottolinguali e salivari minori. Relativamente a queste ultime, la sede più
frequente appare il palato duro, ma i numeri troppo limitati ed i dati
contrastanti, non permettono di formulare ipotesi relativamente alla
distribuzione dei diversi istotipi.
La chirurgia esclusiva si conferma il trattamento di scelta in tutte le
casistiche esaminate
La letteratura appare concorde nell’indicare la parotidectomia superficiale
come il “minimo” trattamento sia per le neoplasie benigne sia per le
maligne. Resezioni limitate sono coralmente scoraggiate.
I dati di Shikhani (6), riportano per i tumori benigni (92% adenoma
polimorfo)
percentuali
di
recidive
locali
del
39.5%
e
19.5%,
rispettivamente, dopo resezioni limitate o parotidectomia superficiale.
Risultati simili anche nel trattamento delle neoplasie maligne (94% MEC)
dove per le due tecniche si osservano rispettivamente recidive nel 48.3% vs
30.7%.
Risultati non diversi riferiscono de Cassia Braga Ribeiro (5) ed Orvidas (8)
dopo trattamenti ottimali, rispettivamente 18.2% e 14.8% le recidive nei
tumori benigni e 25.9% e 37.5% nei maligni.
Questi dati sono simili a quelli osservati nell’adulto. Anche in una nostra
(12) recente revisione dei MEC delle ghiandole salivari maggiori, con
casistica comprendente tutte le età, le recidive locali dopo trattamento
ottimale sono state del 28%.
Il trattamento delle aree linfatiche nelle neoplasie maligne è riservato ai casi
con metastasi clinicamente evidenti (4, 5, 11).
In tutte le neoplasie originate dalla ghiandola sottomandibolare è indicato lo
svuotamento completo della loggia sottomandibolare (11, 13)
La rarità di questi tumori rende molto difficile la raccolta di dati relativi ai
risultati clinici. La sopravvivenza osservata a 5 anni varia dall’ 81.6%, (5) al
90%, (4) fino a raggiungere il 100% nella serie di Ethunandan (10) ed in
quella di Kessler (11) a 2 anni. Solo nella serie di Baker (7), in cui erano
presenti solo 3/13 (23%) MEC la sopravvivenza dopo un follow up di oltre
5
TREP – Tumori epiteliali delle ghiandole salivari
10 anni è solo del 50%. E’ possibile ipotizzare che la prognosi buona,
generalmente riferita, sia probabilmente legata al basso numero di tumori
ad alto grado presenti nel bambino. I nostri dati, coerenti con altri (5,8)
suggeriscono che questi carcinomi presentano lo stesso decorso clinico
manifestato negli adulti.
Infatti, nostri dati precedentemente pubblicati e riferiti a casistica mista
(prevalenza adulti)
(12)
riportano
per i MEC a basso
grado, una
sopravvivenza libera da malattia dopo 5 anni del 97% che ben corrisponde
a quella riferita nei bambini.
La morbilità post-chirugica appare ancora più difficile da definire. Orvidas
(8) riferisce deficit del nervo facciale nel 9.5% dei casi, e la comparsa di S
di Frey nel 47%. Ethunandan (10), riporta, invece, deficit e sindrome
nell’8.3% dei casi. In circa la metà (10/21) dei casi di Callander (4) è stata
necessaria la sezione di uno o più rami del nervo facciale. Questi dati e la
nostra esperienza (14% di lesioni, parziali o globali, del nervo facciale)
sembrano confermare un maggiore rischio di morbilità del VII nc nel
bambino rispetto all’adulto. Essendo basso nei bambini il numero di tumori
ad alto grado sembra giustificato affermare che la lesione del nervo durante
l’intervento chirurgico nei giovani pazienti, è più probabile.
L’utilizzo della radioterapia post-operatoria per una neoplasia maligna delle
ghiandole salivari insorta in età pediatrica deve essere riservato a casi
selezionati anche in considerazione delle possibili sequele correlate a questa
modalità terapeutica. Trisma, carie dentali, sviluppo asimmetrico dello
scheletro facciale e osteoradionecrosi rappresentano i più probabili effetti
tardivi da radioterapia in questo sottogruppo di pazienti e la loro comparsa
è stata riportata, in alcune casistiche, anche nel 50% dei bambini irradiati
(4). In generale, la radioterapia post-operatoria è indicata in caso di
neoplasia ad alto grado di malignità, in presenza di residuo post-chirurgico
micro
o
macroscopico,
estensione
nei
tessuti
extraghiandolari,
coinvolgimento dei linfonodi cervicali o ricaduta locale (20).
6
TREP – Tumori epiteliali delle ghiandole salivari
1.1 CASISTICA RETROSPETTIVA: ESPERIENZA INT Milano
1975-2004
Si tratta di 52 pazienti, 25 femmine e 27 maschi con età mediana di 15 anni
(range 4-18 anni). Il 73% (38/52) ha un’ età maggiore o uguale a 10 con
una distribuzione molto simile nei due generi.
Nella quasi totalità dei casi (90%) la malattia si è presentata come
tumefazione non dolente di pertinenza ghiandolare.
La durata mediana dei sintomi è stata di 12mesi (range 1-70) sia per i
maligni che per i benigni.
Le ghiandole salivari maggiori rappresentano complessivamente la sede di
insorgenza nel 92% dei casi. In particolare la parotide in 41casi (79%), la
ghiandola sottomandibolare in 5 (9.6%); seguono, palato molle-duro e
ghiandola sottolinguale con 4 e 2 casi rispettivamente. La distribuzione per
sede è mostrata in tabella 4.
Tabella 4. Sede di insorgenza
Sede
MALIGNI
BENIGNI
Parotide
9 (60%)
32 (86%)
Gh. Sottomandibolare 1
4
Gh. Sottolinguale
2
-
Palato molle-duro
3
1
Totale
15
37
La distribuzione delle sedi di insorgenza appare sovrapponibile nei due
generi.
Gli istotipi osservati sono riportati in tabella 5.
Tabella 5. Istotipo. Intera serie 52 casi
Istotipo
n.casi
%
Localizzazione (%)
Parotide
SM
SL
altro
Adenoma polimorfo
37
71.2
32
4
-
1
Ca Cell. Aciniche
2
3.8
-
1
1
-
Ca Adenoido-cistico
1
1.9
1
-
-
-
Ca Mucoepidermoide
12
23.1
8
-
1
3
Totale
52
100
41 (79)
5 (9.6)
2 (3.8)
4 (7.6)
7
TREP – Tumori epiteliali delle ghiandole salivari
2.0 BENIGNI
L’adenoma polimorfo rappresenta l’unico istotipo benigno identificato (37
casi).
Le dimensioni mediane all’esordio erano di 2 cm (range 1-4 cm ).
Tutti i pazienti sono stati sottoposti a chirurgia. Cinque di 37 ebbero il loro
primo trattamento in altra istituzione.
La tabella 6 mostra gli interventi eseguiti come primo trattamento ed il
numero di recidive osservato per ciascuno suddivisi per istotipo.
Sette di 37 pazienti hanno sviluppato una recidiva locale dopo un intervallo
mediano di 31 mesi. Le recidive dopo parotidectomia si osservarono nel 4.5
% dei casi mentre dopo enucleazione nel 50%. Le dimensioni dei tumori
recidivati erano comprese tra 2 e 3 cm. Tutte le recidive sono state
rioperate.
Quattro
di
7
pazienti
hanno
sviluppato
una
seconda
recidiva
e
conseguentemente sono stati nuovamente operati, ma 2/4 non sono mai
stati resi liberi da malattia.
Globalmente, 35/37 pazienti con neoplasia benigna sono vivi e liberi da
malattia al momento della revisione dopo un intervallo mediano di 58 mesi,
mentre 2 erano vivi con malattia.
3.0 MALIGNI
Il MEC è stato diagnosticato in 12/15 casi ( 80%). Nove di questi erano a
basso grado di malignità (83%). Due casi di tumore a cellule aciniche ed un
caso di ACC.
I dati relativi alla categoria di T ed N sono disponibili in 13 delle 15
neoplasie maligne. Nessun paziente presentava adenopatie clinicamente
apprezzabili alla prima diagnosi. Si trattava di quattro T1, cinque T2, tre
T4a ed un T3.
La tabella 6 mostra gli interventi eseguiti come primo trattamento ed il
numero di recidive osservato per ciascuno suddivisi per istotipo.
Sette casi ebbero il loro primo intervento in altra istituzione.
Il trattamento di N (svuotamento livelli I a III) è stato eseguito
contemporaneamente all’intervento su T in 2/9 neoplasie maligne a sede
parotidea. L’indagine istologica ha dimostrato, in entrambi i casi, assenza di
metastasi linfonodali. Due pazienti sono stati sottoposti a RT post-
8
TREP – Tumori epiteliali delle ghiandole salivari
operatoria, entrambi per neoplasia maligna a sede parotidea: un caso era
un MEC T3 (grado intermedio), l’altro un ACC T4a.
Tabella 6. Interventi chirurgici per istotipo e Recidive. Intera serie,
52 casi.
Tipo intervento
T. maligni Recidive (%) T. benigni Recidive (%)
Parotidectomia (sup-tot)
8
Parotidectomia allargata
1
Enucleazione
2 (25)
22
1 (4.5)
4
1 (25)
10
5 (50)
Scialoadenectomia SM
-
-
4
-
Exeresi
1
-
1
1 (100)
Demolizioni palato
1
-
-
-
Totale
15
3 (20)
37
7 (19)
Dopo un follow-up mediano di 21 mesi 3 pazienti presentarono una recidiva.
Si trattava, alla diagnosi, di un MEC a basso grado T1N0, un MEC basso
grado T2N0 ed un carcinoma a cellule aciniche T4aN0. Il primo caso ebbe
una recidiva locale, il secondo linfonodale mentre il terzo ebbe un ripresa
locale con metastasi a distanza (polmone). I pazienti con recidiva locale e
linfonodale
furono
rioperati
e
risultarono
vivi
e
liberi
da
malattia
rispettivamente dopo 10 e 90 mesi dalla recidiva.
Il paziente portatore di carcinoma a cellule aciniche è deceduto per
metastasi polmonari. Globalmente, 14 su 15 pazienti con tumore maligno
risultano vivi e liberi da malattia dopo un follow-up mediano di 71 mesi.
RISULTATI FUNZIONALI
I risultati funzionali dopo chirurgia parotidea sono disponibili in 36/41
pazienti: 5 (14%) hanno presentato un deficit permanente del nervo
facciale (parziale o totale) e 7/36 (19.4%) soffrivano di Sindrome di Frey
(arrossamento
e
sudorazione
locale
della
cute
parotidea
durante
l’alimentazione).
9
TREP – Tumori epiteliali delle ghiandole salivari
4.0 LINEE GUIDA
4.1 Campo di applicazione
Le raccomandazioni qui riportate si riferiscono alle neoplasie epiteliali
maligne e benigne delle ghiandole salivari diagnosticate in soggetti con età
inferiore ad anni 18 compresi.
4.2 Classificazione
La tipizzazione istologica ed il grading dei tumori epiteliali delle ghiandole
salivari è riportata in appendice B e C.
4.3 Stadiazione delle neoplasie epiteliali maligne
La classificazione suggerita è quella TNM UICC 2002 Sesta Edizione solo per
i tumori delle ghiandole salivari maggiori (parotide, sottomandibolare,
sottolinguale).
I
tumori
che
derivano
dalle
ghiandole
salivari
minori
(ghiandole
mucosecernenti delle vie aerodigestive superiori) non sono incluse in questa
classificazione, bensì nelle loro sedi di origine anatomica, per esempio il
labbro.
(n.d.r. La classificazione AJCC Sesta edizione 2002 appare sovrapponibile
per tutte le categorie.)
Le procedure per stabilire la definizione delle categorie T,N ed M sono
l’esame clinico e la diagnostica per immagini. (appendice A)
4.4 Criteri per la diagnosi
•
Ghiandole salivari maggiori
Ogni tumefazione ad insorgenza nella regione delle ghiandole
salivari
maggiori
deve
essere
indagata
con
ecografia
ed
eventualmente con RMN.
La RMN è indispensabile soprattutto in quei casi in cui la localizzazione
appare critica per la pianificazione chirurgica (es. lobo profondo parotideo,
tumori extraghiandolari, invasione dell’osso e dei tessuti molli) o per
differenziare/confermare le forme di natura vascolare (le più frequenti nei
bambini) o flogistica (linfonodale).
10
TREP – Tumori epiteliali delle ghiandole salivari
La biopsia incisionale od escissionale deve essere evitata in ragione
del
rischio
consistente
di
disseminazione
locale,
anche
nelle
neoplasie benigne (adenoma polimorfo).
Per
la
rarità
delle
neoplasie
di
pertinenza
ghiandolare
in
sede
sottomandibolare si raccomanda l’esclusione di ogni altra possibile diagnosi
prima di procedere all’intervento chirurgico.
•
Ghiandole salivari minori
Generalmente accessibili per una facile biopsia con oncotomo.
TC/RM utile per la pianificazione chirurgica.
AGOASPIRATO CON AGO SOTTILE (FNAB, 22 gauge)
Non è necessario per le tumefazioni parotidee. Una volta accertata la
natura non vascolare della neoplasia (spesso sufficiente l’imaging) la
citologica non modifica l’approccio terapeutico che rimane la parotidectomia
(spesso superficiale. Vedi oltre) per qualunque istotipo.
FNAB può essere indicata in quei casi in cui l’imaging esprime incertezze
diagnostiche relative a natura o sede della neoplasia.
Utile
nelle
tumefazioni
sottomandibolari
e
sottolinguali
per
differenziare le rarissime neoplasie di origine salivare da altre più
comuni patologie (linfoadenopatie etc).
Nelle sospette lesioni delle ghiandole salivari minori è meglio
prediligere la biopsia con oncotomo.
4.5 Terapia
La terapia delle neoplasie di origine salivare è sempre chirurgica qualora
tecnicamente possibile.
CHIRURGIA
Ghiandola parotide:
A scopo tassonomico sono definiti i classici interventi descritti in letteratura:
•
Parotidectomia superficiale: prevede l’asportazione dell’intero lobo
ghiandolare superficiale rispetto il VII nc.
11
TREP – Tumori epiteliali delle ghiandole salivari
•
Parotidectomia totale: prevede l’asportazione, in un tempo, del
lobo ghiandolare superficiale e del lobo profondo (parafaringeo), in
genere mediante divaricazione dei rami del VII nc.
•
Parotidectomia
allargata
(totale
o
superficiale):
prevede
l’estensione della resezione alla cute e/o tessuti molli periparotidei
Ognuna di queste può prevedere il sacrificio del VII nc (N.facciale) in toto
oppure di uno o più dei suoi rami.
•
Enucleazione-enucleoresezione della neoplasia. Si tratta della
asportazione del nodulo neoplastico “sgusciandolo” dal restante
parenchima ghiandolare. Il piano di clivaggio è rappresentato dalla
capsula o “pseudo-capsula” della neoplasia.
Il trattamento di scelta deve essere sempre la parotidectomia
superficiale o totale in relazione alla sede della neoplasia. Ciò vale
per gli istotipi maligni ed anche per quelli benigni
Il risparmio del nervo facciale (tronco e rami) deve essere sempre ricercato
quando non direttamente infiltrato dalla neoplasia.
La ricostruzione immediata delle lesioni del n. facciale con tecnica
microchirurgica deve essere sempre presa in considerazione.
La parotidectomia allargata potrà essere indicata per garantire una
adeguata rimozione della neoplasia nei casi avanzati (rari).
Interventi di enucleazione-enucleoresezione vanno evitati per la elevata
probabilità di ledere accidentalmente il nervo facciale e per la frequenza
delle recidiva locale.
Anche la cd. Parotidectomia superficiale o totale “parziale”, come descritta
da Leverstein (14) non sembra scevra dai medesimi rischi.
La tecnica chirurgica deve tenere conto della anatomia particolare del
giovane paziente.
Stazioni linfonodali: Nei rarissimi casi N+ è indicato lo svuotamento
linfonodale dei livelli I, II, III. Nei casi N0 non è mai indicato lo
svuotamento cd “profilattico”.
Ghiandola sottomandibolare:
Gli interventi decritti sono:
•
Enucleazione-enucleoresezione della neoplasia (vedi sopra)
12
TREP – Tumori epiteliali delle ghiandole salivari
•
Scialectomia sottomandibolare: asportazione della sola ghiandola
sottomandibolare.
•
Svuotamento della loggia sottomandibolare (compresa la ghiandola):
asportazione della ghiandola in blocco con il restante contenuto
(tessuto adiposo e linfonodi dei livelli Ib secondo Robbins) della loggia
sottomandibolare (15).
•
Resezioni allargate a mandibola-tessuti molli circostanti
Per tutti gli istotipi appare indicato lo svuotamento della loggia
sottomandibolare.
Per ragioni simili a quelle già descritte sopra, non sono raccomandati
interventi di enucleoresezione.
Stazioni linfonodali: Nei rarissimi casi N+ è indicato lo svuotamento
linfonodale dei livelli I, II, III. Nei casi N0, l’asportazione del I livello
linfonodale contemporaneo all’intervento su T conferisce un incremento
dell’accuratezza diagnostica a basso costo biologico.
Le resezioni allargate possono essere indicate per garantire un’adeguata
rimozione della neoplasia nei casi avanzati (rari).
Ghiandole salivari minori e ghiandola sotto linguale:
L’approccio chirurgico alle neoplasie maligne varia ovviamente in relazione
alla sede di insorgenza. Complessivamente non è differente rispetto a quello
utilizzato per il carcinoma spinocellulare.
Nelle forme benigne sono suggerite resezioni conservative ma complete.
TRATTAMENTO DEL PEZZO OPERATORIO
•
Il pezzo operatorio deve essere inviato al servizio di Anatomia
Patologica integro cioè non esplorato dal chirurgo. Questa
raccomandazione scoraggia le sezioni della neoplasia dopo aver
staccato il pezzo operatorio. L’indicazione mira ad evitare che i
rapporti della neoplasia con i tessuti circostanti o i veri margini
chirurgici possano essere alterati da artefatti.
•
In caso di necessità, è opportuno che il chirurgo esamini insieme al
patologo il pezzo operatorio (es.: orientamento, margini particolari,
richieste particolari).
•
Il
materiale
dovrà
essere
trattato
dal
patologo
seguendo
le
raccomandazioni in appendice D.
13
TREP – Tumori epiteliali delle ghiandole salivari
ESAME ESTEMPORANEO AL CONGELATORE
Non è previsto l’esame estemporaneo al congelatore per l’accertamento
dell’istotipo.
RADIOTERAPIA
Le linee guida per il trattamento radiante delle neoplasie maligne delle
ghiandole salivari in età pediatrica, considerata la rarità dei casi in questa
fascia di età, non sono state, fino al momento attuale, standardizzate e
fanno riferimento, di necessità, all’esperienza maturata in ambito adulto pur
tenendo presente il peso maggiore, in termini di qualità di vita, che le
sequele dei trattamenti oncologici hanno nel giovane paziente (21).
Radioterapia post-operatoria
Indicazioni
•
radicalità chirurgica non ottenuta o marginale. Il giudizio è
istologico ma anche chirurgico intraoperatorio. La dissezione del
nervo facciale da una neoplasia che gli è in stretta prossimità (ma
senza infiltrarlo) è sicuramente una dissezione marginale ma in caso
di neoplasie a basso grado e non voluminose non costituisce da sola
indicazione a RT. L’asportazione di neoplasia maligna (anche basso
grado)
in
multipli
frammenti
costituisce,
invece,
indicazione
categorica a RT.
•
neoplasie in stadio avanzato (T3-T4) (Appendice A)
•
caratteristiche
istologiche
aggressive
quali
invasione
perineurale, vascolare o linfatica. Si tratta di eventualità rara in
età pediatrica.
•
invasione delle strutture scheletriche
•
dopo ricaduta locale. Quando possibile tecnicamente, le ricadute
locali o su N devono essere trattate con chirurgia. Sulla base delle
indicazioni
istologiche
ragionevolmente
in
ed
intraoperatorie
considerazione
la
RT
potrà
essere
seguendo
i
presa
criteri
precedentemente enunciati.
14
TREP – Tumori epiteliali delle ghiandole salivari
Dose
La dose totale consigliata è di 56-60 Gy all’estensione del tumore primitivo,
somministrata con un frazionamento convenzionale di 1.8-2 Gy per frazione
in
base
anche
all’entità
del
volume
irradiato.
In
caso
di
residuo
macroscopico post-chirurgico è raccomandabile una sovradose di 10-14 Gy.
Note tecniche
Allo scopo di ridurre la dose agli organi e tessuti normali circostanti, si
ritiene
indispensabile
l’elaborazione
di
un
piano
di
trattamento
computerizzato dopo acquisizione di immagini TAC del volume d’interesse.
L’utilizzo di tecniche conformazionali tridimensionali per lo studio della
distribuzione
e
la
somministrazione
della
dose
di
radioterapia
è
raccomandata.
Per il trattamento verranno utilizzati fasci di fotoni di alta energia
eventualmente associati a fasci di elettroni.
Radioterapia esclusiva
Un trattamento radiante esclusivo può essere preso in considerazione nei
rari casi di neoplasia non resecabile o con metastasi a distanza alla
diagnosi. In questo sottogruppo, la dose totale consigliata è di 66-70 Gy,
somministrata con frazionamento convenzionale.
Irradiazione dei linfonodi del collo
Considerata la rarità dell’interessamento linfonodale latero-cervicale nelle
casistiche pediatriche, non si ritiene indicata di routine un’irradiazione
elettiva del collo nei pazienti clinicamente negativi.
In caso di positività clinico-patologica dei linfonodi del collo, le indicazioni e
le modalità di un eventuale trattamento radiante post-operatorio vanno
discusse con il Centro di riferimento.
CHEMIOTERAPIA
La chemioterapia continua ad avere un ruolo secondario nel trattamento
delle neoplasie delle ghiandole salivari: viene in genere indicata nei tumori
ad alto grado di malignità plurirecidivati e nei casi metastatici, spesso però
con un significato solo palliativo.
Il regime chemioterapico storicamente più utilizzato è lo schema CAP
(ciclofosfamide, adriamicina, cisplatino), al quale è stato aggiunto anche il
5-fluorouracile (FACP); anche i taxani sono farmaci considerati di una certa
15
TREP – Tumori epiteliali delle ghiandole salivari
efficacia. Sono in corso studi clinici volti a indagare il possibile ruolo di
imatinib mesilato (Glivec) nei casi che esprimono c-kit, di cetuximab
(Erbitux), anticorpo monoclonale diretto contro il recettore di epidermal
growth factor, e di antiandrogeni nei casi di carcinoma duttale con recettori
positivi (22-29).
5.0 IL FOLLOW UP
Il razionale per la pianificazione dei controlli si fonda sulla possibilità di
intercettare le riprese loco-regionali in fase precoce, guadagnando la
possibilità di un trattamento chirurgico di recupero efficace. In letteratura
non si ritrovano indicazioni esplicite. Possono comunque essere dedotte
alcune osservazioni utili a supporto delle raccomandazioni che seguiranno:
•
Le neoplasie maligne sono generalmente poco aggressive e gli eventi
sfavorevoli tendono ad esaurirsi con poche eccezioni entro i 5 anni
successivi alla diagnosi (picco entro i primi 2)
•
Le neoplasie benigne presentano storie cliniche lunghe con recidive
non rare oltre i 5 anni (circa l’80% dei pazienti entro 7 anni)
Tutte
le
neoplasie
maligne
dovrebbero
essere
seguite
con controlli
clinici/strumentali (vedi) ogni 4 mesi per i primi 2 anni e mezzo. Poi ogni 6
mesi sino a 5 anni.
Ghiandole salivari maggiori:
•
Visita ORL
•
Ecografia completa delle stazioni linfonodale del collo
•
TC/RM quando presenza di sospetto ecografico.
Ghiandole minori:
•
Visita ORL
•
TC/RM quando presenza di sospetto clinico
NB: Se Ca adenoidocistico-o altro ca ad alto grado, pianificare un Rx torace
ogni anno.
Le neoplasie benigne operate in modo completo dovrebbero prevedere un
controllo clinico/strumentale (vedi) ogni 6 mesi per i primi 4 anni. Poi
annuale per ulteriori 3 anni.
•
Visita ORL
•
Ecografia locale (ghiandole salivari maggiori)
•
TC/RM quando presenza di sospetto clinico
16
TREP – Tumori epiteliali delle ghiandole salivari
APPENDICE A
CLASSIFICAZIONE TNM - UICC Sesta Edizione 2002
T
Tumore primitivo
TX
Tumore primitivo non definibile
T0
Tumore primitivo non evidenziabile
T1
Tumore di dimensione massima inferiore a 2 cm senza estensione
extraparenchimale*
T2
Tumore di dimensione massima compresa fra 2 e 4 cm senza
estensione extraparenchimale*
T3
Tumore di dimensione massima superiore a 4 cm con estensione
extraparenchimale*
T4a
Tumore che invade la cute, la mandibola, il canale uditivo o il nervo
facciale
T4b
Tumore che invade la base del cranio, le lamine pterigoidee o
ingloba l’arteria carotide
Nota:
*
Estensione
extraparenchimale
significa
evidenza
clinica
o
macroscopica di invasione di tessuti molli o nervi, eccetto quelli classificati
come T4a e T4b. L’invasione dimostrabile solo microscopicamente non
costituisce un’estensione extraparenchimale a scopo classificativo.
N
Linfonodi regionali (si intendono quelli cervicali)
NX
Linfonodi regionali non valutabili
N0
Linfonodi regionali liberi da metastasi
N1
Metastasi in un solo linfonodo omolaterale di dimensione massima
inferiore a 3 cm
N2
Metastasi in un solo linfonodo omolaterale di dimensione massima
fra 3 e 6 cm; in più linfonodi omolaterali, bilaterali o controlaterali,
nessuno dei quali abbia dimensione massima superiore a 6 cm
N2a
Metastasi in un solo linfonodo omolaterale di dimensione massima
fra 3 e 6 cm
N2b
Metastasi
in
linfonodi
omolaterali,
nessuno
dei
quali
abbia
dimensione massima superiore a 6 cm.
N2c
Metastasi in linfonodi bilaterali o controlaterali nessuno dei quali
abbia dimensione massima superiore a 6 cm.
N3
Metastasi in qualsiasi linfonodo di dimensione massima superiore a
6 cm.
17
TREP – Tumori epiteliali delle ghiandole salivari
M
Metastasi a distanza
MX
Metastasi a distanza non accertabili
M0
Metastasi a distanza assenti
M1
Metastasi a distanza presenti
Raggruppamento per stadi
Stadio I
T1
N0
M0
Stadio II
T2
N0
M0
Stadio III
T3
N0
M0
T1
N1
M0
T2
N1
M0
T3
N1
M0
Stadio IVA T1
N2
M0
T2
N2
M0
T3
N2
M0
T4a
N0-N1-N2 M0
Stadio IVB T4b
ogni T
Stadio IVC Ogni T
ogni N
M0
N3
M0
Ogni N
M1
18
TREP – Tumori epiteliali delle ghiandole salivari
APPENDICE B
CLASSIFICAZIONE DEI TUMORI EPITELIALI DELLE GHIANDOLE SALIVARI
Seifert G and Sobin LH, 1991(18); Ellis GL and Auclair PL, 1996 (19)
TUMORI EPITELIALI BENIGNI
Tumore misto (adenoma polimorfo)
Mioepitelioma
Tumore di Warthin
Adenoma a cellule basali
Adenoma canalicolare
Oncocitoma
Papillomi duttali
Sialoadenoma papillifero
Papilloma duttale invertito
Papilloma intraduttale
Linfoadenomi e adenomi sebacei
Sialoblastoma
TUMORI EPITELIALI MALIGNI
Carcinoma mucoepidermoide
Adenocarcinoma
Adenocarcinoma a cellule aciniche
Carcinoma adenoide cistico
Adenocarcinoma polimorfo a basso grado
Tumori misti maligni
Carcinoma in tumore misto
Carcinosacoma
Tumore misto metastatizzante
Carcinoma spinocellulare
Adenocarcinoma a cellule basali
Carcinoma epiteliale-mioepiteliale
Adenocarcinoma a cellule chiare
Cistoadenocarcinoma
Carcinoma indifferenziato
Carcinoma
indifferenziato
piccole cellule
19
a
TREP – Tumori epiteliali delle ghiandole salivari
Carcinoma
indifferenziato
grandi cellule
Carcinoma linfoepiteliale
Carcinoma oncocitico
Carcinoma dei dotti salivari
Adenocarcinoma sebaceo e linfoadenocarcinoma
Carcinoma mioepiteliale
Carcinoma adenosquamoso
Adenocarcinoma mucinoso
20
a
TREP – Tumori epiteliali delle ghiandole salivari
APPENDICE C
GRADING
Per questi istotipi la classificazione di per sé determina il grado:
-
o
o
-
CARCINOMI A BASSO GRADO:
•
Adenocarcinoma a cellule aciniche
•
Adenocarcinoma a cellule basali
•
Adenocarcinoma polimorfo a basso grado
CARCINOMI AD ALTO GRADO:
•
Carcinoma dei dotti salivari
•
Carcinoma spinocellulare primitivo
•
Carcinoma indifferenziato
Per i seguenti istotipi sono applicati sistemi di gradazione
specifici:
o
ADENOCARCINOMA, NAS:
Valutazione di caratteristiche citoarchitetturali
o
CARCINOMA ADENOIDE CISTICO:
Grado intermedio vs alto grado:
•
Pattern di crescita cribriforme-tubulare vs
>30% solido
o
CARCINOMA MUCOEPIDERMOIDE:
Presenza/assenza di caratteristiche di crescita e
citoarchitetturali:
21
TREP – Tumori epiteliali delle ghiandole salivari
PARAMETRO
PUNTEGGIO
Componente intracistica <20%
+2
Presenza di invasione neurale
+2
Presenza di necrosi
+3
Indice mitotico > 4/10HPF
+3
Anaplasia
+4
GRADO
SCORE TOTALE
A basso grado
0-4
Di grado intermedio
5-6
Ad alto grado
7 o più
o
CARCINOMA IN TUMORE MISTO:
Grading secondo il metodo più adatto al tipo di
componente carcinomatosa
22
TREP – Tumori epiteliali delle ghiandole salivari
APPENDICE D
ESAME MACROSCOPICO E CAMPIONAMENTO
-
Descrivere, pesare e misurare il pezzo operatorio
-
Indicare dove necessario il margine di resezione in china
-
Campionare la neoplasia ed il suo rapporto con i margini di resezione
e le strutture adiacenti
-
Campionare i linfonodi divisi per sedi
-
Campionare ogni altra struttura compresa nel pezzo operatorio
REFERTAZIONE
-
Istotipo
-
Grado, ove necessario
-
Invasione vascolare
-
Invasione perineurale
-
Necrosi
-
Invasione delle strutture adiacenti
-
Stato dei margini di resezione
-
Stato dei linfonodi
-
Stato di ogni altra struttura compresa nel pezzo operatorio
23
TREP – Tumori epiteliali delle ghiandole salivari
APPENDICE E
CENTRALIZZAZIONE
-
Modulo per la privacy compilato, se non previsto implicitamente dal
protocollo (vedi Allegato 1)
-
Inviare ogni notizia utile riguardo eventuali altre malattie o neoplasie
del
paziente,
esami
istologici
precedenti,
precedente
terapia
chirurgica/chemioterapia/radioterapia
-
Inviare un set di preparati rappresentativi colorati con EE (verranno
trattenuti) + 10 sezioni in bianco per immunocitochimica di un repere
rappresentativo
-
Inviare copia dell’esame istologico riportante:
-
i dati identificativi del paziente con la data di nascita
-
tipo di intervento
-
materiale in esame
-
descrizione macroscopica
-
sede dei prelievi
-
corrispondenza fra vetrini e sede dei prelievi
Inviare il materiale al seguente indirizzo, indicando nella lettera di
accompagnamento che si tratta di ‘CENTRALIZZAZIONE PROTOCOLLO TREP’
e specificando l’indirizzo del patologo (eventuale telefono, fax, indirizzo email) a cui va inviata la risposta:
dott.ssa Paola Collini
Dipartimento di Anatomia Patologica
Istituto Nazionale Tumori
Via Venezian 1
20133 Milano
tel. 02-2390-3214
fax 02-2390e-mail [email protected]
24
TREP – Tumori epiteliali delle ghiandole salivari
ALGORITMO TRATTAMENTO TUMORI EPITELIALI
GHIANDOLA PAROTIDE
Tumefazione
della regione
parotidea
ECO
e/o
RMN
DIAGNOSI INCERTA
PER SEDE e/ o ETIOLOGIA
FNAB
DIAGNOSI CERTA
Patologia extra ghiandolare
Neoplasia vascolare
Patologia flogistica
Neoplasia della ghiandola
Operabile
Non operabile
RT / CT
PAROTIDECTOMIA
SUPERFICIALE O TOTALE
25
TREP – Tumori epiteliali delle ghiandole salivari
ALGORITMO TRATTAMENTO TUMORI EPITELIALI
GHIANDOLA SOTTOMANDIBOLARE
Neoplasia vascolare
Patologia flogistica
Tumefazione
della regione
sottomandibolare
ECO
e/o
RMN
FNAB
Neoplasia della ghiandola
Operabile
SVUOTAMENTO LOGGIA
SOTTOMANDIBOLARE
Patologia extra ghiandolare
Non operabile
RT / CT
26
TREP – Tumori epiteliali delle ghiandole salivari
LOGGIA PAROTIDEA
Legenda. 1: parotide; 2: A carotide esterna; 3: n. facciale; 4: V giugulare
esterna; 5: V giugulare interna; 6: A carotide interna; 7: processo stiloideo;
8: tonsilla palatina; 9: corpo vertebrale; 10: m pterigoideo interno; 11
ramo della mandibola; 12: m prevertebrali; 13: dotto di Stesone; 14:
prolungamento faringeo della parotide; 15: ventre post. m digastrico; 16:
m
sternocleidomastoideo;
A:
lobo
ghiandolare
superficiale;
B:
lobo
ghiandolare profondo.
27
TREP – Tumori epiteliali delle ghiandole salivari
LOGGIA PAROTIDEA
Legenda. 1: m. sternocleidomastoideo; 2: n.grande auricolare 3: n.
auricolo-temporale (III nc); 4-5: A e V temporale superficiale; 6: processo
temporale dello zigomatico; 7: A traversa della faccia; 8: m. massetere; 9:
dotto di Stenone; 10: m. platisma ribaltato.
N.B. Si prega di inviare le schede di registrazione e quelle diagnostico
terapeutiche (allegate alla fine del protocollo) per ciascun caso registrato al
Centro raccolta dati:
Dr. Gianluca De Salvo
Servizio sperimentazioni cliniche e biostatistica – IOV-IRCCS
via Gattamelata, 64 – 35128 Padova
Tel: 049/8215704 – Fax: 049/8215706
Si ricorda che i medici referenti per questa neoplasia sono il dr. Ferrari e il dr.
Guzzo (vedi frontespizio linea guida).
Referente Anat.Pat.: Dott.ssa Collini (Milano)
Per qualsiasi informazione contattare la Data Manager dello studio:
Sig.ra Mancini Elisa
Clinica Chirurgica Pediatrica
Dipartimento di Pediatria
Azienda Ospedaliera di Padova
Via Giustiniani, 3 – 35128 Padova
e-mail: [email protected]
Tel: 049/8218045 Fax: 049/8211781
28
TREP – Tumori epiteliali delle ghiandole salivari
6.0
BIBLIOGRAFIA essenziale
1. Seifert G et al Epithelial salivary gland tumors in children and
adolescents ORL 48:137-149;1986
2. Fonseca I et al Epithelial salivary gland tumors of children and
adolescents in southern Portugal Oral Surg Oral Med Oral Pathol 72:696701;1991
3. Lack EE et al. Histopathologic review of salivary gland tumors in
childhood Arch Otolaryngol Head Neck Surg 114:898-906;1988
4. Callender DL et
al. Salivary gland
neoplasms
in children. Arch
Otolaryngol Head Neck Surg 118:472-476;1992
5. De Cassia Braga Ribeiro K et al.Epithelial salivary glands neoplasms in
children
and
adolescent:
A
forthy-four-year
experience.
Med.Pediatr.Oncol 39:594-600;2002
6. Shikhani AH et al. Tumors of the major salivary glands in children. Head
& Neck Surgery 10:257-263;1988
7. Baker SR and Malone B Salivary gland malignancies in children Cancer
55:1730-1736;1985
8. Orvidas LJ et al. Pediatric parotid masses. Arch Otolaryngol Head Neck
Surg 126:177-184;2000
9. Rogers DA et al Primary malignancy of the salivary gland in children J
Pediatr Surg 26:44-47;1994
10.Ethunandan M et al Parotid neoplasms in children:experience of
diagnosis and management in a district general hospital Int J Oral
Maxillofac Surg 32:373-377;2003
11.Kessler A et al Salivary gland neoplasms in children: a 10-year survey at
The Children’s Hospital of Philadelphia Int J Pediatr Otorhinolaryngol
29:195-202;1994
12.Guzzo M, Andreola S, Sirizzotti G and G Cantù Mucoepidermoid
carcinoma of salivary glands: clinicopathologic teview of 108 patients
treated at National Cancer Institute of Milan
13.Weber RS et al Submandibular gland tumors Arch Otolaryngol Head Neck
Surg 116:1055-1060;1990
14.Leverstein H et al Surgical management of 246 previously untreated
pleomorphic adenomas of the parotid gland British J Surg 84:399403;1997
29
TREP – Tumori epiteliali delle ghiandole salivari
15.Robbins TK Classification of neck dissection. Otolaryngol Clinics North
America 31 (4)639-655; 1998
16.Luna MA et al Salivary gland in children AnnOtol Rhinol Laryngol
100:869-871;1991
17.Pediatric
Neoplasia
–
Morphology
and
Biology,
Parham
DM
ed.,
Lippincott-Raven, 1996
18.Seifert G and Sobin LH The World Health Organization’s Histological
classification of salivary gland tumors Cancer 70(2) 379-383; 1991
19.Atlas of Tumor Pathology – Tumors of the salivary glands – Ellis GL and
Auclair PL eds. - AFIP - 1996
20.Halperin E et al. Pediatric Radiation Oncology. Lippincott Williams and
Wilkins eds., 4th edition, 2005
21.Terhaard CHJ, Lubsen H, Rasch CRN et Al. The role of radiotherapy in
the treatment of malignant salivary gland tumors. Int J radiation
Oncology Biol Phys 61: 103-111, 2005
22.Alberts D, et al. Adriamycin/cisplatinum/cyclophosphamide combination
chemotherapy for advanced carcinoma of the parotid gland. Cancer
1981;47:645-648.
23.Dreyfuss
A,
et
al.
Cyclophosphamide,
doxorubicin,
and
cisplatin
combination chemotherapy for advanced carcinomas of salivary gland
origin. Cancer 1987;60:2869-2872.
24.Vennok A, et al. Cisplatin, doxorubicin, and 5-fluorouracil chemotherapy
for salivary gland malignancies: a pilot study of the Northern California
Oncology Group. J Clin Oncol 1987;5:951-955.
25.Dimeyr I, et al. Fluorouracil, doxorubicin, cyclophosphamide, and
cisplatin combination chemotherapy in advanced or recurrent salivary
gland carcinoma. J Clin Oncol 1990;8:1056-1062.
26.Belli F, et al. Docetaxel in the treatment of metastatic carcinoma of the
salivary glands: report of a case. Clin Ter 1999;150:77-79.
27.Hotte SJ, et al. Imatinib mesylate in patients with adenoid cystic cancers
of the salivary glands expressing c-kit: a Princess Margaret Hospital
phase II consortium study. J Clin Oncol 2005;23:585-590.
28.Goldberg RM. Cetuximab. Nat Rev Drug Discov 2005 May;Suppl:S10-1.
29.Fan CY, et al. Expression of androgen receptor, epidermal growth factor
receptor, and transforming
growth factor alpha
in salivary duct
carcinoma. Arch Otolaryngol head Neck Surg 2001;127:1075-1079.
30
TREP – Tumori epiteliali delle ghiandole salivari
30.Guzzo M., Ferrari A., Marcon I. et al. Salivary gland neoplasms in
pediatric age: the experience of Istituto Nazionale Tumori of Milan.
Pediatric Blood & Cancer in press.
31