NITRATO D’ARGENTO - AgNO3 1
• Questo sale è dotato di attività antisettica, germicida ed
astringente. Tale capacità è riconducibile alla capacità degli
ioni argento di denaturare e precipitare le proteine.
• Il meccanismo di precipitazione delle proteine si basa
sull’interazione degli ioni Ag+ con i gruppi polari presenti
negli aminoacidi, elementi fondamentali che costituiscono il
biopolimero proteico. I gruppi funzionali degli aminoacidi
che sono coinvolti principalmente sono:
-SH
gruppo tiolico
-NH2
gruppo amminico
-COOH
gruppo carbossilico
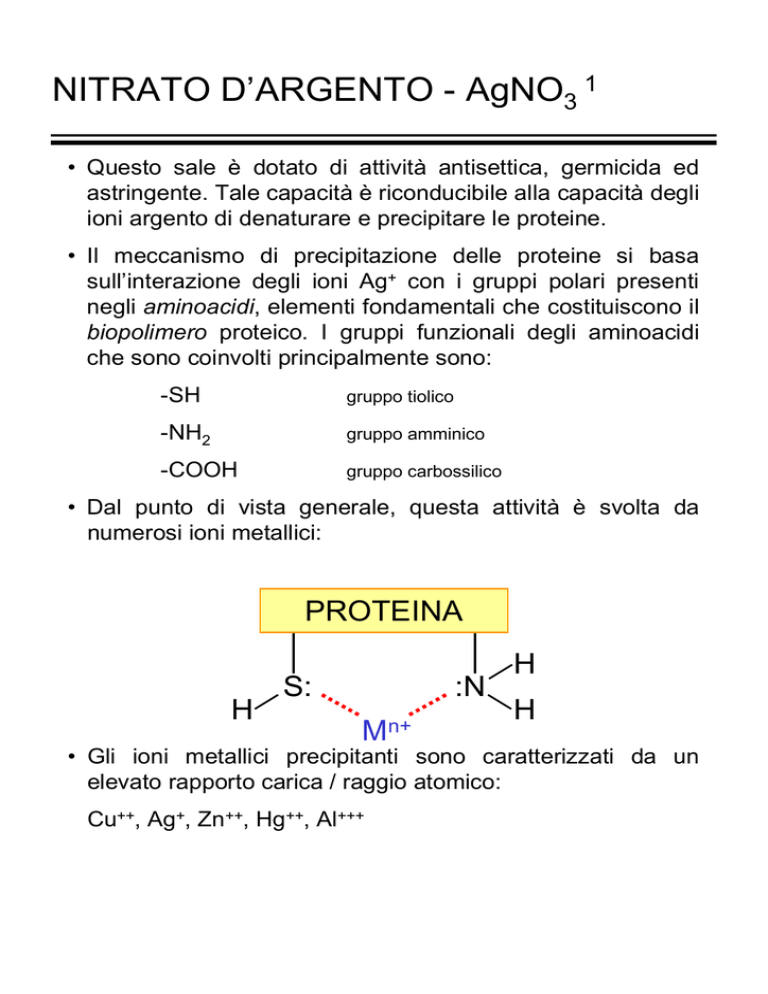
• Dal punto di vista generale, questa attività è svolta da
numerosi ioni metallici:
PROTEINA
H
S:
:N
Mn+
H
H
• Gli ioni metallici precipitanti sono caratterizzati da un
elevato rapporto carica / raggio atomico:
Cu++, Ag+, Zn++, Hg++, Al+++
NITRATO D’ARGENTO - AgNO3 2
• L’effetto di precipitazione non è selettivo e come
conseguenza si ha la denaturazione sia delle proteine
batteriche, sia di quelle umane.
• A seconda della concentrazione utilizzata si possono avere
differenti attività:
• Attività astringente
• Attività irritante
Concentrazione
• Attività antibatterica
• Attività corrosiva
• Gli ioni argento esercitano un’attività locale perché in breve
tempo precipitano sottoforma di AgCl per effetto del cloruro
presente fisiologicamente.
• I sali d’argento colorano la pelle di nero per deposizione di
ossido d’argento e argento metallico.
Indicazioni terapeutiche
• Congiuntivite gonococcica neonatale: impiego di una
soluzione oftalmica all’1%
• Prevenzione delle infezioni nelle scottature gravi: impiego
di una soluzione allo 0,6 %
• Disinfettante per uso topico.
CLORURO MERCURICO - HgCl2
• E’ un potente antisettico, tuttavia è molto tossico.
• Negli ultimi anni, i composti mercuriali sono stati
ampiamente sostituiti da agenti terapeutici dotati di
maggiore specificità ed efficacia, oltre che minore tossicità.
• L’attività antisettica dello ione Hg++ si esplica grazie alla
sua capacità di interagire con i gruppi sulfidrilici (detti
anche tiolici) dell’aminoacido cisteina presente nelle
proteine. Come risultato si ha la formazione di addotti
chiamati mercaptidi che provocano l’inattivazione di enzimi
e quindi interferiscono con le funzionalità cellulari.
PROTEINA
H
S:
:S
Hg++
PROTEINA
S
S
Hg
H
Al2(SO4)3, KAl(SO4)2, AlCl3
• Solfato di alluminio, solfato di potassio e alluminio (detto
anche allume) e cloruro di alluminio sono farmaci
astringenti, antitraspiranti ed emostatici.
• Anche in questo caso l’attività è riconducibile alla capacità
dello ione alluminio di precipitare le proteine.
Nota bene:
• Gli astringenti sono dei farmaci ad azione locale che
precipitano le proteine tessutali. Sono caratterizzati da una
scarsa capacità di penetrazione nei tessuti (azione locale).
• Le applicazioni dei farmaci astringenti sono:
1. Emostatici locali: coagulazione del sangue e
costrizione dei capillari.
2. Antitraspiranti: riducono la sudorazione
costrizione dei pori della superficie cutanea.
3. Effetto
anticongestionante:
riduzione
irrorazione sanguigna a livello delle mucose.
per
della
IDROSSIDO DI ALLUMINIO – Al(OH)3
• L’idrossido di alluminio è impiegato nel trattamento
dell’ulcera gastrica e duodenale. E’ definito antiacido
gastrico:
Al(OH)3 + 3 HCl
AlCl3 + 3 H2O
• L’effetto alcalinizzante dell’idrossido di alluminio rallenta la
velocità dello svuotamento gastrico ed inibisce la peristalsi
intestinale.
• Per inibire i possibili effetti costipanti, è somministrato in
associazione con altri antiacidi contenenti Mg++.
es. Maalox
Al(OH)3 + Mg(OH)2
SOLFATO DI ZINCO – ZnSO4
CLORURO DI ZINCO – ZnCl2
• I sali di zinco vengo utilizzati nella preparazione di soluzioni
e colliri astringenti da applicare in caso di irritazioni e
congiuntiviti.
• Anche in questo caso, l’attività è riconducibile alla capacità
degli ioni zinco di precipitare le proteine.
• Essendo dotati di effetto antitraspirante, li si trovano
frequentemente in preparati deodoranti.
• Sono anche utilizzati negli integratori alimentari per
supplire le carenze di zinco nella dieta.
OSSIDO DI ZINCO - ZnO
• L’ossido di zinco ha proprietà astringenti, antisettiche e
lenitive.
• L’effetto astringente/antisettico è riconducibile al rilascio di
piccole quantità di ioni zinco per l’effetto dell’ambiente
debolmente acido della pelle:
ZnO + 2 HCl
ZnCl2 + H2O
• L’ossido di zinco viene impiegato topicamente sottoforma
di pasta/crema come agente lenitivo e protettivo negli
eczemi e nelle escoriazioni lievi.
• E’ spesso contenuto nei filtri solari come schermo di tipo
fisico dal momento che riflette le radiazioni ultraviolette
(UV) dannose per la cute.
CLORURO DI CALCIO – CaCl2
• I sali di calcio come il cloruro di calcio ed il gluconato di
calcio, sono impiegati principalmente nel trattamento di
deficit di calcio.
• Tale situazione si può instaurare a seguito di una dieta mal
bilanciata, gravidanza/allattamento, diarrea cronica, ecc.
• Nel caso di ipocalcemia acuta, i sali di calcio vengono
somministrati per via parenterale.
CALCIO FOSFATO BIBASICO – CaHPO4
CALCIO FOSFATO – Ca3(PO4)2
• Sono indicati come supplemento di calcio e fosfato durante
la gravidanza e l’allattamento.
• Sono utilizzati anche nel trattamento di lievi stati
ipocalcemia e dell’osteoporosi.
• Vengono utilizzati in tecnica farmaceutica come eccipienti
diluenti per capsule e compresse.
• Possono essere impiegati come adsorbenti ed addensanti
per creme ed unguenti.
• Frequentemente rientrano nella formulazione di paste
dentifrice per l’effetto abrasivo/meccanico che svolgono in
associazione alle setole dello spazzolino da denti.
SOLFATO DI CALCIO – CaSO4
• Il solfato di calcio è un eccipiente utilizzato in tecnica
farmaceutica per la formulazione di capsule e compresse.
• E’ anche impiegato nella preparazione di calchi in gesso
per odontoiatria e nella produzione di presidi medicochirurgici quali le bende gessate.
CARBONATO DI CALCIO – CaCO3
• Il carbonato di calcio è un antiacido gastrico ad azione
rapida, classificato come antiacido non sistemico perché
non induce stati di alcalosi sistemica.
CaCO3
CO32- + 2 H+
H2CO3
Ca++ + CO32H2CO3
H2O + CO2
• E’ utilizzato come antiacido e nel trattamento delle
ipocalcemie.
• E’ spesso somministrato in associazione con sali di
magnesio, utili per ridurre la possibilità di stipsi.
SOLFATO DI SODIO – Na2SO4
• Il solfato di sodio ha la caratteristica di essere scarsamente
assorbito
dall’apparato
gastrointestinale
e
come
conseguenza, per effetto osmotico, trattiene acqua nel
lume intestinale.
• Viene somministrato per via orale (per os) in soluzioni
diluite come lassativo salino per favorire l’evacuazione.
• Viene anche somministrato in associazione al solfato di
bario (mezzo di contrasto) al fine di ridurne la tossicità:
BaSO4(s)
Na2SO4(s)
Ba++ + SO422 Na+ + SO42-
Il solfato di sodio sposta ulteriormente verso sinistra
(principio di Le Chatelier) l’equilibrio di dissoluzione del
solfato di bario per incremento della concentrazione
dell’anione solfato. In questo modo si riduce ulteriormente
la quantità di Ba++ in soluzione, responsabile della tossicità
del solfato di bario.
FOSFATO MONOBASICO DI SODIO - NaH2PO4
FOSFATO BIBASICO DI SODIO - Na2HPO4
• Entrambi questi sali vengono utilizzati come purganti salini.
• Vengono somministrati sia per via orale, sia per via rettale.
• La preparazione più comunemente usata è chiamata fosfati
di sodio soluzione per uso orale. Può essere realizzata
come segue:
• 4,8 g di fosfato monobasico di sodio.
• 1,8 g di fosfato bibasico di sodio.
• 10 ml di acqua deionizzata
BICARBONATO DI SODIO – NaHCO3
• Il bicarbonato di sodio trova principalmente impiego come
antiacido gastrico.
• Gli antiacidi gastrici sono basi deboli che reagiscono con
l’acido cloridrico dello stomaco diminuendone la
concentrazione.
• Gli antiacidi gastrici vengono impiegati nel trattamento
dell’ulcera peptica proprio per la loro capacità di innalzare il
pH del succo gastrico riducendone la capacità erosiva nei
confronti della parte lesa.
NaHCO3 + HCl
H2CO3
NaCl + H2CO3
CO2 + H2O
• Il bicarbonato è anche impropriamente utilizzato per
favorire la digestione. In particolare, l’effetto alcalinizzante
induce l’apertura dello sfintere pilorico (apertura pHdipendente) favorendo lo svuotamento gastrico.
• L’utilizzo del bicarbonato di sodio è tuttavia limitato perché
è facilmente assorbito nell’intestino, provocando alcalosi
sistemica e ritenzione di liquidi. Non è raccomandabile un
uso prolungato.
• E’ utilizzato nell’acidosi metabolica derivante da
chetoacidosi diabetica, disturbi renali e grave acidosi
lattica. In questo caso è somministrato per infusione
endovenosa lenta (soluzione fino all’8,4 %) o per infusione
endovenosa continua (soluzione ~1,26 %).
ACETATO DI SODIO – CH3COONa
• L’acetato di sodio è viene utilizzato per veicolare all’interno
dell’organismo il bicarbonato di sodio.
• Ciò è dovuto al fatto che l’acetato, una volta assorbito nel
tratto gastrointestinale, viene completamente metabolizzato
in bicarbonato in tempi molto brevi:
CH3COO-
metabolismo
HCO3-
• L’acetato di sodio trova impiego nei casi di acidosi
metabolica derivanti da chetoacidosi diabetica, disturbi
renali e grave acidosi lattica.
• Può essere considerato un profarmaco. Per profarmaco si
intende una molecola che di per sé non è attiva, e che ha
bisogno di essere interconvertita in farmaco dagli enzimi
metabolici per poter svolgere il proprio effetto.
FLUORURO DI SODIO – NaF 1
• Lo smalto dei denti è costituito principalmente da un
minerale chiamato idrossiapatite, normalmente insolubile in
acqua:
Ca5(PO4)3OH
insolubile in H2O
tuttavia è parzialmente solubile a pH acido.
• La placca è un film costituito da carboidrati e proteine
(mucina) stratificato sulla superficie dello smalto.
• Se la placca non viene rimossa, la fermentazione batterica
dei carboidrati della placca, porta alla formazione di acido
lattico con conseguente riduzione del pH intorno ad un
valore di 4,5.
OH
placca
Fermentazione
H3C CH COOH
OH
OH
H3C CH COOH
acido lattico
+
H2O
H3C CH COO -
+ H3O +
• L’ambiente acido porta ad una parziale dissoluzione
dell’idrossiapatite:
Ca5(PO4)3OH(s) + 4 H3O+
5 Ca++ + 3 HPO42- + 5 H2O
Come risultato si ha la formazione di cavità (carie).
FLUORURO DI SODIO – NaF 2
• Per prevenire la formazione di carie, viene aggiunto il
fluoruro ai dentifrici. L’effetto protettivo si esplica per
conversione dell’idrossiapatite dello smalto in fluoroapatite:
Ca5(PO4)3OH + F-
Ca5(PO4)3F + OH-
idrossiapatite
fluoroapatite
• La fluoroapatite è molto meno solubile negli acidi della
idrossiapatite poiché il fluoruro è una base decisamente più
debole rispetto all’OH-.
Composizione tipica di una pasta dentifricia:
Ingrediente
%
Funzione
Acqua
37
Diluente
Glicerolo
32
Umettante
CaHPO4
27
Abrasivo
Sodio laurilsolfato
2
Surfattante
Fluoruri
1
Protettivo
Dolcificanti
Conservanti
1
Coloranti
Altri abrasivi: CaCO3, MgCO3, Ca3(PO4)2.
IODURO DI SODIO – NaI
IODURO DI POTASSIO – KI
• Lo iodio viene utilizzato dalla ghiandola tiroide per la
biosintesi di ormoni tiroxina (tetraiodotironina, T4) e
triiodotironina (T3) che giocano un ruolo fondamentale nel
controllo del metabolismo dell’organismo (accrescimento,
termogenesi, metabolismo degli zuccheri, delle proteine,
dei lipidi, del calcio e del fosforo).
• A bassi dosaggi, gli ioduri vengono utilizzati nella profilassi
e nel trattamento di disturbi da deficit di iodio.
• Il Ministero della Salute ha emanato una normativa che
prescrive il contenuto di ioduro nel sale marino nella
quantità di 30 mg per Kg.
• Lo iodio radioattivo (131I) è indicato in quelle forme di
ipertiroidismo resistenti ai trattamenti farmacologici
convenzionali (radio-ablazione). Viene somministrato per
via orale una sola volta. Viene captato dalle cellule della
tiroide causandone la morte.
• Lo iodio radioattivo è anche utilizzato a scopi diagnostici
(test di captazione dello iodio radioattivo per la diagnosi
dell’ipertiroidismo).
• Lo ioduro rientra nella composizione della tintura di iodio: 2
% di iodio, 2-4 % ioduro di sodio, in miscela al 47% di
acqua ed etanolo. La tintura di iodio viene utilizzata come
disinfettante anche se ha la sgradevole controindicazione
di colorare la regione dove viene applicata.
IODATO DI POTASSIO – KIO3
• Lo iodato di potassio presenta le medesime applicazioni
terapeutiche degli ioduri.
• Per questo viene utilizzato nella profilassi e nel trattamento
di disturbi derivanti da deficit di iodio nella dieta.
• Lo si trova frequentemente
integratori alimentari.
nella
composizione
di
CARBONATO DI LITIO – Li2CO3
• Tutti i sali di litio vengono impiegati come fonte di ioni litio.
• Farmaci a base di litio appartengono alla più ampia classe
degli antispicotici, farmaci atti al trattamento della
schizofrenia. Sono anche chiamati neurolettici per la loro
capacità di interferire su diversi importanti sistemi cerebrali.
• Il carbonato di litio è considerato un farmaco antimaniacale
utilizzabile anche in alcuni casi di depressione.
• Esplica la sua funzione stabilizzando i cambiamenti di
umore in pazienti con disturbi affettivi bipolari (maniacodepressivi).
• Questo tipo di disturbi hanno una forte componente
genetica e sembrano correlati ad una forte attività
catecolaminargica (dopamina, adrenalina, noradrenalina).
• Il Li+ sembra dovere la sua attività alla capacità di indurre
una rapida distruzione delle catecolamine a livello
presinaptico, di inibire il rilascio dei neurotrasmettitori a
livello sinaptico e di ridurre la sensibilità dei recettori
postsinaptici.
ACIDO BORICO – H3BO3
BORACE – Na2B4O7
• L’acido borico è un blando batteriostatico e fungistatico per
uso topico.
• Si usa in soluzione acquosa al 2,2 %, isotonica col liquido
lacrimale, per lavaggi oculari e per colluttori.
• In associazione con la borace, viene utilizzato come
tampone ad uso topico ed oftalmico.
• Ultimamente, l’acido borico viene utilizzato sempre meno
frequentemente per il verificarsi di gravi forme di
avvelenamento, soprattutto nei bambini. Ciò si può
verificare quando si irriga eccessivamente un tessuto leso
con la soluzione di acido borico. In queste condizioni,
l’acido borico viene assorbito sistemicamente diventando la
fonte dell’avvelenamento.
TIOSOLFATO DI SODIO – Na2S2O3
• Il tiosolfato di sodio è indicato nel trattamento da
avvelenamento acuto da cianuro e da composti che
vengono metabolizzati in vivo a cianuri (es. nitroprussiato
di sodio).
• L’avvelenamento da cianuro può avvenire per via
respiratoria (HCN), dermica, congiuntivale e orale. Le dosi
letali sono di 90-100 mg per HCN e 150-300 mg per NaCN.
• I sintomi dell’avvelenamento sono: irritazione delle mucose,
bruciore alla bocca ed alla faringe, mal di testa, nausea,
stato
confusionale,
ansietà,
vomito,
convulsioni,
tachicardia,
edema
polmonare,
alterazione
della
respirazione.
• La tossicità del cianuro si esplica a livello dell’emoglobina
similmente al monossido di carboni (CO). Il cianuro si fissa
al ferro eminico con un’affinità nettamente superiore a
quella dell’ossigeno, impedendo così che l’emoglobina
possa svolgere la sua funzione di trasportatore.
• Il tiosolfato per riduzione viene convertito in zolfo. Lo zolfo
e il cianuro sono substrati dell’enzima rodanasi che li
converte in tiocianato (SCN-), molto meno tossico del
cianuro perché non si fissa all’emoglobina.
• Il tiosolfato viene somministrato per infusione endovenosa
lenta alla dose di 0,3 - 0,5 g/Kg in soluzione al 25 %.
• Il trattamento con tiosolfato può essere associato ad una
terapia iperbarica (O2 è in competizione con CN-).
METABISOLFITO DI SODIO – Na2S2O5
• Il metabisolfito viene utilizzato come antiossidante nelle
forme farmaceutiche orali, paraenterali e topiche nella
quantità di 0,01 – 1 %.
• Generalmente, un antiossidante viene utilizzato nelle forme
farmaceutiche tutte quelle volte che si ha a che fare con
principi attivi facilmente ossidabili. La sua funzione è quella
di mantenere il principio attivo allo stato ridotto (= attivo)
aumentando la conservabilità della formulazione.
• Il meccanismo antiossidante può essere duplice:
– L’agente antiossidante si ossida al posto del principio
attivo.
– Il principio attivo, una volta ossidato, viene ridotto al
suo
normale
stato
per
opera
dell’agente
antiossidante.
• Il metabisolfito (E223) viene usato anche come
conservante alimentare (es. bevande, succhi di frutta,
conserve di frutta, vino).
• E’ usato anche come agente sterilizzante per le linee di
produzione industriale delle bevante.
SOLFATO DI MAGNESIO – MgSO4
CLORURO DI MAGNESIO – MgCl2
ACETATO DI MAGNESIO – (CH3COO)2Mg
• Il magnesio è quantitativamente il secondo dei cationi
presenti nei liquidi intracellulari e risulta un’elettrolita
essenziale per l’organismo.
• E’ un importante cofattore in numerosi sistemi enzimatici
con funzioni sia strutturali, sia catalitiche. E’ coinvolto nel
trasferimento dei fosfati, nella contrazione muscolare e
nella trasmissione nervosa.
• Il solfato di magnesio ed il cloruro di magnesio sono
utilizzati principalmente nel trattamento del deficit di ioni
magnesio e nella ipomagnesia.
• Le cause responsabili di una ipomagnesia possono essere:
– un ridotto apporto del catione nella dieta;
– cattivo
assorbimento
gastrointestinale;
a
livello
dell’apparato
– perdita eccessiva di elettroliti per vomito e diarrea.
• L’acetato di magnesio può comparire nella formulazione di
soluzioni iniettabili.
CARBONATO DI MAGNESIO – MgCO3
OSSIDO DI MAGNESIO – MgO
IDROSSIDO DI MAGNESIO – Mg(OH)2
• Trovano impiego come antiacidi gastrici:
MgO + H2O
Mg(OH)2
Mg(OH)2
Mg++ + 2 OH-
OH- + H+
H2O
MgCO3
CO32- + 2 H+
H2CO3
Mg++ + CO32H2CO3
H2O + CO2
• Data la scarsa solubilità che hanno nel tratto
gastrointestinale, l’effetto antiacido può durare parecchie
ore.
• Sono caratterizzati da uno scarso assorbimento e pertanto
non danno alcalosi sistemica.
• Trovano anche impiego come lassativi salini (osmotici).
SOLFATO DI MAGNESIO – MgSO4
ACETATO DI MAGNESIO – (CH3COO)2Mg
• Questi due sali trovano impiego principalmente per via
orale come lassativi salini.
• Questo effetto è dovuto al fatto che vengono scarsamente
assorbiti e permangono nel lume gastrointestinale.
• In questo modo, richiamano acqua per effetto osmotico
aumentando il volume delle feci che estendendo le pareti
intestinali, favoriscono la peristalsi.
BIOSSIDO DI TITANIO – TiO2
• E’ utilizzato in tecnica farmaceutica come pigmentante
(bianco) ed opacizzante delle capsule di gelatina dura.
• E’ utilizzato nella preparazione di filtri solari (filtri fisici) in
quanto è capace di riflettere le radiazioni U.V.
• Lo si può trovare nella composizione di numerose
preparazioni cosmetiche (es. creme per viso, ceretta
depilante, ecc).
• Il biossido di titanio è quasi inerte e per questo è
considerato una sostanza non tossica. E’ il principale
motivo che lo vede impiegato come eccipiente.
SOLFATO DI BARIO – BaSO4
• E’ principalmente utilizzato come mezzo di contrasto nella
diagnostica per immagini (radiologia e risonanza
magnetica) per rendere meglio visibili alcune strutture del
corpo umano.
• In radiologia, forniscono una immagine di sé le sole
formazioni corporee che interagiscono con i raggi X in
maniera selettiva e definita e quindi arrestano i raggi di più
o di meno delle formazioni adiacenti.
• Se un organo assorbe poco le radiazioni e comunque le
assorbe allo stesso modo degli organi che lo circondano,
esso non risulterà visibile in modo utile sull'immagine
radiografica (es. stomaco, fegato, reni).
• Il bario è fortemente radiopaco: se somministrato
opportunamente mette in risalto organi generalmente
invisibili ai raggi X.
• Il solfato di bario è praticamente inerte per via della sua
bassissima solubilità. In ogni caso, per evitare il pur minimo
rilascio di Ba++ (tossico), viene somministrato in
associazione con solfato di sodio.
CLORURO DI SODIO – NaCl
• Il cloruro di sodio viene utilizzato principalmente per
preparare soluzioni isotoniche.
• Viene somministrato per infusione in caso di pazienti
soggetti a perdite di sodio come in caso di gastroenteriti,
chetoacidosi diabetica ed ileo paralitico.
• Va limitata la somministrazione in caso di scompenso
cardiaco, insufficienza renale, ipertensione, edema
periferico e polmonare.
• In caso di deficit contemporaneo di sodio ed acqua si usa
una miscela 1:1 di cloruro di sodio isotonico e di glucosio al
5 %. La funzione del glucosio è quella di permettere
l’ingresso di una quota di acqua libera nelle cellule che
soffrono maggiormente per la disidratazione.
• Il cloruro di sodio è anche utilizzato in preparazioni
oftalmiche per far sì che la soluzione sia isotonica col
liquido lacrimale.
CISPLATINO1
Cl
H3N
NH3
Cl
Pt
H3N
cis
(attivo)
Pt
Cl
H3N
Cl
trans
(inattivo)
• Il cis-diamminodicloroplatino (II) (cis-DDP, cisplatino) è
stato scoperto nel 1844, quando venne sintetizzato da
Michel Peyrone, e divenne noto con il nome di Cloruro di
Peyrone.
• Cinquant’anni dopo Alfred Werner, nella sua teoria della
chimica di coordinazione, assegnò correttamente a questo
composto la geometria cis.
• La sua struttura venne definitivamente determinata ai raggi
X solo nel 1966.
• Nello stesso periodo, Barnett Rosenberg, ipotizzando
un’analogia fra fuso mitotico e linee di forza di un campo
elettrico, osservò che, facendo passare della corrente
alternata attraverso una coltura di Escherichia coli,
mediante una coppia di elettrodi di platino, le cellule
smettevano di dividersi e si allungavano formando
filamenti.
• Rimuovendo il campo elettrico, la divisione cellulare
riprendeva dopo circa due ore.
CISPLATINO2
• Le cellule, sottoposte al campo elettrico, smettevano di
duplicarsi, ma la crescita non veniva arrestata (potevano
raggiungere una dimensione fino a 300 volte quella
normale).
Senza cis-DPP
Con cis-DPP
• Ulteriori studi portarono ad ipotizzare che gli effetti sulla
crescita batterica non erano imputabili al campo elettrico,
ma bensì ad una nuova specie chimica generata dal
processo elettrolitico.
• Successivamente
cisplatino.
questa
specie
fu
identificata
nel
• Rosenberg continuò i suoi studi dapprima su linee cellulari
di topo, poi direttamente su animali osservando una
completa regressione del tumore a seguito del trattamento
con cisplatino.
• I risultati furono eccezionali per l’epoca poiché non si
conoscevano altri farmaci antitumorali.
CISPLATINO3
Meccanismo d’azione:
• Il principale bersaglio del cisplatino è il DNA: esso è in
grado di formare addotti col DNA.
• Legandosi al DNA, inibisce l’azione progressiva della DNApolimerasi, enzima chiave nel processo di duplicazione
cellulare (blocco in fase S del ciclo cellulare).
• La formazione di complessi non è sufficiente per spiegarne
l’attività, poiché anche il trans-DPP è in grado di legarsi al
DNA, ma non possiede attività antiproliferativa.
• Probabilmente la differente geometria dei complessi delle
due specie presenta delle differenze tali che soltanto un
tipo è riconosciuto dagli enzimi coinvolti nel ciclo cellulare.
Somministrazione:
• Viene somministrato ai pazienti per via endovenosa in
soluzione salina (contenente cloruro di sodio) sterile.
• Una volta entrato nel flusso sanguigno, il farmaco rimane
inalterato a causa dell’elevata concentrazione di ioni
cloruro.
• Entra nelle cellule sia per diffusione passiva, sia per
assorbimento attivo da parte delle cellule stesse.
• Durante questo processo la concentrazione degli ioni
cloruro cala drasticamente, determinando l’idrolisi della
molecola con formazione di specie cariche positivamente
che sono la forma attiva.
MERCURIALI
• I mercuriali sono farmaci inorganici a base di mercurio che
sono stati utilizzati dal 1850 ai primi del 1900 nella cura di
malattie veneree come la sifilide.
• Si tratta di un’infezione dovuta al Treponema pallidum che
può causare danni al SNC, occhi, sistema cardiovascolare,
fegato, ossa e articolazioni.
• Il loro utilizzo è stato abbandonato con l’avvento degli
antibiotici a causa della loro scarsa attività, ma soprattutto
per la tossicità.
• Il mercurio era somministrato sottoforma di unzioni, frizioni,
impiastri, inalazioni con cinabro (HgSO4), pillole (pillole del
Barbarossa a base di mercurio metallico).
• Gli effetti curativi sono:
• cessazione dei dolori ossei;
• scomparsa delle manifestazioni cutanee tipiche;
• abbondante salivazione e sudorazione (si credeva che
questi fenomeni favorissero l’eliminazione del “veleno”
della malattia).
• Gli effetti collaterali sono piuttosto gravi (avvelenamento da
mercurio):
• disidratazione legata all’eccessiva salivazione
sudorazione;
• diarrea (e conseguente disidratazione);
• ulcere cutanee;
• tremori e paralisi;
• perdita dei denti.
e
BROMURI - NaBr, KBr, CaBr2
• Nel 1800, prima della scoperta degli psicofarmaci, i bromuri
erano utilizzati come deprimenti del SNC e più in
particolare come sedativi.
• Venivano somministrati per via orale sottoforma di
compresse ed elisir.
• Nel 1912 furono scoperte le proprietà anticonvulsivanti del
KBr che fu utilizzato fino al 1957, anno di scoperta del
fenobarbital, per calmare le convulsioni dovute all’epilessia.
• Il KBr è ancora oggi usato come anticonvulsivante per uso
veterinario.
• Alcune nazioni autorizzano la somministrazione del KBr
agli esseri umani in associazione col fenobarbital.
Meccanismo d’azione:
• Il bromuro compete col cloro nel trasporto attraverso le
membrane.
• Essendo gli ioni bromo in grado di penetrare in quantità
maggiore rispetto agli ioni cloro, viene indotta una
iperpolarizzazione delle membrane neuronali.
• Grazie ad un potenziale di riposo più negativo, i neuroni
sono minormente soggetti al superamento della soglia di
eccitazione.
• Tale soglia risulta così più elevata e quindi meno soggetta
ad essere superata anche dalle scariche provenienti da un
focolaio epilettico.
PROTOSSIDO D’AZOTO - N2O
• Il protossido d’azoto (gas esilarante) è un anestetico
generale che viene somministrato per via inalatoria.
• Gli anestetici generali vengono utilizzati in chirurgia perché
inducono: sedazione, amnesia, analgesia, atonia e
incoscienza.
• Le sue proprietà furono scoperte nel 1772 da Joseph
Priestley, tuttavia la sperimentazione come anestetico
generale in chirurgia è della metà del 1800.
• E’ adatto per ottenere un’azione rapida limitata allo stato
analgesico
• E’ attivo ad alte concentrazioni (50-80%) miscelato con
ossigeno (50-20%) ed eventualmente con altri gas
anestetici per ottenere un più profondo effetto analgesiconarcotico.
• L'effetto anestetico del protossido d’azoto non è ben chiaro.
Sembra che il gas interagisca con le membrane dei neuroni
dell’SNC alterandone la permeabilità e di conseguenza la
comunicazione intracellulare a livello delle sinapsi.
• E’ utilizzato anche come propellente per aerosol.
PEROSSIDO D’IDROGENO – H2O2
• Il perossido d’idrogeno (acqua ossigenata) fu sintetizzato
per la prima volta nel 1818 da Louis Jacques Thénard.
• E’ un liquido incolore che ad alte concentrazioni può
esplodere spontaneamente per decomposizione:
H2O2
½ H 2O + O2 + 24,3 kcal
• Per questo motivo è utilizzato sempre in soluzione alla
concentrazione non superiore al 60%.
• La concentrazione può essere espressa anche in volumi
che sono i litri di ossigeno che si possono sviluppare da un
litro di soluzione acquosa (es. 3% = 10 volumi).
• Viene impiegato come disinfettante per ferite ed ulcere con
concentrazioni dal 3 al 6% (10-20 volumi).
• A causa del suo potere ossidante, bisogna evitare il
contatto con la pelle sana e gli occhi.
• Le bollicine che si sviluppano quando viene a contatto con
una ferita sono dovute all’enzima catalasi che decompone
l’acqua ossigenata in ossigeno.
• Le proprietà disinfettanti sono dovute:
• Azione chimica:
agisce da ossidante denaturando le proteine batteriche.
• Azione meccanica:
le bollicine di gas che si sviluppano per
decomposizione, allontanano meccanicamente i batteri
che si possono annidiare al’interno della ferita.
IPOCLORITO DI SODIO – NaClO
• L’ipoclorito di sodio (candeggina, varechina) è utilizzato in
soluzione dall’1 al 4% come sbiancante e disinfettante per
via della sua forte azione ossidante.
• L’attività disinfettante è dovuta all’ossidazione e quindi alla
denaturazione delle proteine batteriche.
• L’amuchina è una soluzione di ipoclorito di sodio ottenuto
elettrochimicamente da una soluzione di NaCl. In 100 ml di
soluzione sono contenuti:
• 1,15 g di NaClO
• 18 g NaCl
• 35 mg di Na2B4O7
• 35 mg di NaOH
• Attenzione a non miscelare l’ipoclorito di sodio con HCl,
NH3:
2 ClO + 2 H+
H2O + Cl2
il cloro gassoso è tossico ed aggressivo.
NH3 + HClO
H2O + H2NCl
le clorammine sono tossiche
decompongono a dare cloro.
clorammina
(cancerogene)
e
si
OZONO – O3
• L’ozono è un gas dal caratteristico odore agliaceo. E’
estremamente tossico in quanto è un forte ossidante.
• Benché sia 15 volte più solubile in acqua dell’ossigeno, le
sue soluzioni non sono stabili.
• Il nostro olfatto è in grado di rilevarlo anche quando è
presente in quantità inferiore a 1 p.p.m., concentrazione
che già lo rende irritante. A 10 p.p.m. è nettamente tossico.
• E’ instabile e deve essere generato in situ per poter essere
utilizzato mediante ozonizzatori che convertono l’ossigeno
dell’aria in ozono mediante scariche elettriche.
• Viene utilizzato per le sue proprietà disinfettanti alla stessa
stregua del cloro (per es. disinfezione delle acque, aria,
ambienti, prodotti alimentari, pulizia dei tessuti, ecc).
• In medicina, l’ozono viene usato principalmente per curare
malattie del sistema scheletrico quali le ernie discali. Viene
somministrato in soluzione con iniezioni intra-articolari.
• Agisce con due differenti meccanismi:
• Azione biomeccanica.
Azione diretta con rottura dei legami delle catene
macromolecolari del disco leso con conseguente
destrutturazione che porta a disidratazione e riduzione
di volume.
• Azione biologica.
Rilascio di citochine (interferone, TNF, interleuchine,
etc). Ossigenazione dei tessuti e angiogenesi che
migliora la perfusione dei tessuti danneggiati.
ANIDRIDE CARBONICA – CO2
• L’anidride carbonica (biossido di carbonio) è un gas
incolore ed inodore. Non è tossico in sé, ma ad alte
concentrazione può indurre la morte per asfissia.
• E’ solubile in acqua e può essere disciolta maggiormente
sotto pressione per formazione dell’acido carbonico:
CO2 + H2O
H2CO3
• L’acqua gassosa semplice, riportata nella F.U. III ed., è una
soluzione di acido carbonico ed acqua sotto pressione a 5
atmosfere circa.
• Le soluzioni acquose di anidride carbonica hanno una
blanda azione vasodilatatrice e revulsiva (aumento
dell’afflusso di sangue a livello dei tessuti superficiali) sulla
pelle e sulla mucosa gastrica. Hanno anche un’azione
digestiva.
• Il biossido di carbonio solido (ghiaccio secco, -78° C) viene
usato per raffreddare reazioni e per conservare per breve
tempo preparati biologici.
• La CO2 supercritica (ha proprietà intermedie fra un liquido
ed un gas e in più non ha tensione superficiale) viene
utilizzata per estrarre sostanze da miscele complesse (es.
caffeina direttamente dai chicchi di caffè, oli essenziali,
etc).
XENO - Xe
• Lo xeno è un anestetico generale che viene somministrato
per via inalatoria.
• E’ piuttosto costoso.
• Sono stati proposti due meccanismi d’azione:
• Meccanismo specifico.
Lo xeno è in grado di inibire la pompa calcio-ATPasi
che viene usata dalle cellule neuronali a livello sinaptico
per rimuovere il Ca++. In particolare, legandosi ai siti
apolari, induce una variazione nella struttura 3D del
trasportatore (variazione conformazionale) che ne
inibisce l’attività.
• Meccanismo aspecifico
Lo xeno altera le proprietà chimico-fisiche delle
membrane neuronali (permeabilità agli ioni) riducendo
la capacità di trasmettere segnali.
• Non è tossico e può essere maneggiato senza particolari
precauzioni.
• L’isotopo 129Xe è utilizzato nella diagnostica per immagini a
risonanza magnetica nucleare, soprattutto delle vie
respiratorie, per via della sua iperpolarizzabilità che
incrementa la sensibilità dell’analisi.
Bicarbonato d’ammonio – NH4HCO3
• Il bicarbonato d’ammonio è un solido bianco dal lieve odore
di ammoniaca.
• A temperature superiori ai 35°si decompone:
NH4CO3
NH3 ↑+ CO2 ↑ + H2O
• Per questo motivo è utilizzato come agente lievitante per
dolci in associazione con altri sali acidi (lievitazione
chimica).
• Nell’industria alimentare (sigla E503) è impiegato per
regolare
l’acidità
per
permettere
una
migliore
conservazione dei prodotti.
• In Cina è utilizzato anche come fertilizzante economico, ma
ultimamente è stato soppiantato dall’urea perché è
relativamente di bassa qualità ed è parzialmente instabile.







![Sodio Cloruro 0,9% [Soluzione Fisiologica]](http://s1.studylibit.com/store/data/004244744_1-685f63962c5e93590a4b66404cfb3964-300x300.png)
