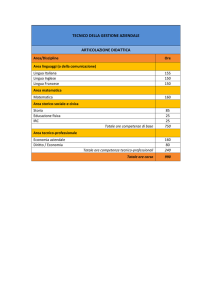
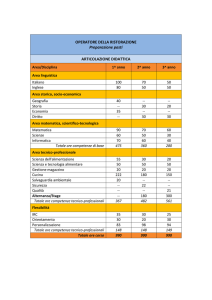
ASSISTENZA PRIMARIA – AGOSTO/settembre 2002
FARMACOVIGILANZA
Si riportano le note informative più significative trasmesse dal
Ministero della Salute nell’arco del mese di luglio, attraverso la rete
nazionale per la farmacovigilanza.
Tutte le informative sono disponibili sul sito internet del Ministero
all’indirizzo
www.sanita.farmaci.it/farmaci
alla
voce
“Note
Informative Importanti”.
EPREX, EPOXITIN, GLOBUREN
Il Ministero della Salute ha aggiornato le informazioni
sulla sicurezza delle specialità medicinali a base epoetina alfa,
in merito al rischio dell’aplasia specifica della serie rossa
(PRCA) diagnosticata in pazienti con insufficienza renale
cronica (IRC) trattati con epoetina alfa commercializzata in Italia
con il marchio Eprex, Epoxitin e Globuren.
Con Dear Doctor Letter del 15/11/2001 il Ministero della
Salute, in accordo con la Janssen-Cilag, aveva fornito alcune
informazioni sulla sicurezza delle specialità
contenenti
epoetina alfa, comunicando che dall’esperienza post-marketing
erano emersi 40 casi rari di PRCA in pazienti con IRC.
Il 18 luglio 2001 ha pubblicato una nuova Dear Doctor
Letter recante importanti informazioni sulla sicurezza ed in
particolare sulle modalità di somministrazione dell’epoetina
alfa nei pazienti con IRC.
Con questa si rende noto che al 31 maggio 2002, i casi
segnalati di sospetta PRCA in pazienti con IRC, sono saliti a
141 di cui 114 confermati dall’esame del midollo; la maggior
parte di questi è associata alla somministrazione per via
sottocutanea di Eprex, Epoxitin e Globuren, solo a pazienti
con IRC.
Il Ministero raccomanda:
la somministrazione dei suddetti farmacia, a pazienti con IRC
per via endovenosa (nel caso non fosse possibile la
somministrazione endovenosa, dovrebbe essere valutato il
rapporto rischio/beneficio della somministrazione sottocutanea);
l’interruzione immediata della somministrazione di Eprex,
Epoxitin e Globuren in caso di diagnosi di PRCA e deve
essere considerata l’esecuzione dei test per gli anticorpi
antieritropoietina;
non dirottare il paziente verso il trattamento con altre
eritropoietine data la reattività crociata tra eritropoietine;
segnalare ogni presunta reazione avversa secondo la
normativa vigente;
attenersi alle indicazioni per le quali sono registrate le singole
specialità medicinali;
raccomandare al paziente la conservazione alla temperatura
tra 2°e 8°C ;
in caso di ulteriori chiarimenti contattare il n° verde: 800821174
SABRIL
Il Ministero della Salute ha pubblicato Dear Doctor Letter con
la quale richiama l’attenzione dei medici sulla possibile
insorgenza di difetti del campo visivo in seguito al trattamento
con SABRIL e quindi alla necessità di controlli regolari.
A tal fine è stata predisposta e pubblicata sul medesimo sito,
la Scheda per il Paziente, già in corso di distribuzione presso i
Medici prescrittori per la successiva consegna ai pazienti in
trattamento.
La suddetta scheda è già disponibile presso i Distretti
dell’ASL.
Il Ministero della Salute
richiama l’attenzione sull’appropriatezza della prescrizione
ricordando che la specialità medicinale è autorizzata soltanto
per il
trattamento in associazione con altri antiepilettici per
pazienti con epilessia parziale resistente con o senza
generalizzazione secondaria e per la monoterapia nel trattamento
di spasmi infantili (sindrome di West);
informa che in pazienti trattati con Vigabatrin (SABRIL) sono
stati riportati difetti del campo visivo con un’alta prevalenza
(approssimativamente 1/3);
fa presente che i dati disponibili suggeriscono che i difetti del
campo visivo sono irreversibili anche dopo l’interruzione del
trattamento;
invita a sottoporre tutti i pazienti ad una visita oculistica con
esame del campo visivo prima di iniziare il trattamento con
Vigabatrin ed almeno ad intervalli di 6 mesi per l’intera durata del
trattamento;
raccomanda di avvisare il paziente di segnalare al proprio Medico
ogni sintomo visivo e qualora si sviluppassero sintomi visivi,
inviare il paziente a visita oculistica. Se si manifesta un
restringimento del campo visivo valutare l’interruzione graduale
del trattamento.>
Dall’analisi delle prescrizioni effettuate nell’anno 2001, dai
MMG e dai PLS dell’ASL di Brescia, é emerso che sono stati
trattati 233 Pazienti con 3.155 confezioni di Sabril, così
suddivisi :
PLS :
201 conf. a 43 assistiti
MMG 2.954 conf. a 190 assistiti
Si invitano quindi i Medici prescrittori a vigilare e segnalare
all’ASL anche il sospetto di eventuali eventi avversi da farmaci.
Luisa Colombi
Responsabile Farmacovigilanza
ASL di Brescia