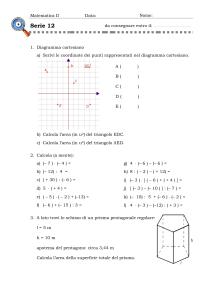
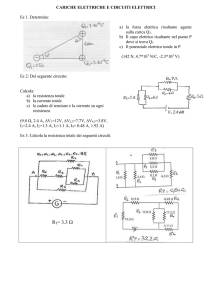
I.T.I.S. T. BUZZI – a.s. 2008/’09
prof.ssa Elisabetta Tempestini
VERIFICA FORMATIVA – MECCANICA APPLICATA
classe 4M – 26 marzo '09
Esercizio n.1
Una massa d'aria viene compressa da p1=2,5 bar e v1=0,344 m3/kg a p2=5 bar.
Calcola i valori finali assunti dal volume massico v2 in seguito a:
una compressione adiabatica ideale
una compressione adiabatica reale (politropica) con esponente m=1,46.
Disegna poi le due trasformazioni sul piano di Clayperon.
Esercizio n.2
Calcola il volume massico dell'aria mediante l'equazione di stato dei gas perfetti quando si
trova a pressione atmosferica e temperatura 20°, 80° e 150°.
Esercizio n.3
Calcola la massa di azoto che occupa un volume di 35 litri alla pressione di 840 mm Hg ed alla
temperatura di 60°.
Esercizio n.4
Una massa unitaria di etano compie una trasformazione di compressione da uno stato iniziale
1, caratterizzato da v1=0,25 m3/kg e T1=293 K, ad uno stato finale 2, caratterizzato da
v2=0,085 m3/kg e T2=310 K. La trasformazione è una linea retta che collega i punti 1 e 2.
Calcola il lavoro ed il calore scambiati con l'esterno.
I.T.I.S. T. BUZZI – a.s. 2008/’09
prof.ssa Elisabetta Tempestini
VERIFICA FORMATIVA – MECCANICA APPLICATA
classe 4M – 26 marzo '09
Esercizio n.1
Una massa d'aria viene compressa da p1=2,5 bar e v1=0,344 m3/kg a p2=5 bar.
Calcola i valori finali assunti dal volume massico v2 in seguito a:
una compressione adiabatica ideale
una compressione adiabatica reale (politropica) con esponente m=1,46.
Disegna poi le due trasformazioni sul piano di Clayperon.
Esercizio n.2
Calcola il volume massico dell'aria mediante l'equazione di stato dei gas perfetti quando si
trova a pressione atmosferica e temperatura 20°, 80° e 150°.
Esercizio n.3
Calcola la massa di azoto che occupa un volume di 35 litri alla pressione di 840 mm Hg ed alla
temperatura di 60°.
Esercizio n.4
Una massa unitaria di etano compie una trasformazione di compressione da uno stato iniziale
1, caratterizzato da v1=0,25 m3/kg e T1=293 K, ad uno stato finale 2, caratterizzato da
v2=0,085 m3/kg e T2=310 K. La trasformazione è una linea retta che collega i punti 1 e 2.
Calcola il lavoro ed il calore scambiati con l'esterno.
Esercizio n.5
Calcola la temperatura di una massa di 150 g di idrogeno che si trova alla pressione p=13
MPa e occupa il volume V=17 litri.
Esercizio n.6
Calcola la variazione di energia interna di un sistema termodinamico che assorbe dall'esterno
il lavoro L=200 KJ ed emette il calore Q=210 KJ.
Esercizio n.7
Calcolare il lavoro compiuto dalla massa di un gas m=1,3 kg che si comprime da un volume
massico iniziale di 0,56 m3/kg a un volume finale di 0,18 m 3/kg, sotto una pressione esterna
costante di 90 kPa.
Esercizio n.8
Un'espansione isoterma d'aria ha inizio alla pressione p1=6 bar e al volume V1=8 litri e si
conclude a pressione ambiente p2=1 bar. Calcola il volume finale V2 ed il lavoro erogato dal
gas.
Esercizio n.9
Un gas ha la costante caratteristica R=260 kJ/(kg K) e la costante k=1,4. Ricava i valori di c p e
di cv.
Esercizio n.5
Calcola la temperatura di una massa di 150 g di idrogeno che si trova alla pressione p=13
MPa e occupa il volume V=17 litri.
Esercizio n.6
Calcola la variazione di energia interna di un sistema termodinamico che assorbe dall'esterno
il lavoro L=200 KJ ed emette il calore Q=210 KJ.
Esercizio n.7
Calcolare il lavoro compiuto dalla massa di un gas m=1,3 kg che si comprime da un volume
massico iniziale di 0,56 m3/kg a un volume finale di 0,18 m 3/kg, sotto una pressione esterna
costante di 90 kPa.
Esercizio n.8
Un'espansione isoterma d'aria ha inizio alla pressione p1=6 bar e al volume V1=8 litri e si
conclude a pressione ambiente p2=1 bar. Calcola il volume finale V2 ed il lavoro erogato dal
gas.
Esercizio n.9
Un gas ha la costante caratteristica R=260 kJ/(kg K) e la costante k=1,4. Ricava i valori di cp e
di cv.