RASSEGNA
“Mal d’Africa” e cuore:
i misteri della fibrosi endomiocardica
Antonio Grimaldi1, Ottavio Alfieri1, Paolo G. Camici1, Giovanni La Canna1,
Gianna Zoppei1, Iacopo Olivotto2
1
Dipartimento Cardio-Toraco-Vascolare, Ospedale Scientifico San Raffaele e Università Vita-Salute, Milano
Centro di Riferimento per le Cardiomiopatie, Dipartimento Cuore e Vasi, Azienda Ospedaliera Universitaria Careggi, Firenze
2
The epidemic of cardiovascular disease is a global phenomenon and the magnitude of its increase in incidence
and prevalence in low-income countries has potentially major implications for those high-income countries
that characterize the developed world. The “epidemiologic transition” provides a useful framework for understanding changes in the patterns of disease as a result of socioeconomic and demographic developments.
According to the migratory flow, the burden of African immigrants in Italy is rising, and there is a need to reassess the clinical management of anything but obsolete western cardiovascular disorders also delving into
the rare tropical neglected diseases. Rheumatic fever and tropical cardiac diseases, such as endomyocardial
fibrosis in Africa and Chagas disease in Latin America, require a human resource framework to direct into research and intervention programs. This review will focus upon endomyocardial fibrosis, by far the most common type of restrictive cardiomyopathy worldwide, still an unsolved puzzle from a pathophysiological point
of view and in need of more attention from the international community of cardiologists. In this paper the
data from the literature are implemented by our personal experience at the St. Raphael of St. Francis Hospital-Nsambya and the Ugandan Heart Institute of Kampala, the capital town of Uganda.
Key words. Endomyocardial fibrosis; Primary cardiomyopathies; Tropical neglected diseases.
G Ital Cardiol 2011;12(5):319-326
INTRODUZIONE
Le malattie cardiovascolari rappresentano una vera e propria
epidemia globale, che interessa prevalentemente i paesi industrializzati, ma la cui portata sta aumentando esponenzialmente
anche nei paesi in via di sviluppo. In un’epoca di flussi migratori senza precedenti, si assiste inoltre ad una vera e propria
transizione epidemiologica1 per cui la presenza di un numero
crescente di cittadini immigrati determina sia un incremento
del tasso di ospedalizzazione per cardiopatie tipicamente occidentali, quali cardiopatia ischemica e scompenso cardiaco, che
non prevedono programmi di prevenzione primaria o secondaria nei paesi in via di sviluppo, sia la recrudescenza di malattie considerate obsolete alle nostre latitudini, quali la malattia
reumatica o le complicanze cardiologiche da tubercolosi. Tutto
questo sta portando alla necessità di rivedere i criteri diagnostici
e i protocolli terapeutici di patologie che erano quasi scomparse dalla nostra pratica clinica. Allo stesso tempo, vi sono patologie endemiche di paesi in via di sviluppo che non hanno ancora un significativo riscontro epidemiologico nel mondo occidentale. La malattia reumatica e la cardite reumatica2 da un lato e le malattie cardiache tropicali rare dall’altro, quali la fibro-
© 2011 Il Pensiero Scientifico Editore
Ricevuto 07.03.2011; accettato 06.04.2011.
Gli autori dichiarano nessun conflitto di interessi.
Per la corrispondenza:
Dr. Antonio Grimaldi Dipartimento Cardio-Toraco-Vascolare,
Ospedale Scientifico San Raffaele, Via Olgettina 60, 20132 Milano
e-mail: [email protected]
si endomiocardica (FEM) in Africa3 e la malattia di Chagas in
America Latina4, impongono una fitta rete di risorse umane ed
assistenziali da coinvolgere nei programmi di prevenzione, diagnosi, cura e ricerca scientifica. Si tratta in genere di patologie
“orfane” in quanto scarsamente oggetto di ricerca e prive di terapie specifiche, ma meritevoli di approfondimento conoscitivo
in quanto potenzialmente “importabili” con i flussi migratori
anche nel nostro paese. In questa prospettiva ci siamo proposti di focalizzare l’attenzione su una malattia endemica nel continente africano: la FEM.
EPIDEMIOLOGIA E PATOGENESI
DI UNA MALATTIA RARA
La FEM, descritta per la prima volta in Uganda nel 19485, è
considerata oggi la più comune forma di miocardiopatia restrittiva, colpisce circa 10 milioni di individui in tutto il mondo2
ed è endemica nei paesi dell’Africa equatoriale6, in Brasile e in
India7. Nelle aree endemiche rappresenta la seconda causa di
ospedalizzazione per malattie acquisite nell’età pediatrica e nei
giovani adulti, subito dopo la malattia reumatica8,9, fino a rappresentare il 20% di tutte le cause di scompenso cardiaco. Dai
dati epidemiologici disponibili a livello di comunità, la prevalenza di FEM risulta più alta nel sesso maschile ed ha una distribuzione bimodale10 per quanto riguarda l’età di insorgenza, con un primo picco nei pazienti in età pediatrica e negli
adolescenti, ed un secondo picco nella quarta decade di vita.
Tale distribuzione potrebbe riflettere, nel primo caso, l’esposizione a fattori ambientali o infettivi in grado di causare da soG ITAL CARDIOL | VOL 12 | MAGGIO 2011
1
A GRIMALDI ET AL
CHIAVE DI LETTURA
Ragionevoli certezze. La presenza di un numero
progressivamente crescente di cittadini
immigranti determina la necessità di rivedere i
principali criteri per la diagnosi ed il trattamento
di malattie cardiovascolari considerate “obsolete”
alle nostre latitudini, quali la malattia reumatica e
la cardite reumatica, e di approfondire la
conoscenza di malattie tropicali come la malattia
di Chagas in America Latina e la fibrosi
endomiocardica (FEM) in Africa, quale esempio
di cardiopatie “neglected” nei paesi occidentali ma
potenzialmente “importabili” con i flussi
migratori. La FEM è la forma più comune oggi di
miocardiopatia restrittiva nel mondo ed è
responsabile fino al 9-20% dei casi di scompenso
cardiaco.
Questioni aperte. La FEM rappresenta un vero
mistero dal punto di vista dell’inquadramento
clinico per la molteplicità dei fattori
eziopatogenetici che si sommano nel determinare
uno spettro clinico assai variabile in termini di
espressività e penetranza. La chirurgia ha un
effetto benefico sui sintomi e sulla sopravvivenza
ma un approccio sistematico richiederebbe
un’accurata caratterizzazione diagnostica della
malattia nelle fasi più precoci, quando cioè
l’obliterazione ventricolare non sia estrema al
punto da controindicare qualsiasi opzione
chirurgica non trapiantologica. L’ecocardiografia
rappresenta lo strumento più semplice e completo
per la diagnosi di FEM, in rapporto alla capacità
di definizione delle caratteristiche morfologiche e
funzionali. La forma di miocardiopatia che in
occidente sembra avvicinarsi maggiormente alla
FEM è l’endocardite di Loeffler, della quale è nota
l’eziopatogenesi infiammatoria/immunomediata
nel contesto di patologie sistemiche più complesse
con interessamento multiorgano. Il comune
coinvolgimento miocardico nelle due forme
prevede una componente infiammatoria acuta, la
successiva trombosi endoventricolare secondaria
al danno vascolare e la FEM con interessamento
del tessuto delle valvole atrioventricolari. Si tratta
di una diagnosi complessa anche nelle migliori
realtà occidentali, dove solo l’integrazione di
competenze interdisciplinari tra cardiologia,
immunologia, medicina generale ed imaging
mirato determina il corretto inquadramento
diagnostico e terapeutico. Sussiste dunque una
chiara necessità di risorse umane coinvolte nella
pianificazione di programmi di prevenzione,
diagnosi, trattamento e ricerca scientifica.
Le ipotesi. La possibilità di estendere i
programmi di ricerca a modelli nosologici affini
presenti nel mondo occidentale può tradursi nello
sviluppo di nuove strategie diagnostiche e
2
G ITAL CARDIOL | VOL 12 | MAGGIO 2011
terapeutiche. Inoltre, integrando i dati della
letteratura con l’esperienza assistenziale e
scientifica di gruppi di ricerca in Italia e nei
territori in cui la malattia è endemica (per
l’Uganda, il St. Raphael of St. Francis HospitalNsambya e l’Ugandan Heart Institute della
capitale Kampala) può essere auspicabile la
creazione di un registro italiano specifico per
l’endocardite di Loeffler e la FEM, teso ad
aumentare la sensibilità nei confronti di queste
entità rare e il corretto inquadramento
diagnostico e terapeutico.
li la malattia in giovane età e, nel secondo, l’effetto additivo di
agenti eziologici più blandi che si sommano in tempi diversi
determinando manifestazioni più tardive. Ancora oggi l’eziopatogenesi rimane sconosciuta nei paesi dell’Africa equatoriale, nonostante numerose ipotesi, non mutuamente esclusive,
che includono l’effetto cardiotossico dell’infiltrazione eosinofila secondaria ad infezioni parassitarie comuni nelle aree endemiche e infezioni da agenti quali il Plasmodium species11, lo
schistosoma, la microfilaria12, gli elminti13, agenti virali del tipo
Coxsackie B e Arbovirus, e il Toxoplasma gondii14. Sono stati
inoltre evocati fattori patogenetici quali predisposizione familiare15, autoimmunità16 e fattori chimici ed ambientali come
l’esposizione a sostanze (cerio)17. Infine, è stato ipotizzato un
ruolo per specifici fattori dietetici quali la malnutrizione cronica e l’ingestione abituale di tuberi di cassava (tapioca) associata ad un regime dietetico molto carente in termini di aminoacidi quali il triptofano18,19.
Studi condotti in comunità africane e rivolti a considerare la
FEM come variante delle sindromi ipereosinofile non sono risultati esaustivi in tal senso. Da una parte, nelle fasi iniziali della FEM è stata riscontrata una relazione inversa tra ipereosinofilia e durata di malattia, e sussiste una indubbia analogia tra alcune manifestazioni della FEM e le sindromi da ipereosinofilia,
quali l’endocardite di Loeffler (come discusso più avanti). Dall’altra, l’eosinofilia è assente nei reperti bioptici ed autoptici20
delle lesioni endocardiche fibrotiche e trombotiche; le forme
aberranti di eosinofili degranulati non sono presenti nel sangue e nell’aspirato midollare dei pazienti affetti da FEM e non
vi sono differenze significative nella concentrazione media delle proteine basiche rispetto ai soggetti normali21. Inoltre, la prevalenza di infezioni parassitarie, noto trigger per l’eosinofilia,
non è significativamente maggiore nei pazienti colpiti da FEM
rispetto alla popolazione generale21,22.
PRESENTAZIONE CLINICA
ED INQUADRAMENTO DIAGNOSTICO
L’esordio e le manifestazioni cliniche della malattia appaiono
alquanto disomogenei, con uno spettro variabile da forme lievi a prevalente coinvolgimento del ventricolo destro e senza
segni rilevanti, a forme dominate dallo scompenso cardiaco
avanzato. L’esiguità di dati omogenei su campioni di popolazioni intra- ed extraospedaliere non consente di stabilire se le
differenti espressioni cliniche della malattia siano correlate a
forme realmente distinte sul piano della penetranza ed espres-
LA FIBROSI ENDOMIOCARDICA
sività o se invece rappresentino le fasi intermedie di un unico
processo evolutivo. I criteri maggiori e minori per la diagnosi di
FEM10,23 sono stati definiti sulla base di aspetti tipici delle fasi
avanzate di malattia e degli stati precoci descritti negli studi
autoptici (Tabella 1). La possibilità di eseguire uno screening
diagnostico a tappeto su cluster familiari in villaggi a bassissimo tenore socio-economico ed esposti ai fattori eziopatogenetici precedentemente descritti, potrebbe far luce sulla natura degli stadi precoci di malattia senza sintomi manifesti (infraclinical disease) e sull’eventuale evolutività clinica, nonché
favorire l’occasione per approfondire le conoscenze sulla base
costituzionale. Infatti, nello studio di Mocumbi et al.10 la prevalenza familiare di FEM in Mozambico è risultata elevata
(19.8%). Tuttavia solo il 22.7% dei soggetti con evidenza di
FEM allo screening ecocardiografico presentava i sintomi; la
maggior parte dei soggetti aveva i pattern ecocardiografici
morfo-funzionali compatibili con la diagnosi ma senza manifestazioni cliniche di malattia.
Anche dall’analisi seppur limitata derivante dall’esperienza del nostro gruppo in Uganda presso il St. Raphael of St.
Francis Hospital-Nsambya (Figura 1) e l’Ugandan Heart Institute della capitale Kampala, si evince che la maggior parte dei
casi di FEM intraospedalieri osservati (3 su 4) corrispondevano a forme avanzate di malattia con estesa obliterazione ven-
Tabella 1. Criteri ecocardiografici per la diagnosi e la stima di severità
della fibrosi endomiocardicaa.
Criteri
Criteri maggiori
Placche endomiocardiche di spessore >2 mm
Chiazze endomiocardiche sottili (≤1 mm)
coinvolgenti più di una parete ventricolare
Obliterazione dell’apice ventricolare destro o sinistro
Trombi o ecocontrasto spontaneo senza disfunzione
ventricolare severa
Retrazione dell’apice ventricolare destro
(“notch” apicale)
Disfunzione della valvola atrioventricolare da
intrappolamento del tessuto valvolare nella parete
Criteri minori
Chiazze endomiocardiche limitate ad
una parete ventricolare
Pattern di flusso restrittivo attraverso la valvola mitrale
o la tricuspide
Apertura diastolica della valvola polmonare
Diffuso ispessimento del lembo anteriore mitralico
Ingrandimento atriale e normali dimensioni ventricolari
Movimento paradosso del setto interventricolare
ed appiattimento della parete posteriorec
Aumentata ecogenicità della banda moderatrice
o di altre bande intraventricolari
a
Punteggio
2
3
4
4
4
1-4b
1
2
2
1
2
1
1
la diagnosi definitiva di fibrosi endomiocardica si basa sulla presenza
di due criteri maggiori o di un criterio maggiore associato a due criteri
minori. Un punteggio totale <8 indica forme lievi, da 8 a 15 forme moderate e >15 forme severe.
b
il punteggio è assegnato in rapporto alla severità dell’insufficienza della valvola atrioventricolare.
c
il movimento del setto interventricolare si riferisce ad un pattern ecocardiografico in M-mode ascrivibile all’obliterazione o restrizione dell’apice ventricolare sinistro in associazione ad insufficienza mitralica.
Tratta da Mocumbi et al.10, con il permesso dell’Editore.
Figura 1. Rappresentazione geografica dell’Uganda e presentazione
del St. Raphael of St. Francis Hospital-Nsambya della capitale Kampala con gli spazi esterni dell’ospedale e la sede del servizio diagnostico
di ecocardiografia.
tricolare fino a costituire il 7% di tutte le cause di scompenso
cardiaco nel campione di popolazione sottoposto allo screening ecocardiografico (Figura 2). La prevalenza di FEM nel nostro campione di osservazione è così distribuita: 2.6% sul totale di 150 soggetti sottoposti a screening ecocardiografico;
3.6% su 110 soggetti con evidenza ecocardiografica di malattia cardiaca (68% di 150); 7% su 57 cardiopatici con segni
ecocardiografici e sintomi di scompenso cardiaco (52% di
110). Un solo paziente è risultato affetto da una forma lievemoderata di FEM senza sintomi manifesti e riscontrata occasionalmente durante un ricovero a seguito di traumatismo
stradale. Tutti i pazienti suddetti condividevano il medesimo
profilo di rischio, in rapporto al tipo di dieta ipoproteica ricca
in cassava, al basso reddito socio-economico e alla comune
esposizione ai vari fattori eziopatogenetici. Appare dunque
plausibile pensare che gli stadi iniziali di malattia siano caratterizzati da forme di parziale coinvolgimento ventricolare senza disfunzione manifesta o severo interessamento valvolare,
tuttavia caratterizzate da uno spettro subclinico di placche endocardiche funzionalmente non obliteranti. Nel tempo, la fibrosi dell’endocardio murale e delle valvole condurrebbe alla
via finale comune di una sindrome restrittiva con importanti
manifestazioni cliniche di scompenso24,25: nelle più comuni
forme di presentazione (prevalente coinvolgimento del ventricolo destro), il quadro clinico è tipicamente dominato dalla
congestione venosa sistemica con esoftalmo, dalla cardiomegalia (Figura 3) e da epato-splenomegalia ed ascite che tipicamente risparmia gli arti inferiori quasi sempre asciutti e sottili26. Nelle fasi avanzate di malattia predominano lo scarso
sviluppo dei caratteri sessuali secondari con atrofia testicolare, ippocratismo digitale, ritardo di crescita e cachessia (Figura 4). Sebbene nelle aree endemiche il quadro clinico risulti di
facile interpretazione, l’ecocardiografia riveste un ruolo determinante per confermare la diagnosi e definire le anomalie
strutturali ed emodinamiche che permettono di differenziare
la FEM da pericardite costrittiva, peritonite tubercolare e schistosomiasi intestinale.
G ITAL CARDIOL | VOL 12 | MAGGIO 2011
3
A GRIMALDI ET AL
Malaa Reumaca
19%
19%
Ipertensione Arteriosa
12%
Cardiopaa Ischemica
12%
Cardiopae Congenite
Varie (Diabete, Peripartum, etc)
31%
7%
Fibrosi Endomiocardica
Popolazione totale: 150 sogge soopos a screening; Cardiopaci: 110 pz (68% di 150),
di cui 57 pz (52%) affe da scompenso cardiaco
Figura 2. Cause principali di scompenso cardiaco in un campione di pazienti cardiopatici afferenti all’ambulatorio di ecocardiografia del St. Raphael of St. Francis Hospital-Nsambya di Kampala, Uganda.
Figura 4. Stato cachettico in un giovane paziente
affetto da fibrosi endomiocardica.
Figura 3. Rx torace standard. Pattern radiologici in
un paziente affetto da fibrosi endomiocardica a
coinvolgimento biventricolare: severa cardiomegalia, versamento pericardico ed ipervascolarizzazione dei campi polmonari.
QUADRI ECOCARDIOGRAFICI
L’ecocardiografia rappresenta lo strumento più semplice e completo per la diagnosi di FEM, in rapporto alla capacità di definizione delle caratteristiche morfologiche e funzionali27-29, quali ispessimento e calcificazioni endocardiche, obliterazione apicale, disfunzione valvolare e trombosi (Tabella 1). I pattern ecocardiografici della FEM possono risultare molto variegati, ma
sono sostanzialmente classificabili in tre forme principali: 1) forme ad interessamento prevalente del ventricolo sinistro, 2) forme a coinvolgimento isolato del ventricolo destro; 3) forme biventricolari.
I casi qui rappresentati fanno riferimento a 3 pazienti affetti da FEM, valutati nel corso di missioni ugandesi presso il St.
Raphael of St. Francis Hospital-Nsambya e l’Ugandan Heart Institute di Kampala finalizzate a scopi assistenziali e scientifici
relativi allo studio delle malattie rare. I primi due casi illustrano
4
G ITAL CARDIOL | VOL 12 | MAGGIO 2011
i reperti ecocardiografici di FEM a prevalente coinvolgimento
ventricolare destro. I criteri attuali utilizzati per la diagnosi di
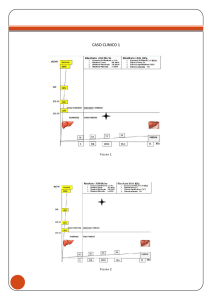
FEM del cuore destro sono rappresentati dalla riduzione parziale della cavità di afflusso destra (Caso 1, Figura 5A) fino alla
quasi completa obliterazione apicale (Caso 2, Figura 5C e 5D),
movimento paradosso del setto interventricolare, piano di clivaggio tra tessuto fibroso e miocardio, presenza di trombi parietali, dilatazione dell’atrio destro, intrappolamento fibrotico
(trapping) dei lembi tricuspidalici con insufficienza relativa (Caso 1, Figura 5B), dilatazione delle vena cava inferiore e versamento pleuro-pericardico. Il terzo paziente presenta invece FEM
a prevalente coinvolgimento ventricolare sinistro. Nelle forme
sinistre prevalgono la totale deformazione del ventricolo che
assume una forma ovoidale, spot calcifici dell’endocardio apicale (Figura 6A), retrazione estrema-ipoplasia del lembo mitralico posteriore con insufficienza correlata (Figura 6B e 6C) ed
ipertensione polmonare. Dal punto di vista diagnostico, la disfunzione della valvola atrioventricolare da intrappolamento del
tessuto valvolare nella parete del ventricolo è la risultante di ripetuti episodi infiammatori che conducono alla retrazione-ipoplasia estrema del lembi (Figura 6B); il processo è talmente rilevante sul piano morfo-funzionale e come determinante clinico dello scompenso, da rientrare nei criteri maggiori per la diagnosi di FEM descritti da Mocumbi et al.10 (Tabella 1). Tuttavia,
LA FIBROSI ENDOMIOCARDICA
occorre sottolineare che spesso le lesioni fibrotiche valvolari osservate all’ecocardiografia rappresentano la via finale comune
di valvuliti infiammatorie di svariata natura (reumatica, endocarditica, immunomediata, ecc.) per cui risulta davvero difficile
nella pratica clinica riconoscerne l’esclusiva dipendenza dalla
FEM in assenza di fibrosi ventricolare o di almeno un altro criterio. Tale riflessione assume una certa rilevanza se si pensa alla necessità di individuare lesioni precoci suggestive di FEM
quando il quadro è ancora sfumato. Se da un lato, dunque,
l’ecocardiografia è uno strumento semplice e sensibile per la
valutazione delle forme conclamate, siano esse moderate o clinicamente manifeste, può mancare tuttavia di specificità nell’inquadramento delle lesioni sfumate, aspecifiche agli occhi
della maggior parte degli ecocardiografisti e suscettibili di bias
additivi (overdiagnosis) nel caso di soggetti ad alta probabilità
pre-test di malattia30.
A tal proposito, occorre ricordare che la risonanza magnetica cardiaca rappresenta uno strumento ideale per definire con
particolare precisione le caratteristiche anatomiche e la localizzazione dei fenomeni di fibrosi, ipoperfusione ed obliterazione
cavitaria nei pazienti con FEM31, soprattutto per lo studio di
quelle lesioni precoci che “imbarazzano” la maggior parte degli ecocardiografisti abituati a osservarle e a minimizzarle in ambito occidentale. Ad oggi, però, se la risonanza magnetica cardiaca è ormai pienamente integrata nell’ambito dell’imaging
cardiovascolare multimodale nel mondo occidentale, essa è per
lo più inaccessibile nelle aree endemiche per la FEM. E dunque
il ruolo dell’ecocardiografia rimane preponderante per l’approccio immediato alla diagnosi, per la sistematizzazione dei
criteri diagnostici, per la stratificazione prognostica e per la selezione dell’appropriato timing chirurgico.
Figura 5. Immagini ecocardiografiche transtoraciche standard relative a due differenti pazienti affetti da fibrosi endomiocardica a prevalente coinvolgimento del ventricolo destro. Caso 1: parziale riduzione della camera di afflusso ventricolare con obliterazione distale (A,
frecce) e “trapping” fibrotico dei lembi tricuspidalici con insufficienza valvolare associata (B, freccia). Caso 2: forma di fibrosi endomiocardica del ventricolo destro con obliterazione quasi completa della
camera di afflusso (C, frecce) e severo “bulging” del setto interventricolare (D, frecce).
AD, atrio destro; VD, ventricolo destro.
PROGNOSI E TRATTAMENTO
La storia naturale della FEM in Africa non è ancora ben conosciuta. La sopravvivenza dal momento della diagnosi stimata,
inizialmente attorno ai 2 anni, è andata successivamente migliorando, ma resta infausta se non adeguatamente trattata,
in rapporto alla elevata incidenza di morte improvvisa da aritmie maligne e tromboembolia. Durante le fasi acute di malat-
Figura 6. Immagini ecocardiografiche transtoraciche relative ad un paziente affetto da fibrosi endomiocardica a prevalente coinvolgimento del ventricolo sinistro: calcificazioni
endocardiche ventricolari para-apicali (A, frecce), severa retrazione fibrotica-ipoplasia
(“trapping”) del lembo mitralico posteriore con insufficienza valvolare associata (B e C,
frecce).
AS, atrio sinistro; VS, ventricolo sinistro.
G ITAL CARDIOL | VOL 12 | MAGGIO 2011
5
A GRIMALDI ET AL
tia il trattamento è principalmente mirato a sostenere la funzione cardiaca e a ridurre il tasso di eosinofili circolanti attraverso l’impiego di corticosteroidi. La più comune tecnica chirurgica utilizzata si basa sulla resezione endocardica associata
alla chirurgia riparativa o sostitutiva valvolare, gravata tuttavia
da una mortalità del 15-30%32. La chirurgia ha un effetto benefico sui sintomi e sulla sopravvivenza33-35 ma trattandosi di
una malattia rara nei paesi occidentali ed essendo carenti le infrastrutture nella maggior parte delle aree in cui la FEM è endemica, l’esperienza chirurgica è limitata a campioni di popolazioni in genere riguardanti gli stadi più avanzati di malattia. I
risultati più incoraggianti relativi alla prognosi a lungo termine
riguardano i casi di FEM a prevalente coinvolgimento del cuore sinistro36. Un approccio più sistematico richiederebbe un’accurata caratterizzazione della malattia ai fini di programmare
un intervento chirurgico adeguatamente individualizzato per
ciascun singolo paziente37. A tal fine, l’importanza della diagnostica precoce, quando cioè l’obliterazione ventricolare non
sia estrema al punto da controindicare qualsiasi opzione chirurgica non trapiantologica, si evince anche nella nostra personale esperienza: un giovane paziente ugandese di 20 anni,
cui è stata riscontrata una forma di FEM con fibrosi limitata ad
un segmento parcellare del ventricolo destro ed insufficienza
mitro-tricuspidalica severa, è stato sottoposto a correzione chirurgica valvolare in maniera elettiva prima che l’eventuale
scompenso cardiaco potesse incidere sulla stima dell’EuroSCORE logistico preoperatorio. In tal caso il coinvolgimento postinfiammatorio delle valvole atrioventricolari è risultato prevalente rispetto alla fibrosi parietale e all’obliterazione ventricolare destra e l’intervento chirurgico di valvuloplastica mitralica e
tricuspidalica ha sortito un reale beneficio in termini di prognosi
a breve e medio termine.
SIMILITUDINI CON L’ENDOCARDITE DI LOEFFLER
Mentre per alcune forme relativamente rare di cardiomiopatie
osservabili alle nostre latitudini, quali la cardiomiopatia ipertrofica, i criteri di diagnosi e cura sono supportati da uno stadio
avanzato di conoscenze in campo clinico e molecolare, per malattie tropicali quali la FEM i dati a nostra disposizione sono alquanto frammentari. La possibilità di estendere i programmi di
ricerca a modelli nosologici affini presenti nel mondo occidentale può tradursi nello sviluppo di nuove strategie diagnostiche
e terapeutiche; tuttavia, la scarsità di nozioni in possesso riguardanti la FEM non rende agevole questo tipo di studi comparativi. La forma di miocardiopatia che in occidente sembra
avvicinarsi maggiormente alla FEM è l’endocardite di Loeffler,
della quale è nota l’eziopatogenesi infiammatoria/immunomediata nel contesto di patologie sistemiche più complesse con
coinvolgimento multiorgano38,39. È il caso dell’interessamento
cardiaco riportato nella Figura 7. Si tratta di un caso di sindrome di Churg–Strauss, in cui il tropismo cardiaco è la manifestazione locale di un coinvolgimento sistemico complesso che
include asma allergico, eosinofilia, infiltrati polmonari, anomalie dei seni paranasali e positività del titolo anticorpale pANCA.
In tali casi il coinvolgimento miocardico comprende una componente infiammatoria acuta con necrosi ed infiltrato eosinofilo, la successiva trombosi endoventricolare secondaria al danno vascolare e la FEM con interessamento del tessuto valvolare mitralico40, spesso confuso con esiti di valvulite reumatica. Si
tratta di una diagnosi complessa anche nelle migliori realtà occidentali, dove solo l’integrazione di competenze interdisciplinari tra cardiologia, immunologia, medicina generale ed imaging mirato sortisce il corretto inquadramento diagnostico e terapeutico. In Figura 8 è rappresentato un esempio di integrazione tra ecocardiografia transesofagea e risonanza magnetica
cardiaca nell’ambito dello studio di complicanze trombotiche
endoventricolari da cardite di Loeffler nel contesto di una sindrome di Churg-Strauss occidentale.
CONCLUSIONI E PROSPETTIVE FUTURE
La FEM rappresenta un vero e proprio mistero dal punto di vista clinico, eziologico e fisiopatologico e richiede maggiore attenzione da parte della comunità cardiologica internazionale.
Nei paesi in cui la malattia è endemica, restano da chiarire i costi relativi alla pianificazione degli interventi e come investire o
implementare i programmi di gestione. Finora, le risorse limitate
sono state finalizzate soprattutto al contenimento delle malattie trasmissibili (malaria, HIV/AIDS). Tuttavia, va affiorando una
progressiva coscienza riguardo alle malattie cosiddette “non
communicable”, quali cardiopatia ischemica, ictus e cardiomiopatie, con eventuali risvolti positivi in ambito preventivo e di
ricerca. In Italia, in considerazione delle analogie e del comune
coinvolgimento cardiaco delle sindromi ipereosinofile, sarebbe
auspicabile la creazione di un registro italiano di endocardite di
Figura 7. Endocardite di Loeffler in una giovane donna italiana affetta da sindrome di ChurgStrauss: immagini ecocardiografiche transtoracica e transesofagea (A) di flogosi attiva endocardica complicata da trombosi endoventricolare (triangoli). La proiezione 4 camere apicale standard
evidenzia il “trapping” fibrotico dei lembi mitralici con associata insufficienza valvolare (B, freccia).
AS, atrio sinistro; VS, ventricolo sinistro.
6
G ITAL CARDIOL | VOL 12 | MAGGIO 2011
LA FIBROSI ENDOMIOCARDICA
Figura 8. Esempio di “multimodality imaging” in una giovane paziente italiana
affetta da sindrome di Churg-Strauss complicata da endocardite di Loeffler: flogosi endocardica attiva complicata da trombosi endoventricolare apicale evidenziata alla risonanza cardiaca (A, frecce nere) e all’ecocardiografia transesofagea
(B, frecce bianche).
AS, atrio sinistro; VS, ventricolo sinistro.
Loeffler e di FEM, teso ad aumentare la sensibilità nei confronti di queste entità rare e il corretto inquadramento diagnostico
e terapeutico.
RIASSUNTO
L’epidemiologia delle malattie cardiovascolari è un fenomeno globale la cui incidenza e prevalenza aumentano esponenzialmente nei
paesi in via di sviluppo con implicazioni che riguardano anche i paesi
industrializzati. La transizione epidemiologica segue i flussi migratori e la presenza di un numero progressivamente crescente di immigranti in Italia ha determinato la necessità di rivedere i principali
criteri diagnostici e il trattamento di malattie cosiddette “obsolete”,
nonché di approfondire malattie cardiache rare potenzialmente
“importabili” con i flussi migratori. La malattia reumatica da un lato
e le malattie cardiache tropicali rare dall’altro, quali fibrosi endomiocardica in Africa e malattia di Chagas in America Latina, impongono una fitta rete di risorse umane ed assistenziali da coinvolgere nei programmi di prevenzione, cura e ricerca scientifica. In
questa rassegna focalizzeremo l’attenzione su una malattia “orfana” endemica in Africa, la fibrosi endomiocardica, integrando i
dati della letteratura con l’esperienza personale in Uganda presso
il St. Raphael of St. Francis Hospital-Nsambya e l’Ugandan Heart Institute della capitale Kampala. La fibrosi endomiocardica è la forma
più comune oggi di miocardiopatia restrittiva al mondo, rappresenta
un vero mistero dal punto di vista clinico, eziologico e fisiopatologico e necessita pertanto di maggiore attenzione da parte della comunità cardiologica internazionale.
Parole chiave. Fibrosi endomiocardica; Malattie cardiache tropicali
rare; Miocardiopatie primitive.
RINGRAZIAMENTI
Si ringrazia l’AISPO (Associazione Italiana per la Solidarietà tra i Popoli) nelle figure di Renato Corrado, Elena Balducci e Francesco
Aloi. Si ringraziano inoltre i medici che hanno preso parte alle missioni a finalità assistenziale e scientifica in Uganda: Enrico Ammirati, Francesco Arioli, Filippo Figini, Santo Ferrarello, Andrea Radinovic, Anna Chiara Vermi e Francesco Sacco. Un sentito ringraziamento alla dr.ssa Francesca Baratto per il prezioso aiuto nell’elaborazione dei dati, alla dr.ssa Barbara Vergani, infettivologa dell’Ospedale L. Sacco di Milano e a tutto lo staff medico ed infermieristico dell’Ospedale St. Raphael of St. Francis Hospital-Nsambya di Kampala.
BIBLIOGRAFIA
1. Yusuf S, Reddy S, Ounpuu S, Anand S.
Global burden of cardiovascular diseases:
Part II: variations in cardiovascular disease by
specific ethnic groups and geographic regions and prevention strategies. Circulation
2001;104:2855-64.
2. Marijon E, Ou P, Celermajer DS, et al.
Prevalence of rheumatic heart disease detected by echocardiographic screening. N
Engl J Med 2007;357:470-6.
3. Yacoub S, Kotit S, Mocumbi AO, Yacoub MH. Neglected diseases in cardiology: a call for urgent action. Nat Clin
Pract Cardiovasc Med 2008;5:176-7.
Analisi dei fattori di sviluppo e progresso scientifico che hanno portato ad
una considerevole riduzione della mortalità e morbilità per malattie cardiovascolari negli ultimi 50 anni contribuendo
ad aumentare l’aspettativa e la qualità
di vita.
4. Yacoub S, Mocumbi AO, Yacoub MH.
Neglected tropical cardiomyopathies: I. Chagas disease: myocardial disease. Heart
2008;94: 244-8.
5. Davies JN. Endomyocardial fibrosis in
Uganda. East Afr Med J 1948;25:10-6.
6. Kutti VR, Abraham S, Kartha CC. Geographical distribution of endomyocardial fibrosis in South Kerala. Int J Epidemiol
1996;25:1202-7.
7. Ferreira B, Matsika-Claquin MD, HausseMocumbi AO, Sidi D, Paquet C. Geographic
origin of endomyocardial fibrosis treated at
the Central Hospital of Maputo (Mozambique) between 1987 and 1999. Bull Soc
Pathol Exot 2002;95:276-9.
8. Somers K, D’Arbela PG, Patel AK. Endo-
myocardial fibrosis. In: Shaper AG, Kibukamusoke JW, Hutt MS, eds. Medicine in a
tropical environment. London: British Medical Association, 1972:348-63.
9. Freers J, Mayanga-Kizza H, Ziegler
JL, Rutakingirwa M. Echocardiographic
diagnosis of heart disease in Uganda.
Trop Doct 1996;26:125-28.
Caratterizzazione della fibrosi endomiocardica in uno dei principali serbatoi
endemici, l’Uganda.
10. Mocumbi AO, Ferreira MB, Sidi D,
Yacoub MH. A population study of endomyocardial fibrosis in a rural area of
Mozambique. N Engl J Med 2008;359:
43-9.
Pietra miliare degli studi recenti sulla
fibrosi endomiocardica con analisi degli
aspetti epidemiologici relativi alla preG ITAL CARDIOL | VOL 12 | MAGGIO 2011
7
A GRIMALDI ET AL
valenza in un’area endemica del continente africano e classificazione dei criteri ecocardiografici di inquadramento
diagnostico.
11. Shaper AG, Kaplan MH, Mody NJ, McIntyre PA. Malarial antibodies and autoantibodies to heart and other tissues in the immigrant and indigenous peoples of Uganda.
Lancet 1968;1:1342-6.
12. Berenguer A, Plancha E, Munoz Gil J.
Right ventricular endomyocardial fibrosis
and microfilarial infection. Int J Cardiol
2003;87:287-9.
13. Andy JJ, Ogunowo PO, Akpan NA,
Odigwe CO, Ekanem IA, Esin RA.
Helminth associated hypereosinophilia
and tropical endomyocardial fibrosis
(EMF) in Nigeria. Acta Trop 1998;69:12740.
Gli autori discutono la storia naturale
della fibrosi endomiocardica in relazione all’ipereosinofilia indotta dai parassiti.
14. Ijaola O, Falase AO. Distribution of antibodies against Coxsackie B viruses, arboviruses and Toxoplasma gondii among
patients with endomyocardial fibrosis (EMF)
compared with normal subjects from EMF
endemic and non-endemic zones of Nigeria.
Afr J Med Med Sci 1990;19:93-103.
15. Patel AK, Ziegler JL, D’Arbela PG,
Somers K. Familial cases of endomyocardial
fibrosis in Uganda. Br Med J 1971;4:331-4.
16. Shaper AG, Kaplan MH, Foster WD,
Macintosh DM, Wilks NE. Immunological
studies in endomyocardial fibrosis and other
forms of heart-disease in the tropics. Lancet
1967;289:598-600.
17. Prakash Kumar B, Shivakumar K. Alterations in collagen metabolism and increased
fibroproliferation in the heart in ceriumtreated rats: implications for the pathogenesis of endomyocardial fibrosis. Biol Trace
Elem Res 1998;63:73-9.
18. McKinney B. Studies on the experimental production of endomyocardial fibrosis
and cardiomegaly of unknown origin by dietary means. Am Heart J 1975;90:206-14.
19. Sezi CL. Effect of protein deficient cassava
diet on Cercopithecus aethiops hearts and
its possible role in the etiology and pathogenesis of endomyocardial fibrosis in man.
East Afr Med J 1996;73(5 Suppl):S11-S16.
20. Somers K, Hutt MS, Patel AK, D’Arbela
PG. Endomyocardial biopsy in diagnosis of
cardiomyopathies. Br Heart J 1971;33:82232.
21. Urhoghide GE, Falase AO. Degranulated
eosinophils, eosinophil granule basic proteins and humoral factors in Nigerians with
endomyocardial fibrosis. Afr J Med Med Sci
1987;16:133-9.
22. Patel AK, D’Arbela PG, Somers K. Endomyocardial fibrosis and eosinophilia. Br
Heart J 1977;39:238-41.
8
G ITAL CARDIOL | VOL 12 | MAGGIO 2011
23. Mocumbi AO, Yacoub S, Yacoub MH.
Neglected tropical cardiomyopathies: II.
Endomyocardial fibrosis: myocardial disease. Heart 2008;94:384-90.
Eccellente rassegna sulla fibrosi endomiocardica con analisi di fattori eziopatogenetici e delle problematiche inerenti all’inquadramento diagnostico,
prognosi e trattamento chirurgico.
24. Parry EH, Abrahams DG. The natural
history of endomyocardial fibrosis. Q J Med
1965;34:383-408.
25. Somers K, Patel AK, D’Arbela PG. The
natural history of African endomyocardial fibrosis. In: Hayase S, Murao S, eds. International Congress Series 470. Amsterdam: Excerpta Medica, 1978.
26. Freers J, Mayanga-Kizza H, Rutakingirwa M, Gerwing E. Endomyocardial fibrosis: why is there striking ascites with little or no peripheral
oedema? Lancet 1996;347:197.
Analisi dello spettro delle manifestazioni cliniche principali della fibrosi endomiocardica con particolare riferimento all’ascite senza edema degli arti
inferiori.
27. Berensztein CS, Pineiro D, Marcotegui M, Brunoldi R, Blanco MV, Lerman J. Usefulness of echocardiography
and Doppler echocardiography in endomyocardial fibrosis. J Am Soc Echocardiogr 2000;13:385-92.
Descrizione dei principali aspetti ecocardiografici presenti nei differenti tipi
di fibrosi endomiocardica.
28. Hassan WM, Fawzi ME, Al Helaly S,
Hegazy H, Malik S. Pitfalls in diagnosis
and clinical, echocardiographic, and hemodynamic findings in endomyocardial
fibrosis: a 25-year experience. Chest
2005;128:3985-92.
Rassegna sulla fibrosi endomiocardica
fuori dal contesto dei tropici ed analisi
dei pattern ecocardiografici, emodinamici ed angiografici anche relativamente alla diagnosi differenziale con
altre malattie.
29. Mocumbi AO, Carrilho C, Sarathchandra P, Ferreira MB, Yacoub M, Burke M.
Echocardiography accurately assesses the
pathological abnormalities of chronic endomyocardial fibrosis. Int J Cardiovasc
Imaging 2010 Nov 26 [Epub ahead of
print].
Interessante correlazione tra aspetti
ecocardiografici, anatomia chirurgica ed
istopatologia nelle lesioni della fibrosi
endomiocardica.
30. Marijon E, Celermajer DS, Tafflet M,
et al. Rheumatic heart disease screening
by echocardiography: the inadequacy
of World Health Organization criteria
for optimizing the diagnosis of subclinical disease. Circulation 2009;120:663-8.
Eccellente analisi delle problematiche
inerenti all’inquadramento diagnostico
della malattia reumatica relativamente
all’inadeguatezza dei criteri clinico-strumentali utilizzati.
31. D’Silva SA, Kohli A, Dalvi BV, Kale PA.
MRI in right ventricular endomyocardial fibrosis. Am Heart J 1992;123:1390-2.
32. Valiathan MS, Balakrishnan KG,
Sankarkumar R, Kartha CC. Surgical
treatment of endomyocardial fibrosis.
Ann Thorac Surg 1987;43:68-73.
Descrizione clinica della fibrosi endomiocardica in un’area endemica con
analisi dettagliata del trattamento chirurgico mediante resezione endocardica
e sostituzione valvolare e delle relative
complicanze precoci e tardive.
33. Moraes F, Lapa C, Hazing S, Tenorio E, Gomes C, Moraes CR. Surgery
for endomyocardial fibrosis revisited.
Eur J Cardiothorac Surg 1999;15:30913.
Gli autori presentano una casistica di
pazienti con fibrosi endomiocardica descrivendo la propria esperienza in termini di evoluzione delle tecniche chirurgiche.
34. Gonzalez-Lavin L, Friedman JP,
Hecker SP, McFadden PM. Endomyocardial fibrosis: diagnosis and treatment.
Am Heart J 1983;105:699-705.
Rassegna sui risultati del trattamento
chirurgico della fibrosi endomiocardica
al di fuori delle aree endemiche con
analisi delle tecniche utilizzate.
35. Cherian KM, John TA, Abraham KA. Endomyocardial fibrosis: clinical profile and
role of surgery in management. Am Heart J
1983;105:706-9.
36. Bertrand E. Endomyocardial fibrosis or
fibroblastic endocarditis. Indications and results of surgical treatment. Ann Cardiol
Angeiol 1984;33:35-41.
37. Mocumbi AO, Sidi D, Vouhe P, Yacoub M. An innovative technique for
the relief of right ventricular trabecular
cavity obliteration in endomyocardial
fibrosis. J Thorac Cardiovasc Surg 2007;
134:1070-2.
Analisi di un approccio sistematico al
trattamento chirurgico mirato dei pazienti affetti da fibrosi endomiocardica,
basato sulla valutazione del timing chirurgico più appropriato e preceduto da
ottimizzazione della terapia medica
preoperatoria.
38. Scott ME, Bruce JH. Loffler’s endocarditis. Br Heart J 1975;37:534-8.
39. Oakley CM, Olsen GJ. Eosinophilia and
heart disease. Br Heart J 1977;39:233-7.
40. Pelà G, Tirabassi G, Pattoneri P, Pavone
L, Garini G, Bruschi G. Cardiac involvement
in the Churg-Strauss syndrome. Am J Cardiol 2006;97:1519-24.