SYLLABUS 2008
Fisiologia dell’ipofisi
L‟ipofisi è una delle più importanti ghiandole endocrine presenti nel nostro organismo in
quanto controlla e regola la secrezione della maggior parte delle altre ghiandole a secrezione
interna. Essa a sua volta è al centro di un complesso sistema di regolazione sia da parte di strutture
superiori (ipotalamo e strutture corticali) sia da parte di ormoni periferici tramite meccanismi di
feed-back.
Il ciclo mestruale è la risultante di una serie di eventi correlati tra loro che coinvolgono
diversi organi funzionalmente uniti in un unico asse: ipotalamo-ipofisi-ovaio. L'organo bersaglio è
l'utero, che si modifica in risposta alle variazioni dei livelli circolanti degli estrogeni e del
progesterone. La secrezione di questi ormoni steroidei ovarici è controllata dalle gonadotropine
ipofisarie, l'ormone follicolostimolamte (FSH) e l'ormone luteinizzante (LH), i cui livelli circolanti
dipendono dall'azione del gonadotropin-realeasing hormone (Gn-RH) ipotalamico.
Le gonadotropine vengono secrete in maniera pulsatile dall'ipofisi sotto il controllo del GnRH con pattern secretorio diverso nelle varie epoche della vita. Già in epoca neonatale esiste una
secrezione pulsatile di gonadotropine con differenze legate al sesso: mentre nella femmina a
quest'età si rileva una secrezione episodica di FSH, nel maschio si riscontra con maggiore frequenza
un'attività pulsatile dell'LH. Successivamente in entrambi i sessi i livelli di gonadotropine circolanti
si riducono e i picchi di LH sono praticamente non dosabili nel periodo prepubere.
All'inizio della pubertà la secrezione gonadotropinica viene attivata prevalentemente durante
il sonno. Con il passare del tempo la secrezione pulsatile di tali ormoni si prolunga nel corso della
giornata ed iniziano in breve tempo i cicli mestruali ovulatori.
Durante il periodo fertile nella donna si osservano molte differenze nella secrezione
episodica di LH durante il ciclo mestruale. Infatti, durante la fase follicolare la pulsatilità dell'LH
mostra una maggiore frequenza con ampiezza minore mano a mano che ci si avvicina al periodo
ovulatorio. Inoltre, durante la fase follicolare, si assiste ad un rallentamento della frequenza della
pulsatilità dell'LH durante la notte, fenomeno forse mediato dall'aumento dell'attività degli oppioidi
endogeni. In fase ovulatoria la pulsatilità dell'LH aumenta sia in ampiezza sia in frequenza, mentre,
in fase luteale si registra una riduzione della frequenza delle pulsazioni da correlare con tutta
probabilità all'aumento dell'attività oppioide, dal momento che la somministrazione di naloxone
aumenta la frequenza dei picchi di LH.
L'aumento della frequenza di pulsatilità dell'LH rilevabile durante la fase follicolare è
probabilmente dovuto al “clima estrogenico” caratteristico di questa fase, mentre la riduzione
dell'ampiezza potrebbe essere collegata con il feedback negativo esercitato dagli estrogeni sulla
secrezione di Gn-RH e di gonadotropine. I cambiamenti della frequenza e dell'ampiezza della
pulsatilità di LH durante la fase luteale sono dovuti all'azione del progesterone sul sistema
ipotalamo-ipofisario.
Anche l'FSH viene secreto in maniera episodica ed una stretta correlazione tra la secrezione
episodica di FSH e quella di LH aggiunge un'ulteriore evidenza del ruolo svolto dal Gn-RH nella
regolazione della secrezione di entrambe le gonadotropine. La secrezione di FSH sembra essere
modulata non solo dal Gn-RH ipotalamico, ma anche da fattori inibitori ovarici, come inibina e
follistatina, così come da fattori ipofisari che agiscono con meccanismi paracrini e autocrini.
Tuttavia evidenze sperimentali hanno suggerito che la secrezione di FSH viene regolata
anche mediante un meccanismo centrale: la stimolazione di specifiche aree ipotalamiche nei ratti
induce il rilascio soltanto di FSH e l'iniezione di estratti ipotalamici parzialmente purificati provoca
una secrezione maggiore di FSH rispetto all'LH.
Oltre alle gonadotropine FSH e LH, l‟ipofisi anteriore produce anche il TSH, la prolattina, il
GH, l‟ACTH e i peptidi a questo correlati.
Il TSH stimola la tiroide nella produzione degli ormoni tiroidei. La sua secrezione a sua
volta è controllata dal TRH ipotalamico e dal feed-back degli ormoni tiroidei.
La prolattina agisce principalmente sul tessuto mammario di cui promuove lo sviluppo e
stimola la lattazione. Al di fuori della gravidanza, la prolattina influenza la produzione di
progesterone da parte delle cellule del corpo luteo. Livelli elevati di prolattina invece si associano
ad una inibizione progressiva della secrezione di progesterone. Il controllo neuroendocrino della
produzione della prolattina è soprattutto inibitorio ed è determinato dalla dopamina. Il TRH, invece,
ne stimola la produzione insieme a quella del TSH. Di conseguenza una condizione di
ipotiroidismo, stimolando la produzione di TRH, determina anche iperprolattinemia.
Il GH o ormone della crescita determina un incremento della massa corporea e interviene
nella regolazione dei processi metabolici. La sua secrezione è sottoposta ad un controllo nervoso,
metabolico e ormonale.
L‟ACTH, infine, stimola il surrene nella produzione di glucocorticoidi, mineralcorticoidi e
androgeni. Esistono tre componenti principali nel controllo della secrezione dell‟ACTH: una
ritmicità circadiana intrinseca; un feed-back a circuito chiuso che risponde a variazionio dei livelli
circolanti del cortisolo, e una componente a circuito aperto sensibile a numerosi stimoli mediati per
via nervosa comunemente denominati stress.
L‟ipofisi posteriore o neuroipofisi secerne molti peptici che fungono da neuroormoni, ma gli
unici ad essere stati studiati approfonditamente sono l‟ossitocina e la vasopressina. Mentre la
regolazione della secrezione dell‟ossitocina non è stata ancora ben delineata, la secrezione della
vasopressina è regolata da diversi fattori quali: la pressione osmotica del plasma, variazioni di
pressione e/o di volemia, nausea, ipoglicemia, il sistema renina-angiotensina, stress e l‟ipossia e
l‟ipercapnia. L‟azione più importante della vasopressina consiste nella conservazione dei liquidi
dell‟organismo, attraverso la riduzione della diuresi.
Le patologie ipofisarie si dividono in patologie da iposecrezione o patologie da
ipersecrezione. Le patologie da ipofunzione sono legate a tumori, processi infiammatori o
degenerativi, cause iatrogene o traumatiche che possono colpire l‟ipotalamo o l‟ipofisi stessa,
determinando ipopituitarismo secondario o primitivo. Le manifestazioni cliniche variano in
funzione della presenza di uno o più difetti ormonali. La terapia è volta alla rimozione della causa
scatenante e alla terapia ormonale sostitutiva dell‟ormone mancante. Le patologie da ipersecrezione
sono perlopiù dovute a neoplasie secernenti. Gli ormoni dell‟ipofisi che vengono più comunemente
secreti in eccesso sono il GH (acromegalia e gigantismo); prolattina (galattorrea) e l‟ACTH (forma
ipofisaria della sindrome di Cushing). La terapia di scelta di tali neoplasie è l‟intervento
neurochirurgico e la somministrazione di dopaminoagonisti in caso di prolattinomi.
Bibliografia
-
Skinner MK. Regulation of primordial follicle assembly and development. Hum Reprod
Update 2005; 11(5):461-71.
-
Luisi S et al. Inhibins in female and male reproductive physiology: role in gametogenesis,
conception, implantation and early pregnancy. Hum Reprod Update. 2005;11(2):123-35.
-
Gennazzani AR, De Leo V. Le iperprolattinemie: fisiologia, diagnosi clinica e terapia. In “
Attualità in Ginecologia, Ostetricia e Medicina Perinatale”, Ed. Medico Scientifiche 1982;
2: 83-140.
-
Di Sarno A, Landi ML, Marzullo P, et al. The effect of quinagoÌide and cabergoline, two
selective dopamine receptor type-2 agonists, in the treatment of prolactinomas. Clin
Endocrinol 2000; 53: 53-60.
-
Krassas GE, Pontikides N, Kaltsas PH, et al. Menstrual disturbances in thyrotoxicosis. Clin
Endocrinol 1994; 40: 641-644.
-
Chiovato L, Santini F, Pinchera A. Treatment of hyperthyroidism. Thyroid Intemational
1995; 2:1.
-
Roti E, Minelli R, Salvi M. Management of hyperhyroidism and hypothyroidism in the
pregnant woman. J Clin Endocrinol Metab 1996; 81:1679.
FISIOPATOLOGIA TIROIDEA: CASI CLINICI
Prof. F. Pacini
Dip.to di Medicina Interna, Scienze Endocrino-Metaboliche e Buiochimica
Università degli Studi di Siena
La tiroide è una ghiandola endocrina posta nella regione anteriore del collo al davanti e
lateralmente alla laringe ed ai primi anelli tracheali, il cui compito principale è quello di
produrre ormoni iodati. L’unità funzionale della tiroide è il follicolo tiroideo, costituito da un
singolo strato di cellule epiteliali (tireociti) che circonda il lume contenente una sostanza
vischiosa denominata “colloide”. La tireoglobulina (Tg) è il principale costituente proteico della
colloide ed è il precursore degli ormoni tiroidei. Gli ormoni tiroidei (tiroxina T4 e
triiodotironina T3 controllano importanti processi biologici quali, nella vita fetale lo sviluppo
del sistema nervoso centrale, nell’età evolutiva l’accrescimento corporeo e, nell’età adulta, la
regolazione di numerose funzioni metaboliche. La T4 è prodotta esclusivamente dalla ghiandola
tiroide, mentre solo il 20% della T3 circolante è direttamente secreto dalla tiroide e la quota
rimanente deriva dalla trasformazione periferica della T4 in T3.
Il costituente principale degli ormoni tiroidei è lo iodio che, assunto con gli alimenti,
viene incorporato nella tiroide dal circolo ematico. Affinché la tiroide possa sintetizzare e
secernere quantità sufficienti di ormoni è necessario che l’apporto iodico giornaliero sia
adeguato, ovvero che sia almeno uguale a 150 mg al giorno. La tiroide è infatti avida di iodio e
capta tutto lo iodio a disposizione in circolo, mediante un trasportatore tiroideo dello iodio
(sodium iodine symporter, NIS) che è presente sulla membrana basolaterale dei tireociti. Una
volta internalizzato nel tireocita, lo ione ioduro attraversa la cellula tiroidea e, raggiunta la
membrana apicale, viene esportato nel lume del follicolo. Nella colloide lo iodio viene
incorporato nei radicali tirosinici della Tg. Questo processo, denominato organificazione dello
iodio, è catalizzato dalla tireoperossidasi (TPO), un enzima sintetizzato dai tireociti ed espresso
sulla loro membrana apicale. Lo iodio viene così depositato come tiroxina o T4 (contenente
quattro molecole di iodio) o come triiodiotironina o T3 (contenente tre molecole di iodio),
nell’ambito della molecola di tireoglobulina. Il rilascio degli ormoni tiroidei da parte del tireocita
avviene mediante l’internalizzazione della Tg (endocitosi) contenuta nella colloide seguita dalla
degradazione lisosomiale della stessa e dal rilascio degli ormoni tiroidei dalla membrana
basolaterale dei tireocita nel circolo ematico.
Nel sangue gli ormoni tiroidei si trovano in gran parte legati alle proteine (Thyroxine
binding globulin TBG, la thyroxine binding pre-albumin TBPA e l’albumina) e solo lo 0.030.05% della T4 e lo 0.3-0.5% della T3 circolano in forma libera. La forma ritenuta attiva
dell’ormone è quella libera (FT3, FT4), pertanto la funzione tiroidea è più strettamente
correlata alla concentrazione di ormone circolante libero che legato. Gli ormoni tiroidei
esplicano i loro effetti prevalentemente attraverso il legame a recettori nucleari. Regolano
quindi l’espressione genica, promuovendo la trascrizione di acidi ribonucleici messaggeri
(mRNA) tessuto-superfici, il cui messaggio è tradotto in proteine con funzioni enzimatiche o
strutturali.
La sintesi e la secrezione degli ormoni tiroidei sono principalmente regolate dal TSH,
ormone sintetizzato e secreto a livello dell’ipofisi anteriore. Il TSH si lega ad uno specifico
recettore presente sulla membrana dei tireociti e induce la sintesi delle proteine coinvolte nella
produzione degli ormoni tiroidei nonché la crescita del tireocita e l’endocitosi della
tireoglobulina. La stimolazione del TSH determina pertanto l’aumento della sintesi e della
secrezione degli ormoni tiroidei circolanti. La produzione del TSH è a sua volta regolata dalla
concentrazione sierica degli ormoni tiroidei venendosi così a determinare un meccanismo di
regolazione a “feedback” negativo. L’alterazione di questo equilibrio porta a due opposte
condizioni patologiche, l’ipotiroidismo e l’ipertiroidismo.
In condizioni di ridotta produzione di ormoni tiroidei, mancando il meccanismo inibitorio
sulla secrezione del TSH, la sintesi e la secrezione di questo ormone aumentano nel tentativo
di compensare la ridotta produzione degli ormoni tiroidei. Pertanto nell’ipotiroidismo primitivo i
livelli sierici di TSH sono elevati mentre quelli degli ormoni tiroidei sono bassi (ipotiroidismo
franco) o normali (ipotiroidismo sub-clinico). Al contrario, l’eccesso degli ormoni tiroidei
determina la soppressione del TSH da parte dell’ipofisi. Ne consegue che nell’ipertiroidismo
primitivo il TSH sierico è indosabile mentre gli ormoni tiroidei sono elevati o normali
(ipertiroidismo sub-clinico).
La causa più frequente di ipotiroidismo primitivo è quella legata all’infiltrazione
linfocitaria della tiroide che si osserva nella tiroide autoimmune, oppure all’asportazione
chirurgica della tiroide o alla sua distruzione mediante iodio radioattivo. Un’altra causa di
ipotiroidismo primitivo è quella dovuta ad alterazioni genetiche delle proteine responsabili della
sintesi e della secrezione degli ormoni tiroidei. Ad esempio le alterazioni a carico del NIS
(proteina di trasporto dello iodio) sono responsabili di una ridotta captazione dello iodio da
parte dei tireociti con conseguente ridotta sintesi degli ormoni tiroidei. Un’alterazione a carico
della TPO (enzima responsabile della organificazione dello iodio) determina invece una ridotta
organificazione dello iodio che esita in una condizione di ipotiroidismo. In genere, in tali
condizioni, l’ipotiroidismo è accompagnato da gozzo (aumento di volume della tiroide). Tali
difetti molecolari sono comunque tra le cause più rare di ipotiroidismo, così come lo sono i
difetti di secrezione del TSH (ipotiroidismo centrale).
Una severa carenza alimentare di iodio può essere responsabile di un fenotipo simile a
quello che si osserva nei difetti molecolari. Essendo lo iodio il costituente principale degli
ormoni tiroidei, un suo ridotto apporto alimentare comporta una ridotta produzione degli
ormoni tiroidei con secrezione compensatoria di TSH. Permanendo la carenza iodica, il continuo
stimolo esercitato dal TSH è responsabile di alterazioni organiche a carico della ghiandola
tiroidea quali l’ipertrofia e l’iperplasia delle cellule follicolari tiroidee con conseguente
ingrandimento della ghiandola stessa. Inizialmente si tratta di un ingrandimento diffuso che,
tuttavia, nel corso degli anni, può evolvere verso la forma nodulare e successivamente portare
ad un quadro di ipertiroidismo da gozzo nodulare tossico.
Nelle aree a normale apporto iodico, la causa più frequente di ipertiroidismo è invece
quella autoimmune (morbo di Basedow). Il meccanismo patogenetico che sta alla base di
questa forma di ipertiroidismo è la presenza di anticorpi rivolti contro il recettore del TSH
(Trab). Tali anticorpi sono in grado di legare e attivare il recettore stesso stimolando così la
crescita tiroidea e la produzione di ormoni da parte della tiroide. L’unica alterazione molecolare
in grado di determinare ipertiroidismo è rappresentata dalle mutazioni attivanti il recettore del
TSH che sono responsabili dell’ipertiroidismo che si osserva nel gozzo nodulare tossico e
nell’adenoma tossico, due condizioni frequenti in aree geografiche di grave carenza iodica.
Anche alcuni farmaci contenenti iodio (amiodarone) o mezzi di contrasto iodato possono
determinare un aumento della sintesi o della secrezione degli ormoni tiroidei con vari
meccanismi. Raramente l’ipertiroidismo è dovuto ad aumentata secrezione di TSH
(ipertiroidismo secondario o centrale).
DIFFERENZE DI GENERE A CONFRONTO: L’ANDROPAUSA È IL PALINDROMO
DELLA MENOPAUSA O SOLTANTO UNA “MAGROPAUSA”?
F. LOTTI, M. MAGGI
S.O.D.
ANDROLOGIA,
DIPARTIMENTO
UNIVERSITÀ DI FIRENZE.
DI
FISIOPATOLOGIA
CLINICA,
CORRISPONDENZA:
Prof. Mario Maggi, Unità di Andrologia, Dipartimento di Fisiopatologia Clinica, Viale Pieraccini 6,
50139, Firenze. Tel.: +39-55-4271415. Fax: +39-55-4271413
e-mail: [email protected]
Le leggi di uguale opportunità sono state promulgate per permettere ai singoli di essere assunti,
pagati, formati e promossi sulla base delle proprie attitudini e capacità, indipendentemente dal
genere di appartenenza. Queste leggi sono una realtà nei Paesi Occidentali. Di conseguenza, la
discriminazione sessuale sul lavoro è considerata illegale, qualsiasi sia la posizione occupata: se
qualcuno lamentasse di essere sfavorito sul lavoro a causa del proprio sesso, stato civile o genere,
per legge il datore di lavoro dovrebbe porre fine a qualsiasi discriminazione basata sulla differenza
di genere. D‟altronde, le differenze di genere hanno ancora un ruolo e rivestono importanza
biologica nella medicina della riproduzione e della sessualità.
Complessivamente, ovaio e testicolo, che derivano entrambi dalla gonade indifferenziata, si
differenziano notevolmente nel corso dello sviluppo fetale, e tali differenze persistono per tutta la
vita. Una traslazione palindromica di genere dei problemi riproduttivi o sessuali da un genere ad un
altro non è un prodotto della rivoluzione sessuale, vale a dire una modificazione nella percezione
culturale dell‟etica sessuale e del comportamento sessuale, ma un mero errore medico. Un buon
esempio di questo errore è rappresentato dall‟applicazione del concetto di menopausa, proprio del
sesso femminile, al sesso maschile, mediante il termine andropausa. Come noto, la menopausa
rappresenta il momento della vita della donna in cui cessano i cicli mestruali come conseguenza
dell‟esaurimento del patrimonio ovarico di follicoli e cellule germinali. Infatti, nel sesso femminile,
il numero delle cellule germinali è determinato nell‟epoca prenatale e, dopo la pubertà, si osserva
una continua e irreversibile riduzione del numero degli ovociti, che, al termine del processo,
conduce al reale esaurimento del patrimonio ovarico. Ne risulta un‟improvvisa riduzione della
secrezione ormonale ovarica. All‟esaurimento ovarico (in termini sia di cellule germinali che di
secrezione endocrina), si associa la cessazione dei flussi mestruali, ovvero la menopausa. Il temine
menopausa deriva dalla radice greca “meno” (mese) e “pausa” (esaurimento). A partire dallo scorso
secolo, l‟esaurimento della capacità ovarica di ovulare e di produrre ormoni sessuali si realizza
molto precocemente rispetto alla massima durata di vita della donna (si realizza, infatti, all‟inizio
della quinta decade di vita). La menopausa è preceduta da un periodo di durata variabile, detto
climaterio, caratterizzato dalla presenza di cicli mestruali irregolari, che riflette il declino del
numero dei follicoli ovarici e dei livelli degli ormoni sessuali. Mentre l‟organismo tenta di adattarsi
al rapido declino dei livelli degli ormoni ovarici, insorgono numerosi sintomi, tra cui disturbi
vasomotori e secchezza vaginale.
Nel testicolo, invece, spermatogenesi e steroidogenesi non cessano improvvisamente e, nella
maggior parte dei casi, non cessano affatto. Di conseguenza, la capacità riproduttiva della maggior
parte dei maschi persiste per tutta la durata della vita. Mentre la meiosi rappresenta un evento
relativamente raro nell‟ovaio anche prima della menopausa, nel testicolo si presenta invece come
un processo continuo. Non esiste dunque un esaurimento della spermatogenesi e della secrezione
ormonale testicolare come tale; esistono però condizioni particolari, sempre più frequenti nel
maschio anziano, che si associano ad un ipogonadismo età-correlato, erroneamente chiamato
andropausa, climaterio maschile, declino androgenico parziale del maschio anziano (“partial
androgen decline in the aging male”, PADAM), deficit androgenico nel maschio anziano
(“androgen deficiency in the aging male”, ADAM) e così via. Il declino della funzione testicolare
età-correlato si associa spesso al declino contemporaneo di altre funzioni fisiologiche (che
includono le funzioni cardiaca, respiratoria, renale). Si tratta semplicemente dell‟invecchiamento!
Infatti, non esistono i termini cardiopausa e pneumopausa. I segni e i sintomi caratteristici
dell‟ipogonadismo (calo della libido, disfunzione erettile, riduzione di massa e forza muscolare,
peggioramento della funzione cognitiva e della memoria, facile affaticabilità, vampate di calore)
ricordano in qualche modo quelli presenti in modo variabile nel maschio anziano. Pertanto il
maschio anziano è stato considerato, per definizione, ipogonadico, come la femmina anziana. Ma,
in realtà, esiste un‟importante differenza nell‟invecchiamento gonadico maschile e femminile:
mentre le donne anziane sono invariabilmente ipogonadiche (esaurimento ovarico), gli uomini
anziani possono esserlo solo in alcune particolari condizioni.
E‟ noto che l‟incremento della massa grassa e la riduzione della massa magra, insieme
all‟invecchiamento, rappresentano i principali determinanti del deficit androgenico che si riscontra
frequentemente nel maschio anziano (1). Quindi, più che di andropausa, si dovrebbe parlare di
un‟epidemia di “magropausa”! L‟automazione, la mancanza di tempo, e i cambiamenti dello stile
di vita associati alla rivoluzione industriale, hanno condotto progressivamente alla riduzione
dell‟attività degli individui: in questo l‟iperalimentazione gioca un ruolo chiave.
L‟iperalimentazione e la riduzione dell‟attività fisica rappresentano oggi un‟epidemia. Molte
condizioni cliniche che conducono all‟obesità sono state associate a questi cambiamenti dello stile
di vita, nati in Occidente e poi diffusi in tutto il mondo. La distribuzione del grasso corporeo è
diversa da persona a persona. L‟adipe si deposita generalmente in due diverse sedi: viscerale
(disposto intorno agli organi interni) e sottocutaneo (sotto la cute)- circa l‟80% di tutto il grasso
corporeo. Uomini e donne normopeso presentano una differenza di genere nella distribuzione del
grasso corporeo; ciò è più evidente quando soggetti maschi in sovrappeso sviluppano un‟obesità
tronculare, con un eccesso di grasso localizzato prevalentemente nelle regioni adipose sottocutanee
e viscerali. Infatti, mentre nelle donne l‟adipe si localizza prevalentemente a livello dei glutei e
delle cosce (distribuzione adiposa gluteofemorale), negli uomini il grasso tende ad accumularsi
nella regione addominale. Si parla, rispettivamente, di conformazioni “a pera” e “a mela”. Quindi,
la distribuzione corporea del grasso è diversa negli uomini e nelle donne, ed è considerata come una
caratteristica sessuale secondaria, dipendente dalla presenza di ormoni sesso-specifici. L‟accumulo
di adipe viscerale (conformazione “a mela”), è oggi riconosciuta come un‟entità clinica distinta,
componente chiave di una condizione definita sindrome metabolica.
La sindrome metabolica (SM), originariamente nota come sindrome X, è una costellazione di
alterazioni cliniche che si associa ad un aumento del rischio complessivo di sviluppare patologie
cardiovascolari e metaboliche. Le componenti della SM sono rappresentate da insulino-resistenza
(iperinsulinemia, alterata tolleranza al glucosio, diabete mellito di tipo 2), dislipidemia
(ipertrigliceridemia, bassi livelli di HDL) e ipertensione arteriosa. Il termine “sindrome metabolica”
risale almeno alla fine degli anni cinquanta. Più di venti anni dopo, Gerald B. Phillips suggerì che i
fattori di rischio per l‟infarto del miocardio costituissero una “costellazione di anomalie” associate
non soltanto alle cardiopatie, ma anche all‟invecchiamento, all‟obesità e ad altre condizioni
cliniche, e ipotizzò che gli ormoni sessuali potessero rappresentare un fattore di legame tra tali
condizioni (2). E‟ oggi chiara l‟esistenza di un‟associazione tra SM e disfunzione erettile (DE),
caratterizzata da un‟incremento della prevalenza della DE al crescere del numero delle componenti
della SM (3, 4). Oggi sappiamo anche che la SM si associa spesso ad una riduzione dei livelli
plasmatici di testosterone, mentre l‟ipogonadismo rappresenta un fattore di rischio per lo sviluppo
del diabete mellito e della SM (5). L‟ipogonadismo maschile, come la DE, può essere considerato
un‟altra condizione associata alla SM, che concorre alle o scaturisce dalle alterazioni metaboliche e
cardiovascolari associate alla SM.
Sebbene la classificazione della SM più utilizzata, quella del NCEP-ATPIII, attribuisca la stessa
importanza a tutti i criteri diagnostici di SM, è noto che ogni criterio ha un impatto diverso sul
rischio metabolico e cardiovascolare. Abbiamo osservato che l‟ipertensione arteriosa e
l‟iperglicemia, noti fattori di rischio cardiovascolare, si associano in misura maggiore a peggiori
flussi vascolari penieni rispetto alle altre componenti della SM (3, 4). D‟altra parte, l‟ipogonadismo
correla con il grado di adiposità viscerale e con l‟iperglicemia (1, 3 ,4). Ciò significa che il tessuto
adiposo non è un deposito inattivo di riserva energetica, ma è in grado di sintetizzare ed elaborare
molecole in grado di modulare l‟asse ipotalamo-ipofisi-testicolo. E‟ stato ipotizzato un ruolo
regolatore per estrogeni, insulina, leptina, TNF e altre adipochine. In tal senso, è stato recentemente
dimostrato che la somministrazione di una bassa dose settimanale (2.5 mg) dell‟inibitore
dell‟aromatasi letrozolo è in grado di ripristinare normali livelli di testosterone e incrementare i
livelli di LH in maschi ipogonadici con obesità severa (6). Pertanto, l‟aumentata aromatizzazione
degli androgeni da parte del tessuto adiposo si accompagna ad un incremento dei livelli plasmatici
di estrogeni, che, d‟altra parte, determinano una riduzione nella secrezione di LH. L‟insulina agisce
direttamente sull‟ipotalamo determinando un incremento della sintesi e secrezione di GnRH (7). A
conferma di ciò, in un modello murino di deplezione centrale del recettore per l‟insulina, il fenotipo
risultante presentava caratteristiche analoghe a quelle presenti nella SM e nell‟ipogonadismo
ipogonadotropo (8).
Gli androgeni, d‟altra parte, possono interagire con gli adipociti mediante il recettore per gli
androgeni (RA) o per gli estrogeni. Studi “in vivo” condotti nell‟uomo hanno dimostrato che il
testosterone influenza il metabolismo dei trigliceridi nei depositi di adipe e regola la sensibilità
all‟insulina (9, 10). Di conseguenza, la delezione del gene del RA nel topo determina caratteristiche
molto simili a quelle che si osservano nei maschi con SM (11). Peraltro, nei modelli murini di
deplezione del “recettore X per i farnesoidi” (“farnesoid X receptor”, FXR), un membro della
superfamiglia dei recettori nucleari dei fattori di trascrizione attivati dal ligando, si osserva un
fenotipo con caratteristiche molto simili a quelle della SM nell‟uomo. I topi FXR–/– presentano
elevati livelli plasmatici ed epatici di colesterolo e trigliceridi, un‟aumentata risposta epatica ad una
dieta ad elevato contenuto di carboidrati e resistenza periferica all‟insulina (12). E‟ interessante
notare come l‟androsterone, uno dei principali metaboliti del diidrotestosterone, steroide di cui, fino
a poco tempo fa, non era nota alcuna attività biologica, sia oggi considerato, insieme all‟acido
biliare, uno dei ligandi naturali del FXR (13).
La modalità con cui gli androgeni possono agire e ridurre i depositi adiposi, è tutt‟oggi oggetto di
studio, ma siamo convinti che questo aspetto rappresenti il punto cruciale della cosiddetta
andropausa, o, almeno, della componente di questo processo età-correlato su cui si può intervenire:
la “magropausa”. La DE rappresenta un altro punto chiave in questo contesto, perché può
sottendere ed essere la spia di comorbilità associate. In qualche misura, i soggetti con DE possono
essere ritenuti “fortunati”, perché lo studio delle comorbilità ad essa associate può consentire di
identificare altre alterazioni metaboliche. SM e diabete mellito sono spesso associati a DE e
ipogonadismo, che, a loro volta, possono esacerbare un disturbo della sessualità. Infatti, nei modelli
animali, la presenza di un ipogonadismo indotto dal diabete mellito può agire negativamente sulle
principali vie metaboliche coinvolte nel processo erettile, quali quelle di NOS, PDE5 e
RhoA/ROCK (14, 15). Il riscontro di condizioni sottese alla DE, cui si perviene indagandone le
comorbilità associate, quali ipogonadismo e/o diabete mellito/SM, può rappresentare per il maschio
un valido motivo per migliorare il proprio stile di vita. Interventi sullo stile di vita, che includono
una dieta equilibrata e l‟attività fisica, possono migliorare non soltanto la salute dell‟individuo, ma
anche la sua sessualità, ritardando l‟andropausa/ “magropausa”.
REFERENZE BIBLIOGRAFICHE
1.
Corona G, Mannucci E, Fisher AD, Lotti F, Petrone L, Balercia G, Bandini E, Forti G,
Maggi M. Low Levels of Androgens in Men with Erectile Dysfunction and Obesity. J Sex Med.
2008
2.
Phillips GB. Sex hormones, risk factors and cardiovascular disease. Am J Med. 1978;65:711
3.
Corona G, Mannucci E, Petrone L, Balercia G, Paggi F, Fisher AD, et al. NCEP-ATPIIIdefined metabolic syndrome, type 2 diabetes mellitus, and prevalence of hypogonadism in male
patients with sexual dysfunction. J Sex Med. 2007;4:1038-45.
4.
Corona G, Mannucci E, Petrone L, Schulman C, Balercia G, Fisher AD, et al. A comparison
of NCEP-ATPIII and IDF metabolic syndrome definitions with relation to metabolic syndromeassociated sexual dysfunction. J Sex Med. 2007;4:789-96.
5.
Maggi M, Schulman C, Quinton R, Langham S, Uhl-Hochgraeber K.The burden of
testosterone deficiency syndrome in adult men: economic and quality-of-life impact. J Sex Med.
2007;4:1056-69.
6.
Loves S, Ruinemans-Koerts J, de Boer H.Letrozole once a week normalizes serum
testosterone in obesity-related male hypogonadism. Eur J Endocrinol. 2008 158:741-7.
7.
Burcelin R, Thorens B, Glauser M, Gaillard RC, Pralong FP. Gonadotropin-releasing
hormone secretion from hypothalamic neurons: stimulation by insulin and potentiation by leptin.
Endocrinology. 2003;144:4484-91
8.
Brüning JC, Gautam D, Burks DJ, Gillette J, Schubert M, Orban PC, et al. Role of brain
insulin receptor in control of body weight and reproduction. Science. 2000;289:2122-5.
9.
Mårin P, Odén B, Björntorp P. Assimilation and mobilization of triglycerides in
subcutaneous abdominal and femoral adipose tissue in vivo in men: effects of androgens. J Clin
Endocrinol Metab. 1995;80:239-43.
10.
Yialamas MA, Dwyer AA, Hanley E, Lee H, Pitteloud N, Hayes FJ. Acute sex steroid
withdrawal reduces insulin sensitivity in healthy men with idiopathic hypogonadotropic
hypogonadism. J Clin Endocrinol Metab. 2007;92:4254-9.
11.
Lin HY, Xu Q, Yeh S, Wang RS, Sparks JD, Chang C. Insulin and leptin resistance with
hyperleptinemia in mice lacking androgen receptor. Diabetes. 2005;54:1717-25.
12.
Sinal CJ, Tohkin M, Miyata M, Ward JM, Lambert G, Gonzalez FJ. Targeted disruption of
the nuclear receptor FXR/BAR impairs bile acid and lipid homeostasis. Cell. 2000;102:731-44.
13.
Wang S, Lai K, Moy FJ, Bhat A, Hartman HB, Evans MJ. The nuclear hormone receptor
farnesoid X receptor (FXR) is activated by androsterone. Endocrinology. 2006;147:4025-33.
14.
Zhang XH, Filippi S, Morelli A, Vignozzi L, Luconi M, Donati S, et al. Testosterone
restores diabetes-induced erectile dysfunction and sildenafil responsiveness in two distinct animal
models of chemical diabetes. J Sex Med. 2006;3:253-64;
15.
Vignozzi L, Morelli A, Filippi S, Ambrosini S, Mancina R, Luconi M, et al. Testosterone
regulates RhoA/Rho-kinase signaling in two distinct animal models of chemical diabetes. J Sex
Med. 2007;4:620-30
Obesità e ciclo mestruale
Paolo Moghetti
Sezione di Endocrinologia e Metabolismo
Dipartimento di Scienze Biomediche e Chirurgiche
Università di Verona
L‟ipotesi che il peso corporeo possa influenzare la funzione riproduttiva femminile è stata formulata
nel 1970 da Frisch e Revelle. Questi autori avevano osservato che per una normale ciclicità
mestruale appariva indispensabile la presenza di una quantità critica di tessuto adiposo, anche se
all‟epoca i meccanismi che potevano essere responsabili di questo fenomeno rimanevano totalmente
oscuri. In una visione finalistica non appariva tuttavia già allora sorprendente che fra gli adattamenti
dell‟organismo conseguenti ad uno stato di carenza di riserve energetiche vi potesse essere la messa
a riposo della funzione riproduttiva, date le implicazioni che una carenza di nutrienti può
determinare in rapporto alle esigenze di una eventuale gravidanza. L‟ipotesi di Frisch e Revelle ha
poi avuto varie conferme epidemiologiche e sperimentali e oggi sappiamo che i meccanismi alla
base delle alterazioni riproduttive spesso presenti nei soggetti con peso ridotto sono verosimilmente
ascrivibili alla ridotta secrezione da parte del tessuto adiposo di leptina e altre adipochine. Il tessuto
adiposo è infatti un organo capace di liberare varie sostanze biologicamente attive ed è attraverso
queste sostanze che i centri superiori possono essere informati sullo stato di replezione energetica
dell‟organismo.
Studi epidemiologici più recenti hanno evidenziato che i disturbi della funzione riproduttiva
presentano una relazione ad U con il BMI. La figura 1 riporta i risultati di un‟analisi condotta
sull‟ampia coorte del Nurses‟ Health Study e mostra come il rischio di infertilità riconducibile a
disturbi ovulatori sia maggiore nelle donne con valori di BMI inferiori a 18 kg/m2 ma soprattutto in
quelle con BMI aumentato e già a partire da valori ai limiti superiori della norma. Il fenomeno è
comunque più evidente sopra i 30 kg/m2, raggiungendo nell‟obesità franca valori di rischio relativo
circa 2 volte e mezzo superiori a quello della popolazione con peso normale.
Se la presenza di una relazione fra funzione riproduttiva femminile ed eccesso ponderale è chiara, i
meccanismi che sottendono questo fenomeno sono ancora controversi. Una spiegazione parziale è
data dalla possibile coesistenza di questi aspetti nell‟ambito della sindrome dell‟ovaio policistico
(PCOS). L‟obesità è infatti un comune riscontro nelle pazienti con PCOS e questa condizione è
tipicamente caratterizzata da oligo-anovulazione cronica. Anche se i dati epidemiologici sulla
PCOS restano discordanti e condizionati dalla eterogeneità delle casistiche e dalle insufficienti
dimensioni dei campioni esaminati, si stima che la prevalenza di obesità o sovrappeso in questi
soggetti raggiunga valori intorno al 60%. Inoltre, anche nei soggetti con BMI normale vi è spesso
un eccesso relativo di grasso viscerale.
I meccanismi che legano eccesso ponderale a PCOS restano tuttavia ancora mal definiti e sono
probabilmente molteplici. Queste pazienti sono spesso insulinoresistenti e una larga messe di dati
indica che l‟insulinoresistenza, con l‟iperinsulinemia compensatoria che l‟accompagna, costituisce
un importante meccanismo patogenetico alla base della sindrome. In questo contesto, l‟obesità
potrebbe fungere da fattore facilitante l‟insulinoresistenza e attraverso questa determinare, in
soggetti predisposti, le manifestazioni tipiche della PCOS - in primo luogo iperandrogenismo e
disturbi ovulatori. Un„altra possibilità è che l‟eccesso di androgeni che caratterizza questi soggetti
costituisca il meccanismo iniziale che favorisce un accumulo di adipe a livello centrale, con
induzione secondaria di insulinoresistenza.
La presenza, nelle ragazze obese, di aumentati livelli di testosterone e bassi livelli di SHBG già
negli stadi precoci dello sviluppo puberale suggerisce che l‟eccesso di tessuto adiposo sia
verosimilmente un meccanismo iniziale di questo processo. In ogni caso gli stretti legami che
esistono fra questi aspetti possono rendere conto di un circolo vizioso che, qualunque sia il
problema iniziale, tende a mantenere ed aggravare le diverse manifestazioni tipiche della sindrome.
Nel caso dell‟obesità il ruolo svolto dalle adipochine nel determinare le alterazioni del ciclo
mestruale e più in generale delle funzioni riproduttive resta ancora poco chiaro. E‟ stato esaminato
il potenziale ruolo di leptina, adiponectina, resistita, visfatina e di altre componenti di questa ampia
categoria. Gli studi finora condotti non hanno tuttavia dato risultati chiarificatori. Le nostre
conoscenze su questo complesso sistema di regolazione ormonale restano peraltro ancora limitate.
Non vi è dubbio che, indipendentemente dal suo ruolo primitivo o secondario, l‟obesità rappresenta
in molte donne affette da PCOS un elemento clinico e fisiopatologico importante. Diversi recenti
dati indicano che la presenza di obesità si associa a quadri di maggior gravità della sindrome.
Inoltre nelle donne con PCOS obese sono più frequenti le alterazioni metaboliche che caratterizzano
molte di queste pazienti. In particolare, il rischio di sviluppare precocemente alterazioni della
tolleranza ai carboidrati (IGT o diabete tipo 2), ipertensione e altri aspetti della sindrome metabolica
appare nettamente incrementato nelle pazienti con PCOS obese. E‟ verosimile che sia soprattutto in
relazione a questi disordini metabolici che in tali soggetti sono più spesso presenti alterazioni di
diversi parametri che costituiscono indicatori precoci di maggior rischio cardiovascolare, come gli
indici di flogosi cronica e di disfunzione endoteliale, anche se manca ancora la dimostrazione che
tale rischio sia effettivamente aumentato nelle donne che soffrono di questa patologia. Va tenuto
presente, in ogni caso, che l‟epoca della vita in cui le pazienti giungono al medico per gli aspetti
riproduttivi ed endocrini tipici della PCOS è molto più precoce rispetto a quella in cui è verosimile
possano svilupparsi le complicanze cardiovascolari.
Le interrelazioni fra obesità, aspetti metabolici ed aspetti endocrini sono in ogni caso molto
complesse. La figura 2 schematizza i risultati dell‟analisi delle componenti applicata agli aspetti
caratteristici della sindrome dell‟insulinoresistenza in un campione di 255 donne iperandrogeniche.
In questa analisi i diversi aspetti della sindrome dell‟insulinoresistenza risultano raggruppati in tre
componenti principali, quella centrale, che contiene il BMI fra i suoi parametri, e quelle
dell‟iperglicemia e dell‟ipertensione, legate a quella centrale rispettivamente attraverso
l‟iperinsulinemia e l‟eccesso ponderale. Questi dati sono in accordo con quanto già osservato nella
popolazione generale del Framingham Study. Includendo alcuni aspetti endocrini tipici della PCOS
a questa analisi (eccesso di testosterone e iperrisposta del 17-idrossiprogesterone allo stimolo con
GnRH-analoghi), si può osservare una quarta componente, anch‟essa associata a quella centrale
attraverso l‟iperinsulinemia,a suggerire che le manifestazioni della PCOS rappresentino un fenotipo
della sindrome metabolica. Va anche notato che i livelli di testosterone libero compaiono anche in
altre componenti del modello, a suggerire dei nessi molto complessi in questa patologia fra
iperandrogenismo e alterazioni metaboliche associate all‟insulinoresistenza.
E‟ importante notare che tutti gli approcci che determinano calo ponderale, nelle donne obese con
PCOS, dalla dieta ipocalorica, ai farmaci anti-obesità fino alla chirurgia bariatrica - nelle pazienti
con obesità massiva, migliorano non solo gli aspetti metabolici ma anche e soprattutto quelli
riproduttivi di queste pazienti, consentendo in molti casi il ripristino di cicli regolari e ovulatori e la
riduzione dei livelli di testosterone. Inoltre, va ricordato che l‟efficacia della metformina e di altri
strumenti terapeutici è ridotta e il rischio di complicanze di una eventuale gravidanza è aumentato
nei soggetti con obesità grave. L‟approccio terapeutico alla PCOS deve quindi sempre comprendere
l‟obiettivo di correggere l‟eventuale eccesso ponderale.
L‟associazione fra obesità e PCOS non appare spiegare in ogni caso completamente i legami fra
eccesso ponderale e disturbi mestruali e più in generale riproduttivi. L‟eccesso ponderale rimane
predittore di oligoamenorrea anche dopo aver incluso nell‟analisi livelli di androgeni e morfologia
ovarica ed è anche associato a una ridotta capacità di procreazione. Inoltre, le donne obese non
iperandrogeniche presentano alterazioni endocrine peculiari e assai diverse da quelle tipiche della
PCOS, in particolare una riduzione delle gonadotropine. Queste alterazioni si associano spesso ad
uno sfumato aumento della prolattina, che correla con i parametri antropometrici e con i livelli
circolanti della leptina e che risponde alle variazioni ponderali. Anche l‟origine di queste alterazioni
resta poco chiara e ulteriori studi sono necessari per interpretarne il significato.
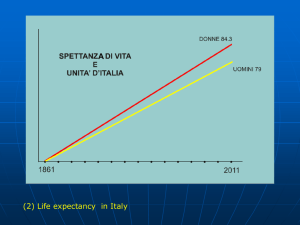
Fig. 1.
Fig 2.
Componenti della sindrome dell’insulinoresistenza
in 255 donne iperandrogeniche
Core
Iperglicemia
Ipertensione
lipidi
glicemia
insulina
BMI
pressione
testosterone
testosterone
testosterone
17OHP
dopo GnRH-a
PCOS
Attività fisica e ciclo mestruale
Marco Bonifazi
Da Zanolin et al, Diabetes Care 2006
U.F. Medicina dello Sport – ASL 7, Dipartimento di Fisiologia, Università degli Studi di Siena
La relazione fra l‟attività fisica e il ciclo mestruale riguarda due aspetti principali: 1) i
possibili effetti sulla prestazione fisica della variazione ciclica delle concentrazioni ematiche degli
ormoni sessuali e 2) gli effetti dell‟allenamento sulla frequenza e durata del ciclo mestruale.
Effetti del ciclo mestruale sulla prestazione
I neurosteroidi derivati dagli ormoni sessuali sono potenti modulatori dell‟attività neuronale.
In sintesi, i neurosteroidi derivati dal progesterone aumentano l‟attività dei recettori per il GABA;
questa azione, parallela a quella delle benzodiazepine e dei barbiturici, riduce l‟eccitabilità delle
cellule nervose. Al contrario, l‟estradiolo ha un effetto anti-GABAergico e incrementa l‟attività dei
recettori NMDA per il glutammato aumentando l‟eccitabilità neuronale. Evidenze sperimentali
sull‟uomo, mediante la tecnica della stimolazione magnetica transcraniale, mostrano che le
variazioni di estradiolo e/o progesterone, durante il ciclo oppure farmacologicamente indotte,
corrispondono a parallele variazioni dell‟eccitabilità delle vie motorie cortico-spinali. Tuttavia tali
variazioni funzionali non corrispondono a variazioni nella prestazione fisica quale, per esempio, la
potenza meccanica degli arti inferiori durante il salto misurata nelle varie fasi del ciclo mestruale. In
effetti, durante il ciclo, non sembrano avvenire variazioni significative nei vari parametri legati alla
prestazione sportiva quali, per esempio, il volume plasmatico e l‟ematocrito, la frequenza cardiaca e
il lattato ematico a parità d‟intensità sotto massimale, e il massimo consumo d‟ossigeno.
Infine, durante la fase luteale, si deve tener presente che la termoregolazione è leggermente
modificata per via del lieve aumento della temperatura corporea basale. Questo condiziona
l‟attivazione dei meccanismi di termo dispersione (sudorazione, vasodilatazione periferica) ad una
temperatura corporea maggiore rispetto alla fase follicolare. In ambiente caldo e umido, ciò
potrebbe ridurre la prestazione nelle prove di lunga durata (come la maratona) per accumulo di
calore.
Effetti dell’allenamento sul ciclo mestruale
L‟allenamento deve essere considerato come un insieme di fattori di stress cronici ai quali
l‟organismo si adatta con conseguente miglioramento della prestazione fisica. Lo stress cronico
presenta risposte di adattamento complesse che coinvolgono molti ormoni, fra i quali quelli
dell‟asse ipotalamo-ipofisi-surrene e la prolattina. Questi ormoni, ed il conseguente rilascio di
endorfine, sono considerati responsabili delle alterazioni della pulsatilità dell‟LH indotte
dall‟esercizio e delle conseguenti alterazioni della ciclicità delle variazioni delle concentrazioni
ematiche degli ormoni sessuali. In coloro che praticano attività fisica, tali alterazioni possono
presenti anche in assenza di disturbi del ciclo mestruale. In una parte di casi le alterazioni ormonali
delle atlete si associano invece a disturbi quali oligomenorrea, amenorrea, ciclo anovulatorio, fase
luteale accorciata.
Due ipotesi principali sono state formulate per spiegare la comparsa di disturbi del ciclo
mestruale legati all‟attività fisica. La prima riguarda l‟entità dell‟attività stessa: secondo questa
ipotesi la comparsa di disturbi è legata ad un aumento importante nel volume o nell‟intensità
dell‟attività fisica praticata. La seconda ipotesi è legata all‟esaurimento frequente delle risorse
energetiche che, a sua volta, può essere dovuto all‟aumento di volume e/o d‟intensità, ma anche ad
un apporto alimentare insufficiente o squilibrato in rapporto alle necessità. Secondo quest‟ultima
ipotesi, la sterilità che consegue al disturbo del ciclo dovrebbe essere considerata come una strategia
di conservazione dell‟energia per proteggere processi biologici immediati più importanti per la
sopravvivenza rispetto alla gravidanza. A questo proposito si deve tener presente che numerose
discipline sportive enfatizzano la riduzione del grasso corporeo. Fra esse quelle di resistenza (corsa,
ciclismo, sci di fondo) e di destrezza e potenza (salto in alto, ginnastica) nelle quali il peso limita la
prestazione, quelle che prevedono categorie di peso (arti marziali, canottaggio) ed infine quelle che
usano costumi o tenute da gara che rivelano il contorno del corpo (nuoto, pallavolo). La riduzione
del grasso corporeo è considerata un fattore importante fra tutti quelli legati alla comparsa di
disturbi del ciclo mestruale. Tuttavia è necessario sottolineare che ci sono atlete normalmente
mestruate pur essendo al di sotto della percentuale critica di grasso corporeo indicata nel
normogramma di Frisch ed altre atlete oligo/amenorroiche con normali valori di composizione
corporea. Del resto, la meta-analisi dei vari fattori associati alla frequenza del ciclo mestruale nelle
atlete (grasso corporeo, intensità e tipo di attività, volume dell‟attività, età) indica che solo una
percentuale ridotta delle alterazioni mestruali può essere spiegata dall‟insieme di questi fattori.
L‟alterazione del ciclo mestruale legata all‟attività fisica è reversibile e non richiede, di
solito, alcun trattamento ormonale. Si deve però considerare che le alterazioni degli ormoni sessuali
possono essere così gravi da portare a osteoporosi e che il quadro d‟insieme può essere sostenuto e
aggravato da disturbi alimentari di carattere psicogeno quali l‟anoressia. Le atlete con disturbi
mestruali dovrebbero quindi essere attentamente controllate nel tempo. Infatti, alcune di esse
potrebbero sviluppare la cosiddetta “triade dell‟atleta femmina” secondo il termine coniato
dall‟American College of Sports Medicine nel 1992. Esso si riferisce ad una sindrome grave, per la
quale è necessario un intervento combinato di diversi specialisti, caratterizzata dalla presenza di tre
componenti fra loro correlate: disturbo alimentare psicogeno, amenorrea e osteoporosi.
Dieta e fertilità femminile
F. Dotta, M. Calabrese
U.O. di Diabetologia, Università di Siena
Diversi sono i fattori che possono incidere sulla fertilità. Le cause possono agire in sinergia tra loro
ed in variabili momenti della vita: da quella intrauterina alla vita adulta. La compromissione della
fertilità è maggiore tanto più precoce è il danno a carico della funzione riproduttiva. Una dieta
corretta è comunque un ottimo alleato per la fertilità. Le donne decisamente sottopeso o sovrappeso
hanno in genere più difficoltà ad intraprendere una gravidanza: l'eccessiva magrezza può causare
irregolarità mestruali e arrivare a sopprimere del tutto l'ovulazione, ma anche l'obesità può
interferire con il funzionamento del sistema ormonale.
La funzionalità dell‟ovaio risente della quantità di tessuto adiposo: il controllo degli ormoni
riproduttivi femminili da parte del cervello è molto sensibile agli effetti della nutrizione (in
particolare la secrezione ipotalamica di GnRH). Donne sottopeso riferiscono cicli irregolari. Donne
anoressiche sono amenorroiche. L‟organismo compensa la mancanza di energia di riserva
impedendo un ulteriore consumo, che avverrebbe con il ciclo ovarico, e con una gravidanza che non
potrebbe essere “mantenuta” da un organismo già depauperato. La leptina è un ormone prodotto
dalla cellule adipose. In caso di riduzione importante del peso corporeo la secrezione di leptina si
riduce nettamente: si assiste ad una ridotta secrezione di GnRH e conseguentemente di FSH e LH,
mancato reclutamento follicolare e mancata produzione di ormoni sessuali. D‟altronde il
sovrappeso, con l‟incremento del numero delle cellule adipose, comporta un aumento della leptina e
dell‟insulina con innalzamento dei livelli di LH. La secrezione di FSH risulta compromessa,
rendendo impossibile il reclutamento follicolare e viene stimolato eccessivamente lo stroma ovarico
(per effetto degli elevati livelli di LH) che produce testosterone in eccesso.
La sindrome dell‟ovaio policistico (PCOS) rappresenta un quadro clinico classico dove possono
coesistere alterazioni metaboliche associate ad alterazioni della funzionalità ovarica. Questa
sindrome, che oggi è sempre più frequente, si caratterizza infatti per l‟iperandrogenismo, la ridotta
capacità riproduttiva e le alterazioni metaboliche. Circa il 40-50% delle donne affette da PCOS è in
sovrappeso o francamente obesa e presenta spesso iperinsulinemia ed un alterato metabolismo del
glucosio. E‟ stato pertanto ipotizzato e quindi dimostrato che la riduzione di peso corporeo in questo
sottogruppo di pazienti può essere seguita da una ripresa della ciclicità mestruale. In effetti la
riduzione del peso corporeo del 6-8% è associata alla riduzione dei livelli di LH, di testosterone,
dell‟iperinsulinemia, dall‟aumento di SHBG e della frequenza dei sanguinamenti mestruali. Il
trattamento della PCOS con farmaci insulino-sensibilizzanti, quali la metformina, associata ad un
adeguato regime dietetico, rappresenta un‟attuale strategia per evitare la progressione verso il
diabete tipo 2 o verso le alterazioni del metabolismo glucidico tipiche di questa sindrome.
DISORDINI DEL COMPORTAMENTO ALIMENTARE E PSICHIATIA
Francesca Brambilla,
Dipartimento di Salute Mentale, Centro per i Disordini del Comportamento Alimentare, Ospedale
Luigi Sacco, Milano
Come possono essere definiti i Disordini del Comportamento Alimentare (DCA)? La scienza
medica mondiale li classifica fra le patologie mentali, in una categoria a sé stante che include
l‟Anoressia Nervosa (AN, restrittiva o bingeing/purging), la Bulimia Nervosa (BN, purgativa e
non), il Disordine Compulsivo da Abbuffata (BED, con o senza obesità) e la Sindrome da
Abbuffate Notturne (SAN). Tutte patologie la cui eziopatogenesi e l‟assetto psicopatologico non
lasciano dubbi sulla loro appartenenza alla sfera delle alterazioni psichiche. Tuttavia esse sono
caratterizzate da una componente così ampia di alterazioni fisiche da far sì che nel tempo esse
siano state catalogate anche fra le endocrinopatie (AN) o nell‟obesità semplice (BED, SAN) cioè fra
patologie prettamente fisiche. Oggi si sa che queste sono, fuori di ogni dubbio, delle malattie
psichiche, spesso associate ad altre psicopatologie, quali la depressione maggiore, le sindromi
bipolari, le malattie d‟ansia (sindrome ossessiva-compulsiva, fobie, sindrome da attacchi di panico),
i disturbi di personalità, l‟abuso di sostanze dopanti, la cleptomania, e quindi ancor più a ragione
incluse nella scienza psichiatrica. Tuttavia, ciò che crea incertezza nella diagnosi e nel trattamento
di queste patologie è il fatto che i sintomi fondamentali che le caratterizzano sono rappresentati da
alterazioni dell‟alimentazione, con conseguente grave denutrizione (AN), malnutrizione con scelte
abnormi dei cibi (BN, SAN) o eccesso di nutrizione (BED), ma non indotte da alterazioni organiche
del senso di fame, di sazietà o di scelta preferenziale dei cibi, bensì da un‟ideazione distorta sia del
proprio corpo e del significato dei cibi che dei propri valori, che spinge i pazienti a non mangiare
pur avendo intensa fame e assente senso di sazietà (AN), o a stramangiare pur avendo una fame del
tutto normale (BN, BED, SAN). Da questo alterato rapporto col cibo derivano tutte le altre
patologie organiche che caratterizzano i DCA.
I DCA sembrano essere legati a una patologia genetica che determina a livello cerebrale delle
alterazioni delle secrezioni neurotrasmettitoriali, che a loro volta condizionano la comparsa di
caratteristiche di personalità che pongono i pazienti in condizione di non potere o di non sapere
come affrontare la realtà e il mondo esterno. Come risultato essi si retraggono nella torre d‟avorio
della malattia che, essendo voluta e vissuta come un‟ancora di salvezza, gratifica a modo suo i
pazienti stessi. E ne condiziona la ferrea volontà di non curarsi e di non guarire. A loro volta, le
alterazioni neurotrasmettitoriali ingenerano o si associano ad alterazioni neuropeptidiche, in
particolare di elementi che oltre a condizionare fame, sazietà e gusto, esercitano anche un‟influenza
sul tono dell‟umore (depressione, ansia) o sul piano cognitivo (distorsione delle idee). Infine, le
alterazioni neurotrasmettitoriali stanno alla base delle patologie endocrine che, se sembrano essere
legate solo al disordine nutrizionale come dimostrato dal fatto che si sviluppano dopo l‟insorgere
dei DCA e regrediscono totalmente dopo la loro guarigione, tuttavia influenzano la comparsa o
aggravano la sintomatologia psichiatrica, probabilmente agendo con un meccanismo di feedback a
livello neurotrasmettitoriale. In pratica, nei pazienti con DCA assistiamo all‟insorgere di un circolo
vizioso per cui le psicopatologie sono responsabili di danni fisici che a loro volta si riflettono sulla
patologia mentale. E l‟opera prima del terapeuta, quindi deve essere proprio quella di spezzare
questo circolo vizioso, agendo contemporaneamente sui due livelli, psichico e fisico. Solo questo
approccio può condurre a risultati positivi.
Nel secolo scorso, le alterazioni fisiche dei DCA sono state prese poco in considerazione, proprio
per la loro natura di fenomeni sicuramente secondari e autocorreggibili, tranne nel caso di rischio di
morte, per altro altissimo, legato a patologie cardiache, renali, epatiche, cerebrali, idroelettrolitiche
e di altri organi ed apparati. Oggi sappiamo che alcune alterazioni organiche periferiche possono
essere coinvolte nella strutturazione dei dCA durante il loro decorso. Cioè possono avere una
funzione patogenetica, anche se non primaria, e debbono quindi essere prese sempre in
considerazione nel trattamento dei pazienti affetti da DCA. Ci riferiamo qui a patologie cerebrali
della secrezione di neurotrasmettitori e neuropeptidi e a patologie periferiche del sistema endocrino,
che durante il decorso delle malattie possono influenzare l‟insorgere di specifici gruppi
sintomatologici dei DCA, e quindi necessitare di trattamenti farmacologici adeguati.
Quali sono i neurotrasmettitori e neuropeptidi sempre alterati nei DCA? I primi includono la
serotonina, la noradrenalina, la dopamina, l‟acetilcolina, che come ben sappiamo sono alterate con
secrezioni in eccesso o in difetto in tutte le patologie mentali e richiedono specifici trattamenti
farmacologici. I secondi includono patologie secretorie del corticotropin-releasing hormone (CRH),
gonadotropin-releasing hormone (GnRH), somatotropin-releasing hormone (GHRH), thyrotropinreleasing hormone (TRH), vasopressina (ADH), ossitocina (OX), neuropeptide Y (NPY), agutirelated peptide (ARP), oppiodi endogeni, melatonina (MT), melanocortina (α-MSH), brain-derived
neurotropic factor (BDNF) neurotensina, somatostatina che oltre ad esplicare la loro funzione di
regolatori della fame, sazietà e gusto e ad agire specificamente sui sistemi ghiandolari agiscono
anche a livello cerebrale influenzando vari aspetti psicologici. Perifericamente vi sono alterazioni di
funzionalità di tutti i sistemi ghiandolari, ma anche della secrezione di peptidi che esplicano la loro
azione a livello centrale stimolando o inibendo fame e sazietà e vari aspetti psichici. Essi includono
il peptide YY (PYY), la colecistochinina (CCK), il glucagon-like peptide (GLP), la grelina, la
leptina, il polipeptide pancreatico (PP), la galantina, la gastrina, l‟adiponectina e la resistina.
Le alterazioni endocrine e peptidiche hanno sicuramente una funzione compensatoria tentando di
limitare o circoscrivere i danni metabolici indotti dalle alterazioni nutrizionali. Ma, come già detto
sopra, ormoni e peptidi centrali o periferici influenzano gli aspetti psichici dell‟individuo e quindi
possono essere responsabili della comparsa di sintomi specifici durante il decorso dei DCA,
condizionandone alcuni aspetti psicopatologici, influenzando la risposta alle terapie e quindi la
prognosi delle malattie.
Un esempio molto tipico di quanto detto più sopra riguarda le alterazioni della funzionalità del
asse ipotalamo-ipofisi-gonadi (HPG) in corso di AN e meno frequentemente di BN e di SAN.
Nell‟AN il sistema HPG è costantemente alterato, tanto che non vi può essere diagnosi di AN senza
la presenza di amenorrea che della disfunzione HPG è il risvolto clinico. La secrezione di GnRH,
delle gonadotropine FSH ed LH, degli estrogeni, del progesterone e del testosterone é
profondamente ridotta, tanto da raggiungere livelli prepuberali o addirittura infantili. E tale si
mantiene per tutto il decorso della malattia, riprendendo i livelli normali dopo un certo lasso di
tempo (fino a un massimo di 6 mesi circa) dall‟avvenuta guarigione della malattia. Nella BN e nel
SAN generalmente la funzionalità del sistema HPG e la regolarità mestruale sono mantenute, e solo
quando la patologia raggiunge un‟estrema gravità si assiste alla comparsa di amenorrea con i
relativi danni del sistema HPG identici a quelli osservati nell‟AN. Si è sempre ritenuto che questa
patologia sia legata nell‟AN alla denutrizione grave che la caratterizza e nella BN e nel SAN alla
malnutrizione, con assenza di specifici elementi nutritizi, sulla scorta di analoghe alterazioni
ritrovate in corso di denutrizione o malnutrizione semplice. Essendo il fenomeno sempre stato
considerato come un meccanismo di risparmio di energia, e molto legato all‟assenza di grassi
nell‟alimentazione dei pazienti AN e talvolta BN e SAN, indispensabili per la formazione di ormoni
steroidei, si è sempre convenuto sulla non necessità o addirittura la pericolosità di trattare questa
patologia, proprio a causa della sua natura compensatoria. Tuttavia è noto che essa è responsabile di
danni gravi di altri sistemi ed apparati, vedi ad esempio di una osteoporosi a volte devastante. E
quindi si è discusso su quale via terapeutica seguire. Tanto più che è oggi ben noto come
l‟alterazione del sistema HPG interferisca anche sulla funzionalità mentale dell‟individuo,
attraverso gli effetti che esso esplica sui sistemi neurotrasmettitoriale e neuropeptidico,
particolarmente a livello dell‟ipotalamo, dell‟ippocampo, dell‟amigdala e sulla corteccia
prefrontale, e su altri apparati ghiandolari che a loro volta agiscono sul sistema nervoso centrale. E‟
oggi riconosciuto che gli steroidi gonadici agiscono sul tono dell‟umore, sull‟ansia, e sui processi
cognitivi venendo a interferire profondamente sulla psiche dell‟individuo, e quindi sulla sua
capacità di adattamento al mondo esterno. Che è profondamente alterato nei DCA.
Se i danni periferici causati dalla deficitaria funzionalità HPG possono essere corretti nell‟AN,
BN e SAN senza interferire direttamente sulla secrezione ipofiso-gonadica, questo non può essere
ottenuto per quanto attiene ai danni cerebrali. E vi è quindi da domandarsi se una terapia ormonica
gonadica non debba essere instaurata , magari in dosi subliminali, per favorire la guarigione
psichica dell‟individuo.
Un aspetto a parte è quello dei pazienti BED, in cui in genere la funzionalità HPG è ben
mantenuta. Tuttavia quando essi raggiungono la grande obesità che è il traguardo finale della
malattia possono avere dei deficit HPG, con ridotta secrezione degli ormoni, simile a quelli trovati
nell‟obesità semplice. E‟ più difficile in questo caso dire che cosa è dovuto alla malattia psichica e
cosa alla grave alterazione metabolica in atto. Tanto più che questa porta a disfunzioni di altri
sistemi endocrini che si riflettono a loro volta sulle funzioni cerebrali.
I danni osservati nell‟asse HPG sono presenti anche in tutti gli altri sistemi endocrini, che a loro
volta comportano alterazioni della funzionalità cerebrale. Ci riferiamo qui all‟iperfunzione
surrenalica, all‟ipofunzione tiroidea, all‟ipersecrezione di ormone somatotropo associata ad un
deficit di somatomedina, all‟ipoprolattinemia che caratterizzno sempre l‟AN e con minor gravità la
BN e il SAN. Tutte queste patologie endocrine si riflettono sulla stabilità psichica dell‟individuo,
influenzandone i vari aspetti cognitivi ed affettivi. Questo impone la necessità di riprendere in mano
gli studi dei danni periferici, e in particolare da quelli endocrini, creati dalle alterazioni nutrizionali
indotte dai DCA, nel tentativo di potenziare l‟efficacia delle attuali terapie e di ottenere della
guarigioni più rapide di quanto non avvenga oggi e soprattutto più definitive.
Estrogeni: farmacologia e applicazioni terapeutiche
G. Morgante, V. Scolaro.
Clinica Ostetrica e Ginecologica
Università degli Studi di Siena
Fisiologia
Gli estrogeni sono steroidi a 18 atomi di carbonio derivanti dall‟estrano; i principali
sono il 17 - estradiolo, che è il più importante in età riproduttiva, l‟estrone, che
caratterizza soprattutto la steroidogenesi extragonadica nell‟età post-menopausale, e
l‟estriolo, che possiede un‟azione estrogenica debole e che viene prodotto in
maggiore quantità dall‟unità feto-placentare durante la gravidanza.
Il 17 -estradiolo è il più attivo dei tre estrogeni prodotti e circa il 20 % di esso
circola in forma libera, mentre la quota maggiore è legata alle proteine plasmatiche
(60%all‟albumina e 38% alla globulina legante gli steroidi, gonadal steroid-binding
globulin, GBG).
La formazione degli estrogeni deriva da un processo di aromatizzazione a partire
dall‟androstenedione o dal testosterone; l‟aromatasi è contenuta non solo nelle cellule
della granulosa del follicolo ovarico, ma anche nelle cellule dello stroma del tessuto
adiposo, nel sinciziotrofoblasto placentare, nell‟osso e in diverse regioni encefaliche.
Le ovaie sono la principale fonte degli estrogeni circolanti nelle donne in età fertile.
Nelle donne in postmenopausa, invece, la principale fonte di estrogeni è lo stroma del
tessuto adiposo, dove l‟estrone è sintetizzato a partire dal deidroepiandrosterone,
secreto dalla ghiandola surrenalica.
Grandi quantità di estrogeni sono sintetizzate nella placenta che utilizza il
deidroepiandrosterone fetale e il suo derivato 16 alfa idrossilico per produrre
rispettivamente estrone ed estriolo.
Gli estrogeni intervengono:
1. sullo sviluppo puberale, determinando i caratteri sessuali secondari femminili;
2. durante la fase follicolare del ciclo mestruale favorendo la proliferazione
dell‟endometrio;
3. a metà ciclo mestruale favoriscono il picco preovulatorio di LH ed FSH;
4. promuovendo positivamente la massa ossea;
5. nell‟aumento dei livelli di lipoproteine a bassa densità (HDL) e nella
diminuzione dei livelli di lipoproteine a bassa densità (LDL);
6. aumentando i livelli plasmatici di globulina legante il cortisolo (cortisolobinding globulin, CBG o transcortina), di globulina legante la tiroxina
(thyroxine-binding globulin,TBG) e di globulina legante gli steroidi sessuali
(SSBG) che lega sia gli androgeni che gli estrogeni;
7. favorendo la formazione dei fattori della coagulazione VII e XII e diminuendo
i fattori anticoagulanti proteina C, proteina S, e antitrombina III.
I.
Farmacologia e Indicazioni terapeutiche
Gli estrogeni possono essere distinti in naturali e sintetici e possono essere
somministrati per via orale, parenterale e vaginale.
E‟ stato dimostrato che la via di somministrazione ai fini degli effetti collaterali è più
importante della natura stessa dello steroide somministrato.
I due usi principali sono come componenti dei contraccettivi e come terapia ormonale
sostitutiva nelle donne in postmenopausa.
I due estrogeni più utilizzati nella contraccezione sono l‟etinilestradiolo e il
mestranolo a cui è associato un progestinico. Il contenuto di estrogeni nelle
preparazioni attuali varia tra 15-50g.
L‟associazione tra l‟uso di contraccettivi orali contenenti estrogeni e l‟insorgenza di
tumori non ancora chiara. Studi recenti hanno evidenziato una diminuzione del 50 %
dell‟incidenza del cancro endometriale per effetto del progestinico che si oppone alla
proliferazione indotta dagli estrogeni. Il rischio per quanto riguarda l‟insorgenza del
cancro della mammella in donne in età fertile è molto basso: il rischio relativo è di
circa 1.1.
La dose di estrogeni utilizzati nella terapia ormonale sostitutiva dovrebbe essere la
minima efficace in grado di rimuovere i sintomi legati alla carenza estrogenica. La
dose è diversa a seconda dell‟estrogeno e della via di somministrazione.
I benefici derivanti dalla TOS si manifestano con il miglioramento o la scomparsa
delle manifestazioni vasomotorie, dei disturbi derivanti dall‟atrofia delle mucose
genitali ed urinarie dei disturbi dell‟equilibrio neurovegetativo e psicoemotivo.
Uno degli effetti più importanti della terapia estrogenica è rappresentato dalla
prevenzione delle malattie cardiovascolare e dell‟osteoporosi.
Il
rischio
maggiore
legato
all‟utilizzo
della
terapia
solo
estrogenica
è
l‟iperstimolazione dell‟endometrio; ciò è stato ovviato con l‟associazione con un
progestinico in modo da riprodurre la sequenza ormonale fisiologica che permette di
garantire il normale trofismo endometriale evitandone l‟iperplasia.
Le controindicazioni all‟utilizzo della terapia ormonale sostitutiva sono l‟insorgenza
di tromboflebiti, episodi tromboembolici; malattie e disfunzioni epatiche gravi;
sanguinamenti vaginali non diagnosticati; l‟insorgenza del cancro della mammella o
dell‟endometrio e ipertensione arteriosa.
Gli schemi utilizzati nella terapia ormonale sostitutiva sono: il regime sequenziale
ciclico, sequenziale continuo e combinato continuo che vanno applicati sulla base
delle caratteristiche anamnestiche della donna in postmenopausa.
Bibliografia
- Speroff L, Glass RH, Kase NG. Clinical Gynecologic Endocrinology and
Infertility. 6th ed. Philadelphia, PA: Lippincott, Williams & Wilkins; 1999.
- Dupont WD, Page DL. Menopausal estrogen replacement therapy and breast
cancer. Arch Intern Med 1991; 151:67-72.
- Writing Group For The Women‟s Health Initiative Investigators. Risks and
benefits of estrogen plus progestin in healthy postmenopausal women:
principal results from the women‟s health initiative rendomized controlled
trial. JAMA 2002; 288:321-333.
- The women's health initiative steering committee. Effects of conjugated equine
estrogen
in
postmenopausal
2004;291:1701-12.
women
with
hysterectomy.
JAMA.
Progesterone = ormone nativo
Progestinici = ormoni di sintesi
• Molecole capaci di:
– indurre nell’endometrio estrogenizzato la
trasformazione secretiva
– supportare lo sviluppo ed il mantenimento
della gravidanza
Progestinici: farmacologia e
applicazioni terapeutiche
Prof. Ettore Cicinelli
4° U.O. di Ginecologia ed Ostetricia
Università di Bari
Regimens for progesterone supplementation
• Progesterone administered orally is subjected to
firstpass pre-hepatic and hepatic metabolism.
This metabolic activity results in progesterone
degradation to its 5a- and 5b-reduced
metabolites (Penzias, 2002).
• Parenteral administration (vaginal, rectal and
IM) of progesterone overcomes the metabolic
consequences of orally administered
progesterone (de Ziegler et al., 1995).
Nahoul K. et al. Maturitas 1993:16;185-202
Other Potential Effects
of Progesterone
Metabolismo del P orale
• Necessità quindi di elevate dosi di
progesterone orale rispetto a progestinici
• Metaboliti del progesterone possiedono
effetti anestetici e pertanto l’effetto
sedativo ed ipnotico del progesterone
somministrato per os è probabilmente
mediato dai suoi metaboliti. In uno studio
su 8 pazienti, una paziente dopo una dose
di 400 mg os manifestò uno stato ipnotico
per circa 2 ore.
• Progesterone can modulate CNS GABAA
receptor activity through its reduced
metabolite, allopregnanolone
O moodiness,
CH
– Sleepiness,
depression
O
3
CH3
CH3
CH3
H
Arafat et al., Am J Obstet Gynecol 1988
CH3
H
H
H
H
H
HO
O
Progesterone
Allopregnanolone
CH3
Der. Progesterone
Rationale clinico dei progestinici
Der. Testosterone
PREGNANI
Acetilati:
MAP
Megestrolo
Medrogestone
Ciproterone
Clormadinone
• P per via orale: efficacia limitata
• Potenziamento di alcuni effetti:
– Azione anti-gonadotropinica
– Azione anti-estrogenica
– Azione anti-androgenica
– Azione anti-aldosteronica
GONANI
ESTRANI
1° generazione
2° generazione
3° generazione
Noretindrone
Desogestrel
Gestodene
Dl-Norgestrel
Noretindrone
acetato
Non acetilati:
Levonorgestrel
Diidrogesterone
Etonorgestrel
Norelgestromina
Etinodiolo
diacetato
Norgestimate
4°
generazione
Linestrenolo
NORPREGNANI:
Nomegestrolo
Nestorone
Trimegestone
Dienogest
Noretinodrel
Derivati dello spironolattone:
Drospirenone
Receptor affinities of progestogens (Climacteric, 2004)
PROGESTOGEN
Estrogen
receptor
Anti-estrogen
receptor
Androgen
receptor
Antiandrogen
receptor
Glucocorticoid
receptor
Antimineralcorticoid
receptor
Steroid Receptor
Potency & Selectivity of Progestins
19-nortestosterone
derivatives
Noretisterone
(+)
+
+
-
-
-
Levonorgestrel
-
+
+
-
-
-
Norgestimate
-
+
+
-
-
-
-
+
+
-
-
-
-
+
+
-
(+)
+
-
+
-
+
-
-
Desogestrel
Gestodene
Dienogest
Progesterone
derivatives
This classification no longer satisfactory !
While the endometrial and bone effects of different
progestogens are quite similar, the metabolic ,
vascular and side-effects have substancial
differences
Progesterone
-
+
-
(+)
(+)
Medroxyprogesterone
-
+
(+)
-
+
-
Dydrogesterone
-
+
-
-
-
(+)
Chlormadinone acetate
-
+
-
+
+
-
Medrogestone
-
+
-
(+)
-
-
Cyproterone acetate
-
+
-
+
+
-
Drospirenone
-
+
-
+
-
+
Meccanismi non lipidici = 30-60%
dell’effetto cardio-protettivo
dell’HRT
+
Mol.
PR
Prog
+
Dihyd
NETA
LNG
Cipr.
MPA
Nom
TMG
Drosp
+
++
+++
++
++
+++
+++
++
AR
antiAR
GR
antiGR
antiMR
ER
-
+
-
+/-
+
-
+
++
+
-
++
++
+
+
+-
-
+/+
++
+
+
-
Coronary artery vasomotion
Condition
(females)
Acetylcoline-induced
coronary artery
dilatation/constriction
Normal
Atherosclerotic
estrogen-deficient
Atherosclerotic
CEE-treated
Atherosclerotic
CEE and MPA-treated
(Clarkson et al., 1996)
Effects of different progestagens on
coronary vasospasm in monkeys
Control
Artery atherosclerosis
in oophorectomized cholesterol-fed rabbits
Atherosclerotic aortic lesions
surface (%) after 4 months
Control
Estradiol
31.23
Estradiol +
Norethisterone
28.16
17.91
Vasospastic challenge:
Thromboxane
*
*
(Sanjuan et al., Menopause 2002))
(Miyagava et al., Nature Med 1997)
Coronary artery atherosclerosis
in monkeys
Plaque area
Control
0.23
(mm2)
Estradiol
Estradiol +
progesterone
0.10
0.10
(Clarkson et al., 1996)
Reasons for OC discontinuation
Fourth-generation progestins
Dienogest
Nestorone
Nomegestrol acetate
Trimegestone
Drospirenone
The fourth-generation progestins have
been designed to have no androgenic or
estrogenic actions and to be closer in
activity to the physiological hormone
Sitruk-Ware, Drugs aging 2004
progesterone.
The antimineralocorticoid effect of drsp
Estrogens
breakthrough bleeding (BTB)
nausea
headache
breast tenderness
weight gain
mood swings
acne, and hirsutism
Angiotensinogen
Angiotensin I
Estrogen
Angiotensin II
Dose-dependent
AT1 Receptor
Aldosterone
Drospirenone
Progestin
Molecule-dependent
Darney, Int J Fertil Womens Med 1997
Aldosterone receptor
antagonists
Kidneys
Na and H2O retention
K and Mg2+ Loss
Increased plasma volume
Hypertension
Water-retention-related symptoms including weight gain,
breast tenderness and bloating
Aldosterone and CVD
Aldosterone
Old conceptions:
•
Aldosterone is an adrenal gland
hormone
•
Acts at kidney level
•
Has mineralcorticoid effects
•
Spironolactone is potassium
sparing with weak natriuretic
drugs
Modern conceptions:
•
Aldosterone is produced in other
tissues (including the heart and
vessels)
•
Acts also outside the kidney
(paracrine)
•
Has genomic and nongenomic effects
with major patho-physiological
consequences in CV disease.
• Aldosterone well recognized risk factor for
CVD:
– Pathophysiology of hypertension
– Left ventricular hypertrophy
(Struthers, Curr Heart Fail Rep 2004;
– Heart failure
Rossi et al., Trends Endocrinol Metab 2005)
• Aldosterone promotes:
• myocardial and vascular fibrosis
• impairs arterial compliance and cardiac
remodelling
• induces perivascular inflammation
(MacFayden et al., JECM 1997)
Aldosterone and vasculopathy: mechanisms
Hypertension. 2006 Aug;48(2):246-53.
Effects of a new hormone therapy, drospirenone and 17-beta-estradiol, in postmenopausal women with
hypertension.
White WB, Hanes V, Chauhan V, Pitt B.
Double-blind RCT of 3 doses of DRSP
combined with estradiol, estradiol alone,
and placebo in 750 postmenopausal
women with stage 1 to 2 hypertension
between 45 to 75 years.
• Aldosterone increases superoxide radicals which degrade
endogenous nitric oxide (excess NADH and NADPH oxidase)(
Virdis et al., 2002 ).
Effects of DRSP/E2 vs placebo on clinic BP
after 8 weeks of double-blind therapy.
A is changes in systolic BP and B is
changes in the diastolic BP.
Changes from baseline were significant for
the 3- and 2-mg DRSP/E2 groups only
(systolic BP, P=0.0004 and 0.0195 for 3and 2-mg DRSP/E2 groups, respectively;
diastolic BP, P<0.001 for both 3- and 2-mg
groups).
• Aldosterone produces vascular inflammation (Rocha et al., 1998,
Rocha et al., 2002): “aldosterone-induced vasculitis”
• Aldosterone can activate vascular angiotensin responses:
– significant increase in the binding density of both ACE and AII receptors
in animal experiments.
– increases in expression of tissue ACE by 23-fold in tissue culture (Harada
et al., 2001 ).
Second vs. Third Generation OCP
VTE and 3rd Generation OCP
0,7
180
140
0,5
120
0,4
100
0,3
80
60
0,2
40
0,1
20
0
0
1977- 1979- 1981- 1983- 1985- 1987- 1989- 1991- 1993
8
80
2
4
6
8
90
2
Admission Rate per Million
Person Years
160
0,6
Percentage Use 3rd Gen OCP
Conclusion: DRSP combined with E2
significantly reduces BP in postmenopausal
women with hypertension and did not induce
significant increases in serum potassium.
Use of 3rd OCP
Men
Women
• Third generation OCP first introduced in mid-1980‟s
• Use decreased significantly after 1995 when first reports of
increased risk of DVT appeared
• Postulated reasons for findings
–
–
–
–
Healthy user bias
Prescribing bias
Referral bias
Inadequate control of confounders
• But 1.7 times greater risk confirmed by meta-analysis
Year
BMJ „01; 319:820-1
BMJ „01; 323:1-9
Contraception ‟00;62:21S-8S
Contraception ‟00;62:29S-36S
Effect of OC use of nAPCR-sr determined with
the endogenous thrombin potential-based APCR
test
Effect of progestin type
Helmerhorst et al, T&H 1997
100
II (30 or 50 μg EE)
III (20 or 30 or 35 μg EE)
6
2.0 (1.7- 2.8)
5
(nAPC-sr)
RR 10
1
4
3
2
1
0
3rd generation vs 2nd generation
Men
No OC
2nd
generation
Women
3rd
generation
FV Leiden
No OC
Rosing et al, Am J Obst Gynec 1999
Contraccezione con soli progestinici in donne ad alto
rischio di trombosi venosa profonda
Eventi tromboembolici durante il follow-up (21+18 mesi)
- Utilizzatrici : 3
- Non utilizzatrici: 6
Rischio relativo di trombosi
- Età > 35 anni: RR = 22.2 (95% IC: 3.6 - 138.3)
- Trombofilia: RR = 9.7 (95% IC: 1.3 - 71.5)
Vasilakis- Scaramozza C , Jick H
Lancet 2001; 358:1427-9
- BMI > 30: RR = 6.5 (95% IC: 0.6 - 73.4)
Trattamento CMA: RR = 0.8 (95% IC: 0.2 – 3.9)
Conard, Contraception 2004
The ESTHER Study
Canonico et al., Circulation 2007
• Study design: multicenter case-control study of VTE
among postmenopausal women 45 to 70 years of age
between 1999 and 2005 in France.
• Patients: 271 consecutive cases with a first documented
episode of idiopathic VTE (208 hospital cases, 63
outpatient cases) and 610 controls (426 hospital
controls, 184 community controls) matched for center,
age, and admission date.
The ESTHER Study
Canonico et al., Circulation 2007
Current users oral estr.
Current users transderm.
OR for VTE vs non users
4.2 (95% CI, 1.5 to 11.6)
0.9 (95% CI, 0.4 to 2.1)
- Micronized progesterone and pregnane derivatives: no risk (OR, 0.7; 95% CI,
0.3 to 1.9 and OR, 0.9; 95% CI, 0.4 to 2.3, respectively).
- Norpregnane derivatives: 4-fold-increased VTE risk (OR, 3.9; 95% CI, 1.5 to
10.0).
CONCLUSIONS:
a) Oral but not transdermal estrogen is associated with an increased VTE risk.
b) Norpregnane derivatives (Nomegestrolo acetato, ciproterone acetato,
trimegestone) may be thrombogenic, whereas micronized progesterone
and pregnane derivatives appear safe with respect to thrombotic risk.
EURAS & Ingenix:
Yasmin is as safe as other OCs (TE)
EURAS & Ingenix:
Yasmin as safe as other OCs (VTE)
TE Incidence Rate Ratio –
Yasmin versus Other OCs (95% CI)
VTE Rate Ratios (95% CI)
EURAS
EURAS
INGENIX
INGENIX
0.2
0.25
0.33
0.5
1.0
2.0
3.0
4.0
5.0
0.2
0.25
0.33
0.5
1.0
2.0
3.0
4.0
5.0
ITT analyses.
EURAS - Yasmin = 41,169 WY (N=16,534); Other = 100,816 WY (N=41,769)
INGENIX - Yasmin = 14,541 WY (N=22,429); Other = 28,169 WY (N=44,858)
L’unico effetto comune a tutti
progestinici è l’affinità per i recettori
del progesterone
Schindler et al., Maturitas 2003;46(1):S7–S16
Tutti i progestinici hanno uno specifico profilo
di attività verso i recettori di altri organi
bersaglio, un profilo non necessariamente
condiviso da tutti i progestinici
I progestinici possiedono diversi effetti
biologici
Scelta della via di somministrazione
non-orale
• Evitamento primo passaggio epatico
• Possibilità di concentrare l‟effetto su organo
target
• Ridurre l‟esposizione sistemica
EURAS & INGENIX Studies ITT analyses, Exposure = >180,000 WY
Progesterone/Progestinici
Rationale
• Scelta della molecola
• Scelta della via di
somministrazione
PROGESTINICI
VIE DI SOMMINISTRAZIONE
• Via Intramuscolare (Progesterone)
• Via Orale (Progestinici di sintesi, P Micronizzato)
• Via Transdermica (NETA, Levonorgestrel,
Norelgestromina)
• Via Vaginale (Progesterone, etonorgestrel)
• Via Intrauterina (IUD) (Levonorgestrel)
35
Farmacocinetica del P orale
30
25
• Ampia variabilità interindividuale
nei livelli sierici
• 200 mg/die dose consigliata per
la prevenzione dell’iperplasia
endometriale
• In caso di somministrazione di
200 mg di P orale dopo un pasto
la Cmax è risultata 5 volte più
alta e la AUC0-24 circa due volte
maggiore. Leggermente
aumentata anche la Tmax.
Via transdermica
20
h
Cmax
15
10
• NETA
• Levonorgestrel
• Norelgestromina
5
0
100 mg
200 mg
300 mg
Dosi di P orale
3
2,5
2
h 1,5
Tmax
1
0,5
(Simon et al., 1993)
0
100 mg
200 mg
300 mg
Dosi di P orale
Sistema contraccettivo transdermico
Neta
Farmacocinetica
– Livelli plasmatici costanti
Livelli plasmatici di etinilestradiolo e di norelgestromina dopo
somministrazione orale o dopo applicazione di Evra
Abrams L.S. et al.: Contraception 64:287-294, 2001
Mirena
Progestinici per via locale
• IUD con rilascio continuato di LNG
• Approvato nel 1990 in Finlandia
Via intrauterina:
progesterone
LNG (Mirena)
Via vaginale:
etonorgestrel
progesterone
• Approvato per uso contraccettivo ed
in menopausa
• La riserva di LNG (52 mg) circonda il
braccio verticale dello IUD
• LNG disperso in polidimetilsilossano
e ricoperto da una membrana dello
stesso materiale, che controlla il rate
del rilascio
Mirena
• Tasso di rilascio iniziale è di 20 g/24 h poi si
riduce a 15 g/24 h dopo 5 anni e a 12 g/24
h dopo 7 anni.
• Livelli plasmatici di LNG sono di 170 pg/ml
ad 1 anno, 150 pg/ml a 2 anni e 140 pg/ml a 5
anni (Lahteenmaki, personal
communication)
• Il tempo di vita dello IUD attualmente
approvato è di 5 anni
LNG
Elevate concentrazioni
nell’endometrio
endometrio
concentrazioni nel miometrio
molto basse
miometrio
Mirena
Concentrazioni tissutali di LNG
40
35
30
25
ng/g di
20
tessuto
15
LNG orale
LNG IUD
10
5
0
sierosa
Miometrio, tube,
tessuto adiposo
assorbimento sistemico
Endometrio
(Nilsson et al., Contraception 1992)
Influence of different hormonal regimens on endometrial microvascular density and VEGF
expression in women suffering from breakthrough bleeding.
Rogers PA et al., Hum Reprod. 2005
Mirena & menorragia
PATIENT(S): Thirty-four patients with MBL over 80 mL.
Endometrial blood vessel density
INTERVENTION(S): Insertion of the LNG-IUS on cycle days 5-7 and follow-up at 3-month
intervals for 3 years.
150
90
80
70
60
50
40
30
20
10
0
100
50
MBL (%)
Hb (g/L)
Ferritin (ng/mL)
0
*
-50
-100
ccHT
cyclHT
Mirena
No therapy
0
6
12
24
36
months
Xiao et al., Fertil Steril 2003
Progestins and meno-metrorrhagia
Lethaby et al., Cyclical progestogens for heavy menstrual bleeding. Cochrane
Database Syst Rev. 2000;(2):CD001016.
• Progestogen therapy administered from day 5 to 26 of the
menstrual cycle was significantly less effective at reducing
menstrual blood loss than the progestogen releasing
intrauterine system (LNG IUS) although the reduction from
baseline was significant for both groups. The odds of the
menstrual period becoming "normal" (ie <80mls/cycle) were
also less likely in patients treated with norethisterone (NET)
(days 5 to 26) compared to patients treated with LNG IUS.
• A significantly higher proportion of NET patients found their
treatment unacceptable compared to LNG IUS patients.
However, the adverse events breast tenderness and
intermenstrual bleeding were more likely in the patients with
the IUS.
Progestogen releasing intrauterine systems for heavy menstrual
bleeding (Cochrane Review)
•
•
•
•
•
The levonorgestrel-releasing intrauterine device (LNG IUS) is more
effective than cyclical norethisterone (21 days) as a treatment for
heavy menstrual bleeding.
Women with an LNG IUS are more satisfied and willing to continue
with treatment but experience more side effects such as intermenstrual
bleeding and breast tenderness.
The LNG IUS results in a smaller mean reduction in menstrual blood
loss than transcervical resection of the endometrium (TCRE) and
women are not as likely to become amenorrhoeic but there is no
difference in the rate of satisfaction with treatment.
Women with an LNG IUS experience more progestogenic side effects
compared to women having TCRE for treatment of their heavy
menstrual bleeding but there is no difference in their perceived quality
of life.
There are no data available from randomised controlled trials
comparing progesterone-releasing intrauterine systems to either
placebo or other commonly used medical therapies for heavy
menstrual bleeding.
Lethaby AE, CThe Cochrane Library, Issue 3, 2004.
Mirena
Menorragia
• Significativa riduzione della menorragia:
– Idiopatica (Anderson & Rybo, 1990)
– Associata ad adenomiosi (Fedele et al., 1997)
• Trattamento più semplice e meno costoso
rispetto a:
– Ablazione endometriale
– Isterectomia
Lethaby et al., Cochrane Database Syst Rev, 2000
Mirena
HRT
• Progestinico rilasciato a contatto con il suo organo
bersaglio (endometrio)
• La dose giornaliera è inferiore a quella della terapia
sistemica sia sequenziale che continua
• Le concentrazioni tissutali di LNG durante l’uso di
Mirena sono significativamente più alte di quelle ottenibili
anche con elevate dosi sistemiche di LNG (Nilsson et al.,
Contraception 1992):
– Forte soppressione endometriale (Nilsson et al., 1978)
– Durante ERT continua spotting occasionale nei primi 3-4 mesi,
dopo 12 mesi l’83-88% in amenorrea (Andeson et al., 1992)
– Blocco sintesi ER (insensibilità endometriale anche in caso di
somministrazione continua di E2) (Raudaskoski et al., Am J
Obstet Gynecol 1995; Suhonen et al., Acta Obstet Gynecol Scand
1997)
– Significativa riduzione insorgenza di fibromi a 7 anni (Sivin et al.,
Fertil Steril, 1994)
• Alto tasso di continuazione: 82/100 a 3 anni (Suhonen, 1997)
Mirena and endometrial hyperplasia:
role of apoptosis
•
•
•
•
•
Local application of an intrauterine device with high-dose gestagens was
superior to systemic treatment in women with endometrial hyperplasia
(Vereide AB et al, Gynecol Oncol 2003)
This may be the result of an exposure to dose being many-fold higher due
to the local application (Nilsson CG et al, Clin Endocrinol (Oxford) 1982)
Gestagen hormones have a documented antiproliferative effect in the
human endometrium in vivo as well as in vitro. Former studies suggest that
at least 60% of patients with endometrial hyperplasia will respond to
gestagen therapy and various treatment regimens have been given to
patients [Randall TC & Kurman RJ, Obstet Gynecol, 1997; Amezcua
C.A.et al, Gynecol Oncol 2000)
The secretory changes induced by endogenous progesterone in the normal
cycling endometrium are accompanied by various molecular processes,
among which apoptosis has shown to be of great importance (Maruo T. et
al, Hum Reprod 2001)
Apoptosis or programmed cell death in the histological normal human
endometrium after intrauterine levonorgestrel device has also been
demonstrated (Maruo T. et al, Hum Reprod 2001)
Bcl-2, BAX, and apoptosis in endometrial hyperplasia after high dose
gestagen therapy: a comparison of responses in patients treated with
intrauterine levonorgestrel and systemic medroxyprogesterone.
Vereide AB et al., Gynecol Oncol. 2005 Jun;97(3):740-50.
• Bcl-2
is an antiapoptotic proteins,
shown to protect cells
from apoptosis by
regulating
mitochondrial
membrane function.
• Another member of
the Bcl-2 family, the
BAX protein, increases
the apoptotic
susceptibility of cells in
several organs
Bcl-2, BAX, and apoptosis in endometrial hyperplasia after high dose gestagen
therapy: a comparison of responses in patients treated with intrauterine
levonorgestrel and systemic medroxyprogesterone.
Vereide AB et al., Gynecol Oncol. 2005 Jun;97(3):740-50.
CONCLUSION:
• Proteins in the apoptotic
cascade are regulated by
gestagen therapy in
human endometrial
precancers.
• Expression of these
proteins is shown to be
dependent on
administration form
and/or type of gestagen.
• Stromal Bcl-2 expression
appears to be a potential
biomarker which can
separate responders of
gestagen treatment from
non-responders after oral
administration.
Bcl-2 expression in
endometrial glands and
stroma before and after
treatment
NuvaRing
BAX expression in
endometrial glands and
stroma before and after
treatment
Glands
Anello flessibile, trasparente, di materiale anallergico,
atossico e biocompatibile: EVA (etilene vinilacetato)
• Diametro 5,4 cm, spessore
4 mm
• Rilascia costantemente 15
mcg di EE e 120 mcg di
ENG al giorno.
• La forma ad anello si
adatta alle caratteristiche
anatomiche di tutte le
donne
Stroma
Comparison of uterine concentrations of ethinyl
estradiol and etonogestrel after use of a
contraceptive vaginal ring and an oral
contraceptive
Frans J.M.E et al., Fertil Steril 2006
Profilo farmacocinetico
TABLE 2: Mean EE and ENG uterine tissue concentrations (expressed as pg/0.5 g tissue)
and serum concentrations (pg/mL) (ASPE group).
EE
ENG
NuvaRing (n = COC (n =
5)
3)
NuvaRing e 30 EE/150 DSG COC
NuvaRing (n
= 5)
COC (n =
3)
Uterine tissue
concentrations
Etonogestrel (pg/mL)
Css OC
60
50
1500
40
Css OC
1000
30
500
20
0
10
-500
Etinilestradiolo (pg/mL)
Etonogestrel
Etinilestradiolo
2000
Vaginal
administration of
hormones with
NuvaRing did not
produce elevated
uterine
concentrations of EE
and ENG, compared
with an oral
contraceptive.
Location
Upper myometrium (Myo
63 ± 27
1 and 2)
75 ± 17
344 ± 60
518 ± 219
Mid myometrium (Myo 3
60 ± 26
and 4)
64 ± 23
362 ± 69
349 ± 90
Cervical region (Cerv 1
and 2)
68 ± 19
99 ± 44
327 ± 106
396 ± 12
>223 ± 136
>523 ± 401 1039 ± 297
1766 ± 748
1h
12 ± 2
21 ± 11
1224 ± 399
1235 ± 267
12 h
15 ± 4
14 ± 10
1205 ± 426
926 ± 288
Endometrium (Endo)
Serum concentrations a
Time before surgery
0
0
5
10
15
20
Note: Data are presented as mean±SD.
Tempo dall'inserimento (gg)
Roumen. Uterine hormone levels with NuvaRing. Fertil Steril 2006.
a Serum concentrations were measured 1 h and 12 h before surgery.
Timmer & Mulders, Clin Pharmacokinet, 2000;39:233–42
Effects of OC on hemostatic variables and estrogen-sensitive
liver proteins are largely related to EE and independent of
delivery route during short-term treatment.
Curve di assorbimento del P dopo somministrazione orale e vaginale
P orale
Sitruk Ware R, et al. J Clin Endocrinol Metab. 2007
Prothrombin fr. 1+2
EE (15 mcg)
orally
No Variation
EE (15 mcg)
vaginally
No variation
Angiotensinogen
2754 ng/ml *
2864 ng/ml *
P vaginale
EE: Vaginal administration = oral administration
* Significantly greater than baseline, P < 0.0002
Levine H. et al. Fertil
Steril 2000;73:516-21.
Curve di assorbimento del P dosato con
tecniche ad elevata specificità (RIA dopo
cromatografia su Celite)
Progesterone sierico (ng/ml)
Progesterone 100 mg
5
4,5
4
3,5
3
2,5
2
1,5
1
0,5
0
P vaginale
P orale
0
6
12
18
24
30
36
42
48
Ore
Nahoul K. et al. Maturitas 1993:16;185-202
Livelli sierici di 5a-pregnenolone
(Nahoul et al., Maturitas, 1993)
Livelli sierici di P dopo somministrazione di P
gel 4% a giorni alterni
6
5
P
P
P
4
12
10
P vaginale
P orale
8
6
ng/ml
5alfa-Pregnenolone sierico
(ng/ml)
Progesterone 100 mg
16
14
3
2
1
4
2
0
0
20
40
60
0
80
100
120
140
Hours
0
6
12
18
24
Ore
Days
0
1
2
(Nahoul et al., Maturitas, 1993)
Via vaginale:
CMax: 5-8 ng/ml
TMax: 6-8 h
T/2: 24 h
…………..... e
una sorpresa
3
4
5
6
(Fanchin et al, Obstet Gynecol 1997)
First uterine pass effect
Vaginal progesterone:
dose-effect relationship
Uterine effects
exceed
expectations
drawn from
circulating levels
(De Ziegler, 1999)
Vaginal vs IM progesterone in
estrogenized postmenopausal women
Vaginal Route Paradox
Miles et al., Fertil Steril 1994; 62: 485-90
ng/mL
Serum P levels
Progesterone levels
Endometrial P concentrations
Endometrium
(ng/mg protein)
ng P / mg protein
18
16
14
12
10
8
6
4
2
0
12
10
8
6
4
2,5
2
1,5
1
2
3
IM
4
5
6 Hours
IM
0,5
0
2
0
Vaginal
1
0
10
0
Control
Vaginal
20
30
40
50
Serum (ng/mL)
Vaginal
IM
(Cicinelli et al., Obstet Gynecol 2000)
Countercurrent transport
Vaginal vs IM progesterone in estrogenized
postmenopausal women
Vagina
Vein
Uterine Artery
Endometrium/serum progesterone levels x 100
10
Min
Max
5
IM P Vaginal P
1,15
14,08
0,51
13,07
8,46
59,43
Blood flow
Median
Blood flow
*
15
0
IM P
Vaginal P
~ 1 : 14
Functional “portal system”
(Cicinelli et al., Obstet Gynecol, 2000)
E2/P
Continental divide
Ovarian artery – Uterine artery
(Cicinelli & DeZiegler, Human Reprod 1999)
Variation in blood flow in the uterine artery and in the arteries of
urethra-vaginal septum depending on the level of vaginal
administration
E2/P
300
Ov. art.
Ov. art.
*
*
%
200
*
Omolateral uterine
artery
100
0
-100
Ut. art.
Upper 1/3
Ut. art.
Follicular phase
Contralateral
uterine artery
Luteal phase
(Cicinelli et al., Hum Reprod 2004)
Lower 1/3
Vessels of urethrovaginal septum
Site of vaginal
administration
(Cicinelli et al., Am J Obstet Gynecol 2003)
Importance of the level of vaginal administration
B
U
Local
(preferential)
Uterus
transfer of vaginal
steroids is
influenced by the
level of vaginal
administration:
Upper third:
to the uterus
Steroid Lower third:
to the urethra
Indicazione al progesterone invece che
ai progestinici:
Assoluta:
trattamenti di riproduzione assistita
gravidanza
Preferenziale (a causa degli effetti
indesiderati):
trattamenti a lungo termine (controllo
del ciclo, H.R.T. ecc.)
(Cicinelli et al., Am J Obstet Gynecol 2003)
Ormoni steroidei e teratogenesi
•
RR 2.75 - 8.41 di malformazioni maggiori isolate o in associazione del
complesso VACTREL (V, vertebre; A, ano; C, cuore; T, trachea; E,
esofago; R, rene; L, gambe)
(Nora et al., JAMA 1978; Heinonen et al., N Engl J Med 1977)
•
In campo animale:
– Anomalie dei genitali in macachi di entrambi i sessi in caso di
esposizione a MAP e CA nel periodo critico di sviluppo dei genitali
(Prahalada et al., Teratology, 1985)
– Nei topi trattati con MAP e CA maggiore incidenza dose-dipendente
di ridotto peso alla nascita, labiopalatoschisi, anomalie urinarie,
exencefalia e malformazioni cardiache
(Eibs et al., Teratology, 1982)
•
Nell’uomo l’esposizione intrauterina a MAP non sembra teratogena né
causa anomalie di sviluppo e di salute a lungo termine
(Katz et al., Obstet Gynecol 1985; Yovich et al., Teratology, 1988; Jaffe et al., JAMA 1978)
•
Nessuna malformazione da fallimento “pillola del giorno dopo”
(Contraception, 1997; Agenda salud, 1999)
Ormoni steroidei e teratogenesi
Oral contraception and congenital malformations in
offspring: a review and meta-analysis of the prospective
studies.
Brachen MB, Obstet Gynecol. 1990 Sep;76(3 Pt 2):552-7.
• RR (12 prospective studies): 0.99 (95% CI 0.83, 1.19) for all
malformations.
• RR for congenital heart defects: 1.06 (95% CI 0.72, 1.56)
and for limb reduction defects, 1.04 (95% CI 0.30, 3.55).
• This lack of an association between OCs and birth defects
in prospective studies agrees with the results of most of the
better-designed case-control studies.
Progesterone: indicazioni
Maternal Progestin Intake
and Risk of Hypospadias
Carmichael SL et al. for the National Birth
Defects Prevention Study
Arch Pediatr Adolesc Med. 2005;159:957-962.
In riproduzione/gravidanza
• supporto luteale nei programmi di riproduzione assistita
• prevenzione dell‟aborto
• trattamento dell‟aborto
• trattamento della minaccia di parto pretermine
• prevenzione della pre-eclampsia.
In ginecologia:
• controllo del ciclo mestruale
• dismenorrea
• trattamento della menorragie
• contraccezione
• terapia dell‟endometriosi
• della patologia iperplastica dell‟endometrio
• terapia ormonale sostitutiva
• prevenzione danni neurologici.
Progesterone: indicazioni
Riproduzione/gravidanza
• supporto luteale nei programmi di
riproduzione assistita
• prevenzione dell‟aborto
• trattamento dell‟aborto
• trattamento della minaccia di parto pretermine
• prevenzione della pre-eclampsia.
LPD
Etiology of LPD in IVF cycles
Luteal phase defect (LPD)
• The prevalence of LPD in natural cycles in
normo-ovulatory patients with primary or
secondary infertility is about 8.1%
(Rosenberg et al.,1980).
• Stimulated IVF cycles are associated with a
defective luteal phase in almost all patients
(Ubaldi et al., 1997; Macklon and Fauser,
2000; Kolibianakis et al., 2003).
LPD
Etiology of LPD in IVF cycles
1. Removal of large quantities of granulosa cells during the oocyte
retrieval (OR).
4. Supraphysiological levels of steroids secreted by a high
number of corpora lutea during the early luteal phase
1. However, the aspiration of a preovulatory oocyte in a natural cycle neither diminished the
directly inhibit the LH release via negative feedback
luteal phase steroid secretion nor shortened the luteal phase (Kerin et al., 1981).
actions at the hypothalamic-pituary axis level (Fauser and
2. Prolonged pituitary recovery following the GnRH-a co-treatment may
Devroey, 2003).
result in lack of support of the CL (Smitz et al., 1992).
3. hCG for the final oocyte maturation in stimulated IVF cycles could
potentially suppress the LH production via a short-loop feedback
mechanism (Miyake et al., 1979).
1. However, the administration of hCG did not down-regulate the LH secretion in the luteal
phase of normal, unstimulated cycles in normo-ovulatory women (Tavaniotou and
Devroey, 2003).
LPD
1. Studies in human and primates have demonstrated that the CL requires a
consistent LH stimulus in order to perform its physiological function (Jones,
1991).
2. LH support during the luteal phase is entirely responsible for the maintenance
and the normal steroidogenic activity of the CL (Casper and Yen, 1979).
3. However, withdrawal of LH, unnecessary causes premature luteolysis (Duffy
et al., 1999).
Pinopodes expression correlates with P levels
GnRH antagonists:
• Preliminary studies (IUI cycles) no deleterious effects on
luteal P levels and LP duration (Ragni et al., 2001)
• Subsequent studies in IVF:
– Premature luteolysis (Albano et al., 1998; Beckers et al.,
2003).
– Reduced chances for pregnancy:
• in non-supplemented LP of patients stimulated with rFSH + GnRH
antagonist (antide; 1 mg/day) the overall pregnancy rates (PR) was very
poor (7.5%) and the study stopped (Beckers et al., 2003).
• Despite the rapid recovery of the pituitary function in GnRH-ant.
protocols (Dal Prato and Borini, 2005), LPS remains mandatory
(Tarlatzis et al., 2006).
Temporal and morphologic characteristics of
pinopod expression across the secretory phase of
the endometrial cycle in normally cycling women
with proven fertility
Usadi RS et al., Fertil Steril 2003
LD 2
LD 5
LD 8
LD 10
LD 11
LD 14
Uterine contractility and IVF
Effects of P
Uterine contraction (min)
UC in menstrual cycle and IVF
3D derived method
Fast play
5
UC/min
5.5
4.5
4
7
5
3.5
3
3
*
1
2.5
2
15
16
17
18
19
LH/hCG
20
LH+2/Retrieval
Cycle day
Ayoubi et al. Fertil Steril Oct 2001
<3 3-4 4-5
LH+4/ET
LH+6/ET+2
Ayoubi et al. Fertil Steril 2003
In IVF, starting of
Crinone 8% on the day
of retrieval decreases
UC frequency on the day
of ET (Fanchin et al.)
>5
Ayoubi J-M et al. Ferti Steril 2001;76:736-40.
. uteal phase support in infertility treatment: a meta-analysis
L
of the randomized trials.
Rationale for LPS with progesterone
Meta-analyses
E.A. Pritts and A.K. Atwood. Human Reprod 2002;17:2287-99.
P4 vs. no treatment
S Daya and J Gunby
The Cochrane Database of Systematic Reviews 2004 Issue 4
Copyright © 2004 The Cochrane Collaboration. Published by John Wiley & Sons, Ltd.
DOI: 10.1002/14651858.CD004830 This version first published online: 19 July 2004 in Issue 3, 2004
Nosarka S et al.
Luteal phase support in in vitro fertilization: meta-analysis of randomized trials.
Gynecol Obstet Invest. 2005;60:67-74.
Questions
Outcome
measure
Author
P4 (vaginal) vs. no TT
CPR
P4 (vaginal) vs. no TT
P4 (vaginal) vs. no
treatment
P4 (vaginal) vs. no TT
hCG vs. no TT
DR
OPR
hCG vs. no TT
OPR
hCG vs. no TT
SAB
P4 (i.m.) versus placebo/no
TT
P4 (i.m.) versus placebo/no
TT
P4 (i.m.) vs. placebo/no TT
P4 (i.m.) vs. placebo/no TT
CPR
Artini et al ., 1995; Abate
et al ., 1999b
Abate et al ., 1999b
Artini et al ., 1995; Abate
et al ., 1999b
Artini et al ., 1995
Smith et al ., 1989;
Herman et al ., 1990;
Artini et al ., 1995;
Beckers et al ., 2000
Herman et al ., 1990;
Artini et al ., 1995;
Beckers et al ., 2000
Herman et al ., 1990;
Artini et al ., 1995
Artini et al ., 1995; Abate
et al ., 1999a,b
Artini et al ., 1995; Abate
et al ., 1999b
Abate et al ., 1999b
Artini et al ., 1995
SAB
CPR
Department of Obstetrics and Gynaecology, Stellenbosch Univ., Tygerberg, SA.
Reviewers' conclusions
• Luteal phase support with hCG or progesterone after assisted
reproduction results in an increased pregnancy rate.
• hCG does not provide better results than progesterone and is
associated with greater risks of OHSS when used with GnRHa.
• The optimal route of progesterone administration has not
been established yet.
OPR
DR
SAB
No. of No. of RR
studies patients
95% CI
Meta- Power #2 Power #1
analysis
2
192
2.1
0.95–4.67
yes
0.88
0.35
1
2
104
192
2 0.33–15.52
1.7 0.77–6.02
no
yes
0.61
0.88
0.24
0.35
1
4
11
262
1.1 0.10–31.09
2.7 1.56–4.90*
no
yes
0.1
0.96
0.07
0.46
3
147
2.4
yes
0.77
0.28
1.4 0.15–34.57
yes
0.17
0.08
1.36–4.27*
yes
0.97
0.48
0.93–6.7
2
22
3
278
2.4
2
192
3.8 1.42–11.38*
yes
0.88
0.35
1
1
104
10
5.5 1.25–35.53*
1.3 0.12–36.19
no
no
0.61
0.1
0.21
0.07
S Daya and J Gunby
The Cochrane Database of Systematic Reviews 2004 Issue 4
IR
Copyright © 2004 The Cochrane Collaboration. Published by John Wiley & Sons, Ltd.
DOI: 10.1002/14651858.CD004830 This version first published online: 19 July 2004 in Issue 3, 2004
Vag P
IM P
Crinone 8%
Progesterone vaginal vs. IM administration
Clinical pregnancy per embryo (gamete) transfer – with GnRHa
Alan Penzias, Boston IVF
1‟675 IVF cases, in relation to
the type of P4 preparation
used for luteal support
Penzias AS.
Luteal phase support.
Fertil Steril. 2002;77:318-23.
Penzias AS, Alper MM.
Luteal support with vaginal micronized
progesterone gel in assisted reproduction.
Reprod Biomed Online. 2003;6:287-95.
NON Crinone
PR
Crinone 8%
NS
S Daya and J Gunby
Vaginal natural micronized progesterone
The Cochrane Database of Systematic Reviews 2004 Issue 4
Copyright © 2004 The Cochrane Collaboration. Published by John Wiley & Sons, Ltd.
DOI: 10.1002/14651858.CD004830 This version first published online: 19 July 2004 in Issue 3, 2004
• First choice LPS regimen, mainly due to patient comfort and
effectiveness (Levin et al., 2001).
• At least as effective as IM progesterone at providing LPS in
induced cycles (Simunic et al., 2007).
• In Europe, two different forms:
– Capsules 100-200 mg (Utrogestan, Prometrium, Progeffik)
– Crinone 8%, controlled sustained-release vaginal gel, 90 mg.
– Ring in U.S.
• Dosage:
Progesterone vaginal gel vs. other vaginal administration
Clinical pregnancy per embryo (gamete) transfer – with GnRHa
– Capsules: 200 mg 2-3 times a day (400-600 mg/day)
– Crinone 8% once a day (Ludwig et al., 2002; Simunic et al., 2007)
NS
• At the moment no dose finding studies performed
• Further PRT essential to define the dose for LPS in IVF.
Crinone vs Vaginal capsules
• RCT (n = 126) (Ludwig et al., 2002):
Clinical PR
28.8 vs 18.9%
Clinical abortion rates
14.3 vs 10.0%
Ongoing PR
24.7 vs 17.0%
•
•
NS
NS
NS
•
• Side-effects:
Crinone 8% gel
38/125
Utrogestan vaginal capsules 68/132
Compliance with capsules better than with gel (P <
0.05) (Simunic et al., 2007; Ludwig et al., 2002).
When to start LPS
Timing of LPS remains the subject of debate. Current clinical practice involves
beginning LPS on different days.
No difference on ongoing PR when LPS started on:
– the day of hCG administration
– the day of OR
– the day of embryo transfer (occurring on day 3) (Baruffi et al., 2003)
and administered until 18 days following OR (20.8%, 22.7 and 23.6%) (Mochtar et
al., 2006)
Delaying LPS until 6 days after OR decreases PR of 24% vs. 3 days after OR
(Williams et al., 2001).
Fanchin R et al. Uterine contractility decreases at the time of blastocyst transfers. Hum
Reprod. 2001;16:1115-9.
UC frequency decreases at the time of blastocyst transfers (day 5).
Fanchin R, Righini C, de Ziegler D et al. Effects of vaginal progesterone administration
on uterine contractility at the time of embryo transfer. Fertil Steril. 2001;75:1136-40. .
Early P4 supplementation decreases UC frequency at the time of ET.
Mochtar MH, Van Wely M, Van der Veen F. Timing luteal phase support in GnRH
agonist down-regulated IVF/embryo transfer cycles. Hum Reprod. 2006;21:905-8.
No apparent differences between day hCG, retrieval and ET.
Progesterone supplementation during early gestation after
in vitro fertilization has no effect on the delivery rate.
Progesterone supplementation during early gestation after
in vitro fertilization has no effect on the delivery rate.
Schmidt KL et al. Fertil Steril 2001;75:337-41
Schmidt KL et al. Fertil Steril 2001;75:337-41
Objective: To compare the delivery rate with IVF or ICSI in women
who did and did not receive progesterone supplementation in the
first 3 weeks after a positive hCG test result.
Design: Retrospective study.
Result(s): The number of deliveries was 126 in the study group and
128 in the control group.
Method: Patient(s): 200 pregnant women who did not receive
progesterone (intervention group) and 200 pregnant women who
received progesterone for 3 weeks after a positive hCG result.
P4
Vaginal P4
600 mg/day
Vaginal P4
600 mg/day
Conclusion(s): The delivery rate was the same in pregnant women
who received and those who did not receive P4 for 3 weeks after a
positive hCG result. P4 supplementation for more than 2 weeks after
embryo transfer may therefore yield no benefit in terms of pregnancy.
P4
n=200
n=200
Controls
Controls
n=200
Pregnancy
test
3 weeks
n=200
Vaginal P4
600 mg/day
Vaginal P4
600 mg/day
126/200
128/200
Pregnancy
test
3 weeks No difference
Progesterone supplementation during early gestation after
in vitro fertilization has no effect on the delivery rate.
Progesterone e aborto
Schmidt KL et al. Fertil Steril 2001;75:337-41
Result(s): The number of deliveries was 126 in the study group and
128 in the control group.
• Prevenzione dell‟aborto
Conclusion(s): The delivery rate was the same in pregnant women
who received and those who did not receive P4 for 3 weeks after a
positive hCG result. P4 supplementation for more than 2 weeks after
embryo transfer may therefore yield no benefit in terms of pregnancy.
Vaginal P4
600 mg/day
P4
n=200
Controls
n=200
Vaginal P4
600 mg/day
• Trattamento della minaccia di aborto
126/200
No rationale for continuing luteal support
128/200
beyond the pregnancy test
Pregnancy
weeks
But
like us, most3do!
test
No difference
Progestogen for preventing miscarriage
Progestogen versus placebo/no treatment
Outcome: Prevention of miscarriage (all trials)
Oates-Whitehead et al., Cochrane 2007
Oates-Whitehead et al., Cochrane 2007
Background
• Progesterone is known to induce secretory changes in
the lining of the uterus essential for successful
implantation of a fertilized egg.
• A causative factor in many cases of miscarriage may
be inadequate secretion of progestogens.
• Therefore, progestational agents have been used,
beginning in the first trimester of pregnancy, in an
attempt to prevent spontaneous miscarriage.
Progestogen versus placebo/no treatment,
Progesterone and threatened miscarriage
Prevention of miscarriage (women with previous recurrent miscarriage only)
Oates-Whitehead et al., Cochrane 2007
Oates-Whitehead et al., Cochrane 2007
•
•
•
•
Conclusioni:
• Nessuna evidenza che la somministrazione di routine del P riduca il rischio di abortività
nel primo e nel secondo trimestre.
• P indicato nelle donne con poliabortività con un trend di aumento del tasso di natalità
senza evidenza di aumento del rischio di effetti indesiderati.
• Nessuna differenza significativa tra le diverse vie di somministrazione del progesterone
(orale, IM, vaginale).
Progesterone is prescribed in 13-40% of women with threatened miscarriage
Giving progestogen is expected to support a potentially deficient corpus
luteum gravidarum and induce relaxation of a cramping uterus.
The evidence is of low quality.
3 studies having miscarriage as outcome, overall RR 1.10 (95% confidence
interval 0.92 to 1.31) for progestogens group (al-Sebai et al., 1996; Reljic
2001; Bennett et al., 1996). In the only studies that provided sonographic
evidence of fetal heart activity at presentation, the relative risk for
miscarriage was 1.09 (90% confidence interval 0.90 to 1.33) for the
progestogen group (Pedersen & Mantoni 1990).
• Progesterone does not seem to improve outcome in
women with threatened miscarriage. However, local
application of a progestogen was found to subjectively
decrease uterine cramping more rapidly than bed rest
alone in one small study.
P4 and miscarriages
P4 and miscarriages
Oates-Whitehead RM, Haas DM, Carrier JA. Progestogen for preventing miscarriage.
Cochrane Database Syst Rev. 2003;(4):CD003511.
Effects of Crinone on cramps
P4 supplementation is effective in repeated aborters (>3).
Palagiano A, Bulletti C, Pace MC, de Ziegler D, Cicinelli E, Izzo A. Effects of
vaginal progesterone on pain and uterine contractility in patients with threatened abortion
before twelve weeks of pregnancy. Ann N Y Acad Sci. 2004;1034:200-10.
Cramps
2
P4 offers symptomatic relief in threatened abortion ( cramps/bleeding).
1.5
1
Kalinka J, Szekeres-Bartho J. The impact of dydrogesterone supplementation on
hormonal profile and progesterone-induced blocking factor concentrations in women
with threatened abortion. Am J Reprod Immunol. 2005;53:166-71.
DHP (oral progestin) P4 induced blocking factor (PIBF) in threatened AB
Crinone
0.5
Controls
0
1
2
3
4
Raghupathy R, Al Mutawa E, Makhseed M, Azizieh F, Szekeres-Bartho J.
Modulation of cytokine production by dydrogesterone in lymphocytes from women with
recurrent miscarriage. BJOG. 2005;112:1096-101.
In women w/ recurrent miscariages, DHP (oral progestin) induces a Th1 (IFNg,
TNFa) to Th2 (IL4, IL6) cytokines shift.
5
days
Bulletti and de Ziegler, 2001
Progesterone and preterm birth
Progesterone and preterm birth
• Profilactic use
• Preterm birth is the major complication of
pregnancy associated with perinatal mortality
and morbidity and occurs in up to 6% to 10%
of all births.
• Therapeutic use
P therapy modulates response to inflammation
Am J Obstet Gynecol. 2005 Sep;193(3 Pt 2):1149-55.
Can medroxyprogesterone acetate alter Toll-like receptor expression in a mouse model of intrauterine inflammation?
Elovitz MA, Mrinalini C.
Department of Obstetrics and Gynecology, Center for Research in Reproduction and Women's Health, University of Pennsylvania, Philadelphia, PA,
USA. [email protected]
Prostaglandin H2 synthase
+
+
Cortisol
+
Gram +
Gram -
Innate immune receptors
Toll-like recept. 4
+
+
Labor
+
Inflammation response
Toll-like recept. 2
Prostaglandins
15OH Prostanglandin Deydrogenase
Progesterone
+
Parturition
Intrauterine inflammation
MAP
•
Medroxyprogesterone acetate suppresses lipopolysaccharide-induced up-regulation
of Toll-like receptor 2 messenger RNA. This may be one of the mechanisms by
which progestins are able to decrease preterm birth.
Dodd JM, Flenady V, Cincotta R, Crowther CA. Prenatal administration of progesterone for preventing
preterm birth. Cochrane Database of Systematic Reviews 2006, Issue 1. Art. No.: CD004947. DOI:
10.1002/14651858.CD004947.pub2.
P4 in pregnancy
Da Fonseca E et al.
Am J Obstet Gynecol 2003;188:419-24.
OBJECTIVE: The purpose of this study was to evaluate the effect
of prophylactic vaginal progesterone in decreasing preterm birth
rate in a high-risk population.
Methods
Sample size:
Preterm birth rate of 25% with anticipated 50% decrease in
treatment group to 12.5%. 48 patients/group necessary for study
power of 90% at a significance level of 0.05 (2 tail).
Population:
157 asymptomatic high risk patients w/ past Hx of PTL or
uterine malformation.
Controls
Progesterone
placebo vaginally
100 mg/d vaginally
70
72
Progesterone administration in women who previously delivered prematurely
reduces the risk of recurrent premature delivery.
Dodd JM, Flenady V, Cincotta R, Crowther CA. Prenatal administration of progesterone for preventing preterm birth. Cochrane
Database of Systematic Reviews 2006, Issue 1. Art. No.: CD004947. DOI: 10.1002/14651858.CD004947.pub2.
Dodd JM, Flenady V, Cincotta R, Crowther CA. Prenatal administration of progesterone for preventing preterm birth. Cochrane
Database of Systematic Reviews 2006, Issue 1. Art. No.: CD004947. DOI: 10.1002/14651858.CD004947.pub2.
Progesterone versus placebo subgrouped by route of administration
(intramuscular versus vaginal), Outcome: Preterm birth less than 37 weeks
Progesterone versus placebo subgrouped by route of administration
(intramuscular versus vaginal), Outcome: Preterm birth less than 37 weeks
Dodd JM, Flenady V, Cincotta R, Crowther CA. Prenatal administration of progesterone for preventing preterm birth. Cochrane
Database of Systematic Reviews 2006, Issue 1. Art. No.: CD004947. DOI: 10.1002/14651858.CD004947.pub2.
N Engl J Med. 2007 Aug 2;357(5):462-9.
Progesterone versus placebo subgrouped by cumulative weekly dose (>= 500 mg
versus < 500 mg), Outcome: Threatened preterm labour
Fonseca EB, Celik E, Parra M, Singh M, Nicolaides KH; Fetal Medicine Foundation Second Trimester Screening Group.
Harris Birthright Research Centre for Fetal Medicine, King's College Hospital, London, United Kingdom.
Progesterone and the risk of preterm birth among women with a short cervix.
•
•
BACKGROUND: P reduces the risk of recurrent premature delivery.
Asymptomatic women found at midgestation to have a short cervix are at
greatly increased risk for spontaneous early preterm delivery
METHODS:
– Cervical length measured by TVE at a median of 22 weeks of gestation in
24,620 pregnant women seen for routine prenatal care.
– Cervical length was 15 mm or less in 413 (1.7%), and 250 (60.5%) of these
were randomly assigned to receive:
– vaginal P (200 mg each night) or placebo from 24 to 34 weeks of gestation.
•
The primary outcome was spontaneous delivery before 34 weeks.
RESULTS:
– Spontaneous delivery < 34 weeks: 19.2% in P group vs. 34.4% in placebo
group; relative risk, 0.56; 95% confidence interval [CI], 0.36 to 0.86).
– P was associated with a nonsignificant reduction in neonatal morbidity (8.1%
vs. 13.8%; relative risk, 0.59; 95% CI, 0.26 to 1.25; P=0.17).
– There were no serious adverse events associated with the use of progesterone.
Meis et al. National Institute of Child Health and Human Development Maternal-Fetal Medicine UNits Network:
N Engl J Med 2003: 17 alpha hydroxyprogesterone caproate 250 mg/weekly
• CONCLUSIONS: In women with a short cervix,
treatment with P reduces the rate of spontaneous
early preterm delivery.
N Engl J Med. 2007 Aug 2;357(5):454-61.
Progesterone/progestinici: indicazioni
Ginecologia
A trial of 17 alpha-hydroxyprogesterone caproate to prevent prematurity in twins.
Rouse DJ, Caritis SN, Peaceman AM, Sciscione A, Thom EA, Spong CY, Varner M, Malone F, Iams JD, Mercer BM, Thorp J,
Sorokin Y, Carpenter M, Lo J, Ramin S, Harper M, Anderson G; National Institute of Child Health and Human Development
Maternal-Fetal Medicine Units Network.
• BACKGROUND: In singleton gestations, 17 alpha-hydroxyprogesterone caproate (17P) has been shown to reduce the rate
of recurrent preterm birth. This study was undertaken to evaluate
whether 17P would reduce the rate of preterm birth in twin
gestations.
• RESULTS:
– data from 655 were analyzed (325 in the 17P group and 330 in the
placebo group).
– Delivery or fetal death before 35 weeks occurred in 41.5% of pregnancies
in the 17P group and 37.3% of those in the placebo group (relative risk,
1.1; 95% confidence interval [CI], 0.9 to 1.3).
• CONCLUSIONS: Treatment with 17 alpha-hydroxyprogesterone caproate did not reduce the rate of preterm birth in
women with twin gestations.
•
•
•
•
•
•
•
•
controllo del ciclo mestruale
dismenorrea
trattamento della menorragie
contraccezione
terapia dell‟endometriosi
della patologia iperplastica dell‟endometrio
terapia ormonale sostitutiva
prevenzione danni neurologici
Progesterone/progestogen releasing intrauterine systems versus either
placebo or any other medication for HMB
Lethaby AE, Cooke I, Rees M. The Cochrane Library, 2005.
Data: 5 randomised controlled trials vs TCRE (2) / ABL (3), 1 vs P
Main results:
P- and LNG-IUS have not been compared to placebo or no treatment
LNG-IUS was significantly more effective than oral continuous
norethisterone (NET) (on days 5-26), altough both treatments were
effective from baseline and differences were not perceived by patients.
Some short term side effects (intermenstrual bleeding and breast
tenderness) were more common in the LNG IUS group but a
significantly greater proportion of women in this group were satisfied
and willing to continue with their treatment
Smaller reduction in MBL compared with TCRE/A but no difference in
satisfaction. More P side effects with LNG-IUS
BIOLOGICAL RATIONALE
• Once implanted, ectopic endometrium generates an
inflammatory condition
• Progestogens have anti-inflammatory properties
peritoneal fluid volume
peritoneal fluid leukocytes #
chemokine synthesis
chemoattraction towards peritoneal monocytes
and activated T cells
The Role of a Progestin
A progestin is used to block
- Ovulation
- Estrogen associated endometrial hyperplasia
• Ideal profile for a progestin:
1. Block ovulation
2. Blocks estrogenic activity in the uterus at a low dose
3. Does not block estrogenic activity in bone, CNS &
cardiovascular system
4. Lacks other steroid hormone effects
5. Low breast cancer risk
6. Additional advantages
Invasive Breast Cancer
Women Health Initiative, JAMA 2002
0,03
Cumulative Hazard
The Million Women Study
Placebo
HRT
0,02
0,01
HR 1.26
95% CI 1.00 1.59
0
0
1
2
3
4
5
6
7
Time, y
The WHI-E only study actually notes a 23% reduction in
breast cancer compared with the placebo.
(Lancet, 2003)
Multicenter population-based case-control
study (5298 casi)
Massachusetts, New Hampshire, Wisconsin
Rischio relativo (RR) di carcinoma della mammella con
l‟uso dei soli estrogeni (E) e di estrogeni+progestinici
2
Rischio relativo di cr mammario con > 5 aa. di
terapia
1,5
E
E/P
2.09
1,39
RR
1,57
1
0,5
Estrogeno+progestinico
Progestinico
N
Estrogeno
ew
co
m
b,
St
19
an
95
fo
rd
,
19
C
ol
95
di
tz
,1
Pe
99
rs
8
so
n,
19
99
R
os
Sc s, 2
00
ha
0
ir
er
,2
00
W
0
H
I,
2
W
00
ei
2
ss
,2
M
00
ill
2
io
n,
20
03
L
i,
20
03
0
(Newcomb et al., Cancer Epidemiol Biomark Prev, 2002)
An overview of menopausal oestrogen-progestin hormone therapy
and breast cancer risk.
Lee SA, Ross RK, Pike MC. Br J Cancer. 2005 Jun 6;92(11):2049-58.
•
•
•
•
Meta-analysis using EPT-specific results from the Collaborative
Group on Hormonal Factors in Breast Cancer (CGHFBC)
pooled analysis and studies published since that report to obtain
an overview of EPT use and breast cancer risk.
The overall, EPT results in a 7.6% increase in breast cancer risk
per year of use. The risk was statistically significantly lower in
US studies than in European studies - 5.2 vs 7.9%.
There was a significantly higher risk for continuous-combined
than for sequential EPT use in Scandinavian studies where
much higher total doses of progestin were used in continuouscombined than in sequential EPT.
No overall difference in risk for lobular vs ductal carcinoma but
did observe a slightly higher risk for current vs past EPT use.
Breast cancer risk in relation to different types of hormone replacement therapy in the E3N-EPIC cohort.
Fournier et al., Int J Cancer. 2005 Apr 10;114(3):448-54.
Studio E3N
• Studio prospettico di coorte su 54584 donne francesi
in menopausa
• Giugno 1990-2000
• Durata media della terapia: 5.8 anni
• Età media all’arruolamento: 52.8 anni
• RR cr. mammella E + prog. di sintesi (diidrogesterone, MAP, nomegestrolo ac.): 1.4
• 6000 donne trattate con E2 transdermico e
progesterone 2 cps/die in regime sequenziale (12-14
gg): 0.9
• Se la terapia assunta per < 4 anni l’RR si ferma a 0.7
J Neurotrauma. 2000 May;17(5):367-88.
Gender differences in acute CNS trauma and stroke: neuroprotective
effects of estrogen and progesterone.
Roof RL, Hall ED.
– Sex differences in the pathophysiology of and outcome
after acute neurological injury.
– Lesser susceptibility to postischemic and post-traumatic
brain injury in females in experimental models.
– Sex difference extends to humans as well.
– The greater neuroprotection in females likely due to the
effects of circulating estrogens and progestins.
– Exogenous administration of both hormones improves
outcome after cerebral ischemia and traumatic brain
injury in experimental models.
– The neuroprotection provided by periinjury
administration of E and P extends to males as well.
Progesterone and Brain Injuries
Progesterone and Brain Injuries
• Administration of relatively large doses of
progesterone during the first few hours to days
after injury significantly limits central nervous
system damage, reduces loss of neural tissue,
and improves functional recovery.
• Effects on blunt traumatic brain injury.
• Possible protection from several forms of acute
central nervous system injury, including
penetrating brain trauma, stroke, anoxic brain
injury, and spinal cord injury.
Stein et al., Ann Emerg Med. 2007 Jun 21
P and multiple sclerosis
• In mice PROG produced a moderate delay of
disease onset and reduced the clinical scores.
• Progesterone appears to exert its protective
effects by protecting or rebuilding the
blood-brain barrier, decreasing development
of cerebral edema, down-regulating the
inflammatory cascade, and limiting cellular
necrosis and apoptosis. All are plausible
mechanisms of neuroprotection
Stein et al., Ann Emerg Med. 2007 Jun 21
P for Intracranial meningiomas in lymphangioleiomyomatosis.
•
Lymphangioleiomyomatosis is a progressive
interstitial lung disease that affects young
women.
•
It has been suggested that estrogens play a role in
its evolution, and progesterone therapy is often
provided in these cases.
•
Possible association with meningiomas
Pozzati et al., Surg Neurol. 2007 Jun 20
• PROG attenuated disease severity, and reduced
the inflammatory response and the occurrence
of demyelination in the spinal cord during the
acute phase of EAE.
Garaj et al., J Steroid Biochem Mol Biol. 2007 Jun 22.
Conclusioni 1
1. LPS (con P) è necessario dopo COH
2. Vaginal P4 is equivalent to IM P
3. P indicato nelle donne con poliabortività
con un trend di aumento del tasso di
natalità senza evidenza di aumento del
rischio di effetti indesiderati.
4. P riduce il rischio di ricorrenza di parto
pretermine
5. La scelta del progestinico e della via di
somministrazione deve basarsi sul fine
terapeutico
Conclusioni
6. Nessun progestinico sintetico riproduce
perfettamente le azioni del progesterone naturale.
7. Parte degli effetti indesiderati (rischio CV, cr.
mammella) della HRT sono molecola dipendente e
non classe dipendente
8. I progestinici di ultima generazione sono sempre
più simili al P
9. La somministrazione vaginale offre alcuni
vantaggi:
– Efficacia e selettività di azione sull’utero
– Bassa esposizione sistemica
– Impiego di P
– (< impatto sull’apparato cardiovascolare, <
rischio di cr. della mammella)
– Permette di somministrare gli ormoni naturali
Terapia contraccettiva e peri-menopausa
Villa P1, Suriano R1, Costantini B1, Macri F1, Ricciardi L1, Lanzone A1-2
1
Istituto di Clinica Ostetrica e Ginecologica , Policlinico Universitario A. Gemelli Università
Cattolica del Sacro Cuore (Roma)
2
OASI Istituto di Ricerca Troina (EN)
La perimenopausa rappresenta una fase di transizione nella vita della donna comprendendo gli anni
che precedono la menopausa, e interessando quindi donne relativamente giovani di età compresa
tra 40 e 50 anni. Attualmente è stato dimostrato che tale fase di transizione sia caratterizzata da
ampie ed irregolari fluttuazioni ormonali, a cui si correla una sintomatologia altrettanto irregolare
ed intermittente. La progressiva deplezione del patrimonio follicolare ovarico legata
all‟invecchiamento comporta un calo estrogenico e conseguentemente un
aumento della
produzione di gonadotropine a causa del ridotto feed-back inibitorio a livello ipotalamo-ipofisario.
Il progressivo declino della funzione ovarica determina l‟insorgenza di disturbi legati al deficit
estrogenico e/o progestinico, quali irregolarità mestruali, sintomi vasomotori, deficit di
concentrazione, alterazioni del ritmo sonno-veglia, secchezza vaginale, riduzione del tono
dell‟umore, incremento ponderale, riduzione della libido.
Pertanto, molte donne si rivolgono al curante o al ginecologo di fiducia in questa fase della vita a
causa di una o più di queste manifestazioni, che necessitano di un inquadramento clinico e di un
management appropriato. Inoltre, essendo questo periodo di transizione ancora potenzialmente
fertile, risulta particolarmente importante attuare delle strategie terapeutiche appropriate per la
contraccezione nelle donne in perimenopausa.
L‟utilizzo degli estroprogestinici nelle donne di età pari o superiore ai 40 anni non rappresenta di
per sé una controindicazione assoluta pur tenendo conto che l‟età costituisce un noto, importante
fattore di rischio cardiovascolare, in grado di amplificare altri accertati fattori di rischio quali il
fumo di sigaretta, il diabete mellito, l‟ipertensione arteriosa, l‟obesità, una storia familiare di
trombosi venosa, le dislipidemie. Pertanto è necessario nella singola paziente in età premenopausale
elaborare un‟attenta valutazione del profilo di rischio cardiovascolare prima d‟intraprendere una
contraccezione estroprogestinica.
Un altro aspetto di particolare interesse è rappresentato dai rapporti tra l‟uso della pillola ed il
rischio di cancro della mammella. Gli studi a tal proposito hanno dato pareri discordanti sugli effetti
dei CO sulla mammella. Di fatti, da una meta-analisi (Lancet 1996) è stato riscontrato che l‟uso di
contraccettivi orali aumenta lievemente il rischio di carcinoma della mammella. Il rischio viene
mantenuto fino a 10 anni dalla sospensione della terapia.
Di contro, da un recente studio è stato rilevato che potrebbe non sussiste alcun incremento del
rischio neoplastico in donne utilizzatrici di estro-progestinici, sia attuali o pregresse.
Tuttavia, dato il riscontro epidemiologico di una maggiore incidenza del carcinoma mammario nelle
donne oltre i 40-45 anni di età, la donna in peri-menopausa, deve essere sottoposta,
preventivamente e periodicamente, ad attenta valutazione clinico-strumentale, al pari della
sorveglianza cui viene sottoposta una donna in post-menopausa che faccia uso di terapia ormonale
sostitutiva. Importante è anche la valutazione dell‟effetto che i CO possono avere sull‟ovaio. Si è
potuto riscontare, da diversi studi, che molto probabilmente gli estroprogestinici hanno un effetto
protettivo sull‟ovaio.
A causa delle importanti fluttuazioni ormonali cui è soggetta una donna in perimenopausa, risulta
utile considerare gli effetti dei contraccettivi orali sulla densità ossea. La maggior parte degli studi
condotti in donne normoestrogenizzate, ha dimostrato un effetto sostanzialmente neutro sul
metabolismo e sulla densità minerale ossea. Al contrario, nelle donne ipoestrogenizzate, la
somministrazione di estroprogestinici a basso dosaggio (20 mcg etinil-estradiolo) ha effetti positivi
sulla BMD (densità minerale ossea). L‟utilizzo dei contraccettivi ormonali, sembra essere in grado
di prevenire l‟aumentato turnover dell‟osso, che invece si osserva in perimenopausa nelle donne con
oligomenorrea, proteggendo dal rischio di fratture di femore e colonna.
In considerazione di tutti questi fattori,in donne di età superiore a 35 anni l‟uso dei contraccettivi a
basso dosaggio (< 20 mcg di EE) è da preferire in assenza di controindicazioni assolute all‟uso di
estro-progestinici. Al contrario nelle donne di pari età che presentino altri fattori di rischio
cardiovascolare è possibile suggerire l‟utilizzo del solo progestinico, pur tenendo conto che questo
trattamento non allevierebbe l‟iniziale sintomatologia climaterica.
Nei casi in cui si ritenga necessario un trattamento contraccettivo con estroprogestinici in donne
senza fattori di rischio, vi è la disponibilità di composti contenenti estradiolo, estradiolo emiidrato, e
estradiolo-valerato per somministrazione sia orale che transdermica. La posologia prevede
l‟assunzione di estrogeni in schema sequenziale per 21 giorni associati ad un progestinico negli
ultimi 12 giorni di assunzione degli estrogeni, seguiti da 7 giorni di sospensione (somministrazione
ciclica). Nell‟ambito della componente progestinica esistono differenze per quanto riguarda
l‟attività biologica e la relativa potenza dei vari composti. In particolare ogni preparato presenta
diversi effetti estrogenici, antiestrogenici, androgenici, antiandrogenici ed aldosterone antagonisti. I
progestinici sono disponibili in diverse formulazioni e vie di somministrazione (orale, vaginale,
intramuscolare ed intrauterina) permettendo una terapia individualizzata. In donne che presentano
sanguinamento determinato da cicli anovulatori, la terapia progestinica ciclica regolarizza la
mestruazione e previene la perdita ematica prolungata ed eccessiva, associata con sanguinamenti da
privazione estrogenica.
La perimenopausa rappresenta per la donna un momento di profondi cambiamenti di tipo
psicologico, sociale, clinico. E‟ importante in questa fase inquadrare la paziente, cercare di alleviare
la sintomatologia se presente e, soprattutto, introdurre strategie mirate alla prevenzione delle
patologie degenerative più comuni ed al raggiungimento di uno stile di vita salutare.
La Sindrome dell’Ovaio Micropolicistico
V. De Leo, M.C. Musacchio, G. Morgante, F. Petraglia
Clinica Ostetrica e Ginecologica
Università degli Studi di Siena
La Sindrome dell‟Ovaio Micropolicistico (PCOS) è una complessa patologia endocrina che colpisce
il 5-10% delle donne in età fertile (1). Si manifesta clinicamente con oligo/amenorrea, cicli
anovulatori, irsutismo, acne, ovaie micropolicistiche e, in una significativa percentuale di casi,
insulino-resistenza (2).
Numerosi studi condotti su famiglie di donne con PCOS indicano che nella sua patogenesi sono
coinvolti fattori genetici. Tali fattori contribuirebbero a determinare le alterazioni endocrine e
metaboliche che caratterizzano questa sindrome. Per tali motivi la PCOS viene propriamente definita
una patologia multifattoriale, determinata dall‟associazione di molteplici fattori: genetici, endocrini e
ambientali (3).
Evidenze sempre più numerose, inoltre, segnalano che la PCOS si presenta come una patologia che
“coinvolge tutta la vita” della donna, che inizia nella vita intrauterina in soggetti geneticamente
predisposti, si manifesta clinicamente al momento della pubertà, perdura nell‟età fertile, ed espone,
soprattutto dopo la menopausa, ad un rischio più elevato di sviluppare patologie cardiovascolari,
ipertensione, diabete e altre complicanze metaboliche (4-6). Inoltre, durante l‟età fertile può
determinare infertilità anovulatoria oppure una maggiore incidenza di complicanze gestazionali quali
aborti spontanei, diabete gestazionale e preeclampsia (1).
Per tali motivi risulta evidente che la diagnosi precoce di tale sindrome è fondamentale, in quanto
permette di poter effettuare i trattamenti e i controlli più idonei riducendo così il rischio di sviluppare
tutte le complicanze ad essa correlate.
La patogenesi della PCOS è il risultato di alterazioni a carico di più sistemi come quello endocrino
e metabolico. Il profilo endocrino delle donne con PCOS è caratterizzato da alti livelli di androgeni
di origine ovarica e surrenalica, alterato rapporto LH/FSH, ridotti livelli di SHBG e nel 30% delle
donne anche moderata iperprolattinemia.
E‟ un dato ormai consolidato che l‟insulino-resitenza, presente soprattutto nelle donne obese o in
soprappeso, ma spesso anche in quelle magre con PCOS, sembra rappresentare la “chiave” di questa
complessa patologia (4). L‟insulino-resistenza è definita come una condizione patologica in cui una
cellula, un tessuto o un organismo hanno bisogno di una quantità di insulina superiore alla norma per
ottenere una risposta pressochè normale. Essa determina una maggiore secrezione di insulina da parte
delle cellule pancreatiche e una iperinsulinemia compensatoria, mentre i livelli di glucosio restano
normali. Quando la risposta delle cellule pancreatiche si riduce, si svilupperà un‟intolleranza al
glucosio o il diabete di tipo II (4). I meccanismi attraverso cui si realizza l‟insulino-resistenza
consistono in un difetto del legame dell‟insulina al suo recettore oppure in alterazioni della
trasmissione del segnale (4). Le ovaie di questi soggetti, tuttavia, conservano una risposta pressochè
normale all‟insulina. Una spiegazione parziale di questo fenomeno potrebbe essere fornita
dall‟azione dell‟insulina sull‟ovaio attraverso il recettore per l‟IGF-1, al quale si lega quando
raggiunge concentrazioni elevate come succede nell‟iperinsulinemia compensatoria. Inoltre, l‟azione
dell‟insulina a livello ovarico utilizza come mediatore del segnale il sistema dell‟inositologlicano,
che è diverso dal sistema attivato negli altri tessuti della fosforilazione del recettore a livello della
tirosina e che mantiene la sua funzione a livello ovarico anche nei soggetti insulino-resistenti (7).
L‟iperinsulinemia, a sua volta, stimola direttamente la steroidogenesi ovarica agendo sulle cellule
della teca e su quelle della granulosa, stimola la proliferazione delle cellule della teca, aumenta la
secrezione di androgeni mediata dall‟LH, aumenta l‟espressione del citocromo P450, dei recettori
dell‟LH e dell‟IGF-I (8-9). Poiché gli enzimi coinvolti nella steroidogenesi ovarica sono simili a
quelli surrenalici, numerosi studi hanno dimostrato che l‟insulina agisce direttamente anche
stimolando la steroidogenesi surrenalica (10-12). Studi in vitro hanno inoltre dimostrato che
l‟insulina presenta recettori anche a livello ipotalamico e ipofisario, attraverso i quali stimola il
rilascio di FSH e LH in condizioni basali ed in seguito a stimolo con GnRH (13). L‟insulina
influenza infine l‟iperandrogenemia anche inibendo a livello epatico la sintesi di SHBG (14) e di
IGFBP-1, che lega l‟IGF-1 (8).
Il primo e più efficace trattamento della PCOS è sicuramente rappresentato dalle modificazioni
dello stile di vita. La perdita del peso corporeo riduce significativamente tutte le manifestazioni
cliniche della PCOS: ripristina l‟ovulazione e aumenta la percentuale delle gravidanze, riduce i
livelli di insulina e degli androgeni (15).
Per quanto riguarda il trattamento delle manifestazioni cliniche dell‟iperandrogenismo, uno dei
farmaci più utilizzati nella PCOS è la flutamide, un antiandrogeno che agisce bloccando i recettori
degli androgeni (16). Questo farmaco riduce significativamente l‟iperandrogenemia e l‟irsutismo,
mentre ha effetti trascurabili sui cicli mestruali e sull‟ovulazione (17). Non è ancora chiaro se
questo trattamento eserciti degli effetti anche sull‟insulino-resistenza.
La somministrazione di contraccettivi nelle donne con PCOS si è rivelata utile in quanto riduce
l‟entità dell‟acne e dell‟irsutismo, regolarizza i cicli mestruali e migliora la densità ossea (18).
Tuttavia possono esercitare una serie di effetti metabolici negativi: aumentano i livelli di trigliceridi
e colesterolo totale, peggiorano l‟insulino-resistenza, determinano aumento di peso (19). Questi
effetti possono essere più o meno marcati a seconda del tipo di contraccettivo ormonale utilizzato.
Negli ultimi anni, tuttavia, i farmaci più utilizzati con successo nella PCOS da diversi autori sono
stati sicuramente gli insulino-sensibilizzanti (4), che si sono dimostrati efficaci, somministrati da
soli e in associazione con altri farmaci, non solo sull‟insulino-resistenza e sulla riduzione di peso,
ma anche sulle irregolarità mestruali, sui cicli anovulatori, sui segni dell‟iperandrogenismo e sulle
complicanze gestazionali (8,10,11). Tra questi è risultata particolarmente efficace la metformina,
farmaco molto utilizzato nei pazienti con diabete di tipo II. Nel 30% delle pazienti determina effetti
collaterali come disconfort addominale, caratterizzato da nausea, vomito e inappetenza (8).
Una significativa riduzione dei livelli circolanti di androgeni è stata osservata dopo trattamento a
breve termine con metformina. Tuttavia, nonostante la riduzione nei livelli circolanti di androgeni,
il trattamento a breve termine con metformina sembra avere un effetto minimo sulle manifestazioni
cutanee dell‟iperandrogenemia nelle pazienti con PCOS. Per questi motivi negli ultimi anni è stata
proposta da diversi autori l‟associazione di antiandrogeni e insulinosensibilizzanti nel trattamento di
questa sindrome.
Molti studi hanno dimostrato,inoltre, un significativo miglioramento della frequenza dei cicli
mestruali (25-96%) in seguito a trattamento con metformina (4). Inoltre, gli effetti benefici della
metformina sui fattori di rischio cardiovascolare e sulla sensibilità insulinica hanno portato
numerosi autori a proporre l‟associazione metformina + CO nelle donne con PCOS. E‟ stato
rilevato che l‟associazione metformina + CO rispetto all‟utilizzo dei soli CO nelle donne con PCOS
determina una riduzione più significativa dei livelli di androgeni, senza indurre significative
differenze del BMI, del rapporto vita/fianchi e del rapporto glicemia/insulina (20).
Quando somministrata da sola, o insieme ad altri agenti che inducono l‟ovulazione, la metformina
può giocare un ruolo importante nella infertilità anovulatoria associata con la PCOS. Un‟incidenza
di gravidanza del 39% è stata riportata quando è usata come unica terapia (21), mentre la
gravidanza si verifica nell‟89% dei casi quando è somministrata in associazione con clomifene
citrato nelle donne obese con PCOS clomifene resistenti (6). Nei casi in cui non c‟è risposta al
trattamento con clomifene e metformina oppure è necessario ricorrere a FIVET/ICSI, si impone
l‟impiego terapeutico dell‟FSH esogeno. Recentemente è stato dimostrato che il rischio di
sviluppare iperstimolazione ovarica (OHSS) in seguito a terapia con FSH esogeno aumenta con
l‟aumentare dell‟insulino-resistenza. Sulla base di questa osservazione la terapia combinata
metformina-FSH sembra essere associata ad una risposta dell‟ovaio più fisiologica con un minor
reclutamento follicolare ed una più bassa incidenza di OHSS (22).
Infine, le donne con PCOS sono affette da un‟alta percentuale di aborti spontanei. E‟ stato
dimostrato che la somministrazione di metformina prima del concepimento e nel primo trimestre di
gravidanza è associata ad un‟incidenza di aborti dell‟8,8% (rispetto al 41,9% dei controlli) (23). E‟
stato osservato, inoltre, che la somministrazione di metformina durante la gravidanza è associata ad
una riduzione di circa 10 volte del rischio di sviluppare diabete gestazionale (24).
In conclusione ricordiamo che tra i farmaci insulinosensibilizzanti si sono rivelati efficaci sulle
manifestazioni cliniche della PCOS anche il gruppo dei tiazolidinedioni.. Alcuni farmaci di questo
gruppo, come il rosiglitazone e il pioglitazone, migliorano significativamente la sensibilità
insulinica, riducono gli androgeni e regolarizzano i cicli mestruali (25). In particolare,
confrontandoli con la metformina, sembrano essere meno efficaci sul ripristino dell‟ovulazione e
sul controllo del peso corporeo, ma risultano ugualmente efficaci sulle altre manifestazioni cliniche
della sindrome (26). Inoltre, rispetto alla metformina, determinano meno effetti collaterali e hanno
una compliance migliore, in quanto la loro somministrazione è giornaliera, a differenza della
metformina che deve essere somministrata due o addirittura tre volte al giorno (26).
II.
Bibliografia
1. Carmina E et al. Polycystic ovary syndrome (PCOS): arguably the most common
endocrinopathy is associated with significant morbidity in women. J Clin Endocrinol Metab
1999;84:1897–99.
2. Dunaif A. Insulin resistance and the polycystic ovary syndrome: mechanism and implications
for pathogenesis. Endocr Rev 1997;18:774–800.
3. Franks S et al. Development of polycystic ovary syndrome: involvement of genetic and
environmental factors. International Journal of Andrology 2006;29: 278-85.
4. De Leo V et al. Insulin-lowering agents in the management of polycystic ovary syndrome.
Endocr Rev 2003;24:633-67.
5. Poretsky L et al. The insulin related ovarian regulatory sistem in health and disease. Endocr
Rev 1999;20:535-82.
6. Nestler JE et al. Effects of metformin on spontaneous and clomiphene-induced ovulation in
the polycystic ovary syndrome. N Engl J Med 1998;338:1876-80.
7. Nestler JE et al. Insulin stimulates testosterone biosynthesis by human thecal cells from
women with polycystic ovary syndrome by activating its own receptor and using
inositolglycan mediators as the signal transduction system. J Clin Endocrinol Metab 1998;
83:2001–2005.
8. Duleba AJ et al. Insulin and insulin-like growth factor I stimulate the proliferation of human
ovarian theca-interstitial cells. Fertil Steril 1998;69:335–40.
9. Adashi EY et al. Insulin-like growth factors as intraovarian regulators of granulosa cell
growth and function. Endocr Rev 1985;6:400–20.
10. Kristiansen SB et al. Induction of steroidogenic enzyme genes by insulin and IGF-I in
cultured adult human adrenocortical cells. Steroids 1997;62:258–65.
11. l‟Allemand D et al. Insulin-like growth factors enhance steroidogenic enzyme and
corticotropin receptor messenger ribonucleic acid levels and corticotropin steroidogenic
responsiveness in cultured human adrenocortical cells. J Clin Endocrinol Metab 1996;
81:3892–7.
12. Mesiano S et al. Insulin-like growth factors augment steroid production and expression of
steroidogenic enzymes in human fetal adrenal cortical cells: implications for adrenal
androgen regulation. J Clin Endocrinol Metab 1997;82:1390–6.
13. Arroyo A et al. Inappropriate gonadotropin secretion in polycystic ovary syndrome:
influence of adiposity. J Clin Endocrinol Metab 1997;82:3728–33.
14. Plymate SR et al. Inhibition of sex hormone-binding globulin production in the human
hepatoma (Hep G2) cell line by insulin and prolactin. J Clin Endocrinol Metab
1988;67:460–4.
15. Clark Ame t al Weight loss results in significant improvement in pregnancy and ovulation
rates in anovulatory obese women. Hum Reprod 1995;10:2705–2712.
16. De Leo V et al Hormonal effects of flutamide in young women with polycystic ovary
syndrome. J Clin Endocrinol Metab 1998; 83:99–102.
17. De Leo V et al
Effects of flutamide on pituitary and adrenal responsiveness to
corticotrophin releasing factor (CRF). Clinical Endocrinology (Oxford) 1998; 49 85–89.
18. Jensen JT et al Health benefits of oral contraceptives. Obstet Gynecol Clin North Am 2000;
27:705–721.
19. Mastorakos G et al Androgen and lipid profiles in adolescents with polycystic ovary
syndrome who were treated with two forms of combined oral contraceptives. Fertil Steril
2002; 77:919–927.
20. Elter K et al Clinical, endocrine and metabolic effects of metformin added to
ethinylestradiol-cyproterone acetate in non-obese women with polycystic ovary syndrome:
a randomized controlled study. Human Reproduction 2002; 17 1729–1737.
21. Mitwally Mf et al High ovulatory rates with use of troglitazone in clomiphene-resistant
women with polycystic ovary syndrome. Hum Reprod 1999;2700-2703.
22. De Leo V et al Effects of metformin on gonadotrophin-induced ovulation women with
polycystic ovary syndrome. Fertil Steril 1999; 72: 282-285.
23. Jakubowicz DJ et al Effect of metformin on early pregnancy loss in the polycystic ovary
syndrome. J Clin Endocrinol Metab 2002; 87:524-529.
24. Glueck CJ et al Metformin therapy throughout pregnancy reduces the development of
gestational diabetes in women with polycystic ovary syndrome. Fertil Steril 2002;77:520-5.
25. Ghazeeri G et al Effect of rosiglitazone on spontaneous and clomiphene citrate-induced
ovulation in women with polycystic ovary syndrome. Fertil Steril 2003; 79:562–566.
26. Baillargeon JP et al Effects of metformin and rosiglitazone, alone and in combination, in
non-obese women with polycystic ovary syndrome and normal indices of insulin sensitivity.
Fertility and Sterility 2004; 82 893–902.
Gonadotropin-releasing hormone agonist
treatment before abdominal myomectomy: a
controlled trial
Paolo Vercellini, M.D., Laura Trespı`di, M.D., Barbara Zaina, M.D., Sarah Vicentini, M.D., Giovanna Stellato,
M.D., and Pier Giorgio Crosignani, M.D.
Clinica Ostetrica e Ginecologica I, Istituto “Luigi Mangiagalli,” University of Milan, Milan, Italy
Objective: To ascertain whether adjuvant gonadotropin-releasing hormone (GnRH) agonist therapy decreases blood loss during
abdominal myomectomy.
Design: Randomized controlled trial.
Setting: Academic reproductive surgery center.
Patient(s): One hundred premenopausal women requiring first-line conservative surgery for symptomatic intramural or subserous
fibroids.
Intervention(s): Eight weeks of treatment with depot triptorelin before myomectomy or immediate surgery.
Main Outcome Measure(s): Intraoperative blood loss, operating time, degree of difficulty of the procedure, and short-term rate of
fibroid recurrence.
Result(s): Mean (_SD) intraoperative blood loss was 265 _ 181 mL in triptorelin recipients and 296 ± 204 in patients who had
immediate surgery (mean difference, _31 mL [95% CI, _108 to 46 mL]). No significant differences were observed in blood loss
according to uterine volume, number of fibroids removed, or total length of myometrial incisions. Most procedures in either group
were of routine difficulty. On ultrasonography 6 months after myomectomy, four women in the GnRH agonist group and one in the
immediate surgery group had tumor recurrence.
Conclusion(s): Treatment with a GnRH agonist before abdominal myomectomy has no significant effect on intraoperative blood
loss. Thus, systematic use of medical therapy before abdominal myomectomy does not seem to be justified. (Fertil Steril_
2003;79:1390 –5. ©2003 by American Society for Reproductive Medicine.)
Key Words: Uterine leiomyoma, fibroid, myomectomy, conservative surgery, GnRH agonists, menorrhagia, infertility
A considerable proportion of uterine leiomyomas are
associated with symptoms requiring therapy (1– 4).
The standard treatment in women who desire
pregnancy is myomectomy, which is performed
abdominally if the tumors are not intracavitary (1–3).
This surgical procedure may be associated with
substantial morbidity, in particular major blood loss,
because fibroid removal implies ample myometrial
incision with exposure of numerous severed vessels.
Prompt and meticulous hemostasis is not always
feasible, particularly when large or multiple fibroids
are present. Mechanical devices to limit blood loss may
be awkward to apply or not always successful because
of differences in uterine conformation (2, 3, 5).
Vasoconstrictive agents (e.g., vasopressin or
epinephrine) may cause severe cardiovascular side
effects (3), and their use is prohibited in some
countries.
In the past decade, the use of gonadotropinreleasing
hormone (GnRH) agonists before myomectomy
became popular (5–10). The main purported
advantages of these hypoestrogenizing hormones are
limitation of blood loss and surgical trauma due to
substantial reduction of fibroid volume and uterine
artery blood flow (5–10). On the other hand,
myomectomy after treatment with GnRH agonists is
more cumbersome because it is difficult to identify the
cleavage plane.
In a gross anatomical and histopathologic study of uteri
excised because of fibroids, Deligdisch et al. (11)
observed that pretreatment with GnRH agonists was
associated with a blurred interface between myoma and
myometrium, with obliteration of the cleavage plane.
Moreover, it has been suggested that pretreatment with
GnRH agonists may make identification of small
intramural tumors more difficult and therefore increase
the shortterm recurrence rate of myoma (12).
Randomized controlled trials could verify the above
findings, but the results of the six small randomized
controlled trials published in the English- language
literature are inconsistent (5, 12–16).
We performed an adequately sized controlled trial to
evaluate the effect of GnRH agonist administration
before myomectomy at laparotomy on intraoperative
blood loss.
Secondary outcomes were operating time, degree of
difficulty of the intervention, postoperative morbidity,
and myoma
recurrence. A short-term treatment was chosen to
maintain the advantages of GnRH agonists (reduction
in uterine blood flow and fibroid volume) while
limiting side effects and costs (7, 9, 10, 14).
MATERIALS AND METHODS
Our open-label, parallel-group randomized controlled
trial evaluated the effect of 2 months of treatment with
a GnRH agonist before abdominal myomectomy on
intraoperative blood loss compared with immediate
surgery. The minimum duration of GnRH agonist
treatment before myomectomy needed to accomplish
the desired results is thought
to be 2 months (9).
The study was conducted in an academic department
specializing in conservative and reconstructive
gynecologic surgery. Institutional review board
approval was obtained, and the participants were given
oral and written information and signed a consent form.
Selection Criteria
Eligible patients were premenopausal women 18 to 40
years of age (serum FSH levels < 30 mIU/mL) who
were referred to our center for symptomatic intramural
or subserous fibroids (menorrhagia, infertility, or
pelvic compression) larger than 3 cm that required
first-line conservative surgery. The women underwent
a complete physical examination, urine pregnancy test,
and transvaginal ultrasonography.
Uterine volume was calculated ultrasonographically by
using the usual formula for a prolate ellipsoid (length x
width x depth x 0.5236). The number, diameter, and
site of tumors were also assessed.
Women with predominantly intracavitary fibroids were
excluded. Other exclusion criteria were previous pelvic
surgery for leiomyomas or other genital anomalies,
uterine malformations, present or past pelvic
inflammatory disease, use of GnRH agonists up to 6
months before study entry, ultrasonographic signs of
uterine calcifications, coagulation disorders, and
unstable general conditions. Women with a serum
hemoglobin level <10 g/dL were also excluded because
it was deemed inappropriate to preclude preoperative
GnRH agonist treatment when moderate to severe
irondeficiency anemia was present. Oral iron
supplementation was systematically prescribed to
mildly anemic patients (17).
Treatments
After pretrial screening, eligible patients were
randomized in a proportion of 1:1 to treatment with
intramuscular depot injections of triptorelin, 3.75 mg
(Decapeptyl; IPSEN Biotech, Paris, France), on two
occasions 28 days apart starting during the midluteal
phase, or to immediate surgery.
Treatment allocation was performed with a computergenerated randomization sequence using serially
numbered, opaque, sealed envelopes. The operation
was scheduled in the proliferative phase within 4
weeks of randomization in the immediate surgery
group and within 4 weeks of the second triptorelin
injection in the preoperative medical treatment group.
The day before surgery, women allocated to the GnRH
agonist group underwent a second ultrasonographic
scan to evaluate variations in uterine and myoma
volume.
Myomectomies were performed at laparotomy by six
expert staff surgeons and by four residents specializing
in reproductive surgery. The residents were closely
supervised by the six staff surgeons. Only mechanical
and electrical instruments were used according to a
standard technique described elsewhere (1–3). Fibroids
were removed through a vertical incision as close to the
midline of the uterine corpus as possible. Hemostasis
was achieved with meticulous ligation of bleeders and
obliteration of dead spaces with interrupted 2-0 or 3-0
polyglactic sutures.
Vasoactive drugs, hemostatic tourniquets, and forceps
or clamps on major pelvic arteries were not used. An
oxidized regenerated cellulose surgical adhesion barrier
was applied on the basis of the gynecologists‟
experience and preference.
Ultrashort antibiotic prophylaxis with intravenous
cefuroxime, 2 g (clarithromycin in allergic patients),
was systematically administered 30 minutes before
surgery.
Assessment of Efficacy
The effect of treatment with triptorelin before
myomectomy was based on blood loss, as measured in
the operating room by weighing swabs and adding the
estimated volume of blood to that removed by suction.
The volume of lactated
Ringer‟s solution used to irrigate the pelvis was
estimated precisely and then subtracted from the fluid
collected in the suction unit. No attempt was made to
measure the amount of blood lost during abdominal
wall opening because, in our experience, it is minimal
and practically not evaluable.
The number of myomas removed and their location
was recorded. A tumor was defined as subserous if its
greatest diameter lay outside the uterine contour, or as
intramural in cases of marginal submucosal extension,
provided that the greatest diameter was outside the
uterine cavity (18). To accurately measure the length of
uterine incisions, small marks corresponding to the
extremes of the planned incision were made on the
perimetrium with a needle-point electrode.
A silk suture was stretched on the uterine surface and
cut in correspondence with the marks. The pieces of
surgical thread were collected and measured.
Total operating time was measured from skin incision
to closure; myomectomy time was measured from
opening the peritoneum to start of closure. At the end
of the intervention, the degree of difficulty of the
procedure was graded according to a three-level scale
(easier than usual, routine difficulty, or more difficult
than usual). In addition, the surgeon was asked to state
if the cleavage planes between the fibroids and the
surrounding myometrium were clearly identifiable or
not.
Intraoperative or postoperative complication, blood
transfusion, and duration of hospital stay were
recorded. Serum hemoglobin and hematocrit were
assessed before and 24 hours after the operation.
Febrile morbidity was defined as a body temperature of
38° C or greater recorded on any 2 of the first 10
postoperative days, excluding the first 24 hours.
To test the hypothesis that GnRH agonist treatment
before myomectomy increases the risk of short-term
tumor recurrence (12), the women underwent clinical
evaluation and vaginal ultrasonography 6 months after
the operation.
Statistical Analysis
According to previous experience at our institution, the
standard deviation of blood loss in women undergoing
abdominal myomectomy without adjuvant medical
therapy is around 300 mL (18). A difference of 200 mL
in intraoperative blood loss between treatment groups
was considered clinically significant. To have an 80%
chance of detecting such a difference at an overall
significance level of 5%, about 40 subjects per study
arm were required. Allowing for withdrawals, the aim
was to recruit approximately 50 women per treatment
group. Differences in blood loss, operating time,
number and length of myometrial incisions, number of
tumors removed, serum hemoglobin and hematocrit
values, and duration of hospital stay were analyzed
with the Student t-test for unpaired data. Degree of
difficulty of the intervention was compared by using
the Mann–Whitney U test, and the 2 test or Fisher
exact test was used to analyze the frequencies of
identifiable cleavage planes, febrile morbidity, and
postoperative myoma recurrence.
All statistical tests were two-sided. P <.05 was
considered significant. When appropriate, 95% CIs
were calculated for the observed differences.
triptorelin group and 8 of 48 (17%) in the immediate
surgery group. The maximum blood loss was 700 mL
in 1 triptorelin recipient and 900 mL in 1 patient who
had immediate surgery.
RESULTS
A total of 162 subjects evaluated in an academic
outpatient clinic were eligible. Fifty-one declined
randomization (39 were unwilling to undergo treatment
with a GnRH agonist and 12 requested preoperative
treatment), and 11 were lost to further contact. Fifty of
the remaining patients were allocated to the triptorelin
group and the other 50 to the immediate surgery group.
After randomization and before surgery, 2 women in
the latter group were withdrawn from the study (1
became pregnant and 1 decided to undergo surgery at
another hospital). Myomectomy was converted to
hysterectomy in 1 patient allocated to triptorelin
because of intraoperative diagnosis of disseminated
uterine leiomyomatosis.
Thus, 49 patients in the preoperative medical treatment
group and 48 in the immediate surgery group were
available for the efficacy analysis. Table 1 shows the
baseline clinical characteristics of participants. The
distribution of the variables under study was similar in
the two groups.
Mean ± SD uterine volume in GnRH agonist recipients
decreased by 22% to 269 ± 119 mL at preoperative
ultrasonographic assessment. All women were operated
through a Pfannenstiel or a Ku¨stner transverse
suprapubic incision. No major intraoperative
complications occurred, and no homologous blood
transfusions were required.
The mean number of fibroids removed, number of
myometrial incisions and their mean total length, and
operating time did not significantly differ in the two
groups (Table 2).
Most procedures were judged to be of usual difficulty,
and easy or difficult interventions were equally
distributed between the two groups. In both groups,
identification of cleavage planes was difficult in about
1 of 10 women.
Mean (±SD) intraoperative blood loss was 265 ± 181
mL in the pretreated group and 296 ± 204 in the
immediate surgery group (mean difference, – 31 mL
[95% CI, – 108 to 46 mL]). The amount of blood loss
was 500 mL or more in 6 of 49 (12%) women in the
No significant differences were observed in subgroup
analyses. Mean blood loss was 201 ± 175 mL in the
GnRH agonist group (n = 22) and 244 ± 217 mL in the
immediate surgery group (n = 22) when uterine volume
assessed preoperatively at bimanual examination was
up to 12 gestational weeks and 313 ± 175 mL (n = 27)
and 330 ± 191 mL (n = 26), respectively, in women
with larger uteri. In the triptorelin and immediate
surgery groups, respectively, blood loss was 241 ± 183
mL (n = 25) and 294 ± 208 mL (n = 26) when only one
or two fibroids were present and 285 ± 183 mL (n =
24) and 282 ± 209 mL (n = 22) when three or more
tumors were removed.
Blood loss did not differ between groups when patients
were stratified on the basis of length of myometrial
incisions: It was 223 ± 175 mL (n = 22) in the
triptorelin group and 250 ± 176 mL (n = 18) in the
immediate surgery group when the total length of
incisions was <10 cm and 295 ± 185 mL (n = 27) and
359 ± 237 mL (n = 30) when the total length was 10
cm or greater. Nor was blood loss influenced by the
surgeon‟s expertise: It was 285 ± 190 mL and 248 ±
173 mL in pretreated patients in whom surgery was
done by staff or residents, respectively, compared with
307 ± 214 mL and 281 ± 198 mL in those undergoing
immediate surgery.
To determine whether the above variables were
associated with the amount of blood loss independent
of GnRH agonist use, data from patients in both groups
were pooled.
Uterine volume and total length of myometrial
incisions were reliable predictors of blood loss: Values
were 222 ± 196 mL (n = 44) in women with a uterine
size less than 12 gestational weeks and 322 ± 182 mL
(n = 53) in those with uterine size 12 weeks or larger
(P =.011, unpaired t-test), and 239 ± 174 mL (n = 40)
when the myometrial surface incision was smaller than
10 cm and 321 ± 207 (n = 57) when the incision was
10 cm or large (P =.043).
Unexpectedly, blood loss was not significantly
influenced by number of myomas removed. Values
were 272 ± 198 mL (n = 51) when one or two fibroids
were excised and 284 ± 189 mL (n = 46) when three or
more tumors were present
(P=.761).
Mean serum hemoglobin and hematocrit values in the
GnRH agonist group decreased from 12.7 ± 1.2 g/dL
and 38.4% ± 3.4% before surgery to 12.1 ± 1.2 g/dL
and 35.2% ± 3.1% 6 hours after surgery and to 11.4
±1.0 g/dL and 34.1% ± 2.9% 24 hours after surgery. At
the same time points, serum hemoglobin and
hematocrit values in the immediate surgery group
were, respectively, 12.3 ± 1.1, 11.8 ± 1.2, and 11.0 ±
1.4 g/dL and 37.6% ± 3.3%, 34.5% ± 3.3%, and 33.1%
± 3.9%. None of the above between-group differences
was statistically significant.
One woman in the immediate surgery group underwent
a second intervention to treat an expanding subfascial
hematoma.
Febrile morbidity occurred in 9 (18%) patients treated
with triptorelin and 10 (21%) who underwent
immediate surgery. Mean duration of hospital stay was
6.1 ± 0.8 days in the preoperative GnRH agonist group
and 5.9 ± 0.9 days in the immediate surgery group. The
number of women who did not attend the 6-month
follow-up evaluation was small (8 of 97) and equally
distributed between the study groups. One patient in
the immediate surgery group was excluded from
evaluation of shortterm tumor recurrence because a
deep 1-cm intramural myoma was deliberately left
untreated. The procedures were otherwise deemed
radical. Patients in the GnRH agonist group were more
likely to have persistence or recurrence of their fibroids
6 months after myomectomy than were those who
underwent immediate surgery (4 of 45 patients vs. 1 of
43 patients; P=0.361, Fisher exact test (odds ratio, 4.10
[95% CI, 0.44 to 38.25]).
DISCUSSION
Because GnRH agonists considerably decrease uterine
blood flow and myoma volume (19–21), it seems
reasonable to expect that their use would reduce the
length of the uterine incision, duration of surgery, and,
most important, blood loss in women undergoing
myomectomy (6, 8, 9).
In six randomized controlled trials published in the
English literature, the mean between-group difference
in blood loss ranged from 37 to 156 mL, always in
favor of the GnRH agonist group (5, 12–16). However,
because a vasoconstrictor
was used in the two trials on laparoscopic
myomectomy, those data on blood loss are biased (15,
16). Reduction in operating time varied from 6 to 16
minutes in favor of the GnRH group in five studies,
whereas in one trial on laparoscopic myomectomy, the
difference was in favor of the immediate surgery group
(16).
The combined proportion of women who had
transfusion was 7% (9 of 133) of pretreated patients
compared with 8% (8 of 102) of those undergoing
immediate surgery. The cumulative rate of
postoperative complications was also similar: 20% (13
of 64) in the former group and 21% (14 of 66) in the
latter group. No difference in duration of
hospitalization was observed (10, 21).
We observed a minimal between-group difference in
blood loss; even the 95% confidence limit of about –
100 mL is of marginal clinical importance. Pooling of
data from patients in both groups indicated that uterine
volume and total length of myometrial incisions were
important predictors of intraoperative blood loss.
However, subgroup analyses of the above variables
demonstrated no benefit of preoperative triptorelin
therapy over immediate surgery. Thus, our findings
disagree with those of Friedman et al. (5), who
observed a major reduction in blood loss after
preoperative GnRH agonist use only in patients with
pretreatment mean uterine volume greater than 600 cm3
(roughly the size of a 16-week gestation).
A 2-month course of GnRH agonist was used to limit
side effects and costs without lessening efficacy.
Greater reduction in operative blood loss after
extension of the treatment period with triptorelin to 3
or 6 months cannot be excluded but seems unlikely, as
most of the reduction in uterine volume and blood flow
is observed in the first weeks of therapy (6, 9, 19, 20).
Furthermore, our findings are consistent with the
conclusions of recent systematic literature reviews (10,
21). Finally, because we excluded women with
moderate or severe anemia and prescribed oral iron
supplementation to those with mild anemia, extension
of the treatment period with the aim of normalizing
hematologic values was not justified (17, 22, 23).
A double-blind, placebo-controlled study would have
been preferable but was not feasible because of local
organizational difficulties. However, our primary aim
was determination of blood loss at surgery, an outcome
that should be considered sufficiently objective.
Hemostasis should not be influenced by the surgeon‟s
personal opinions.
Our trial was adequately sized, and only three women
were withdrawn from the study. We expected a
standard deviation of mean blood loss of 300 mL,
which is larger than the standard deviation of around
200 mL observed in both
study groups. However, the former figure was based on
historical data collected retrospectively, which are
likely to be less accurate. We believe that this should
not affect interpretation of the results, because the
sample size as calculated was larger than that needed to
identify the planned difference in blood loss.
Assessment of the degree of difficulty of the procedure
was subjective. However, the turnover of surgeons
should have avoided a systematic bias. Moreover,
operating time, a reasonable indirect measure of
surgical difficulty, was almost identical in the two
study groups. Finally, the definition of cleavage planes
was deliberately dichotomous to limit undue operator
influence. Our data do not support the idea that
preoperative administration of GnRH agonists makes
identification of the cleavage planes and myomectomy
more difficult.
Gonadotropin-releasing hormone agonist–induced
uterine volume reduction is reported to limit the rate of
midline vertical abdominal incisions needed to perform
myomectomy when large tumors are present (21). This
was not the case in our series, as all women underwent
surgery through a lower transverse suprapubic incision
independent of treatment allocation.
No difference between groups in postoperative
morbidity and hospital stay was observed. A policy of
early discharge after conservative surgery at
laparotomy has not yet been implemented in our
department, and the postoperative course of the
enrolled women was managed routinely. The overall
incidence of febrile morbidity was well within the rates
reported in the literature, and preoperative medical
treatment was of no benefit in limiting this specific
complication of
abdominal myomectomy (24).
Some investigators speculate that the decrease in
myoma volume and consistency induced by
hypoestrogenism makes smaller tumors unidentifiable
during operation (12). In a previous small study from
our institution (12), ultrasonography
performed 6 months after myomectomy revealed
recurrence or persistence of intramural fibroids smaller
than 1.5 cm in diameter in 5 of 8 pretreated patients
(63%) compared with 2 of 16 controls (13%). Such a
difference was not confirmed in the study by Friedman
et al. (25), in which the postoperative fibroid
recurrence rate was high (6 of 9 [67%] pretreated
patients and 5 of 9 [56%] controls); however, followup exceeded 2 years.
The distribution of myoma recurrence in our trial was
unbalanced. However, because of limited number of
events (5 of 88 patients [5.7%]), the CI of the odds
ratio is wide and includes unity, which precludes useful
conclusions. Of note,
the odds ratio of myoma recurrence in our study (4.2)
is similar to that calculated by the Cochrane
Collaboration (4.0) in a recent meta-analysis (21).
Accordingly, we cannot rule out the possibility that use
of GnRH agonists before myomectomy increases the
risk of small tumor persistence.
An unanswered question is whether preoperative
hormonal therapy facilitates conception after
conservative surgery (21). In a large observational
study of determinants of reproductive outcome after
myomectomy for infertility (18), the 24-month
cumulative probability of conception was independen
of the preoperative use of GnRH agonists: The rate was
67% in 40 pretreated women compared with 66% in 98
patients who underwent immediate surgery.
Only patient age, duration of infertility, and presence
of other, minor infertility factors in addition to myomas
were significantly associated with postoperative
conception rate.
We are continuing to follow the patients enrolled in the
current trial with the aim of clarifying this matter.
In conclusion, GnRH agonist treatment before
myomectomy has no significant effect on
intraoperative blood loss. Use of adjuvant medical
therapy is justified in anemic women, as amenorrhea
facilitates normalization of hematologic values (2, 8,
17, 22, 23). Otherwise, a modest increase in blood loss
of even 100 mL has no demonstrated practical
consequence (10). Homologous transfusions were not
needed in our series. No effect on operating time,
degree of difficulty of the procedure, and postoperative
morbidity was observed. Larger trials are needed to
verify the hypothesis that hypoestrogenism induced
before surgery increases the risk of small tumor
persistence (12).
The main advantage of combining medical with
surgical treatment in nonanemic women seems to be
that patients could be admitted at any time, thus
avoiding the problem of scheduling the operation
during a few postmenstrual days. In theory, a reduction
of fibroid volume may increase the feasibility of
laparoscopic myomectomy, but our trial was not
designed to clarify this matter. Moreover,
myomectomy at laparoscopy remains controversial,
and it has not yet been demonstrated that the
endoscopic approach constitutes a definite advantage.
Acknowledgments: The authors thank the operating theatre personnel
for their collaboration throughout the study period and IPSEN
Biotech Pharmaceuticals, Milan, Italy, for providing triptorelin depot
injections used in the trial.
References
1. Buttram VC, Reiter RC. Uterine leiomyomata: etiology,
symptomatology,
and management. Fertil Steril 1981;36:433–45.
2. Verkauf BS. Myomectomy for fertility enhancement and
preservation.
Fertil Steril 1992;58:1–15.
3. Thompson JD, Rock JA. Leiomyomata uteri and myomectomy. In:
Rock JA, Thompson JD (eds). Te Linde‟s operative gynecology, 8th
ed.
Philadelphia: Lippincott–Raven, 1997:731–70.
4. Vercellini P, Maddalena S, De Giorgi O, Aimo G, Crosignani PG.
Abdominal myomectomy for infertility: a comprehensive review.
Hum
Reprod 1998;13:873–9.
5. Friedman AJ, Rein MS, Harrison-Atlas D, Garfield JM, Doubilet
PM.
A randomized, placebo-controlled, double-blind study evaluating
leuprolide
acetate depot treatment before myomectomy. Fertil Steril 1989;
52:728–33.
6. Friedman AJ. Use of gonadotropin-releasing hormone agonists
before
myomectomy. Clin Obstet Gynecol 1993;36:650–9.
7. Broekmans FJ. GnRH agonists and uterine leiomyomas. Hum
Reprod
1996;11(Suppl 3):3–25.
8. Crosignani PG, Vercellini P, Meschia M, Oldani S, Bramante T.
GnRH
agonists before surgery for uterine leiomyomas. A review. J Reprod
Med 1996;41:415–21.
9. Lemay A, Maheux R. GnRH agonist in the management of uterine
leiomyoma. Infertil Reprod Med Clin North Am 1996;7:33–55.
10. Vercellini P, Trespide L, Pisacreta A, Vicentini S, Stellato G,
Crosignani
PG. The use of LHRH agonists and antagonists in the treatment of
myomata. Infertil Reprod Med Clin North Am 2001;12:195–214.
11. Deligdisch L, Hirschmann S, Altchek A. Pathologic changes in
gonadotropin
releasing hormone agonist analogue treated uterine leiomyomata.
Fertil Steril 1997;67:837–41.
12. Fedele L, Vercellini P, Bianchi S, Brioschi D, Dorta M.
Treatment with
GnRH agonists before myomectomy and the risk of short-term
myoma
recurrence. Br J Obstet Gynaecol 1990;97:393–6.
13. Shaw RW. Mechanism of LHRH analogue action in uterine
fibroids.
Horm Res 1989;32(Suppl 1):150–3.
14. Golan A, Bukovsky I, Pansky M, Schneider D, Weinraub Z,
Caspi E.
Pre-operative gonadotrophin-releasing hormone agonist treatment in
surgery for uterine leiomyomata. Hum Reprod 1993;8:450–2.
15. Zullo F, Pellicano M, De Stefano R, Zupi E, Mastrantonio P. A
prospective randomised study to evaluate leuprolide acetate treatment
before laparoscopic myomectomy: efficacy and ultrasonographic
predictors.
Am J Obstet Gynecol 1998;178:108–12.
16. Campo S, Garcea N. Laparoscopic myomectomy in
premenopausal
women with and without preoperative treatment using
gonadotrophinreleasing
hormone analogues. Hum Reprod 1999;14:44–8.
17. Benagiano G, Kivinen ST, Fadini R, Cronje´ H, Klintorp S, van
der
FERTILITY & STERILITY Vol. 79, No. 6, June 2003
Spuy ZM. Zoladex (goserelin acetate) and the anemic patient: results
of
a multicenter fibroid study. Fertil Steril 1996;66:223–9.
18. Vercellini P, Maddalena S, De Giorgi O, Pesole A, Ferrari L,
Crosignani
PG. Determinants of reproductive outcome after abdominal
myomectomy
for infertility. Fertil Steril 1999;72:109–14.
19. Matta WH, Stabile I, Shaw RW, Campbell S. Doppler assessment
of
uterine blood flow changes in patients with fibroids receiving the
gonadotropin-releasing hormone agonist buserelin. Fertil Steril 1988;
49:1083–5.
20. Reinsch RC, Murphy AA, Morales AJ, Yen SS. The effects of
RU486
and leuprolide acetate on uterine artery blood flow in the fibroid
uterus:
A prospective, randomised study. Am J Obstet Gynecol 1994;170:
1623–7.
21. Lethaby A, Vollenhoven B, Sowter M. Efficacy of pre-operative
gonadotrophin
hormone releasing analogues for women with uterine fibroids
undergoing hysterectomy or myomectomy: a systematic review. Br J
Obstet Gynaecol 2002;1097–108.
22. Candiani GB, Vercellini P, Fedele L, Arkaini L, Bianchi S,
Candiani M.
Use of goserelin depot, a gonadotropin-releasing hormone agonist,
for
the treatment of menorrhagia and severe anemia in women with
leiomyomata
uteri. Acta Obstet Gynecol Scand 1990;69:413–5.
23. Vercellini P, Crosignani PG. Zoladex and the anaemic patient. Br
J
Obstet Gynaecol 1994;101(Suppl):33–7.
24. Iverson RE, Chelmow D, Strohbehn K, Waldman L, Evantash
EG,
Aronson P. Myomectomy fever: testing the dogma. Fertil Steril
1999;
72:104–8.
25. Friedman AJ, Daly M, Juneau-Norcross M, Fine C, Rein MS.
Recurrence
of myomas after myomectomy in women pretreated with leuprolide
acetate depot or placebo. Fertil Steril 1992;58:205–8.
Nuovi trattamenti medici dell’endometriosi
Felice Petraglia, Lucia Lazzeri, Valentina Ciani, Francesco Calonaci, Aldo Altomare,
Chiara Cancemi, Chiara Ferrata, Sandro Razzi, Stefano Luisi
Dipartimento di Pediatria, Ostetricia e Medicina della Riproduzione,
Clinica Ostetrica e Ginecologica, Università di Siena
Introduzione
L‟endometriosi è una patologia ginecologica cronica, multifattoriale, caratterizzata dalla
presenza di cellule endometriali al di fuori dell‟utero. Questa patologia è tipica dell‟ età fertile e
colpisce prevalentemente donne di età compresa tra la seconda e terza decade di vita, con
un‟incidenza del 16%, che può raggiungere il 30% in donne affette da infertilità. Attualmente è
considerata una patologia sociale, spesso però misconosciuta e sottodiagnosticata. Si calcola infatti
che nella maggior parte dei casi trascorrono diversi anni tra la comparsa dei sintomi, la diagnosi e la
conseguente terapia. Il trattamento medico dell‟endometriosi si basa sul concetto che il tessuto
endometriale ectopico è modulato dagli ormoni sessuali. La strategia terapeutica che viene utilizzata
è quella di creare: i) un clima ormonale ipoestrogenico atto a ridurre il trofismo delle lesioni
endometriosiche, ii) indurre una pseudo-decidualizzazione attraverso trattamenti progestinici
oppure estro-progestinici. Le nuove opzioni terapeutiche nel trattamento medico dell‟endometriosi
si basano sugli stessi principi, ma utilizzano nuovi meccanismi d‟azione. Fra queste nuove opzioni
abbiamo i progestinici somministrati per via locale e gli inibitori dell‟aromatasi.
Uso locale dei Progestinici
Negli ultimi anni nuove vie per la somministrazione ormonale sono divenute di uso corrente.
In particolare, la somministrazione locale (intrauterina o vaginale) di estrogeni, progestinici o estroprogestinici è stata descritta per la terapia ormonale sostitutiva, per la contraccezione e la
menorragia. Per le donne affette da endometriosi, ci sono adesso nuovi dati sull'uso locale dei
progestinici (levonorgestrel e danazolo).
Levonorgestrel intrauterino
Il Levonorgestrel intrauterino (LNG-IUS) esercita un‟azione sull‟ endometrio, che diventa
atrofico ed inattivo senza sopprimere l'ovulazione. Infatti, è stato dimostrato che il LNG-IUS
determina una diminuzione nella proliferazione endometriale ed un aumento dell‟ apoptosi nelle
ghiandole e nello stroma endometriale (1). Questa struttura a forma di T, include un serbatoio
posizionato lungo il braccio verticale che contiene 52 mg di LNG. Il tasso di rilascio è di 20 µg/die
ed il dispositivo può essere lasciato in sede per al massimo 5 anni. Inoltre, le linee guida di
riferimento del Royal College degli ostetrici e dei ginecologi ha affermato che grazie all‟uso di
questo dispositivo medicato intrauterino il controllo del dolore è mantenuto per almeno 3 anni (2).
La somministrazione intrauterina di LNG, con la sua distribuzione diretta sui tessuti pelvici,
determina una concentrazione locale maggiore rispetto ai livelli plasmatici. Sebbene un
assorbimento sistemico sia sempre presente, determinando alcuni effetti collaterali, l'assorbimento
locale sembra avere un'efficacia superiore con effetti collaterali limitati aumentando la compliance
della paziente in particolar modo durante il trattamento di lunga durata (3). Questo sistema
medicato sembra alleviare la dismenorrea correlata all‟ endometriosi ricorrente ed il dolore pelvico
cronico associato all‟ endometriosi profonda. Il suo uso dopo chirurgia conservativa per
endometriosi sintomatica, riduce significativamente il rischio a medio termine di ricorrenza della
dismenorrea moderata o severa ed offre un più alto grado di soddisfazione alla paziente. Questi
risultati sono probabilmente dovuti sia allo stato di amenorrea/ipomenorrea che si viene a creare,
che all‟atrofia endometriale indotta nella maggior parte delle donne dall‟azione del levonorgestrel
liberato localmente. L'uso del LNG-IUS rappresenta un reale avanzamento anche nel trattamento
dell‟ adenomiosi (4). L'efficacia del LNG-IUS nel trattamento dell' adenomiosi è data dalla
decidualizzazione, dalla successiva conseguente marcata atrofia dell‟ endometrio e dall' azione
diretta dell'ormone sui foci adenomiosici (5). Il LNG-IUS è stato indicato inoltre per indurre una
down-regulation dei recettori estrogenici sia nei comparti ghiandolari che stromali dei tessuti
endometriali, prevenendo una ulteriore stimolazione da parte degli estrogeni e portando all‟ atrofia
ed al restringimento dei foci adenomiosici (6).
Danazolo intrauterino
Il danazolo somministrato per via orale è stato comunemente usato nel trattamento medico
del dolore associato all‟ endometriosi, ma il suo uso è limitato pesantemente dalla severità degli
effetti collaterali, in special modo nelle terapie di lunga durata, con una conseguente bassa
compliance della paziente. Di conseguenza, una somministrazione locale, intrauterina o vaginale,
sembra rappresentare un'opzione realmente attraente. È ormai noto che il danazolo agisce
direttamente sul tessuto endometriotico in vitro ed in vivo inibendo la sintesi del DNA ed
inducendo l‟ apoptosi. Dal momento che, il tessuto adenomiotico nel miometrio si collega
direttamente alla superficie dell‟ endometrio ed alla cavità uterina attraverso i dotti delle ghiandole
endometriali, il danazolo somministrato all‟interno della cavità uterina viene trasportato
direttamente al tessuto adenomiotico e successivamente nei tessuti vicini. Dati promettenti sono
stati riportati riguardo ad un dispositivo intrauterino al danazolo in donne affette da adenomiosi.
Infatti, in queste pazienti l'inserzione di questo dispositivo intrauterino medicato ha mostrato la sua
efficacia non solo nella remissione della dismenorrea e della ipermenorrea, ma è risultato anche
efficace in pazienti infertili, permettendo il concepimento dopo la sua rimozione (7). In un recente
studio, abbiamo valutato prospettivamente l'efficacia del rilascio intrauterino continuo di danazolo
per migliorare la dismenorrea, il dolore pelvico cronico e la dispareunia associati alla endometriosi
moderata o severa (8). Sono state incluse nello studio 18 donne con una diagnosi istologica di
endometriosi eseguita dopo trattamento laparoscopico per la presenza di cisti ovariche o sterilità
inspiegata associata a dismenorrea, dolore pelvico cronico o dispareunia. Tutte le pazienti avevano
sospeso qualsiasi trattamento medico fino a 2 mesi prima dell‟arruolamento e nessuna di loro aveva
immagini ultrasonografiche transvaginali caratteristiche per endometriosi. Un sistema intrauterino
danazolo-caricato contenente 400 mg di danazolo (Fuji Latex, Tokyo, Giappone) è stato inserito
nella cavità uterina in anestesia locale, entro 7 giorni dal ciclo mestruale ed il dispositivo è stato
quindi mantenuto per 6 mesi senza alcuna terapia medica aggiuntiva. L‟ intensità della dismenorrea,
della dispareunia e del dolore pelvico cronico è stata valutata il primo giorno del mese per 6 mesi,
usando una scala analogica visiva del dolore (punteggio ≥ 6 = dolore moderato o severo). Tutte le
pazienti arruolate hanno avuto un punteggio consistente con dolore moderato o severo. L'analisi
statistica ha incluso l'analisi della varianza (ANOVA) per la ripetizione di misure attraverso il posthoc test con risultato statisticamente significativo con p<0.05. Tutte le pazienti hanno completato il
follow-up. La dismenorrea, la dispareunia ed il dolore pelvico cronico hanno dimostrato una
diminuzione statisticamente significativa già dopo il primo mese di terapia (p<0.01), con un effetto
persistente per 6 mesi. L‟unico effetto collaterale riferito è stato lo spotting durante il primo mese di
applicazione in due casi. In un solo caso la IUS è stata rimossa e riposizionata successivamente
dopo 2 mesi a causa della sua dislocazione. Questi risultati dimostrano che questo sistema
intrauterino rilasciante danazolo, rappresenta un trattamento efficace e conservativo per il
miglioramento di tutti i sintomi dolorosi associati all‟endometriosi e per il controllo della
menorragia associata all‟adenomiosi.
Danazolo vaginale
La somministrazione vaginale di danazolo, attraverso l‟utilizzo di un anello vaginale, è stata
testata con risultati incoraggianti in pazienti con endometriosi profonda (9). Inoltre, la
somministrazione di un gel per via vaginale, contenente danazolo (100 mg/die in 0,2 ml) per 4 mesi,
ha effettivamente ridotto la dismenorrea ed il dolore pelvico associato all‟endometriosi in 24 donne
(10). In uno studio prospettico eseguito presso la nostra clinica, è stata dimostrata l‟efficacia nella
somministrazione di danazolo per via vaginale, nel trattamento di donne affette da endometriosi
profonda ricorrente. In 21 pazienti affette da endometriosi profonda, dopo aver eseguito il
trattamento laparoscopico, è stata somministrata una dose di 200 mg die di danazolo in cpr per via
vaginale per 12 mesi, ed è stato valutato dopo tre e sei mesi il loro stato di benessere attraverso una
scala visiva per il dolore, una valutazione ultrasonografica e il profilo ematochimico completo.La
dismenorrea, la dispareunia ed il dolore pelvico cronico sono diminuiti significatamene dopo già tre
mesi di terapia (p<0.01) e sono scomparsi dopo sei mesi di trattamento (p<0.01) senza alterazione
nei parametri metabolici e trombofilici e con pochi effetti collaterali locali riferiti. Inoltre grazie allo
studio ultrasonografico con sonda transvaginale e transrettale è stata dimostrata anche una
diminuzione nel volume dei noduli presenti nel setto retto-vaginale (11). In conclusione, la
somministrazione locale di danazolo, sia intrauterino che vaginale, ha dimostrato di essere un
trattamento efficace e conservativo nella dismenorrea, nel dolore pelvico cronico e nella dispareunia
associate all‟adenomiosi ed alla endometriosi profonda. Non da meno, la somministrazione
intrauterina di Levonorgestrel ha dimostrato una buona efficacia, effetti collaterali limitati e una
buona compliance per la paziente nel trattamento a lungo termine per endometriosi. Infine, come
vantaggi addizionali, LNG-IUS non determina ipoestrogenismo, divenendo il trattamento di prima
scelta nei casi di dolore pelvico cronico associati all‟endometriosi in donne che non desiderano una
gravidanza.
Gli inibitori dell’aromatasi
Nelle donne affette da endometriosi esistono altre due importanti fonti estrogeniche: il
tessuto periferico e le cellule endometriosiche. I tessuti periferici come il tessuto adiposo ed i
fibroblasti cutanei hanno la capacità di convertire gli androgeni in quantità significative di estrogeni
(12). Inoltre, grandi quantità di estrogeni possono essere prodotte localmente all‟interno dell‟
endometrio ectopico con un meccanismo apocrino (13) attraverso l‟espressione dell‟enzima
aromatasi. Questo enzima, non espresso nell‟endometrio normale, è stimolato dalle prostaglandine
E2 (PGE2); la risultante produzione estrogenica stimola a sua volta la produzione di prostaglandine
E2, facendo aumentare ancora di più il livello estrogenico. Questo enzima rappresenta quindi un
evidente obiettivo terapeutico, e gli inibitori dell‟aromatasi sono stati testati in topi affetti da
endometriosi, con buoni successi (13). Inoltre sono stati pubblicati tre case reports sull‟argomento:
l‟utilizzo di anastrazolo in una donna in post-menopausa affetta da endometriosi severa (14);
l‟utilizzo di letrozolo in una paziente di 31 anni ovariectomizzata per endometriosi ricorrente (15);
l‟utilizzo di letrozolo in una paziente in post-menopausa affetta da endometrioma pelvico ricorrente
(16). Tuttavia, la possibile perdita ossea enfatizza la necessità di porre attenzione nell‟utilizzo di
questa classe di farmaci e rinforza la necessità di eseguire studi clinici più ampi per determinare la
loro efficacia e sicurezza.
Conclusioni
Negli ultimi anni, la ricerca rivolta a chiarire i meccanismi dell‟ endometriosi, ha sviluppo
nuovi trattamenti medici, ed infatti, sono state studiati non solo nuovi farmaci, ma anche nuove vie
di somministrazione per gli ormoni. La somministrazione intrauterina e/o vaginale di progestinici,
quali il levonorgestrel ed il danazolo, sembra rispondere ad alcuni problemi relativi al trattamento
dell‟endometriosi per lunga durata in termini di efficacia e tollerabilità.
Il trattamento medico dell‟ endometriosi è significativamente influenzato dalla poca
tollerabilità e dai numerosi effetti collaterali sistemici. Infatti, sebbene esista già un ampio spettro di
terapie mediche, la scelta terapeutica dipende dalla preferenza della paziente dopo una appropriata
informazione riguardo i rischi, gli effetti collaterali ed i costi.
Bibliografia
1
Maruo T, Laoag-Fernandez JB, Pakarinen P, Murakoshi H, Spitz IM, Johansson E. Effects of
the levonorgestrel-releasing intrauterine system on proliferation and apoptosis in the
endometrium. Hum Reprod 2001;16:2103-8.
2
Lockhat FB, Emembolu JO, Konje JC. The efficacy, side-effects and continuation rates in
women with symptomatic endometriosis undergoing treatment with an intra-uterine
administered progestogen (levonorgestrel): a 3 year follow-up. Hum Reprod 2005;20:789-93.
3
Petta CA, Ferriani RA, Abrao MS, Hassan D, Rosa E Silva JC, Podgaec S, Bahamondes L.
Randomized clinical trial of a levonorgestrel-releasing intrauterine system and a depot GnRH
analogue for the treatment of chronic pelvic pain in women with endometriosis. Hum Reprod
2005;20:1993-8.
4
Fong YF, Singh K. Medical treatment of a grossly enlarged adenomyotic uterus with the
levonorgestrel-releasing intrauterine system. Contraception 1999;60:173-5.
5
Fedele L, Bianchi S, Raffaelli R, Portuese A, Dorta M. Treatment of adenomyosis-associated
menorrhagia with a levonorgestrel-releasing intrauterine device. Fertil Steril 1997;68:426-9.
6
Critchley HOD., Wang H, Kelly RW, Gebbie AE, Glasier AF. Progestin receptor isoforms and
prostaglandin dehydrogenase in the endometrium of women using a levonorgestrel-releasing
intrauterine system. Hum Reprod 1998;13:1210–17.
7
Igarashi M, Abe Y, Fukuda M, Ando A, Miyasaka M, Yoshida M, Shawki OA. Novel
conservative medical therapy for uterine adenomyosis with a danazol-loaded intrauterine
device. Fertil Steril 2000;74:412-13.
8
Cobellis L, Razzi S, Fava A, Severi FM, Igarashi M, Petraglia F. A danazol-loaded
intrauterine device decreases dysmenorrhea, pelvic pain, and dyspareunia associated with
endometriosis. Fertil Steril. 2004;82:239-40.
9
Igarashi M, Iizuka M, Abe Y, Ibuki. Novel vaginal danazol ring therapy for pelvic
endometriosis, in particular deeply infiltrating endometriosis. Hum Reprod 1998;13:1952-56.
10 Janicki TI, Dmowsky WP. Intravaginal danazol significantly reduces chronic pelvic pain in
women with endometriosis. Supplement to the Journal of the Society for Gynecologic
Investigation (SGI) 2004 Annual Meeting, abs n. 266.
11 Razzi S, Luisi S, Calonaci F, Altomare A, Bocchi C, Petraglia F. Efficacy of vaginal danazol
treatment in women with recurrent deeply infiltrating endometriosis. Fertil Steril 2007;
88:789-94.
12 Bulin SE. Aromatase in aging women. Seminars in Reproductive Endocrinology 1999; 17:
349–58.
13 Bulun SE, Zeitoun KM, Takayama K & Sasano H. Molecular basis for treating endometriosis
with aromatase inhibitors. Human Reproduction Update 2000; 6: 413–18.
14 Takayama K, Zeitoun K, Gunby RT, Sasano H, Carr BR, Bulun SE. Treatment of severe
postmenopausal endometriosis with an aromatase inhibitor. Fertil Steril. 1998;69:709-13.
15 Razzi S, Fava A, Sartini A, De Simone S, Cobellis L, Petraglia F. Treatment of severe
recurrent endometriosis with an aromatase inhibitor in a young ovariectomised woman.
BJOG. 2004; 111:182-84
16 Fatemi HM, Al-Turki HA, Papanikolaou EG, Kosmas L, De Sutter P, Devroey P. Successful
treatment of an aggressive recurrent post-menopausal endometriosis with an aromatase
inhibitor. Reprod Biomed Online. 2005;11:455-57
IL SANGUINAMENTO UTERINO ANOMALO
Loverro G, Caringella A.M.
Dipartimento Ginecologia, Ostetricia e Neonatologia
Università degli Studi Bari
Introduzione
Il sanguinamento uterino anomalo (in inglese AUB, abnormal uterine bleeding)
rappresenta , in una donna che per altri versi gode di buona salute, una grave
limitazione in quanto pur non essendo definitivamente invalidante, tuttavia
influenza pesantemente la sfera della salute, oltre che alterare ogni tipo di rapporto
personale e sociale. Donne con AUB, oltre che ricorrere all’utilizzo di frequenti
consultazioni, con notevole impegno delle risorse del SSN, sono costrette ad
assentarsi dal lavoro molto frequentemente, con notevoli ricadute economiche .
Queste donne hanno spesso uno stato di salute significativamente più cagionevole,
pur a confronto di una scarsa propensione dei medici di base ad individuare donne
che necessitano terapia.
Il ciclo mestruale normale
Fondamentale, prima dell’inquadramento clinico dell’AUB, è la definizione della
normalità della mestruazione, onde stabilire il sottile limite al di là del quale la
donna si deve preoccupare.
Il problema è tanto antico e veniva affrontato già nel testo medico Hindu Ayurveda
(5000 a.C.) dove la quantità definita normale era definita come quella contenuta in
quattro ‘Anjalis’ (cavo di due mani congiunte).
Nonostante la grande mole di studi di popolazione, non esistono esatte definizioni
della normalità.
Classicamente, un ciclo mestruale veniva definito normale allorché aveva una durata
di 4-6 giorni, con una perdita ematica media di circa 30 - 80 mL, ad intervalli non
inferiori a 32 giorni, senza alcuna interferenza sulla attività giornaliera.
Secondo recenti dati, un ciclo si può definire normale allorché le variazioni dei
quattro parametri fondamentali (regolarità, durata del flusso, frequenza, volume di
sangue perso) oscillano tra il 5° ed il 95° degli standard derivati dagli studi sulla
qualità del ciclo mestruale (Fig 1)
Figura 1: parametri di normali delle mestruazioni
Parametri di Normalità delle mestruazioni
1. Regolarità
2. Durata del Flusso
3. Frequenza
4. Volume
Regolare
Variazione + 2- 20
Irregolare
Variazione + 2 – 20
Assente
……
Prolungato
>8
Normale
4,5 – 8
Raccorciato
< 4,5
Frequente
< 24
Normale
24 – 38
Infrequente
> 38
Abbondante
> 80
Normale
5 – 80
Leggero
< 5
Il problema delle perdite uterine anormali
L’adozione di una definizione universalmente accettata dei problemi correlati alle
perdite uterine anormali rappresenta un problema ancora aperto. Per anni nelle
scuole ginecologiche si è insegnato la differenza tra i vari diversi termini
(Menorragia, Metrorragia, Polimenorrea, Perdita ematica intermestruale, Perdita
ematica postcoitale, Perdita
Dysfunctional uterine bleeding.
ematica
postmenopausale,
Menometrorragia,
Questa varietà di definizioni è stata definita dal alcuni autori come una “menstrual
confusion”, in quanto molti termini infatti sono di origine greca o latina, sono mal
definiti e possono avere un significato differente in diverse parti del mondo. La
situazione diventa ancora più confusionale quando vengono utilizzati termini come
‘dysfunctional uterine bleeding’ (DUB).
Gran parte degli autori sono oggi d’accordo nell’abbandonare queste terminologie,
in quanto il loro utilizzo rende difficile la comunicazione dei dati scientifici e rende
impossibile l’attuazione di trials clinici internazionali. Pertanto questi termini devono
essere sostituiti da semplici termini descrittivi che chiariscano le modalità delle
perdite uterine, tenendo della regolarità del ciclo, della frequenza delle
mestruazioni, del volume ed della durata del flusso mestruale (vedi parametri di
normalità prima definiti).
Idealmente, questi termini devono essere comprensibili dalla gente comune e
devono essere traducibili in altre lingue.
Tutti questi disturbi devono essere classificati sotto il termine di “abnormal uterine
bleeding”, intendendo per essa tutte quelle alterazioni mestruali, sotto forma di
segni o sintomi, che originano dal corpo uterino.
Al contrario, segni o sintomi di irregolarità mestruali che originano da lesioni al di
fuori del corpo uterino (e.g., cervice, vagina) o in corso di gravidanza non devono
essere contrassegnati con questo termine, ma sotto il nome di “abnormal
reproductive tract bleeding”.
Per quanto concerne i metodi utilizzati per la quantificazione del sangue mestruale,
in caso di sospetto AUB, la discussione si può definire ancora in fase propositiva.
Tali metodi dovrebbero essere sganciati dalla estrema soggettività e resi più
obiettivi come proposto recentemente (E Confino: Abnormal uterine bleeding, a
new terminology is needed Fertility and Sterility. 87, 479-480, 2007)
Secondo queste proposte si dovrebbe costituire uno score in base ad una formula in
cui ad ogni sintomo viene attribuito un numero (B entità della metrorragia
quantificata da -2 a + 2, D durata del ciclo da -1 a + 2, F frequenza identifica il
numero di cicli in 1 anno, A anemia 1 anemia lieve e 2 anemia grave, C in caso di
presenza di coaguli, M se presente un mioma).
Indubbiamente l’uso della formula eliminerebbe la difficoltà di comunicazione
derivante dalle varie terminologie ed aumenterebbe la riproducibilità dei dati clinici.
Si resta in attesa delle opzioni del mondo scientifico internazionale e di
comprendere se l’attuale formula narrativa potrà essere sostituita da questo score.
PERIODO PERIMENOPAUSALE e CISTI OVARICHE
F.M. Severi, C. Boni, C. Ferrata, C. Cancemi, A. Imperatore, C. Bocchi, F. Petraglia.
Clinica Ostetrica e Ginecologica
Dipartimento di Pediatria, Ostetricia e Medicina della Riproduzione
Università degli Studi di Siena
Perimenopausa e modificazioni ovariche
Secondo la definizione dell‟OMS, si definisce periodo perimenopausale quello che precede
immediatamente la menopausa, quando elementi endocrinologici, biologici e clinici cominciano ad
indirizzare alla menopausa, continuando per almeno un anno dopo di essa. La menopausa è definita
come la permanente cessazione delle mestruazioni, consistendo nella perdita dell‟attività follicolare
ovarica. Durante la menopausa l‟epitelio germinale mostra un elevato numero di cisti e cripte
circondate da uno strato di cellule metaplasiche. In questa fase di modificazione è frequente il
rilevamento di lesioni cistiche a carico dell‟ovaio, in particolare la cisti sierosa semplice, che
rappresenta la formazione più tipica delle cisti benigne ed è caratterizzata da una formazione
uniloculare, a contenuto fluido, a pareti lisce e regolari, prive di papille. Tali cisti, specialmente in
premenopausa, sono spesso cisti di tipo disfunzionale, che si riassorbono nel tempo, da distinguere
pertanto dalle più preoccupanti cisti organiche.
L‟accuratezza diagnostica degli ultrasuoni nel differenziare le cisti ovariche “funzionali” da quelle
“organiche” è elevatissima, anche grazie alla possibilità che offrono di monitorare nel tempo la
lesione e di studiarla nei minimi particolari con un approccio tridimensionale.
In premenopausa è importante pertanto valutare la cisti sierosa a distanza, in quanto molte
formazioni cistiche non si evidenziano più ai controlli successivi.
Molto complessa risulta, invece, la diagnosi differenziale tra neoformazioni benigne e maligne ed in
particolar modo l‟identificazione dei tumori ovarici borderline. L‟accuratezza diagnostica
dell‟ecografia è in questo caso pesantemente condizionata da ecostruttura ed ecoarchitettura della
massa e, in modo particolare, dal rapporto tra componente liquida e solida. A questo scopo
l‟utilizzazione di scores “ecomorfologici” ha reso l‟interpretazione delle lesioni ovariche meno
soggettiva, rendendo anche “meno semplicistica” e più precisa la descrizione delle masse
complesse.
Ecografia e tumefazioni ovariche
L‟approccio ultrasonografico applicato allo studio dei campi annessiali è divenuto irrinunciabile
poiché:
1) permette di oggettivare la reale presenza di una massa;
2) ne definisce origine, dimensioni e caratteri ecostrutturali, permettendone spesso una diagnosi
tipologica;
3) nei casi in cui non è possibile una diagnosi di certezza (l‟accuratezza dell‟ecografia nei confronti
della diagnosi tipologica delle masse ovariche varia tra il 68 ed il 91%), fornisce comunque
informazioni fondamentali per un corretto iter diagnostico/terapeutico.
L‟ecografia transaddominale, per anni primo step diagnostico nello studio della patologia
ginecologica, è divenuta oggi, eseguita a vescica vuota, approccio di seconda istanza,
particolarmente utile in presenza di voluminose masse pelviche o quando se ne sospetti la malignità,
poiché rende possibile una visione panoramica della pelvi femminile, permettendo di valutare,
quando necessario, anche strutture ed organi extrapelvici (fegato, reni).
L‟ecografia transvaginale rappresenta l‟approccio metodologico più corretto nello studio di una
massa annessiale, poiché fase di approfondimento diagnostico che garantisce l‟acquisizione di
immagini maggiormente definite e dotate di una più semplice ed accurata chiave di lettura.
L‟indagine dovrebbe essere sempre completata con la quantificazione color/power Doppler della
circolazione intra- e peri-lesionale delle tumefazioni rilevate: questo avviene tramite la
determinazione degli indici qualitativi di flusso PI (Pulsatility Index) ed RI (Resistance Index) e lo
studio ecoarchitettonico vascolare finalizzato alla valutazione morfologica ed alla distribuzione
topografica dei vasi.
I reperti ecografici che caratterizzano le tumefazioni ovariche sono molteplici e spesso non specifici
di un determinato quadro patologico: sebbene l‟identificazione ecografica di una massa annessiale
possa di per sé sembrare agevole, non sempre è possibile raggiungere una diagnosi tipologica
specifica. A questo proposito deve essere sottolineato come l‟interpretazione dei rilievi ecografici
non può mai prescindere da una dettagliata conoscenza del quadro clinico.
Lo studio ultrasonografico dei genitali interni femminili permette di determinare:
1.
la localizzazione nella pelvi di una tumefazione, i rapporti di questa con il parenchima
ovarico e con gli organi limitrofi;
2.
la morfologia, le dimensioni, l‟ecostruttura ed i margini della tumefazione;
3.
la presenza/quantità di vascolarizzazione, l‟architettura e la morfologia vascolare, la
qualificazione del flusso (power/color Doppler ed indici velocimetrici);
la presenza di falda fluida nel Douglas o di ascite..
Studi finalizzati alla diagnosi precoce del cancro ovarico hanno associato all‟ecografia tradizionale
il color/power Doppler al fine di poter individuare alcune precoci modificazioni vascolari che
precedono le modificazioni dell‟architettura ovarica.
Il razionale per l‟uso del Doppler è basato sull‟osservazione che durante la fase di crescita rapida il
tumore si diffonde mediante la creazione di vasi neoformati caratterizzati da una scarsa componente
muscolare liscia (neoangiogenesi): la resistenza al flusso sanguigno in questi vasi neoangiogenetici
è più bassa rispetto a quella che si riscontra all‟interno di vasi normoconformati. Lo studio
color/power Doppler della vascolarizzazione di una massa annessiale permette inoltre di
visualizzare anche vasi di piccolo calibro, caratterizzati da flusso lento, definendone aspetto,
distribuzione ed architettura. A questo proposito vanno sempre tenute presenti quelle modificazioni
ovariche fisiologiche (es. corpo luteo, corpo luteo emorragico), che per propria natura hanno le
stesse caratteristiche Doppler delle neoplasie (vasi neoangiogenetici con flusso a bassa resistenza).
L'approccio ecografico tridimensionale rappresenta un‟evoluzione tecnologica della tradizionale
ecografia bidimensionale: le immagini tridimensionali forniscono una ricostruzione più “realistica”
delle strutture esaminate nei 3 piani dello spazio permettendo all‟operatore di visualizzare sul
monitor l‟area di interesse sui tre piani di scansione (longitudinale, coronale e trasversale)
contemporaneamente. Nello studio delle tumefazioni ovariche complesse l'ecografia
tridimensionale ha permesso una più dettagliata analisi della superficie interna delle cisti, dei
margini e della vascolarizzazione, migliorando l'accuratezza diagnostica degli ultrasuoni nella
valutazione del rischio di malignità, particolarmente nei confronti delle tumefazioni di piccole
dimensioni.
Dal punto di vista della semeiologia ecografica esistono tre tipi di lesioni ovariche: cistiche, solide e
complesse.
Tumefazioni ovariche cistiche
a) Anecogene
I più comuni aspetti di una massa ovarica cistica sono caratterizzati da un aspetto ovalare,
bordi netti e regolari e contenuto anecogeno o scarsamente ecogeno. Il diametro è variabile da un
range di 2-10 cm. Anche le cisti funzionali follicolari o luteiniche ed alcuni tipi di cistoadenoma
possono essere classificati in questa categoria. Il rischio di malignità è minimo.
Forme più complesse sono generalmente caratterizzate dalla presenza di setti spessi, di
grossi setti che si ispessiscono nell‟area di confluenza. Queste lesioni cistiche sono spesso
espressione di una patologia organica, ma raramente sono maligne.
Considerando poi le forme più complesse, esistono forme miste, prevalentemente cistiche,
ma con una componente solida, correlate a un buon rischio di malignità, di cui gli ultrasuoni
rappresentano l‟unico mezzo diagnostico.
Sono state descritte due tipi di vegetazioni: piccole proiezioni papillifere (originano dalla capsula o
dai setti, con una ben definita zona di impianto), escrescenze papillifere più complesse (con
digitazioni multiple e complesse, frequentemente espressione di adenocarcinoma). La parete esterna
della vegetazione endocistica non è valutabile, se non in presenza di ascite. L‟importanza di una
corretta individuazione delle papille risiede nel fatto che il criterio intrinseco nella stima del rischio
di malignità consiste nella valutazione della percentuale di componenti solide interne.
b) Ipoecogene
Le forme semplici, di solito, sono benigne, di origine mucinosa o endometriale, caratterizzate da
bordi ben definiti, contenuto omogeneo, a volte con pareti spesse come nell‟endometrioma ovarico.
In alcuni casi la struttura del contenuto appare non uniformemente distribuita, come
nell‟endometrioma, o nel cistoadenoma mucinoso.
Le forme complesse possono presentare setti e possono avere due principali aspetti: una
componente fluida ipoecogena caratterizzata da setti multipli e spessi (cistoadenoma mucinoso) e da
una componente ipoecogena con setti spessi che confluiscono.
Le forme complesse con le proiezioni papillifere sono spesso espressione di un origine maligna
della massa cistica.
Tumefazioni ovariche solide
Le masse ovariche solide generalmente sono caratterizzate dalla presenza di un‟ecostruttura interna
ecogena. I tumori solidi ovarici possono essere rappresentati da lesioni di natura benigna (fibromi
ovarici, tecomi e fibrotecomi), da tumori ovarici primitivi maligni (adenocarcinomi e tumori ovarici
indifferenziati) e da localizzazioni secondarie quali le metastasi dal tratto gastro-intestinale o da
linfomi. La diagnosi differenziale con i fibromi uterini peduncolati o intralegamentari può essere
difficoltosa. Una diagnosi differenziale con i disordini tubarici, le linfoadenopatie, il rene ectopico a
localizzazione pelvica e le masse ad origine intestinale può talvolta essere necessaria.
Tumefazioni ovariche complesse
Una massa pelvica è definita “complessa” quando contiene sia la componente solida che quella
liquida. I tumori ovarici che contengono principalmente quella solida o setti irregolari, possono
essere classificati in questa categoria. In generale, in caso di tumore epiteliale, più solida e
irregolare è la morfologia interna, più facilmente questo tipo di tumore può essere maligno. La più
comune massa complessa è rappresentata dalla cisti dermoide (teratoma cistico maturo), ma anche il
tumore epiteliale ovarico (cistoadenoma, cistoadenocarcinoma). A volte, anche l‟endometrioma può
presentare un aspetto complesso. L‟ecostruttura complessa è dovuta all‟estrema variabilità delle
componenti della massa. Come nel caso delle cisti dermoidi, inclusi nella massa, posso essere
presenti vari tessuti (grasso, denti, capelli, ossa e zone calcifiche) dando luogo ad aspetti ecografici
molto vari. In conclusione gli elementi morfologici delle lesioni ovariche ottenute con gli ultrasuoni
sono importanti per escludere una malignità ovarica. Questa opportunità è facilitata dall‟uso
dell‟ecografia 3D transvaginale. Il potere dell‟eco-doppler 3D può essere un‟informazione
aggiuntiva per supportare la diagnosi differenziale della discutibile lesione ovarica.
Il collagene nella fisiopatologia del prolasso genitale
Relatore: Dott.Federico Spekzini, Dirigente Medico
c/o Unità operativa Ostetricia e Ginecologia Ospedale san Gerardo, Monza
Clinica Universitaria Università degli studi di Milano - Bicocca
Il collagene è la proteina più abbondante contenuta nel corpo umano, infatti
corrisponde al 30% delle proteine totali. E‟ sintetizzato dai fibroblasti. E‟ una
proteina fibrosa che garantisce la resistenza alla tensione alla cute, ai tendini e
all‟osso. Ne sono stati identificati 19 tipi e il tipo I e III risultano essere i
componenti principali del tessuto epiteliale.1
Il tessuto connettivo contiene fibre collagene, fibre elastiche e proteoglicani
che sono i principali costituenti della matrice extracellulare.2 Le fibre collagene
sono i principali costituenti della struttura che ha la funzione primaria di dare
resistenza allo stress meccanico e ad altre forze di tensione. Tra le forme di
collagene vanno ricordate le fibre di tipo I, di tipo II e quelle di tipo III, che
sono responsabili delle resistenza alla trazione e alle forze meccaniche esterne.
Il tipo IV non è strutturato in fibre ed ha la funzione di garantire un supporto
per una maggiore flessibilità della membrana basale.3 Il tipo V e VI hanno la
funzione di connettere gli elementi della matrice alle altre componenti
tissutali.4 In particolare il collagene di tipo V sembra essere coinvolto nella
fibrillogenesi e nel controllo delle dimensioni delle fibre che costituiscono
l‟arco tendineo della fascia pelvica.5
Ciascuna delle componenti di collagene fibrillare di tipo I, III e V è stato
descritto all‟interno della parete vaginale ed i tessuti di supporto sono
considerati essere i determinanti principali della resistenza del tessuto.6
Lo spessore e la lunghezza delle fibre dipendono dal tipo di collagene.7
Il collagene di tipo I forma grosse fibre ad elevata resistenza meccanica,
caratteristica tipica di legamenti, tendini, cute e strutture ossee.
Il collagene III, costituito da fibre più sottili a ridotta resistenza è predominante
in tessuti sottoposti a stress periodici che richiedono alta flessibilità e
distensibilità . A livello dell‟apparato genitale il collagene III è il sottotipo
predominante nell‟mucosa vaginale, nella fascia endopelvica8 e nei legamenti
uterosacrali9.
Il collagene di tipo V costituisce quantitativamente la parte minore e forma
fibre piccole e di scarsa resistenza meccanica. Questo sottotipo è importante nel
corso dei processi cicatriziali al fine di direzionare la fibrillogenesi10. Il ruolo
del collagene di tipo V nella vagina e nei tessuti di supporto non è ancora
chiaramente stato delucidato.
Il collagene di tipo I copolimerizza con il collagene III e V a formare fibrille di
diverso diametro, che influenzano le caratteristiche biomeccaniche di un
1
Jackson SR, 1996
Scott JE, 1988
3
Bailey AJ, 2001
4
Van Der Rest, 1991
5
Moalli PA et al., 2004
6
Ottani V, 2001
7
Nimni ME, 1983
8
Moalli PA, 2005
9
Gabriel B, 2005
10
Birk DE, 2001
2
determinato tessuto.11 Un aumento in percentuale di collagene III e V
diminuisce la resistenza meccanica di un tessuto connettivo, diminuendo il
calibro delle fibre che lo compongono.12
Il rapporto fra collagene I e collagene III+V è un indicatore della resistenza
tensile di un tessuto.13,14,15,16
Il ruolo del collagene nella fisiopatologia del pavimento pelvico è stato
parzialmente studiato, con risultati inoltre spesso contradditori.
Moalli e collaboratori, hanno misurato il rapporto fra sottotipi di collagene
nella vagina e nei tessuti di supporto. I risultati dimostrano che il collagene III
è il sottotipo prevalente nell‟ arco tendineo della fascia pelvica e che vi è una
diminuzione nel rapporto fra collagene I e III+V in pazienti in menopausa
senza terapia sostitutiva ormonale. L‟introduzione della terapia ormonale
riequilibrava il rapporto riportandolo a valori precedenti alla menopausa.
Questi dati suggeriscono che lo status ormonale condizioni le proprietà
biomeccaniche dei tessuti di supporto della vagina.17 E‟ stato infatti dimostrato
da alcuni studi che i recettori di estrogeni e androgeni sono localizzati a livello
dei fibroblasti della cute e che molte cellule sono suscettibili a questi stimoli
ormonali.18 La presenza di recettori per gli estrogeni nel tratto urinario basso,
nella muscolatura del pavimento pelvico e attorno ai legamenti pelvici dimostra
la sensibilità di questi tessuti all‟attività ormonale.19
In uno studio di Alperin è stato riscontrato che il collagene di tipo III è
aumentato nello strato sottoepiteliale e muscolare della vagina in pazienti
affette da prolasso, rispetto a pazienti non portatrici di prolasso,
indipendentemente da età e parità.20
Altri studi hanno riportato un aumento di collagene di tipo III nei legamenti
uterosacrali e cardinali in pazienti affette da prolasso genitale sintomatico.21
La quantità di collagene nella cute si modifica con l‟età, diminuendo
approssimativamente dell‟1 % ogni anno.22 Nel primo anno dopo la menopausa
questa perdita è maggiore, raggiunge il 30% nei primi cinque anni, ma può
essere reversibile o per lo meno prevenuta, dall‟utilizzo della terapia ormonale
sostitutiva.23 E‟ stato dimostrato che c‟è un‟associazione tra il collagene della
cute e quello dei tessuti urogenitali.24
In uno studio Barbiero et al., hanno fatto un‟analisi qualitativa del collagene di
tipo I nel parametrio di pazienti con e senza prolasso uterino ed è emerso che
c‟erano importanti alterazioni nelle fibre collagene. Nelle pazienti con prolasso
uterino, il tessuto connettivo del parametrio era ricco di fibre collagene ma
queste erano più corte, più sottili e arrangiate in maniera disordinata, rispetto a
quelle delle pazienti senza prolasso.25
11
Wenstrup RJ, 2004
Niyibizi C, 2000
13
Fleischmajer R, 1990
14
Klinge U, 2002
15
Zheng H, 2002
16
Eriksen HA, 2002;
17
Moalli PA et al., 2004
18
Stumpf WE, 1974
19
Smith P, 1990
20
Moalli PA, Alperin, 2005
21
Ewies AA, 2003
22
Schuster S, 1975
23
Brincat M, 1987
24
Versi E, 1988
25
Barbiero EC, Ferriera Sartori MG, 2003
12
Diversi studi hanno dimostrato un aumento dell‟espressione del collagene di
tipo III in pazienti con prolasso, nei tessuti di supporto della vagina26.
Gabriel et al. hanno confrontato biopsie dei legamenti uterosacrali di pazienti
con e senza prolasso, ed è emerso un aumento dell‟espressione del collagene di
tipo III nelle pazienti con prolasso.27
Ewies et al. hanno riscontrato un aumento dell‟espressione del collagene di tipo
III nei legamenti cardinali di pazienti con prolasso.28
Da quanto riportato, appare certo che la composizione delle strutture di
sostegno subisca dei processi di trasformazione nel corso della vita, in seguito
ad eventi specifici quali la gravidanza ed il parto o la menopausa.
26
Moalli A, 2005
Gabriel B, 2005
28
Ewies AA, 2003
27