CONDUTTIMETRIA
La conduttimetria studia la conducibilità delle soluzioni.
Le applicazioni analitiche della conduttimetria si basano sul fatto che la conducibilità di una
soluzione elettrolitica dipende dalla concentrazione delle specie ioniche in essa presenti.
Per un qualsiasi conduttore (sia esso un metallo o una soluzione
elettrolitica), la conducibilità o conduttanza (simbolo ) e' definita
come l'inverso della sua resistenza R (unità di misura Ohm ) :
Il significato fisico di questa grandezza è chiaro: la conducibilità di
un conduttore è una misura della sua capacità di farsi attraversare
da una corrente elettrica.
1
R
L'unità di misura della conducibilità è il Siemens (simbolo S): dalla definizione su scritta si
deduce che 1 S = 1 -1. Spesso si usano i sottomultipli del Siemens (mS o S).
La conducibilità di un conduttore dipende sia dalla sua natura (cioè se si tratta di metallo
es. Cu o Al o di una soluzione ad es. di NaCl) che dalle sue caratteristiche geometriche,
cioè in ultima analisi, dalla sua forma e dimensione.
Questa duplice dipendenza può essere espressa in forma
esplicita; indicando con S la sezione e con l la lunghezza di un
conduttore, allora la sua conducibilità è data da:
S
l
In questa relazione, il termine S/ l tiene conto della geometria, mentre il termine
dipende solo dalla natura del conduttore e si chiama conducibilità specifica
Le dimensioni di
si deducono dall'espressione appena scritta: se S è espressa in cm2 e
l in cm, allora risulta espressa in S/cm
CONDUTTORI
In un conduttore metallico la corrente è data dal movimento di e-: si parla di
conduttori elettronici (in questa sede non ci interessano).
In una soluzione contenente uno o più elettroliti disciolti (es. sali come NaCl,
MgSO4 ecc.) sono presenti ioni. Se alla soluzione viene applicato un campo
elettrico, gli ioni si muovono sotto l'azione di tale campo (gli ioni positivi verso
l’elettrodo carico negativamente, gli ioni negativi verso l’elettrodo carico
positivamente). Essendo gli ioni particelle cariche, il loro movimento determina una
corrente elettrica. Tutti i conduttori elettrici in cui la corrente è data dal movimento di
ioni (e non di elettroni) vengono detti conduttori ionici o elettrolitici. La
conduttometria studia questi ultimi
FATTORI DA CUI DIPENDE LA CONDUCIBILITÀ
La conducibilità elettrica di una soluzione elettrolitica, (intesa in senso generico come
capacità di condurre la corrente per trasporto degli ioni in essa presenti) dipende da
diversi fattori quali:
Concentrazione degli ioni in soluzione. E' facile rendersi conto anche
intuitivamente che: con l'aumentare della concentrazione degli ioni, aumenta il
numero dei trasportatori di cariche per unità di volume e quindi la conducibilità
(Fig.1).
Gli elettroliti deboli, cioè quelle sostanze che si dissociano solo parzialmente:
presentano una concentrazione ionica effettiva in soluzione minore di quello che ci
si potrebbe aspettare sulla base della concentrazione molare dell'elettrolita; una
prima (e ovvia) conseguenza di ciò è che generalmente la conducibilità di un
elettrolita debole è minore di quella di un elettrolita forte, a parità di concentrazione.
(Fig.1).
La conducibilità non aumenta all’infinito con la concentrazione. Quando la libertà di
movimento degli ioni viene ridotta da un eccessivo affollamento, c'è da attendersi,
come conseguenza, una parallela diminuzione di conducibilità (Fig.2).
Fig.1
Fig.2
In prima approssimazione, la conducibilita' specifica dipende dalle concentrazioni ioniche.
Le carica ioniche. Uno ione Mg++ che ha due cariche condurrà
approssimativamente il doppio di uno ione Na+ che ha una carica sola.
la velocità di migrazione degli ioni in soluzione o mobilità dipende in modo
complesso dalle interazione ione – solvente
Inoltre, dipende anche dalla:
temperatura, pressione, viscosità del solvente, natura dielettrica del solvente.
CONDUCIBILITÀ EQUIVALENTE A DILUIZIONE INFINITA
La conducibilità equivalente a diluizione infinita ( ° ) individuale esprime la capacità di un
dato ione di muoversi sotto l'effetto di un campo elettrico in assenza di interazioni
con altre specie ioniche, indipendentemente dalla sua carica. Inoltre a diluizione
infinita anche gli elettroliti deboli sono completamente dissociati. In pratica ° è la pura e
semplice conducibilità di uno ione, indipendentemente da concentrazione, carica e grado
di dissociazione. Si misura in -1 cm2.
E’ possibile ricavare matematicamente le ° dei vari ioni, anche se qui non verrà fatto.
Conducibilità equivalenti limite di singoli ioni:
CATIONI
° (-1 cm2)
ANIONI
° (-1 cm2)
H+
349,82
OH-
198,50
K+
73,52
Br-
78,40
Na+
50,11
Cl-
76,34
NH4+
73,40
I-
76,80
Ag+
61,92
NO3-
71,44
Mg2+
53,1
CH3COO-
40,9
Da notare che gli ioni OH- e H+, grazie al legame a idrogeno, si muovono molto più
velocemente degli altri ioni.
LEGGE DI KOHLRAUSCH O "LEGGE DELLA INDIPENDENTE MIGRAZIONE IONICA"
Secondo questa legge ogni ione dà un contributo definito alla conducibilità totale
dell'elettrolita, indipendentemente dalla natura dell'altro ione; questa regolarità è
rigorosamente vera solo a diluizione infinita, quando cessa qualsiasi interazione ionica.
Λ0 di un sale può considerarsi dovuta alla somma di due termini, la conducibilità
equivalente limite del catione e dell'anione
Λ0 = λ0+ + λ0−
Per es:
λ°H+= 349,8 ;
λ°CH3COO-= 40,9
λ°CH3COOH= 349,8 + 40,9 = 390,7
METODI DI ANALISI CONDUTTOMETRICI
Gli strumenti per effettuare misure di conducibilità e titolazioni conduttimetriche sono
generalmente poco costosi e semplici; per questo le misure di conducibilità sono molto
impiegate nell’industria sia in laboratorio che sugli impianti per il controllo di processi. La
conducibilità di una soluzione elettrolitica, si misura con una cella conduttimetria
In pratica, si misura una porzione di
soluzione confinata tra due elettrodi
(generalmente di platino), di
superfice S e posti a distanza l
S
l
Lo strumento misura la conducibilità
. Note le caratteristiche
geometriche dell’elettrodo (il
rapporto S/l chiamato anche
costante di cella) si può ricavare .
S
l
Uno strumento (conduttimetro) fa
circolare una corrente alternata di
elevata frequenza fra gli elettrodi e
misura la conducibilità della
soluzione compresa fra gli elettrodi.
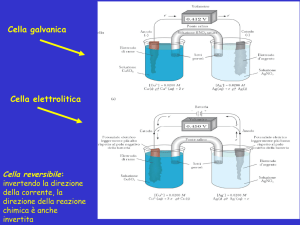
Celle conduttometriche
In linea di principio sono costituite da due
elettrodi cui viene applicata una tensione
alternata, che vengono immersi in soluzione. Il
tipo di maggior impiego, solitamente realizzato
in vetro, è schematizzato a fianco.
Il materiale costituente gli elettrodi è di solito
platino platinato (cioè rivestito di nero di platino),
ma vengono utilizzati anche il titanio e la grafite
vetrosa.Lo strato di platino, molto spugnoso,
permette di diminuire la cosiddetta resistenza di
contatto, aumentando di centinaia di volte la
superficie di contatto elettrodo-soluzione, senza
modificare le dimensioni della cella.
L’efficienza di una cella conduttimetrica è legata
quindi all’efficienza dello strato di platino. Deve essere evitato:
1. Depositi di sostanze grasse. Occorre lavare le celle con acetone o etanolo più volte
e risciacquare ripetutamente con acqua distillata. Non si deve assolutamente
tentare di pulire la superficie degli elettrodi con mezzi meccanici.
2. Incrostazioni di sali.
3. Distacco del nero di platino. Se succede occorre effettuare una nuova platinatura.
LE MISURE CONDUTTOMETRICHE SONO DI DUE TIPI:
a) misure dirette di conducibilità specifica (χ)
b) misure indirette (titolazioni).
a) misure dirette. Data la relazione già vista:
S
l
Si prende una soluzione di cui è nota . Si misura .
Si misura il rapporto S/l (costante di cella)
Si prende la soluzione di cui si vuole misurare . Si misura .
Attraverso la relazione sopra riportata e nota la costante di cella si determina
Le misure di sono importanti perché sono una misura del contenuto in
elettroliti (generici) presenti in una soluzione.
Con i moderni conduttimetri non è necessario determinare la costante di cella:
all’accensione dello strumento essi richiedono la taratura che viene eseguita con
soluzioni di KCl a titolo noto. Lo strumento calcola automaticamente il rapporto s/l e
fornisce le successive misure direttamente come .
Fra le applicazioni della conduttimetria diretta si puo' citare il controllo della purezza
dell'acqua, intesa come verifica dell'assenza di elettroliti disciolti: la conducibilita' specifica
dell'acqua ultrapura e' pari a 6 10-2 μS cm-1
Nella maggior parte delle acque naturali la conducibilità specifica è compresa tra un valore
di 100 e 1000
caso delle piogge ci si aspettano valori tanto più elevati quanto più grande è la
concentrazione delle specie presenti nell’aria che vengono portate in soluzione dalle
precipitazioni.
b) misure indirette (titolazioni).
Uno dei principali impieghi analitici della conduttimetria consiste nell’utilizzarla per
seguire il decorso di una titolazione.
Si misura la Variazione di conducibilità (, non in funzione della quantità di titolante. E’
un metodo applicabile solo se in corrispondenza del p.e. si ha una brusca variazione di
conducibilità. Ciò si verifica nelle reazioni acido base e in quelle di precipitazione.
E’ importante prestare una particolare attenzione a:
Mantenere la temperatura costante (per ogni °C la conducibilità aumenta dell’1-3%)
Utilizzare titolanti 50-100 volte più concentrati della sostanza in analisi e utilizzare
grossi volumi di soluzione da titolare (in modo da annullare l’effetto di diluizione,
limitando la variazione di conducibilità del campione).
Titolazioni acido forte – base forte (HCl con NaOH)
Ricordare:
H+ ha una mobilità 5 volte maggiore a
quella degli altri ioni (349,8 λ°)
OH- ha una mobilità 3 volte maggiore a
quella degli altri ioni (198 λ°)
Reazione: Na+OH- + H+Cl- → H2O + Na+ClL’elevata concentrazione iniziale di ioni H+ (provenienti da HCl) determina un’eletava
conducibilità iniziale.
Aggiungendo NaOH, gli ioni H+ vengono “catturati” dagli ioni OH- determinando un calo
drastico della conducibilità.
Continuando ad aggiungere NaOH, gli ioni OH- in eccesso vanno a far aumentare
nuovamente la conducibilità.
Specie
Na+
Cl-
OH-
H+
λ
Prima p.e.
↑
invariata
invariata
↓
↓ (λH+ >> λH+)
Dopo p.e.
↑
invariata
↑
invariata
Grafico risultante:
Titolazioni acido debole – base forte
Reazione:
a) CH3COOH ↔ H+ + CH3COOb) Na+OH- + CH3COOH → H2O + CH3COO- Na+
L’iniziale concentrazione di H+ è bassa, poiché deriva da un acido debolmente dissociato
e perciò la conducibilità è relativamente bassa
Le prime gocce di NaOH formano acetato il cui aumento di concentrazione fa retrocedere
la dissociazione (a). Gli H+ diminuiscono e così la conducibilità (tratto 1-2)
La successiva aggiunta di NaOH va a reagire con l’acido acetico (b) formando un sale
completamente dissociato (CH3COONa) che quindi va a dare un lieve aumento di
conducibilità. (tratto 2-3)
Quando tutto l’acido acetico è esaurito, gli ioni OH- in eccesso non vanno più a formare
acqua ma rimangono liberi determinando un brusco aumento di conducibilità. (tratto 3-4)
Altro esempio di titolazione è quella dei cloruri con AgNO3
Determinazione della conducibilità specifica di un’acqua
Questo parametro dipende dalle componenti ioniche dell’acqua e costituisce quindi una misura
indiretta del suo contenuto salino. La conducibilità dell'acqua piovana è quasi nulla ma essa cresce
man mano che l'acqua scorrendo nel terreno si arricchisce di sali e quindi di elettroliti forti come lo
ione cloruro e solfato di metalli alcalini e alcalino-terrosi.
Un improvviso aumento della conducibilità di acque profonde e superficiali può avere significato di
inquinamento da parte di liquami domestici o di scarichi industriali.
La determinazione della conducibilità specifica viene effettuata mediante i conduttometri che si
dimostrano particolarmente adatti sia per misure discontinue di laboratorio, sia per il controllo
continuo di impianti ove sia importante rilevare eventuali variazioni di composizione dell’acqua nel
tempo Questo parametro, che viene espresso in µS/cm, nella maggior parte delle acque naturali è
compreso tra 100 e 1000, ma non sono rare le acque che presentano valori esterni a questo
intervallo (l’acqua distillata per esempio ha un valore inferiore a 2).
La conducibilità specifica del campione in esame, espressa in µS/cm viene calcolata dalla
conducibilità letta dallo strumento previa conoscenza e verifica periodica della costante delle celle,
effettuata mediante l’uso di soluzioni di riferimento a conducibilità specifica nota.
REAGENTI:
. Soluzione di riferimento di KCl ( Potassio Cloruro) 0,1 N.
Introdurre 7,4365 g di cloruro di potassio essiccato in stufa a 105 °C per due ore, in un
matraccio tarato da 1000 ml, sciogliere con acqua distillata e portare a volume alla temperatura
di 25 °C.
PROCEDIMENTO:
Taratura del sistema di misura:
Lavare a lungo e accuratamente la cella conduttimetrica con la soluzione di riferimento di cloruro di
potassio scelta (nel mio caso quella 0,1 N);
Misurare il valore della conducibilità della soluzione di riferimento in µS/cm, operando alla
temperatura ambiente e confrontare il valore ottenuto con le apposite tabelle. Calcolare la costante
di cella:
k=/
dove è la conducibilità letta sullo strumento e è la conducibilità specifica del KCl alla
temperatura di lavoro ricavata dalle tabelle
Determinazione: Lavare accuratamente con acqua distillata la cella conduttimetrica, asciugarla ed
effettuare la misura sul campione posto in becher asciutto e pulito.
ESPRESSIONE DEI RISULTATI:
Per il campione d’acqua si ricava la conducibilità specifica:
=/k