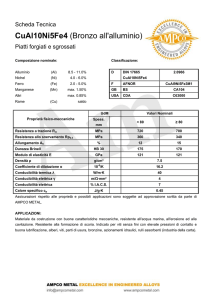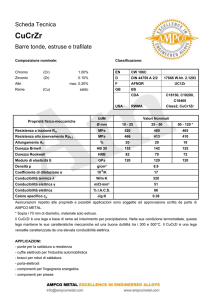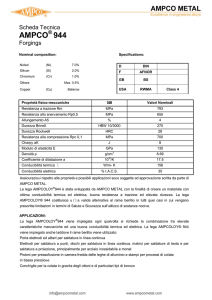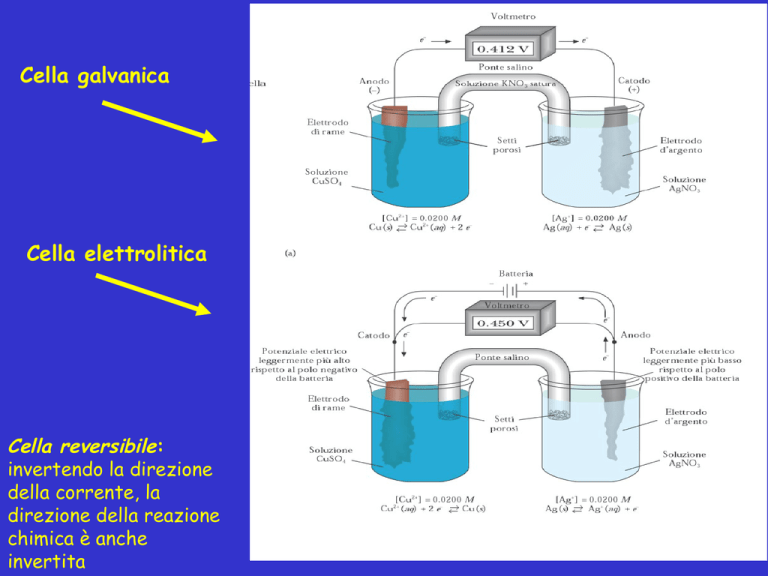
Cella galvanica
Cella elettrolitica
Cella reversibile:
invertendo la direzione
della corrente, la
direzione della reazione
chimica è anche
invertita
CONDUTTIMETRIA
Si basa sulla misura della conducibilità elettrica di una
soluzione elettrolitica.
La conducibilità (o conduttanza elettrica) Λ di una soluzione è
l’inverso della sua resistenza R :
1
Λ=
R
In base alla II legge di Ohm la resistenza dipende dalla
geometria (l e S) del conduttore:
l
R= ρ
S
1 S
Λ =
ρ l
ρ = resistività, in Ω • cm
l = lunghezza del conduttore, in cm
S = area della sezione, in cm2
1/ρ = χ = conduttività o conducibilità specifica
S
Λ = χ
l
Λ = χ k
Λ = conducibilità della soluzione, in S
χ = conducibilità specifica in S • cm-1
k = costante di cella, in cm
La conducibilità specifica χ dipende da:
2.
3.
4.
5.
concentrazione degli ioni in soluzione;
cariche ioniche;
velocità di migrazione degli ioni in soluzione;
temperatura.
Conducibilità equivalente Λe,: conducibilità di una soluzione in cui si
trova disciolto un equivalente di elettrolita, compreso interamente tra
i due elettrodi alla distanza di 1 cm
Λe=
χ
c
(S cm 2 /eq)
(1)
χ = conducibilità specifica
c = concentrazione dell’elettrolita in eq/cm3
Essa non dipende né dalla concentrazione né dalla carica degli ioni.
Dal momento che la misura diretta di Λe è molto laboriosa, in pratica si
misura χ e si calcola Λe mediante la (1).
La conducibilità equivalente tende ad un valore limite Λ0, detta
conducibilità equivalente a diluizione infinita, indipendente oltre che
dalla carica anche dalle interazioni tra gli ioni.
Legge di migrazione indipendente degli ioni o legge di Kohlrausch:
la conducibilità equivalente a diluizione infinita è uguale alla somma
delle conducibilità equivalenti limite dei singoli ioni:
λo= λo+ + λoλ0+ = conducibilità equivalente a diluizione infinita del catione;
λ0+ = conducibilità equivalente a diluizione infinita dell’anione
METODI DI MISURA DELLA CONDUTTIVITÀ
La misura della conduttività di una soluzione posta tra due elettrodi si
effettua determinando la resistenza di essa.
Celle conduttimetriche
Sono costituite da due elettrodi,
immersi nella soluzione da analizzare, a
cui viene applicata una tensione
alternata. La conducibilità si ricava da
misure di corrente elettrica.
Gli elettrodi possono essere di:
• platino platinato
• Ti
• carbonio vetroso
Λ = χ k
l = distanza tra gli elettrodi
S = area di ciascun elettrodo
S/l = k = costante di cella
MISURE CONDUTTIMETRICHE
Le misure conduttimetriche sono di due tipi:
• misure dirette di conducibilità specifica (χ);
• misure indirette (titolazioni e studio della cinetica di reazione).
Misure dirette
Si effettuano per determinare il contenuto di sali disciolti in un
fluido.
Applicazioni:
• controllo del grado di inquinamento,
• misure di salinità
• K di acidi o basi deboli,
• Kps o grado di idrolisi.