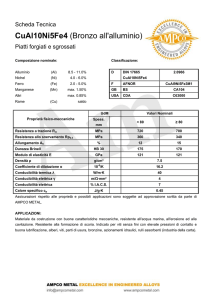
ITIS “G.Galilei”
Lab. Biochimica
Conducimetria
La conduttometria si basa sulla misura della conducibilità elettrica di una soluzione di elettrolita e/o
della sua variazione al variare del tipo o della concentrazione delle specie ioniche presenti in
soluzione.
Conducibilità elettrica delle soluzioni
La conducibilità (o conduttanza, ) di una soluzione è l’inverso della sua resistenza elettrica ( R ).
1
R
Ciò significa che una debole resistenza offerta dalla soluzione acquosa di un conduttore ionico è
sinonimo di una sua elevata conduttanza, potremmo quindi definire la conduttanza come la
misura della facilità con la quale una soluzione di elettrolita trasporta la corrente
elettrica.
In base alla seconda legge di Ohm la resistenza R che un conduttore oppone al passaggio della
corrente elettrica, è direttamente proporzionale alla lunghezza del conduttore l ed inversamente
proporzionale alla sezione S del conduttore
R
l
S
dove (si legge “ro”) è la resistività (in * cm); l è la lunghezza del conduttore (in cm); S è l’area
della sezione (in cm2).
Inserendo questa equazione nella precedente si ottiene:
1
1 S
l
l
S
l’inverso della resistività (1/) è detta conduttività ( o conducibilità specifica) e, nel caso di
soluzioni elettrolitiche viene indicata con (si legge “chi”); l’equazione precedente, diventa perciò:
S
l
l’unità internazionale di conducibilità elettrica è il Siemens (S): 1S= 1/ (indicato più raramente
con mho, da ohm-1).
La conducibilità elettrica di una soluzione viene misurata con il conduttimetro, collegato alla cella
conduttometrica, che è costituita da due elettrodi, in genere di platino platinato, immersi nella
soluzione in analisi.
Possiamo immaginare la cella conduttometrica come un tubo di liquido di lunghezza l e con la
sezione di area S in cui passa corrente: l è la distanza fra gli elettrodi e S l’area di ciascun elettrodo.
1
ITIS “G.Galilei”
Lab. Biochimica
Il materiale di cui sono fatti gli elettrodi può essere così poroso da fare aumentare sensibilmente la
superficie effettiva a contatto con la soluzione, rendendola maggiore dell’area geometrica, per
questo motivo si preferisce indicare il rapporto S/l per un determinato elettrodo mediante una
costante K, detta costante di cella.
La legge fondamentale su cui si basa la conduttometria assume quindi la forma:
K
Dove è la conducibilità della soluzione (in S); la conducibilità specifica
(in S/cm); K la costante di cella (in cm).
Le soluzioni elettrolitiche conducono l’elettricità molto meno dei metalli,
ma più dei solventi organici, che non contengono ioni mobili, e più
dell’acqua deionizzata.
I fattori che agiscono sui meccanismi di conduzione, e quindi sul valore
della conducibilità specifica, sono sostanzialmente quattro:
1. la concentrazione degli ioni in soluzione;
2. le cariche ioniche;
Figura 1: schema di
cella conduttometrica
3. la velocità di migrazione degli ioni in soluzione;
4. la temperatura.
Concentrazione ionica della soluzione
Il trasporto di corrente in soluzione dipende anzitutto dal numero di ioni presenti e quindi dalla loro
concentrazione.
Per gli elettroliti forti (come NaOH e HCl) la conducibilità specifica aumenta linearmente con la
concentrazione fino a che la soluzione è abbastanza
diluita. A concentrazioni molto elevate cresce
l’”affollamento” degli ioni e le interazioni
reciproche diventano più intense; di conseguenza
diminuisce la velocità con cui gli ioni si spostano in
soluzione e, ad un certo punto, comincia a
diminuire anche la conducibilità elettrica.
Per gli elettroliti deboli (come CH3COOH o NH3),
in soluzioni abbastanza diluite, l’andamento della
conducibilità specifica in funzione della
concentrazione è simile a quello degli elettroliti
forti, ma la pendenza è inferiore perché l’effetto
dovuto all’aumento di concentrazione viene
attenuato dal minore grado di dissociazione
dell’elettrolita.
Cariche ioniche
Figura 2:andamento della conducibilità specifica in
funzione della concentrazione
Uno ione bivalente trasporta, a parità di
2
ITIS “G.Galilei”
Lab. Biochimica
condizioni, una quantità di carica doppia rispetto ad uno ione monovalente; perciò la conduttanza
specifica aumenta.
Velocità di migrazione degli ioni
A parità di intensità del campo elettrico applicato, la velocità di ogni ione dipende dal rapporto
carica/raggio e dalla sua massa, dalle forze di interazione con gli altri ioni e con il solvente ed anche
dalla viscosità del solvente.
Temperatura
Al variare della temperatura variano sia la concentrazione ionica (che dipende dagli equilibri di
dissociazione, di complessazione e di solvatazione di ogni ione in soluzione) sia la velocità con cui
si spostano i singoli ioni (che dipende dalla viscosità del solvente). Di conseguenza la conducibilità
specifica aumenta di circa l’1-3% per ogni grado di temperatura.
Le misure conduttimetriche sono di due tipi:
misura diretta di conducibilità specifica
misure indirette (titolazioni e studio della cinetica di reazione)
La misura diretta della conducibilità specifica viene effettuata quando si vogliono informazioni
utili sulle caratteristiche della soluzione in esame (ad esempio la concentrazione salina, il grado di
purezza,ecc.). Il controllo della purezza di un’acqua, cioè la verifica che non vi siano sali disciolti, è
di fondamentale importanza in un laboratorio e nell’industria. Inoltre la conducibilità è un
parametro molto usato per controllare il grado di inquinamento, dovuto ad elettroliti, sia di acque di
superficie sia di acque sotterranee.
Nelle misure indirette (titolazioni) ciò che conta è la variazione della conducibilità, non il suo
valore assoluto. Nelle titolazioni spesso si verifica una apprezzabile variazione del valore della
conducibilità in corrispondenza del punto equivalente la cui determinazione si basa sulla
sostituzione di uno o più ioni con altri di diversa mobilità.
CELLE CONDUTTIMETRICHE
Le celle conduttimetriche sono costituite da due elettrodi, generalmente di platino, immersi nella
soluzione in esame, cui viene applicata una tensione alternata.
Si tratta di celle a funzionamento amperometrico, nelle quali il valore di conducibilità viene
ricavato in base a misure di corrente elettrica.
Gli elettrodi sono in genere costituiti da sottili lamine di platino ricoperte, per elettrodeposizione, di
uno strato di nero di platino (platino platinato). Tale strato, molto spugnoso, permette di diminuire
la cosiddetta resistenza di contatto, aumentando di centinaia di volte la superficie di contatto
elettrodo-soluzione, senza modificare le dimensioni della cella.
Le celle devono essere scelte in base al tipo di analisi che andiamo ad eseguire.
3
ITIS “G.Galilei”
Lab. Biochimica
Esistono vari tipi di celle: quelle più diffuse sono ad immersione,
con costante di cella compresa tra 0,1 a 10cm.
Celle di questo tipo, con elettrodi verticali, sono le più usate nelle
titolazioni di routine; le celle con elettrodi orizzontali, invece,
danno qualche problema soprattutto se sono usate per reazioni di
precipitazione, perché il precipitato tende a depositarsi sugli
elettrodi, falsando la misura.
Celle di questo tipo , con supporti più resistenti (materia plastica al
posto del vetro) sono impiegate anche per effettuare misure di
conducibilità sul campo.
Esistono altri tipi di cella; di lato sono riportate ne sono riportati
alcuni casi particolari.
Fig. 1: cella per titolazioni di precisione
Fig.2: cella di Jones, impiegabile per titolazioni in
bagno termostatato e non. È consigliata per misure di precisione e
per soluzioni ad elevata conducibilità.
Fig. 3: cella ad immersione per
titolazioni.
Particolarmente
adatta
per
titolazioni in bagno termostatico, gli elettrodi
sono ad anello.
L’efficienza di una cella è legata soprattutto all’efficienza dello strato di platino.
Oltre l’uso di sostanze aggressive, le possibili cause che determinano l’inefficienza dello strato di
platino possono essere di tre tipi diversi:
1. depositi di sostanze grasse
2. incrostazione di sali
3. distacco del nero di platino (in questo caso occorre togliere completamente il vecchio strato
immergendo la cella in una soluzione cromosolforica e lavando con acqua, successivamente
procedere alla riplatinatura seguendo le indicazioni del costruttore).
Per evitare di incorrere nelle condizioni sopra riportate occorre:
a) Conservare le celle sempre immerse in acqua distillata. Se gli elettrodi non si bagnassero bene
(perché rimasti troppo tempo a secco), si può eliminare l’inconveniente risciacquandoli prima
con etanolo.
b) Dopo l’impiego lavare con etanolo o acetone e risciacquare più volte con acqua distillata.
c) Se si sono formate incrostazioni di sali o si è lavorato in presenza di carbonati, lavare con HNO3
0,1N. Dopo un’analisi argentometrica, lavare con ammoniaca.
d) Controllare ogni volta lo stato del nero di platino: se qualche frammento si è staccato occorre
ricontrollare la costante di cella.
La misura della conducibilità presuppone le conoscenze geometriche dell’elettrodo date dal
rapporto s/l, perciò le caratteristiche fisiche delle lamine devono essere standardizzate. Esse, in
genere, hanno una superficie s (in genere 1 cm2) e sono posizionate ad una distanza l (in genere 1
cm) l’una dall’altra. Il rapporto s/l viene indicato con K e denominato costante di cella.
4
ITIS “G.Galilei”
Lab. Biochimica
Il valore della K è indicato dal produttore e riportato sulla cella; con il passare del tempo e con il
deterioramento degli elettrodi, è però opportuno misurare sperimentalmente tale valore.
Conduttometro METROHM
Questo strumento copre un campo di misura tra 10 e 106 suddiviso in 5 gamme selezionabili
mediante un commutatore. È costituito da un ponte
di Kohlrausch alimentato con tensione alternata, da
un amplificatore e da un occhio magico, quindi lo
strumento in questione non è a lettura diretta ma ad
azzeramento manuale potenziometrico.
Apparecchi del genere sono detti end point (punto
finale) in quanto vengono usati per seguire
l’andamento di una titolazione, non per effettuare
misure dirette di conducibilità.
Per effettuare la misura si deve:
a) inserire la cella di misura ed accendere lo
strumento lasciando trascorrere un certo tempo
per il raggiungimento delle condizioni di
regime termico delle parti elettroniche.
b) collocare il selettore delle scale sulla gamma
più idonea alla conducibilità della soluzione in
esame.
c) Spostare la manopola della scala fino a che l’occhio magico non indiche la posizione di
equilibrio. Il valore letto sulla scala corrispondente a questa posizione, moltiplicato per il fattore
specifico indicato dal commutatore delle gamme, dà il valore della resistenza della soluzione.
d) Se l’occhio magico non riesce ad indicare la posizione di equilibrio, nonostante la totale
escursione della manopola della scala, occorrerà selezionare una nuova gamma di sensibilità e
ripetere le operazioni.
5