24/11/2010
Chimica Generale e Inorganica
28
Obbiettivi
Il corso di Chimica Generale e Inorganica sarà un insieme di
informazioni esprimibili in leggi. La prima parte del corso cerca di
porre le basi elementari per affrontare e superare due aspetti
fondamentale della Chimica Generale che sono la teoria del legame
chimico e la termodinamica. La seconda parte del corso affronta lo
studio delle reazioni chimiche, la loro fattibilità. Ogni argomento è
completato con un certo numero di esercizi che illustrano la
validità dei concetti esposti. La terza parte riguarderà la chimica
degli elementi con particolare riguardo a quelli essenziali alla vita
animale e vegetale. Alla fine lo studente avrà acquisito un
atteggiamento critico nei confronti della materia che lo metteranno
nelle condizioni di affrontare anche argomenti non trattati a
lezione. Infine gli argomenti trattati metteranno in grado lo
studente di affrontare senza problemi gli altri corsi di carattere
chimico professionalizzanti.
24/11/2010
Chimica Generale e Inorganica
29
Cos’è la Chimica:
la scienza che studia le proprietà, la composizione e la
struttura della materia, in particolare in relazione alle
sostanze di cui questa è costituita, alle trasformazioni
alle quali queste sono soggette e agli effetti energetici
che ne seguono.
la scienza delle molecole e delle loro trasformazioni,
non solo di un centinaio di elementi, ma della infinita
varietà di molecole che possono essere costruite da essi
La chimica inoltre costruisce molecole che prima non
esistevano, ovvero può “creare” l’oggetto del suo studio
24/11/2010
Chimica Generale e Inorganica
30
Cos’è la Chimica
• Il suo metodo di indagine è quello
sperimentale o induttivo. Tale metodo può
essere suddiviso nelle seguenti fasi:
Osservazione del fenomeno.
Raccolta di dati sperimentali.
Formulazione di ipotesi.
Elaborazione critica dei dati sperimentali.
Formulazione della legge.
Applicazione della legge e verifica
sperimentale della sua validità.
24/11/2010
Chimica Generale e Inorganica
31
Modello Scientifico
Per modello si intende la visualizzazione di
una realtà invisibile, quindi sconosciuta,
mediante una o più immagini concrete
tratte dall'esperienza quotidiana.
Il modello formulato non deve essere
considerato una riproduzione in miniatura
di una realtà macroscopica (es. un
modellino di nave), bensì uno strumento
concettuale di cui ci si serve per
interpretare il comportamento delle cose.
24/11/2010
Chimica Generale e Inorganica
32
24/11/2010
Chimica Generale e Inorganica
33
Modello di Gas
Un gas può essere concepito secondo il
seguente modello: formato da piccolissimi
corpuscoli o particelle, separate tra loro e
disperse nello spazio.
Le particelle sono dotate di movimento senza
alcun rapporto di reciproca dipendenza;
frequentemente collidono tra loro e con le pareti
del contenitore.
Le forze tra le particelle sono molto modeste.
Il volume effettivo delle particelle è trascurabile
rispetto a quello del contenitore che racchiude il
gas.
24/11/2010
Chimica Generale e Inorganica
34
Modello di Liquido
I liquidi, intermedi tra gas e solidi, possono
essere rappresentati secondo questo
modello:
Costituiti da corpuscoli piccolissimi o
particelle molto vicine tra loro ma che non
occupano posizioni fisse; tra una particella
ed un’altra esistono piccoli vuoti.
Tra le particelle esistono forze attrattive di
media intensità che, pur costringendole a
rimanere in contatto, permettono loro
movimenti di scorrimento le une sulle altre.
24/11/2010
Chimica Generale e Inorganica
35
Modello di un Solido
• Formato da piccolissimi corpuscoli o particelle
che sono vicinissime tra loro.
• Tra le particelle vi sono forze attrattive molto
intense che, oltre a mantenerle in stretto contatto
tra loro, ne impediscono ogni apprezzabile
movimento; si ammette però che esse possano
vibrare intorno alle loro posizioni di equilibrio pur
occupando una posizione quasi fissa.
• Le particelle possono risultare distribuite nello
spazio con regolarità (solidi ordinati o cristallini)
oppure senza alcuna regola (solidi disordinati o
amorfi).
24/11/2010
Chimica Generale e Inorganica
36
24/11/2010
Chimica Generale e Inorganica
37
Teoria Cinetica della Materia
• Secondo tale teoria tutta la materia è
formata da particelle (atomi, molecole o
ioni); esse sono in movimento costante e
tutte le collisioni sono perfettamente
elastiche (urto elastico: non si verifica
cambiamento dell' energia cinetica totale).
24/11/2010
Chimica Generale e Inorganica
38
La Materia
• La materia è tutto ciò che si trova
nell'universo ed è dotata di massa propria.
Una porzione limitata di materia è detta
corpo.
24/11/2010
Chimica Generale e Inorganica
39
Materia
Miscela
Eterogenee
(grossolane)
24/11/2010
Sostanze pure
Omogenee
(soluzioni)
Elementi
Chimica Generale e Inorganica
Composti
40
Nomi e Simboli degli Elementi
Elemento
Simbolo
Abbondanza %
Elemento
Simbolo
Abbondanza %
Alluminio
Al
7,5
Manganese
Mn
0,09
Argento
Ag
0,00001
Mercurio
Hg
0,00005
Azoto
N
0,03
Nichel
Ni
0,010
Bromo
Br
0,00025
Oro
Au
0,0000005
Calcio
Ca
3,4
Ossigeno
O
49,4
Carbonio
C
0.08
Piombo
Pb
0,0016
Cloro
Cl
0,2
Potassio
K
2,4
Cromo
Cr
0,018
Rame
Cu
0,007
Ferro
Fe
4,7
Silicio
Si
25,8
Fosforo
P
0,12
Sodio
Na
2,6
Idrogeno
H
0,9
Titanio
Ti
0,56
Iodio
I
0,00003
Zinco
Zn
0,008
Magnesio
24/11/2010
Mg
1,9 Chimica GeneraleZolfo
e Inorganica
S
0,06
41
24/11/2010
Chimica Generale e Inorganica
42
I Fenomeni
• E' detto fenomeno qualsiasi evento o
trasformazione che interessa un corpo. I
fenomeni possono essere suddivisi in:
Fenomeni fisici: quelli che interessano le
proprietà fisiche del corpo quali la massa, il
volume, il colore, lo stato di aggregazione,
il punto di fusione, la conducibilità elettrica.
Fenomeni chimici: quelli che portano ad un
cambiamento della composizione chimica
di un corpo (reazioni chimiche).
24/11/2010
Chimica Generale e Inorganica
43
Sostanze Semplici
• Le sostanze semplici, dette
comunemente elementi, sono specie
chimiche non più scomponibili in
sostanze ancora più semplici. Sono
costituite da atomi dello stesso tipo.
24/11/2010
Chimica Generale e Inorganica
44
I Composti
• Sono specie chimiche costituite da più
elementi e, quindi, da atomi di diverso
tipo.
24/11/2010
Chimica Generale e Inorganica
45
24/11/2010
Chimica Generale e Inorganica
46
Le Fasi
• Un corpo o un insieme limitato di corpi oggetto di
indagini chimico-fisiche è detto sistema.
• Una porzione di un sistema limitata da superfici
fisicamente definite e con una serie di proprietà
fisiche costanti in ogni suo punto è detta fase.
• Un sistema è definito fisicamente omogeneo quando
è costituito da una sola fase (es. l'aria, il vino, le
soluzioni ).
• Un sistema è detto fisicamente eterogeneo quando è
costituito da più fasi separate tra di loro da superfici
ben definite, osservabili ad occhio nudo o al
microscopio.
• Un miscuglio eterogeneo tra un solido ed un liquido è
detto sospensione (es. miscuglio acqua - sabbia). Un
miscuglio eterogeneo
due
liquidi non miscibili è47
24/11/2010
Chimicatra
Generale
e Inorganica
detto emulsione (es. latte, miscuglio acqua - olio ).
Le Grandezze
• I fisici definiscono grandezza ogni ente,
introdotto per descrivere un fenomeno fisico,
che sia, in qualche modo, misurabile. Le
grandezze si descrivono con un numero
seguito dalla loro unità di misura.
• Le grandezze possono essere classificate in:
Grandezze fondamentali: quelle le cui unità di
misura sono definite e fissate, per
convenzione, dal Sistema Internazionale (SI)
sono sette (Tabelle) .
Grandezze derivate: derivano dalle precedenti
e sono ottenute da queste tramite
combinazioni algebriche, prodotti o divisioni.
Le
più
importanti,
di
interesse
dei
chimici
e
dei
24/11/2010
Chimica Generale e Inorganica
48
fisici, sono riportate nella sezione "Tabelle"
Le Grandezze
• Le unità di misura SI molto spesso sono o
troppo grandi o troppo piccole, per cui è
necessario utilizzare dei loro sottomultipli o dei
loro multipli, definiti da prefissi moltiplicatori. In
alcuni casi si utilizzano anche unità di misura
al di fuori del SI, spesso diverse da paese a
paese.
• Le grandezze fisiche, fondamentali e derivate,
definiscono quindi le proprietà fisiche della
materia.
24/11/2010
Chimica Generale e Inorganica
49
Grandezze Fisiche Fondamentali
24/11/2010
Chimica Generale e Inorganica
50
Grandezze fondamentali
• Lunghezza (l) La sua unità di misura è il
metro (simbolo dell’unità: m). Questo può
essere definito come la distanza, a 0°C e
alla pressione di 1,01325x105 Pa (ossia di
una atmosfera), tra i centri di due sottili
incisioni fatte su un prototipo in platino-iridio
(metro campione) conservato nell’Ufficio di
Pesi e Misure di Sèvres (Francia)
• Rigorosamente, il metro è la lunghezza
percorsa dalla luce nel vuoto nell’intervallo
di tempo di 1/299792458 secondi
24/11/2010
Chimica Generale e Inorganica
51
Grandezze fondamentali
• Massa (m) La sua unità di misura è il chilogrammo
(simbolo dell’unità: kg). Questo è la massa del
prototipo di platino-iridio (chilogrammo campione)
conservato nell’Ufficio di Pesi e Misure di Sèvres
(Francia)
• Tempo (t) La sua unità di misura è il secondo
(simbolo dell’unità: s), che può essere definito
come la 86400-esima parte del giorno solare
medio
• Rigorosamente, il secondo è la durata di
9192631770 periodi della radiazione
corrispondente alla transizione tra due livelli
iperfini dello stato fondamentale dell’isotopo 133Cs
24/11/2010
Chimica Generale e Inorganica
52
Grandezze fondamentali
• Corrente elettrica (i) La sua unità di misura è
l’ampere (simbolo dell’unità: A), che può essere
definito come la corrente elettrica che fluendo in
modo continuo e costante deposita 1,11800 mg di
argento in un secondo da una soluzione acquosa
di nitrato d’argento (AgNO3).
• Rigorosamente: l’ampere è la corrente elettrica
che, mantenuta costante in due conduttori paralleli
di lunghezza infinita, di sezione circolare
trascurabile e posti nel vuoto a distanza di 1 metro
l’uno dall’altro, produrrebbe tra questi conduttori
una forza uguale a 2x10-7 newton per ogni metro
di lunghezza
24/11/2010
Chimica Generale e Inorganica
53
Grandezze fondamentali
• Temperatura termodinamica (o temperatura assoluta)
(T) La sua unità di misura è il kelvin (simbolo
dell’unità: K), che può essere definito come la
centesima parte della differenza tra la temperatura di
ebollizione e quella di congelamento dell’acqua pura
alla pressione di 1 atmosfera (ossia 1,01325x105 Pa).
In realtà, questa è la definizione di grado Celsius (°C),
tradizionalmente chiamato grado centigrado. Sta di
fatto che quantitativamente 1 grado centigrado e 1
kelvin coincidono dato che l’intervallo di temperatura
di 1 grado centigrado è uguale a quello di 1 kelvin.
• Rigorosamente: il kelvin è pari a 1/273,16 della
temperatura termodinamica del punto triplo dell’acqua.
24/11/2010
Chimica Generale e Inorganica
54
Grandezze fondamentali
• Quantità di sostanza (n) La sua unità di misura
è la mole (simbolo dell’unità: mol). La mole può
essere definita come la quantità di sostanza di
un sistema che contiene 6,02212367x1023 unità
elementari (atomi, molecole, oggetti ecc.)
• Rigorosamente: la mole è la quantità di una
sostanza di un sistema che contiene tante unità
elementari quanti sono gli atomi contenuti in
0,012 kg dell’isotopo 12C.
24/11/2010
Chimica Generale e Inorganica
55
Grandezze fondamentali
• Intensità luminosa (Iv) La sua unità di misura è
la candela (simbolo dell’unità: cd), che
corrisponde all’intensità luminosa, in una data
direzione, di una sorgente che emette una
radiazione monocromatica di frequenza di
540x1012 hertz e che ha una intensità radiante
in quella direzione di 1/683 watt per steradiante
(lo steradiante è l’unità di misura dell’angolo
solido).
24/11/2010
Chimica Generale e Inorganica
56
Prefissi
Multiplo Nome
10
102
103
106
109
1012
1015
24/11/2010
Deca
Etto
Chilo
Mega
Giga
Tera
Peta
Simbolo Sotto
multiplo
Da
10-1
H
10-2
K
10-3
M
10-6
G
10-9
T
10-12
P
10-15
Chimica Generale e Inorganica
Nome
Simbolo
Deci
Centi
Milli
Micro
Nano
Pico
Fento
D
C
M
M
N
P
F
57
Proprietà della Materia
• Le proprietà della materia e, quindi delle sostanze, sono
classificabili in:
• Proprietà fisiche: sono le grandezze fisiche già viste e
dipendono dalla sostanza stessa.
• Possono essere distinte in:
• Proprietà estensive: dipendono dall'estensione del
campione, ovvero dalla quantità di materia dello stesso
(es. volume, massa, lunghezza).
• Proprietà intensive: non dipendono dalla quantità, bensì
dal tipo di materia (es. punto di fusione, densità).
• Proprietà chimiche: dipendono in prevalenza
dall'influenza di altre sostanze sulla sostanza in esame
(es. reattività con l'ossigeno, reattività con l'acqua,
reattività con gli acidi).
• Proprietà organolettiche: possono essere percepite e
valutate dagli organi
di senso (es. sapore, odore, 58
24/11/2010
Chimica Generale e Inorganica
colore).
Lunghezza
• Grandezza fondamentale corrispondente
alla dimensione orizzontale più estesa. Unità
di misura del SI è il metro (m).
24/11/2010
Chimica Generale e Inorganica
59
Volume
• E' la porzione di spazio che un corpo occupa; varia in funzione
della temperatura e della pressione. Tale variazione non è
significativa nei solidi e nei liquidi in quanto, anche se possono
subire modeste dilatazioni, sono da considerarsi incomprimibili.
Nei gas, invece, è determinante in quanto essi possono subire
notevoli dilatazioni o compressioni per effetto, appunto, di
pressione e temperatura.
• Il volume è una grandezza derivata dalla lunghezza e l'unità di
misura, nel SI, è il metro cubo (m3). Detta unità è, però, troppo
grande per il chimico che comunemente usa i suoi sottomultipli.
Tra questi il più utilizzato è il decimetro cubo (dm3) che
corrisponde al volume occupato da un kg di H2O distillata alla
temperatura di 4 °C.
• In laboratorio si usa più frequentemente il centimetro cubo
(cm3). Quando si devono misurare volumi di fluidi (liquidi e gas)
si utilizzano comunemente unità di misura non SI dette di
capacità; le più importanti sono il litro (L) che corrisponde ad 1
dm3 ed il millilitro (mL) che corrisponde ad 1 cm3. Pertanto:
24/11/2010
Chimica Generale e Inorganica
60
3
3
3
•
1 dm = 1000 cm = 1 L = 1000 mL ; 1 cm = 1 mL.
Massa
• Si definisce massa la quantità di materia
che costituisce un corpo.
• E' una proprietà estensiva costante, infatti
non varia al variare della posizione del
corpo nello spazio ed è indipendente dalla
temperatura e dalla pressione. Si misura
per confronto con una quantità di materia
presa come campione. L'unità di misura SI
è il kilogrammo (kg). In laboratorio si usano
comunemente i suoi sottomultipli, quali, ad
esempio il grammo ( g ), corrispondente a
• 10-3 kg e il milligrammo (mg , pari a 10-6 kg)
24/11/2010
Chimica Generale e Inorganica
61
Forza
• La forza (F) è una grandezza vettoriale che può
essere definita come l'agente fisico in grado di
modificare lo stato di moto o di quiete di un corpo;
è sempre applicata da un corpo materiale ad un
altro ed è caratterizzata da una intensità e da una
direzione lungo la quale agisce.
• Unità di misura del SI per la forza è il newton (N);
• 1 N corrisponde alla forza capace di imprimere ad
un corpo di massa = 1 kg un'accelerazione di 1
m/s2
24/11/2010
Chimica Generale e Inorganica
62
Peso
• Per peso (P) si intende la forza con la quale un corpo è
attratto verso il centro della terra.
• Il peso è, quindi, una forza ed è direttamente proporzionale
alla massa del corpo; la costante di proporzionalità è la forza
di attrazione gravitazionale (g che, in un dato luogo, è la
stessa per tutti i corpi.
• Per un corpo posto a livello del mare il valore di g è di 9,8
m/s2. La relazione per ricavare il peso è : P = m × g.
• L'unità di misura del peso, in quanto forza, è il newton (N). In
pratica è spesso utilizzato il kilogrammo-peso (kgp), ovvero il
peso di un corpo avente massa = 1kg, posto a 45° di
latitudine e a livello del mare; ne deriva che 1kgp = kg 9.8
m/s2 = 9.8 m/s2 e, di conseguenza, 1kgp = 9.8N .
• Per esemplificare, il peso di un oggetto portato sulla luna si
riduce ad 1/6 del peso che lo stesso aveva sulla terra in
quanto la forza di attrazione gravitazionale sulla luna è 1/6 di
quella terrestre; ovviamente
la massa dell'oggetto rimane
24/11/2010
Chimica Generale e Inorganica
63
invariata.
Densità Assoluta
• E' una proprietà intensiva della materia,
indipendente cioè dall'estensione del
campione, ed esprime la massa dell'unità
di volume di un corpo omogeneo. In altre
parole è data dal rapporto tra massa e
volume. La densità si indica, in Italia, con il
simbolo d, anche se il SI raccomanda l'uso
della lettera greca r (rho); l'unità di misura
SI è il kilogrammo su metro cubo (kg/m3);
comunemente si usa anche il grammo su
centimetro cubo (g/cm3).
• L'espressione della densità è: d = m / v, da
cui deriva V = m / d e m = v · d.
24/11/2010
Chimica Generale e Inorganica
64
Densità Relativa
• Rappresenta il rapporto tra la massa di un
campione e la massa di un eguale volume di
acqua distillata alla temperatura di 4 °C. E'
una grandezza adimensionale, espressa,
cioè, da un numero puro che rappresenta il
rapporto tra due grandezze definite dalla
stessa unità di misura. Ad esempio la densità
dell'oro è = 19,3, ovvero l'oro ha densità 19,3
volte maggiore di quella dell'acqua distillata a
4 °C.
24/11/2010
Chimica Generale e Inorganica
65
Pressione
• La pressione (P) è definita come la forza
esercitata sull'unità di superficie: P = forza /
superficie.
• L'unità di misura della pressione del SI è il pascal
(Pa) corrispondente a 1N/m2 , ovvero ad una
forza di 1 newton che agisce su un'area di 1 m2.
Il pascal è una unità molto piccola, per cui
comunemente si usano i suoi multipli, l'ettopascal
(1ePa = 100 Pa) e il kilopascal (1kPa = 1000 Pa).
• Molto utilizzato, specie in meteorologia, è il bar
che corrisponde a 100000 Pa ed il millibar
(mbar), corrispondente a 100 Pa e, quindi,
sinonimo di ettopascal.
24/11/2010
Chimica Generale e Inorganica
66
Pressione
• Tradizionalmente sono utilizzate in molti campi
diverse unità di misura non-SI, quali, ad esempio,
l' atmosfera (atm), pari alla pressione esercitata
su 1cm2 di superficie, a livello del mare e in una
giornata serena, da una colonna di aria alta
quanto l'atmosfera. Questo valore corrisponde
anche alla pressione esercitata su 1cm2 di
superficie da una colonna di mercurio alta 760
mm, alla temperatura di 0 °C.
• Ne deriva che 1atm = 760 mm Hg. 1atm
corrisponde poi a 101325 Pa e, di conseguenza,
a 1013.25 ePa o mbar .
• In onore di Evangelista Torricelli, il mm di
mercurio è stato chiamato torr: 1mm Hg = 1 torr =
133.32 Pa .
24/11/2010
Chimica Generale e Inorganica
67
Energia
• L'energia è l'attitudine di un corpo a compiere un
lavoro. Può presentarsi sotto sei aspetti:
meccanica, termica, radiante, elettromagnetica,
chimica, nucleare.
• Energia meccanica: è un tipo particolare di
energia cinetica; es. energia di una turbina, di un
elica.
• Energia termica: è quella accumulata dai corpi
quando sono riscaldati senza cambiamenti di
stato di aggregazione.
• Energia radiante: è l'energia associata alla luce o
ad altre radiazioni elettromagnetiche. Si presenta
sotto forma di luce visibile, luce infrarossa o
ultravioletta, raggi X, microonde, etc.
24/11/2010
Chimica Generale e Inorganica
68
Energia
• Energia elettromagnetica: energia che
proviene dal flusso di corrente elettrica
risultante da forze elettriche non
bilanciate.
• Energia chimica: energia contenuta nelle
sostanze chimiche; le reazioni chimiche
permettono che questa energia sia
liberata e convertita in altre forme di
energia, ad es. luce o calore.
• Energia nucleare: energia prodotta da
reazioni di fissione o fusione nucleare.
24/11/2010
Chimica Generale e Inorganica
69
Energia
• L'energia si presenta sotto tre forme fondamentali:
energia cinetica, energia potenziale ed energia di
massa.
• Energia cinetica: è l'energia associata al
movimento dei corpi. Un corpo di massa m che si
muove con velocità v possiede una energia cinetica
Ec = 1/2 mv2 .
• Energia potenziale (Ep): è, ad esempio, quella
associata alla posizione di un corpo sul quale
agiscono costantemente forze particolari dovute ad
altri corpi. Tali forze sono, ad esempio, la forza
gravitazionale e le forze di natura elettrica. Un tipo
particolare di e.p. è l'energia potenziale chimica che
rappresenta il contributo al contenuto energetico
totale dovuto alle interazioni tra particelle.
24/11/2010
Chimica Generale e Inorganica
70
Energia
• Energia di massa: è l'energia associata alla
massa inerziale di un corpo; è espressa
dall'equazione di Einstein E = mc2 ove c è la
velocità della luce nel vuoto (~3 × 108 m/s) e m
rappresenta la massa.
• Unità di misura del SI per l'energia è il joule (J)
che corrisponde al lavoro compiuto dalla forza di
1N quando il suo punto di applicazione si sposta
di 1m nella direzione e nel verso della forza
stessa (1J = 1N × m .
• In pratica si usano altre unità di misura, quali la
caloria (cal), la kilocaloria (kcal) e l'elettronvolt
(eV).
24/11/2010
Chimica Generale e Inorganica
71
Energia
• Si riportano i fattori di conversione delle
unità di misura dell'energia:
•
•
•
•
Energia
J
Erg
Cal
J
1
10-7
4,184
erg
107
1
4,184x107
cal
0,23901
2,3901x10-4
1
eV
6,2415x1018
6,2415x1011
2,6114x1019
• Per caloria si intende la quantità di calore
necessaria ad aumentare la temperatura di
un grammo di acqua distillata da 14,5 a
15,5 °C, alla pressione di 1 atm.
24/11/2010
Chimica Generale e Inorganica
72
Calore
• Per calore si intende l'energia termica che passa tra due
corpi per effetto di una differenza di temperatura. Se si
pongono a contatto un corpo a temperatura più alta ed
uno a temperatura più bassa, il secondo riceve calore
ceduto dal primo. Questo passaggio è un trasferimento di
energia termica che si trovava nel corpo più caldo sotto
forma di energia potenziale.
• In altre parole, il calore si propaga sempre da zone o
corpi più caldi a zone o corpi più freddi.
• Unità di misura del calore nel SI è il joule (J); come già
noto, si utilizzano spesso la caloria (cal) e la kilocaloria
(kcal).
• La temperatura è la misura dell'intensità del calore.
• L'unità di misura della temperatura è nel SI il Kelvin (K) e
la sua scala è detta scala assoluta; comunemente si usa
il grado centigrado (°C) della scala centigrada.
24/11/2010
Chimica Generale e Inorganica
73
Calore
• Entrambe le unità di misura si equivalgono (1K = 1°C), ma lo
zero della scala assoluta è posto a -273.15°C e si chiama zero
assoluto. Ne deriva che lo zero della scala centigrada è posto a
273.15 K. Le temperature assolute si indicano con T mentre
quelle centigrade con t.
• Se con il trasferimento di calore si ha un passaggio di stato il
calore trasferito è detto calore latente; a seconda del passaggio
di stato si hanno:
• Calore latente di fusione: quantità di calore necessaria a far
passare 1g di sostanza dallo stato solido a quello liquido. Ad
esempio il calore latente di fusione dell'acqua è pari a 80 cal/g.
• Calore latente di vaporizzazione o ebollizione: quantità di
calore necessaria a far passare 1g di sostanza dallo stato
liquido a quello di vapore. Ad es. il calore latente di ebollizione
dell'acqua è di 540 cal / g.
• La quantità di calore richiesta da una data quantità di sostanza
durante il passaggio di stato è data dalla relazione: Q = calore
latente
× massa in g della
sostanza.
24/11/2010
Chimica Generale e Inorganica
74
Calore
• Per calore specifico (c) di una sostanza si intende la
quantità di calore necessaria a far aumentare di 1°C 1g di
sostanza e si esprime, nel SI, in J/g °C; si utilizza anche
la cal / g °C.
• Per capacità termica (C) di un corpo si intende la quantità
di calore necessaria a far aumentare di 1°C la sua
temperatura; l'espressione è data dal prodotto del calore
specifico per la massa del corpo (C = c × m) e si esprime
con le stesse unità di misura del calore specifico.
• Nelle trasformazioni fisiche ove non abbiano luogo
reazioni chimiche o passaggi di stato, un corpo assorbe
e cede calore secondo la relazione Q = m × c × t (t =
tfinale - tiniziale).
• Ad esempio, la quantità di calore necessaria per
riscaldare 500 g di ferro (cmedio = 0.115 cal / g °C) da 50°C
a 120 °C è:
• Q = 500 g × 0.115 cal / g °C × 70 °C, Q = 4025 cal.
24/11/2010
Chimica Generale e Inorganica
75
24/11/2010
Chimica Generale e Inorganica
76
24/11/2010
Chimica Generale e Inorganica
77
24/11/2010
Chimica Generale e Inorganica
78
Tavola Periodica degli Elementi
24/11/2010
Chimica Generale e Inorganica
79
ABBONDANZA DEGLI
ELEMENTI CHIMICI
Si è ben lontani da una distribuzione uniforme degli
elementi chimici nella crosta terrestre, negli oceani e nel
cosmo.
Il 95.25% della crosta terrestre e dei mari è costituito da
soli 9 elementi chimici: l’ossigeno, il silicio, l’idrogeno,
l’alluminio, il ferro e il calcio.
Nel cosmo l’elemento che predomina è l’idrogeno, seguito
dall’elio, a conferma di quanto detto a proposito
dell’origine degli atomi.
In natura l’abbondanza degli elementi diminuisce
all’aumentare del numero atomico. Perché se il numero
atomico Z è molto grande i nuclei subiscono
spontaneamente un processo di fissione nucleare e
risultano instabili. Anche se l’elemento più pesante
riportato nella tavola è il laurenzio (Z = 103), sono stati
24/11/2010
Generale
e Inorganica
80
prodotti nuclei conChimica
numeri
atomici
fino a 109.
24/11/2010
Chimica Generale e Inorganica
81
Materia
La Materia è il costituente fisico dell’universo ed è
costituita da tutto ciò che:
Occupa spazio
Possiede massa (a riposo)
Sostanze
Elementi: Sostanze Pure a Composizione
Chimica
Costante
ed
Invariabile
–
Non
scomponibili
Composti: Sostanze Pure a Composizione
Chimica
Costante
ed
Invariabile
–
scomponibili/costituiti da due o più elementi
24/11/2010
Chimica Generale e Inorganica
82
Costituenti Base della Materia
• La materia è formata da:
Atomi (sostanze semplici). Non
scomponibili in sostanze più semplici
Molecole formate da due o più atomi.
Facilmente scomponibili in sostanze
semplici
Ioni specie cariche (ioni positivi cationi,
ioni negativi anioni)
24/11/2010
Chimica Generale e Inorganica
83
Teoria Atomica
TEORIA ATOMICA
Dalton, 1803
La materia è costituita da particelle estremamente piccole ed
indivisibili, dette atomi
Esistono atomi di diversa natura, dalle differenti proprietà
(elementi)
Gli atomi di un dato elemento sono tutti identici
Le reazioni chimiche non riescono a mutare gli atomi di un
elemento in un altro
Nel corso delle reazioni chimiche gli atomi non si creano né si
distruggono, ma cambiano solamente la disposizione relativa
nello spazio
Un composto è una precisa combinazione di atomi di uno o
più elementi
In un dato composto il numero relativo e la specie degli atomi
sono costanti
24/11/2010
Chimica Generale e Inorganica
84
Scoperta dell’Atomo
Fine del XIX secolo, inizio del XX
Esperimenti di Geissler, Plucker, Crookes
Tubi a scarica, 1855
Esperimenti di Goldstein
Raggi catodici, 1876
Goldstein scopri l’esistenza di particelle
cariche positivamente, 1886
Esperimento di Thompson 1897
Scoperta dell’elettrone
24/11/2010
Chimica Generale e Inorganica
85
Scoperta dell’Atomo
Fine del XIX secolo, inizio del XX
Esperimento di Rutherford 1910
Scoperta del ‘nucleo’
Esperimento di Millikan 1913
Misura della carica elementare
Esperimento di Chadwick su elementi
radioattivi
Scoperta del neutrone, 1932
24/11/2010
Chimica Generale e Inorganica
86
Scoperta dell’Atomo
Fine del XIX secolo, inizio del XX
Atomo di Ruherford o Atomo
nucleare
Atomo di Bohr, idea della
quantizzazione, 1913
Ipotesi di De Broglie ipotizza che
alle particelle microscopiche si può
associare anche un'onda: questo
portò al dualismo onda-particella,
1928
24/11/2010
Chimica Generale e Inorganica
87
Scoperta dell’Atomo
Fine del XIX secolo, inizio del XX
Principio di indeterminazione di
Heisemberg afferma che la misura
simultanea di due variabili coniugate,
come posizione e quantità di moto
oppure energia e tempo, non può
essere compiuta senza un'incertezza
ineliminabile,1927
Equazione di Schroedinger e Dirac,
1927, base della moderna teoria
atomica
24/11/2010
Chimica Generale e Inorganica
88
DIMENSIONI DELL’ATOMO
• Carica dell’elettrone e del protone =
1,60219x 10-19 C
• Massa dell’elettrone = 9,10953x10-31 Kg
• Massa del protone = 1,67235x10-27 Kg
• Massa del neutrone = 1,67492x10-27 Kg
• Raggio classico dell’elettrone = 2,81794x1015 metri
• Raggio della prima orbita di Bohr = 5.29177x
10-11 metri
24/11/2010
Chimica Generale e Inorganica
89
ATOMO NATO DALLE STELLE
Trascorso un decimo di secondo dal Big Bang,
l’universo doveva essere pervaso da una
miscela di particelle elementari. Solo dopo circa
3 minuti, dal Big Bang, elettroni e nuclei si sono
uniti per formare gli atomi e si sono formati tutti
gli elementi.
L’universo
primordiale
era
costituito
essenzialmente da idrogeno ed elio. Gli atomi
più pesanti, quelli cioè col numero atomico Z più
grande, si sono formati dopo la nascita delle
stelle nel corso delle reazioni di fusione
termonucleari che avvengono nel loro interno.
24/11/2010
Chimica Generale e Inorganica
90
INTRODUZIONE
FISICA CLASSICA
EQUAZIONI DI MAXWELL
EFFETTO FOTOELETTRICO
ETERE
MODELLO ATOMICO
ESPERIMENTO DI MORLEY
TEORIA QUANTISTICA
RADIOATTIVITA’
24/11/2010
Chimica Generale e Inorganica
RELATIVITA’
91
STORIA ANTICA
600 a.C. Teoria di Talete
Teoria di Democrito
300 a.C. Teoria di Aristotele
Medioevo: domina la teoria di Aristotele
Rinascimento: si riscopre la teoria di Democrito
24/11/2010
Chimica Generale e Inorganica
92
STORIA MODERNA
1789: Legge di Lavoisier ( nasce la chimica moderna)
1794: Legge di Proust
1803: Teoria di Dalton
1830: Scoperta dell’elettrone (Thomson)
1869: Tavola periodica ( Mendeleev )
1886: Scoperta del protone ( Goldentein )
1897: teoria atomica di Thomson
1900: Sviluppo della teoria Quantistica ( Plank )
24/11/2010
Chimica Generale e Inorganica
93
1911: teoria atomica di Rutherford
1913: teoria atomica di Bohr
1916: Einstein descrive le orbite degli elettroni più lontani
1927: principio di indeterminazione di Heisenberg
1925: principio di esclusione di Pauli
1926: equazioni di Schroedinger
1932: scoperta del neutrone ( Chadwich )
1942: prima reazione nucleare ( Fermi )
1951: prime centrali nucleari negli U.S.A.
24/11/2010
Chimica Generale e Inorganica
94
ULTIME SCOPERTE
1968: si scoprono i Quark
1993: progetto di fissione nucleare ( Rubbia )
1997: si produce in laboratorio l’anti idrogeno
24/11/2010
Chimica Generale e Inorganica
95
TALETE
Filosofo greco del’ 600 a.C. Fu uno dei
primi a teorizzare l’origine della materia.
Egli sosteneva che: la materia traesse
origine dall’acqua, la quale solidificando
diventava terra ed evaporando diventava
aria.
24/11/2010
Chimica Generale e Inorganica
96
DEMOCRITO
Filosofo greco (460 – 370 a.C.). Con Democrito nasce
la teoria atomica della materia. Intuisce che la
materia è formata da piccolissime particelle che lui
chiama atomi.
24/11/2010
Chimica Generale e Inorganica
97
ARISTOTELE
Filosofo greco, negava l’esistenza del
vuoto per cui attribuiva a tutti gli
elementi una natura materiale.
Aristotele negava inoltre l’esistenza degli atomi
ritenendo la materia costituita da: terra, acqua,
fuoco e aria
24/11/2010
Chimica Generale e Inorganica
98
LAVOISIER
Con il chimico francese A. L. Lavoisier
nasce la chimica moderna. Di lui
ricordiamo il principio con il quale nel 1789
enunciò la legge di conservazione della
massa:
In tutte le reazioni chimiche la massa si
conserva, cioè la massa dei reagenti è
uguale alla massa dei prodotti.
24/11/2010
Chimica Generale e Inorganica
99
J. L. PROUST
Nel 1794 il chimico francese Joseph
Louis Proust emana la legge che
stabilisce la costanza dei rapporti
delle masse secondo cui due o più
elementi si combinano fra loro. È
detta anche legge delle proporzioni
definite e costanti.
24/11/2010
Chimica Generale e Inorganica
100
DALTON
Dalton fu il primo chimico a formulare, nel 1803
una teoria atomica basata sulle intuizioni di
Democrito vissuto 2500 anni fa.
Secondo Dalton:
• Tutti i corpi sono costituiti da atomi indivisibili
• Gli atomi di uno stesso elemento sono tutti
uguali
• Nelle reazioni chimiche gli atomi rimangono
inalterati combinandosi in precisi rapporti.
24/11/2010
Chimica Generale e Inorganica
101
J. J. THOMSON
Fisico inglese che
nel 1880 scopre
l’elettrone.
Joseph John Thomson osservò che in un tubo con
neon con all’estremità due elettrodi collegati ad un
generatore si forma una scarica elettrica proveniente
dal catodo. Questi raggi catodici dovevano essere
costituiti da particelle di carica negativa ovvero gli
24/11/2010
Chimica Generale e Inorganica
102
elettroni.
GOLDESTEIN
Dopo la scoperta degli elettroni usando
apparecchiature simili furono individuate
particelle che venivano attratte dal catodo.
Da queste osservazioni Goldestein scoprì
la seconda particella fondamentale: il
24/11/2010
Chimica Generale e Inorganica
103
protone.
PLANK
Il fisico tedesco Max Plank con la sua
teoria qantistica portò notevole
contributo al successivo modello di
Bohr. Secondo Plank l’energia
aumenta secondo tappe fisse definite
quanti da immaginare come pacchetti
di energia.
24/11/2010
Chimica Generale e Inorganica
104
RUTHERFORD
Nel 1911 Lord Rutherford in seguito all’esperimento
qui sopra è riuscito a formulare il modello nucleare
24/11/2010
Chimica Generale e Inorganica
105
planetario
I grandi angoli di deflessione delle paricelle alfa si potevano spiegare solo
ideando un nuovo modello atomico. Lo fece nel 1911 Ernest Rutherford, il
quale assunse che gli atomi fossero dotati di un nucleo centrale in cui
risiede quasi tutta la sua materia.
Nonostante avesse introdotto il concetto rivoluzionario e corretto di nucleo,
il modello di Rutherford risultò insoddisfacente sotto due punti di vista. Per
prima cosa, non spiegava le emissioni e gli assorbimenti di onde
elettromagnetiche da parte degli atomi osservate in spettroscopia. Ma,
soprattutto, non giustificava la stabilità degli atomi.
24/11/2010
Chimica Generale e Inorganica
106
BOHR
24/11/2010
Chimica Generale e Inorganica
107
TEORIA DEGLI ORBITALI
Nel 1913 il fisico danese Niels Bohr
concepì un modello capace di
conciliare il concetto di nucleo con
stabilità degli atomi. Secondo il modello
di Bohr, non tutte le orbite circolari
sono permesse. Gli elettroni possono
muoversi solo su quelle che hanno una
distanza dal nucleo ben definita.
Questo meccanismo proposto da Bohr
era in grado di spiegare le
caratteristiche principali delle righe
spettrali
dell’atomo di idrogeno e
questo fatto contribuì al successo del
modello
24/11/2010
Chimica Generale e Inorganica
108
Righe spettrali idrogeno
24/11/2010
Chimica Generale e Inorganica
109
Linee di emissione dell’idrogeno
24/11/2010
Chimica Generale e Inorganica
110
Linee di Emissione dell’idrogeno
Paschen Series
Balmer Series
4352435
132
Lyman Series
24/11/2010
Chimica Generale e Inorganica
111
LA MECCANICA ONDULATORIA
Albert Einstein fu il primo, nel 1905, a intuire che la luce, e
quindi tutta la radiazione elettromagnetica, può essere
descritta come un insieme di particelle che ne trasportano
l’energia: i fotoni.
Nel 1924 il fisico francese Louis De Broglie, in analogia con il
caso della luce, propose di studiare le proprietà
ondulatorie degli elettroni e, più in generale, di tutte le
particelle. Secondo De Broglie, l’elettrone poteva essere
descritto come un’onda. Per farlo si dovevano collegare i
parametri fondamentali dell’onda a grandezze fisiche
appartenenti all’elettrone.
Nel 1927 Heisenberg formulò il principio di indeterminazione
che porta il suo nome. Questo principio afferma che è
impossibile conoscere simultaneamente e con precisione
la posizione e la velocità di una particella elementare.
24/11/2010
Chimica Generale e Inorganica
112
EINSTEIN
Il modello di Bohr però presentava ancora
dei limiti: infatti non riusciva a calcolare le
orbite degli elettroni molto lontani dal
nucleo. Le orbite di questi elettroni
saranno descritte da Albert Einstein nella
teoria della relatività ristretta.
24/11/2010
Chimica Generale e Inorganica
113
W. PAULI
Nel 1925 Wolfgan Pauli osserva per la
prima volta che i due elettroni presenti
nell’orbitale non possono mai avere gli
stessi numeri quantici per cui il loro spin
deve essere opposto (lo spin, +½ o - ½
indica la possibilità di un elettrone di
ruotare in un senso o nell’altro attorno al
proprio asse). Questo principio è noto
come principio di esclusione di Pauli.
24/11/2010
Chimica Generale e Inorganica
114
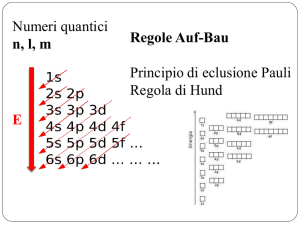
IL PRINCIPIO DI
ESCLUSIONE DI PAULI
Quando in un atomo si ha più di un elettone nasce
anche il problema della loro disposizione nei
vari sottogusci da parte degli elettroni atomici
avviene sulla base di due criteri molto
importanti:
1. Raggiungimento di uno stato di energia
minima da parte dell’atomo;
2. Il numero di elettroni accettato da ogni
sottoguscio è imposto dall’altro, fondamentale
criterio: il principio di esclusione di Pauli.
Secondo tale principio, in un atomo non
possono esistere due elettroni che abbino gli
stessi numeri quantici.
24/11/2010
Chimica Generale e Inorganica
115
E. SCHROEDINGER
1887-1961
Erwin Schroedinger pubblica nel 1926
un saggio riguardante un’equazione
con la quale era possibile calcolare la
funzione d’onda dell’elettrone e
quindi calcolare la probabilità di
trovare un elettrone in un dato punto
dell’orbitale e anche il suo livello
energetico.
24/11/2010
Chimica Generale e Inorganica
116
L’equazione di Schroedinger e le
funzioni d’onda
La forma delle funzioni d’onda che descrivono gli elettroni,
si determina risolvendo l’equazione di Schrodinger.
Nell’equazione di Schrodinger compare per la prima
volta (L) il numero quantico secondario.
L’equazione di Schorodinger può essere risolta
esattamente solo nel caso dell’atomo di idrogeno. Se
l’atomo ha più di un elettrone bisogna rinunciare a una
descrizione completa e trascurare alcuni aspetti
secondari. Ciononostante l’equazione di Schrodinger è
risultata essere uno strumento teorico potentissimo a
disposizione dei fisici atomici. Grazie a questa e più in
generale alla meccanica quantistica, l’atomo non ha più
segreti.
24/11/2010
Chimica Generale e Inorganica
117
W. HEISENBERG
1901-1976
Nel 1927 Wemer Heisenberg formulò
in principio di indeterminazione
secondo il quale è impossibile
conoscere simultaneamente e con
precisione sia la posizione, sia la
velocità di una particella. Questo
principio è alla base della
meccanica quantistica.
24/11/2010
Chimica Generale e Inorganica
118
J. CHADWICK
Nell’atomo oltre a protone ed elettrone
esiste
un’altra
particella
restata
inosservata fino al 1932, quando
James Cadwick scoprì la presenza
all’interno del nucleo del neutrone
particella priva di carica e di massa
molto simile a quella del protone.
24/11/2010
Chimica Generale e Inorganica
119
Le particelle fondamentali
Nel 1968, negli Stati Uniti, si scopre che protone e
neutrone non sono due particelle fondamentali, in quanto
sono composte da particelle ancora più piccole: i Quark. I
Quark che costituiscono i nucleoni sono i Quark up down,
gli elettroni fanno parte della famiglia dei leptoni assieme
ai vari tipi di neutrini. A tenere uniti i tre quark all’interno
del protone c’è la forza nucleare forte, la cui forza
residua tiene a sua volta uniti i vari nucleoni. Queste sono
le caratteristiche principali del modello standard, il
modello attualmente accettato per la descrizione delle
paricelle fondamentali
24/11/2010
Chimica Generale e Inorganica
120
24/11/2010
Chimica Generale e Inorganica
121
L’ANTIMATERIA
Nel 1932 è scoperto un elettrone con carica positiva
subito battezzato positone. Il positone è l’anti
particella dell’elettrone, uguale in tutto fuorché
nella carica. L’esistenza dell’antimateria era già
stata prevista dal fisico inglese Paul Dirack.
Nel 1997 in laboratorio viene prodotto il primo atomo
di anti idrogeno, mettendo insieme positoni e anti
quark.
24/11/2010
Chimica Generale e Inorganica
122