CHIMICA Thomas Fraling L’atomo 1. Modelli atomici Tra i molti scienziati che studiarono l’atomo spicca J. Thomson, il quale contribuì notevolmente alla scoperta del modello atomico. Lui fu il primo a dire che dentro all’atomo ci sono più cariche, precisamente due: positiva e negativa; dunque fu anche il primo a parlare dell’esistenza di elettroni. Thomson immaginò l’atomo come una sfera costituita da carica positiva, cioè pieno, all’interno della quale si trovano gli elettroni, in numero tale che la carica totale sia nulla. = Elettrone (carica negativa) Modello atomico 2+ di Thomson Thomson non seppe determinare con precisione la carica dell’elettrone, ma gli attribuì la carica -­‐ 1 u.e.s. (unità elettrostatica). Come si vede nel disegno le cariche si annullano: due cariche positive e due cariche negative. Questo modello venne anche chiamato modello dell’anguria o a panettone. Thomson dunque immagina l’atomo pineo e divisibile, perché queste particelle possono essere strappate dall’atomo. L’idea degli elettroni sarà confermata successivamente da Rutherford. E. Rutherford, nella speranza di ottenere informazioni, fece eseguire un esperimento di diffusione delle particelle α (alfa) attraverso un sottile foglio metallico. Decise di usare come pistola il radio, emettitore naturale di particelle, furono perfetti per l’esperimento perché Rutherford scoprì che il radio era doppiamente ionizzato e dunque aveva perso due elettroni (carica 2+). Questi proiettili furono in grado di attraversare la sottile lastra di metallo. Si affermò quanto detto da Thomson: le particelle α deviarono, attraversando la lastra di metallo. Questa deviazione è dovuta alla presenza di elettroni all’interno dell’atomo, essendo di carica opposta delle particelle α. Gli atomi sono distribuiti in modo omogeneo e le deviazioni sono completamente casuali. Quando Rutherford vide che alcune particelle α tornarono indietro, al posto di subire solamente di una deviazione, propose un nuovo modello atomico. Rutherford scoprì che la materia all’interno dell’atomo non è distribuita omogeneamente: l’atomo è quasi interamente vuoto e la maggior parte della materia si trova nel nucleo di carica positiva, intorno ad esso orbitano gli elettroni (-­‐). Il nuovo modello prese il nome di modello orbitale di Rutherford. Naturalmente le particelle α che passano a una grande distanza dal nucleo subiranno una deviazione molto piccola, mentre l’elettrone viene strappato dall’atomo (ionizzazione); le particelle α che passano vicino al nucleo provocano una grande deviazione o addirittura rimbalzano. Marzo 2013 1 CHIMICA Thomas Fraling L’atomo Rutherford immaginò l’atomo in questo modo, già più vicino alla realtà: = elettrone (negativo) Modello atomico di Rutherford = nucleo (positivo) Attraverso l’esperimento eseguito, Rutherford poté stimare il diametro del nucleo dell’atomo di oro (oro fu il materiale più adeguato per l’esperimento): il diametro del nucleo è circa 1 / 20.000 del diametro dell’atomo. Dopo l’elettrone (e-­‐) fu scoperto il protone (p+). L’idrogeno ionizzato ha carica +1, vuol dire che ha solamente un elettrone; H+ ha una massa di 1 uma e dunque Thomson disse che era costituito da una particella elementare chiamata protone. L’atomo di idrogeno è dunque formato da un protone di carica +1 e di massa circa 1 uma e di un elettrone di massa circa 1 / 20.000 di uma e di carica -­‐1: l’atomo e neutro e di massa complessiva circa 1 uma. Il secondo elemento esaminato fu l’elio: ha massa di circa 4 uma e possiede due elettroni, di conseguenza deve possedere due cariche positive, ossia due protoni; ma un atomo formato da due protoni e due elettroni avrebbe massa di circa 2 uma e non 4 uma. Nel 1920, Rutherford, ipotizzò l’esistenza di una seconda particella all’interno del nucleo priva di alcuna carica elettrica, la chiamò neutrone (n). Nel 1932 l’ipotesi si confermò, grazie agli studi di un allievo di Rutherford, Chadwick. Grazie a questo si risolsero due problemi: avendo la massa di circa 1 uma il neutrone, la massa complessiva dell’elio risultò giusta, cioè due protoni e due neutroni nel nucleo e 2 elettroni al di fuori del nucleo hanno massa di circa 4 uma; inoltre il neutrone dimostrò la presenza di forze forti, senza le quali l’atomo tenderebbe a separarsi a causa delle forze repulsive dei protoni (p+). Sulla base delle scoperte dell’elettrone, del protone e del neutrone l’atomo viene definito da due numeri: A e Z. A sta per la somma del N° di neutroni (n) e il N° di protoni (p+), invece Z sta per il numero di protoni (Z è indicato sulla tabella periodica degli elementi). A e Z sono indicati in questo modo accanto al simbolo dell’atomo: Un esempio per capire meglio: 13C (carbonio 13), Z non viene indicato di solito perché si A trova sulla tabella periodica degli elementi. A = N° di massa nuclidica, inoltre indentifica l’isotopo (vedi dopo); Z = N° atomico. Z NB: A ≠ massa dell’elemento. Gli elettroni corrispondono al numero di protoni ma solamente se non sono presenti cariche, cioè quando l’atomo è neutro; se sono invece presenti delle cariche positive o negative e l’atomo è dunque ionizzato bisogna seguire questo schema: Xn+ N°e-­‐ = Z -­‐ n Xn-­‐ N°e-­‐ = Z + n NB: nello schema sopra la “n” non indica i neutroni, ma di quante cariche è dotato l’atomo. X Marzo 2013 2 CHIMICA Thomas Fraling L’atomo Schematizziamo e fissiamo i concetti fondamentali del capitolo 1: 1 -­‐ Modello atomico di Thomson: sfera costituita da carica positiva, cioè piena, all’interno della quale si trovano gli elettroni (e-­‐), in numero tale che la carica totale sia nulla. 2 -­‐ Esperimento di Rutherford: diffusione delle particelle α attraverso una lastra metallica molto sottile (oro). Le particelle α subirono delle deviazioni a causa degli elettroni. Grazie ad esso possiamo affermare la presenza di elettroni e la carica positiva del nucleo. 3 -­‐ Modello atomico di Rutherford: l’interno dell’atomo non è omogeneo, infatti la maggior parte della materia si trova nel nucleo di carica positiva, attorno ad esso orbitano gli elettroni in modo che la carica sia nulla. Tra il nucleo e gli elettroni c’è niente, il vuoto. 4 -­‐ Scoperta del protone e del neutrone: il protone è la parte positiva del nucleo, invece i neutroni sono privi di alcuna carica elettrica, ma sono dotati di cosiddette forze forti grazie alle quali i protoni non si respingono, essendo della stessa carica. Il neutrone fu una logica successione della scoperta del protone, visto il problema dell’elio. 5 -­‐ Per indicare il N° di protoni (p+) usa Z, la somma dei protoni e neutroni (n) si indica con A. Il N° di elettroni (e-­‐) è uguale al N° di protoni ma non se l’atomo è ionizzato perché in quel caso bisogna sottrarre le carica a Z se l’atomo è positivo e aggiungere le cariche a Z se è negativo. Massa Carica +
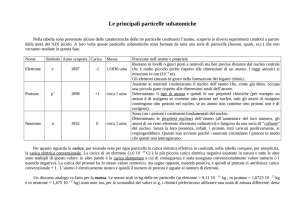
Protone (p ) 1,0073 uma + 1 u.e.s. Neutrone (n) 1,0087 uma (neutro) -­‐
-­‐4
Elettrone (e ) 5,520 x 10 uma -­‐ 1 u.e.s. Nota dell’autore: Per maggiori informazioni e in preparazione al test sarebbe utile leggere la scheda sulla natura elettrica della materia, si trova tra i fogli del fascicolo sull’atomo. Naturalmente potete consultare tutte le schede sull’atomo, per ulteriori approfondimenti o specificazioni. Il prossimo capitolo sarà sugli isotopi e sull’isotopia, argomento legato all’atomo tramite i neutroni e protoni. Inoltre devo sottolineare un fatto molto importante: questo riassunto non è fatto per studiare in preparazione al test, ma solamente per ripassare quello che uno dovrebbe già sapere. Non voglio evitare a nessuno di leggere i miei documenti riassuntivi ma voglio evitare che poi qualcuno si lamenta di aver preso un voto non abbastanza sufficiente a causa delle mie spiegazioni sbagliate; inoltre non voglio che questo documento sia visto come la base di studio per l’esame, ma vale la pena leggerlo una volta per appunto rivedere e ricontrollare le conoscenze sull’argomento. A tutti voi che mi fate il piacere di leggere i miei riassunti: grazie. Questo grazie è rivolto a tutti i cari lettori e anche a quelli che forse per sbaglio lo hanno usato come bigino durante un test. Vi auguro, anche per i successivi anni, un buon proseguimento nella lettura dei miei documenti riassuntivi, che, ricordo, sono fatti per semplificarvi la preparazione a degli esami tanto difficili. Marzo 2013 3 CHIMICA Thomas Fraling L’atomo 2. Gli isotopi e l’isotopia Il primo problema che indusse gli scienziati a parlare di isotopi, fu la massa del cloro. Il cloro ha 17 protoni e 17 elettroni che assieme hanno una massa di 17 uma, ma la massa dell’atomo risulta di 35.5 uma, se si tolgono i 17 uma dalla massa dell’atomo arriviamo a una massa restante di 18.5 uma, numero che non si giustifica (non ci possono essere 18 e mezzo neutroni nel nucleo). Sembra quasi che ci sono più atomi dello stesso tipo ma con masse diverse e che 35.5 sia la media tra le due masse. Questi atomi identici dal punto di vista chimico ma con masse diverse furono chiamati isotopi. L’esistenza degli isotopi si dimostrò con lo spettrografo di massa, con il quale Thomson e Aston eseguirono un esperimento nel 1912. Degli ioni Ne+ vennero accelerati da una lastra caricata negativamente e dotata di una fessura la quale lasciò passare uno stretto fascio di ioni. In seguito gli ioni vennero deviati da un campo magnetico e finendo su una lastra fotografica. Si osservò che gli ioni arrivarono in due punti della lastra, dunque, essendo alla stessa velocità e avendo l’identica carica positiva, solo una differenza di massa poté spiegare la deviazione. Grazie all’osservazione della deviazione, Thomson riuscì a determinare la massa dei due atomi: 20 e 22 uma. Il primo atomo possiede perciò 10 protoni, 10 elettroni e 10 neutroni, invece il secondo possiede 10 protoni, 10 elettroni ma 12 neutroni. Definiamo cosa è un isotopo: -­‐ sono atomi che hanno lo stesso numero atomico (N° p+) ma un numero diverso di neutroni (in sintesi cambia A, ma rimane uguale Z). Adesso però sorge una domanda: perché la massa media del neon (Ne) è di 20.1 e non di 21, avendo due isotopi di massa 20 e 22? La riposta è semplice: Il 20Ne è molto più presente in natura rispetto al 22Ne, precisamente il 20Ne costituisce il 90% del neon presente in natura. Del carbonio ci sono 3 isotopi, il 12C, il 13C e il 14C. Il 12C è presente con il 98,9 % in natura, gli altri due isotopi sono presenti in pochissime quantità. Per questa ragione la Commissione dei Paesi Atomici ha deciso di definire il 12C come elemento di riferimento per le masse atomiche degli elementi e l’hanno usato per definire la mole: siccome la massa di un atomo di 12C è esattamente 12 uma, una mole corrisponde al numero degli atomi che ci sono in 12 g di 12C (6.022 x 1023). Ecco l’atomo definitivo secondo il modello orbitale, basato sugli studi di Thomson e Rutherford. Le palline rosse indicano i protoni, invece le palline nere sono gli elettroni che si trovano al di fuori del nucleo. Oltre ai protoni nel nucleo troviamo i neutroni (palline blu) che rendono possibile la tranquilla vicinanza dei protoni, essendo tutti di carica positiva si respingerebbero, ma grazie ai neutroni si tengono assieme. Riassumendo: -­‐ Isotopi: atomi dello stesso elemento e a sua volta dotati delle stesse caratteristiche chimica, ma con numero di protoni diversi e perciò con masse diverse. Gli isotopi si identificano grazie ad A (N° di protoni più N° di neutroni), esempio: 12C, 13C e 14C (Z è uguale). Marzo 2013 4 CHIMICA Thomas Fraling L’atomo 3. Difetto di massa Massa Carica +
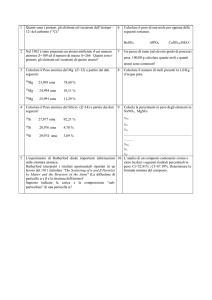
Protone (p ) 1,007276 uma + 1 u.e.s. Neutrone (n) 1,008665 uma (neutro) -­‐
-­‐4
Elettrone (e ) 5,549 x 10 uma -­‐ 1 u.e.s. La tabella sopra indica la massa (in uma) precisa del protone, del neutrone e dell’elettrone; cioè le tre particelle elementari che costituiscono gli atomi. Per spiegare meglio facciamo un esempio: 4
He è formato da 2 protoni, 2 neutroni e 2 elettroni; la somma delle masse delle particelle che costituiscono l’4He risulta essere 4,032980 uma, ma la massa dell’atomo di 4He è leggermente inferiore: 4,002603. La differenza tra la massa delle particelle che costituiscono un determinato atomo e la massa di questo atomo, si chiama difetto di massa; per il 4He il difetto di massa è: Δm = 0,030377 uma. Questa perdita di materia è dovuta alla liberazione di energia, a causa dell’unione delle particelle per formare l’atomo: la materia persa si è trasformata in energia. I processi che legano le particelle (e-­‐, n, p+) si chiamano processi nucleari. La famosa formula di Einstein lega la materia e l’energia: ΔE = Δm x c2; c = velocità della luce; ΔΕ energia liberata o utilizzata per creare materia. Riassumendo: il difetto di massa (Δm) è dovuto alla liberazione di energia, che necessita materia, durante la creazione di un atomo (processo nucleare); la materia persa è il difetto di massa. 4. La radioattività La radioattività è un processo spontaneo nel quale un atomo perde energia sotto forma di materia o sotto forma di onde elettromagnetiche (raggi γ). Essa fu scoperta nel 1896: si notò che l’uranio emise dei raggi capaci di attraversare la materia e che liberò tanta energia. In seguito Rutherford scoprì che esistono tre tipi di raggi: α, β e γ; i tre tipi di raggi furono deviati diversamente da un campo magnetico. 4.1 Il decadimento radioattivo Sappiamo che la radioattività è un fenomeno spontaneo, cioè non possiamo prevedere quando una singola trasformazione accadrà, e non possiamo impedirlo. Quando si ha un numero elevato di atomi radioattivi di un determinato tipo, si può invece calcolare quanti atomi subiranno una trasformazione. Visto che è possibile contare i singoli raggi α emessi da una nota quantità di atomi radioattivi in un determinato tempo, si può calcolare quanto tempo sarà necessario perché la 1
metà degli atomi subisca il decadimento. Questo tempo si dice tempo di dimezzamento (T 2 ), ad esempio: il tempo di dimezzamento del 238U è di 4,5 miliardi di anni. Per l’altra metà dell’uranio ci vorranno altri 4,5 miliardi di anni finché sia decaduto. Vale la pena ricordare che il decadimento radioattivo è un processo nucleare e si divide in decadimenti artificiali e naturali. Marzo 2013 5 CHIMICA Thomas Fraling L’atomo 4.1.1 Il decadimento α (naturale) Durante un decadimento α l’atomo subisce una notevole trasformazione: il numero di massa (A) diminuisce di 4, invece il numero atomico (Z) diminuisce di 2. Lo schema dunque è il seguente: A -­‐ 4
4
4
!
4
! X 2α + Z -­‐ 2 Y ; “” = decadimento α. α = He (Z = 2). Esempio: 206
210
4
84Po 2α + 82Pb Nell’esempio si può notare che la somma di A e Z rimane uguale, cioè si conserva; questa regola vale per tutti i decadimento che vedremo in seguito. Inoltre durante questo decadimento cambia l’isotopo. 4.1.2 Il decadimento β-­‐ (naturale) Durante un decadimento β-­‐ (= e-­‐) A rimane uguale, invece Z aumenta di 1. Lo schema generale è: o
A
A
Z X -­‐1β + Z+1Y Anche qui si può notare che la somma di A e Z rimane uguale prima e dopo il decadimento β-­‐. 4.1.3 Il decadimento γ (naturale) Durante un decadimento attraverso i raggi γ, A e Z rimangono uguali ma grazie al decadimento γ l’atomo si stabilizza, per esempio dopo un decadimento β-­‐. Infatti il decadimento γ avviene solo quando un atomo è contrassegnato con un asterisco (segno per instabilità), che viene tolto dopo il decadimento γ. Inoltre γ ha il numero atomico e il numero di massa uguale a 0. Il decadimento γ non fa cambiare l’isotopo, stabilizza solamente l’atomo. Esempio: o
60
60 *
(instabile) 27Co -­‐1β + 28Ni 60
!" *
0
(stabile) !"Ni 0γ + 28Ni 4.1.4 Il decadimento β+ (artificiale) o +
A
A
Z X +1β + Z-­‐1Y Dopo il decadimento, il numero di massa (A) rimane uguale, invece Z diminuisce di uno. Marzo 2013 6 CHIMICA Thomas Fraling L’atomo 4.1.5 Cattura elettrica (artificiale) A
A
Z X + C.E. Z-­‐1Y Durante questo decadimento artificiale un elettrone, dall’esterno, è entrato nel nucleo cambiando carica (e-­‐); il decadimento si può dunque scrivere così: 0
1
1
1p + -­‐1e 0n Si può notare sopra che anche in questo decadimento A e Z si conservano, come per tutti i tipi di decadimenti visti precedentemente. 4.1.6 I simboli dei decadimenti 2
2
2
! -­‐
! -­‐
1D = 1d = 1H !!β = !!e o +
3
3
o +
1T = 1H +1β = +1e 4
1
4
0n 2α = 2He 1 + 1
1p = 1H 5. Concentrazioni Prima di tutto definiamo cosa è una concentrazione: -­‐ esprime la quantità del soluto (massa, volume o moli) rispetto alla quantità della soluzione (m, v). Ci sono tre modi per esprimere la concentrazione, ecco le tre formule per calcolarle: -­‐ Concentrazione molare (CM): Moli del soluto CM = Volume della soluzione (in litri) (unità di misura: M, molare). Ne derivano le seguenti formule: Moli del soluto = CM x volume della soluzione (in litri) Moli del soluto Volume della soluzione (in litri) = Concentrazione molare Marzo 2013 7 CHIMICA Thomas Fraling L’atomo 5. Concentrazioni -­‐ Concentrazione massa / volume Massa del soluto (in grammi)
Cm/v = Volume della soluzione (in litri) (unità di misura: g/L). Ne derivano le seguenti formule: Massa del soluto = Cm/v x volume della soluzione (in litri) Massa del soluto Volume della soluzione (in litri) = Concentrazione massa / volume -­‐ Percentuale della massa Massa del soluto (in grammi) %m = Massa della soluzione (in grammi) x 100 Ne derivano le seguenti formule: Massa della soluzione (in grammi) x percentuale della massa Massa del soluto (in grammi) = 100
Massa del soluto (in grammi) Massa della soluzione (in grammi) = Percentuale della massa x 100 Come passare da una concentrazione / percentuale all’altra concentrazione / percentuale ? x M -­‐ CM Cm/v : M -­‐ Per poter convertire Cm/v e CM alla percentuale della massa o viceversa devo conoscere la densità della soluzione, perché: x densità Volume soluzione Massa della soluzione : densità NB: se in un esercizio non è espresso il solvente, è l’acqua. Marzo 2013 8