Immunologia
Antonio Nenna
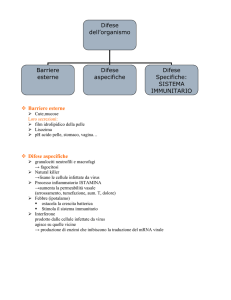
IMMUNITA’ INNATA
Immunità innata o naturale, per differenziarla dall’immunità acquisita o specifica.
Antigene: molecola capace di essere riconosciuta dal sistema immunitario, è self o non-self.
Immunogeno: molecola capace di evocare una risposta immunitaria.
Il self è generalmente non immunogeno. Il non-self può essere non immunogeno o immunogeno.
Immunità specifica: 3/5 gg. per attivare i sistemi di difesa (si attiva sempre dopo quella innata).
Immunità innata: si attiva immediatamente, riconosce l’immunogeno e attiva l’immunità acquisita. Si distingue in immunità tissutale, immunità cellulare e immunità molecolare.
PATTERN MOLECOLARE ASSOCIATO A PATOGENI (PMAP):
- solo negli organismi patogeni, altamente conservato (assente nel self)
- identificano strutture importanti per la sopravvivenza dei microrganismi
PATTERN RECETTORIALE DI RICONOSCIMENTO (PRR):
- riconoscono solo il non-self (se riconoscono il self causano malattie autoimmunitarie)
- attivano immunità innata e immunità acquisita (PRR => Imm.Inn. => Imm.Acq.)
- di tre classi (recettori secreti, recettori endocitici, recettori di segnale)
PRR: recettore nel sistema immunitario, riconosce il PMAP
PMAP: nei patogeni, è una struttura riconosciuta dal PRR
RECETTORI SECRETI: funzionano come opsonine (molecole che aderiscono alla parete dei patogeni e li circondano; sono riconosciuti dai recettori presenti nelle cellule del sistema immunitario). Ne fanno parte le
“lecitine che legano il mannosio”, poichè il mannosio è presente in tutte le pareti batteriche come prodotto
di glicosilazione. Queste lecitine sono prodotte dal fegato e sono delle proteine della fase acuta, riconoscono la parete batterica e sono responsabili dell’attivazione del complemento.
RECETTORI ENDOCITICI: sulla membrana dei fagociti (come i macrofagi). Riconoscono e legano direttamente il PMAP o le opsonine (recettori secreti legati ai batteri) [patogeno – opsonina – recettore endocitico per
le opsonine - macrofago]. Mediano la fagocitosi in associazione con il MHC2 e il burst respiratorio.
Recettori endocitici delle opsonine: anticorpo, complemento, lecitine, fibronectina, PCR,...
Recettori endocitici scavenger: riconoscono le LDL della parete batterica.
RECETTORI DI SEGNALE: nella membrana, riconoscono il PMAP e trasducono il segnale, producendo citochine che amplificano la risposta immunitaria. (endocitici => fagocitosi; di segnale => secrezione di sostanze
proinfiammatorie). Ne fa parte il “toll-like-receptor (TLR)”.
Immunologia
Antonio Nenna
MECCANISMO DI AZIONE DEL TLR-4
Sulla parete del batterio Gram-neg sono presenti dei lipopolisaccaridi (LPS).
Sul macrofago sono presenti CD14 e TLR-4.
LPS vengono legati a LPSBP (recettore secreto). Il complesso LPS/LPSBP trasferisce LPS su CD14. Il complesso CD14/LPS si attiva e interagisce con TLR-4, che trasduce il segnale. TLR-4, solo dopo che CD14 è attivo, va
ad attivare la produzione di citochine mediante l’attivazione della via NFkB (produzione di citochine infiammatorie: IL-1, IL-6, TNF) che richiamano i globuli bianchi.
L’attivazione di questa via ha tre importanti conseguenze:
- rimodellamento tissutale
- infiammazione (amplificazione Imm.Inn., attivazione Imm.Acq.)
- distruzione dei microrganismi
FAGOCITOSI:
1. recruitment dei fagociti nel sito di infezione
2. riconoscimento dei microbi da parte dei fagociti
3. fagocitosi
4. distruzione dei microbi fagocitati
1) RECRUITMENT DEI FAGOCITI NEL SITO DI INFEZIONE
I neutrofili e i monociti sono richiamati nel sito di infezione grazie al legame con molecole di adesione espresse dalle cellule endoteliali dei vasi. Le molecole di adesione vengono secrete in risposta alle chemochine prodotte dai macrofagi residenti in risposta all’infezione.
I macrofagi residenti situati nel sito di infezione riconoscono i microbi e secernono citochine (TNF e IL-1) e
chemochine. Il TNF e la IL-1 hanno la capacità di indurre l’espressione di specifiche molecole di adesione
sulla membrana delle cellule endoteliali. Tali molecole di adesione (E –selectina per i monociti, VCAM-1 per
i neutrofili, ICAM-1 per i linfociti) sono espresse in ordine temporale. Il legame dei fagociti alle cellule endoteliali che esprimono queste molecole di adesione (sono spesso delle venule post-capillari) causa il passaggio attraverso l’endotelio verso il sito extravascolare di infezione. Infine si ha coagulazione dei capillari.
2) RICONOSCIMENTO DEI MICROBI DA PARTE DEI FAGOCITI
I neutrofili ed i macrofagi esprimono sulla loro superficie recettori (pattern recettoriale di riconoscimento)
capaci di riconoscere nel sangue e nei tessuti i microbi e di attivare il processo di distruzione.
3) FAGOCITOSI
La fagocitosi è un processo ATP-dipendente, e si forma una vescicola chiamata fagosoma.
4) DISTRUZIONE DEI MICROBI FAGOCITATI
I neutrofili e i fagociti attivati distruggono i microbi presenti nei fagosomi mediante la produzione di molecole ad attività microbicida. Tale processo si verifica dopo la fusione del fagosoma con il lisosoma (fagolisosoma) presente nel citoplasma dei fagociti. Le sostanze ad attività microbiotica sono:
- radicali liberi dell’ossigeno (ROS), derivati dalla NADPH-ossidasi (NADPH + O2 => NADP + H+ + .O2-);
- ossido nitrico (NO), deriva dalla ossido-nitrico-sintasi (NOS) che è un enzima inducibile e normalmente inattivo nei macrofagi quiescenti. Nei fagolisosomi il NO si combina con H2O2 a formare i perossinitriti;
- enzimi proteolitici, capaci di digerire la componente proteica della parete batterica
Immunologia
Antonio Nenna
COMPONENTI CELLULARI DELL’IMMUNITA’ INNATA
macrofagi
natural killer
eosinofili, basofili, mastociti
eritrociti, piastrine
1) MACROFAGI
FUNZIONI DEI MACROFAGI:
- distruzione del microrganismo: utilizzando ROS, NO, enzimi proteolitici. Si eliminano patogeni (batteri e
virus), cellule necrotiche (tramite contatto cellulare), cellule apoptotiche (tramite recettore).
- presentazione dell’antigene al sistema immunitario specifico: funziona come APC (antigen-presentingcell) ed è il collegamento tra immunità innata e immunità acquisita. L’antigene è un peptide (da 9 a 30 aa)
che deriva dalla distruzione del microrganismo. La presentazione dell’antigene si divide in:
“processamento”, cioè la distruzione del microrganismo e la trasformazione in peptide;
“presentazione”, ovvero l’esposizione di peptide (non-self) e complesso MHC-2 (self), ai linfociti T-helper
(che esprimono il recettore TCR).
RECETTORI PRESENTI SUI MACROFAGI:
- presentano PRR presenti sulla membrana che riconoscono il PMAP sul microrganismo
- permettono di discriminare tra self e non-self
- recettori secreti, recettori endocitici, recettori di segnale (vd sopra)
- FCR (recettore del frammento C1): opsonizzazione e citolisi (fagocitosi) mediata dagli anticorpi
FCγR1: recettore ad alta affinità per il frammento C delle IgG (nei macrofagi)
FCγR3: recettore a bassa affinità per il frammento C delle IgG (nei natural killer)
- CR (recettore del complemento2): opsonizzazione e citolisi (fagocitosi) mediata dal complemento
Un numero maggiore di meccanismi aumenta le capacità di processamento e presentazione dei macrofagi.
Della classe dei macrofagi fanno anche parte le cellule dendritiche (come le c. di Kupffer del fegato).
OPSONIZZAZIONE E CITOLISI MEDIATA DAGLI ANTICORPI
- IgG, con FAB, opsonizzano il batterio (il batterio viene opsonizzato sia dalle IgG che dai recettori per il
mannosio, ovvero i recettori secreti) [le IgG possiedono una regione FAB (variabile, che lega l’antigene sulla
superficie del microrganismo) e una regione FCγ (fissa, che lega il recettore FCγR1 sul fagocita)+
- IgG, con FCγ, si legano al macrofago (macrofago / FCγR1macrofago / FCγIgG / IgG / FABIgG-batterio / batterio)
- interazione tra macrofago e batterio mediata da IgG
- attivazione del macrofago (fagocitosi e distruzione)
OPSONIZZAZIONE E CITOLISI MEDIATA DAL COMPLEMENTO
- C3b (parte del complemento) opsonizza il batterio
- il macrofago esprime CR3 (recettore per C3b) (macrofago / CR3macrofago / C3bbatterio / batterio)
- attivazione del macrofago (fagocitosi e distruzione)
1
Il “frammento C” è la porzione costante delle immunoglobuline (Ig).
Il “complemento” è un sistema di proteine sistetizzate dal fegato normalmente inattivo. Si attiva per invasione estranea. Le proteine, con azione chinasica, si attivano a catena per distruggere il microrganismo.
Queste proteine raggiungono il batterio ed espongono il complesso MAC, che perfora il batterio determinando lisi osmotica (dovuta ad ingresso di acqua e sali, poichè πbatterio < πfisiologica)
2
Immunologia
Antonio Nenna
2) NATURAL KILLER
FUNZIONI DEI NATURAL KILLER:
- distruzione delle cellule infettate da virus o altri microrganismi
- distruzione delle cellule tumorali
SISTEMI DI RICONOSCIMENTO DELL’ANTIGENE:
- CITOTOSSICITA’ CELLULARE ANTICORPO DIPENDENTE (ADCC): analoga alla citolisi anticorpo dipendente
dei macrofagi (nei macrofagi: tra macrofago e microrganismo) (nei NK: tra NK e cellula infettata/tumorale).
NK possiede il recettore FCγR3. IgG, tramite FAB, sulla parete batterica; tramite FCγ, sul recettore.
- RECETTORI KILLER-ACTIVATED O KILLER-INHIBITED: sulla superficie di NK. K-Act attivano i NK, K-Inh modulano negativamente NK. Il rapporto tra fattori attivanti e fattori inibenti regola la distruzione delle cellule
nucleate normali. K-Act riconoscono tutte le molecole sulla superficie delle cellule nucleate; K-Inh riconoscono molecole di MHC-1 sulla superficie delle cellule nucleate. In caso di infezione virale o di malattie autoimmuni si ha un deficit di MHC-1, che induce prevalenza di K-Act e causa la distruzione delle cellule.
L’attivazione contemporanea di K-Act e K-Inh ferma la distruzione cellulare.
DISTRUZIONE DELL’ANTIGENE:
La distruzione avviene tramite la polimerizzazione della perforina. Normalmente, questa proteina si trova
nel citoplasma di NK in forma monomerica. Quando NK sono attivati a causa del contatto con il target, i
monomeri polarizzano (migrano) verso la zona di contatto con il target, fuoriescono da NK e si polimerizzano formando la perforina matura. La perforina ha la forma di un cilindro cavo, che perfora la membrana citoplasmatica della cellla target, e causa morte cellulare tramite:
- comunicazione liquido interstiziale / citoplasma, con ingresso di acqua e sali, causando lisi osmotica
- attivazione della via estrinseca di apoptosi, con ingresso degli attivatori delle caspasi (gram-zyme)
3) EOSINOFILI, BASOFILI, MASTOCITI
Eliminano parassiti mediante cationi e ROS (in modo aspecifico). Partecipano alle reazioni allergiche.
4) ERITROCITI, PIASTRINE
Possiedono recettori per il complemento, e sono capaci di eliminare gli immunocomplessi circolanti.
Immunologia
Antonio Nenna
PROCESSAZIONE e PRESENTAZIONE DELL’ANTIGENE AI LINFOCITI T
Collegamento tra immunità innata e immunità acquisita.
Processazione dell’antigene estraneo: per antigeni batterici, nel fagocita (macrofago); il macrofago fagocita il batterio, lo processa e presenta peptide e MHC-2 ai linfociti T-helper.
Processazione dell’antigene citosolico: nella cellula infettata o tumorale; la cellula processa il microbo e
presenta peptide e MHC-1 ai linfociti T-citotossici.
LINFOCITI T: riconoscono la struttura amminoacidica primaria solo dei peptidi, tramite il recettore TCR; riconoscono il peptide solo se complessato con MHC sulla superficie cellulare.
LINFOCITI B: riconoscono la struttura amminoacidica terziaria di peptidi, proteine, acidi nucleici, polisaccaridi e lipidi; riconoscono l’antigene sia legato (opsonizzato con altre cellule, con MHC) che libero (nel sangue, senza MHC).
MHC-1: riceve un peptide di 9-11 aa. con specifici aa. terminali (estremità della tasca sono chiuse)
MHC-2: riceve un peptide di 9-30 aa. senza specifici aa. terminali (estremità della tasca sono aperte)
Il complesso MHC/peptide non self:
- avviene sulla superficie delle cellule infette o tumorali, utilizzando MHC-1
- avviene sulla superficie dei macrofagi, utilizzando MHC-2
- è riconosciuto dai linfociti T (helper o citotossici) mediante un legame non covalente, a bassa affinità (poca
forza di legame), a bassa specificità, a lunga durata (stabile). L’interazione avviene a livello dei TCR.
MHC1-2/peptide-non-self + TCRcitotossici-helper
La specificità della risposta immunitaria è data dalla capacità di TCR del linfocita T di legare uno specifico
complesso MHC/peptide. Esiste un TCR per ogni antigene (self o non-self) esistente in natura; dopo
l’incontro con l’antigene si moltiplica quel clone di linfociti T. Per ogni batterio vengono comunque evocate
delle risposte policlonali (espressione di più antigeni), dovute alla produzione di più peptidi antigenici da un
batterio di partenza, e si ha quindi la produzione di popolazioni differenti di linfociti T. E’ necessaria una
quantità di antigene molto ridotta per attivare la risposta immunitaria specifica.
Nell’organismo ci sono quattro sistemi di controllo per rilevare la presenza dell’antigene:
1) MACROFAGI. Il microbo che supera la barriera dell’epidermide incontra i macrofagi residenti (c. di Langerhans nella pelle, c. dendritiche nel tratto gastrointestinale e nel tratto respiratorio) che riconoscono il
PMAP sul microbo, lo fagocitano e producono citochine e fattori di crescita. Queste sostanze producono:
- attivazione del metabolismo => amplificazione della risposta infiammatoria
- cambiamento della morfologia cellulare => migrazione (per perdita della capacità adesiva sul connettivo)
I macrofagi penetrano nei vasi linfatici e nei capillari, e durante il percorso (dopo la fagocitosi del microbo)
processano l’antigene in un peptide e producono MHC-2, ed entrambi vengono esposti sulla superficie.
I macrofagi (Antigen Presenting Cells, APCs) tramite i vasi linfatici e i capillari, migrano verso i linfonodi e gli
organi linfoidi (milza), dove avviene l’attivazione del sistema immunitario specifico mediante l’incontro tra
macrofago (contenente il peptide antigenico nella tasca di MHC-2) e i linfociti T vergini (che non hanno mai
incontrato l’antigene).
2) PLACCHE DI PEYER, ANELLO DI WALDAYER. Tessuto linfatico che controlla i tratti GI e respiratorio.
3) MILZA. APC residenti catturano gli antigeni liberi nel sangue e li presentano ai linfociti T splenici.
4) LINFONODI. APC residenti catturano gli antigeni liberi nel sistema linfatico e li presentano ai linfociti T.
APC: macrofagi (c. di Kupffer), linfociti B, c. dendritiche (c. di Langerhans), c. endoteliali
I neutrofili hanno capacità fagocitaria, ma non sono capaci di presentare l’antigene (spazzini).
Immunologia
Antonio Nenna
PROCESSAZIONE DELL’ANTIGENE ESTRANEO.
Da batterio a peptide, nel macrofago, con MHC-2, ai linfociti T-helper.
- captazione delle proteine batteriche nelle AMP (contatto macrofago/batterio, cioè PRR riconosce PMAP
tramite: FCγR1, C3b per opsonizzazione complemento-dipendente, anticorpi per opsonizzazione anticorpodipendente, recettori delle lecitine, scavenger per LDL).
- pinocitosi, con formazione dell’endosoma; fusione dell’endosoma con il lisosoma => endolisosoma.
- degradazione delle proteine in peptidi, con ATP, proteasi acide (catepsina), ROS e RNS.
- trasporto di MHC-2, sintetizzato nel RER/Golgi, fino all’endolisosoma tramite vescicole. Il trasporto è effettuato in un complesso con MHC-2/C.I. (Catena Invariante, una proteina che occupa la tasca di legame
del MHC-2, formata da “clip” che si lega a MHC-2 e “parte esterna” che rimane libera). La C.I. ha tre funzioni: impedisce che la tasca di legame di MHC-2 per il peptide non-self processato sia occupata erroneamente
da peptidi self; favorisce il ripiegamento e l’assemblaggio di MHC-2 (chaperone); indirizza MHC-2 dal RER
all’endolisosoma. Il legame MHC-2/C.I. si forma nel RER, e la sintesi della C.I. è contemporanea a MHC-2.
- internalizzazione di MHC-2/C.I. nell’endolisosoma contenente il peptide batterico processato.
- distacco della C.I. da MHC-2 per lasciare posto al peptide non self. Inizialmente gli enzimi proteolitici distaccano la parte esterna della C.I., lasciando il complesso MHC-2/clip. A questo punto HLA-DM “scambiatore di peptidi”, analogo strutturale di MHC-2, rimuove il clip (lo sottrae a MHC-2, formando HLA-DM/clip),
lasciando libera la tasca di legame di MHC-2, formando MHC-2/peptide-non-self.
- formazione di una vescicola dall’endolisosoma, che raggiunge la membrana cellulare
- esposizione di MHC-2/peptide-non-self, per i linfociti T-helper3.
PROCESSAZIONE DELL’ANTIGENE CITOSOLICO.
Da antigene virale o tumorale a peptide, nella cellula infettata (target), con MHC-1, ai linfociti T-citotossici.
- produzione delle proteine citosoliche, nel citoplasma, tramite il proteasoma, in peptidi di 6-30 aa.
- trasporto dei peptidi processati, dal citosol al RER, dove sta avvenendo la sintesi di MHC-1. Nel macrofago
è MHC-2 che raggiunge il peptide (vd. sopra); nella c. target è il peptide che raggiunge il MHC-1.
- trasportatore TAAP (Transporter Associated with Antigen Processing), proteina transmembrana, forma
un eterodimero sulla superficie del RER. Ha una estremità esterna al RER (verso il citosol), che raccoglie il
peptide direttamente al di sotto del proteasoma. Ha una estremità interna al RER (verso il lume del RER), a
contatto diretto con MHC-1, tramite la proteina tapasina. Il peptide esce dal proteasoma e viene catturato
da TAAP-est, che trasloca il peptide utilizzando ATP, e TAAP-int deposita il peptide su MHC-1.
- MHC-1/peptide-non-self dal RER al Golgi, per la glicosilazione di MHC-1.
- formazione di una vescicola dal Golgi, che raggiunge la membrana cellulare.
- esposizione di MHC-1/peptide-non-self, per i linfociti T-citotossici.
3
I peptidi self (autologhi) vengono normalmente processati, e normalmente si legano a MHC-2. La malattia
autoimmunitaria non si scatena perchè non esistono linfociti T che abbiano TCR che riconosce antigeni self.
Questi linfociti vengono selezionati, soprattutto nel timo, tramite i processi di selezione positiva (eliminazione) e selezione negativa (inattivazione).
Immunologia
Antonio Nenna
ORGANI LINFOIDI
Organi linfoidi primari: midollo osseo, timo.
Organi linfoidi secondari: milza, linfonodo, MALT
MIDOLLO OSSEO
- localizzato all’interno delle ossa, tra le trabecole del tessuto osseo spugnoso. Il parenchima è irrorato dai
vasi che provengono dalle aa. midollari, per la nutrizione delle ossa.
- fornisce 106 cellule al secondo.
- le cellule della linea mieloide e linfoide si sviluppano dalle cellule staminali pluripotenti sotto lo stimolo di
fattori di crescita (CSF) prodotti dalle cellule stromali, endoteliali e staminali del midollo stesso.
TIMO
- nel mediastino anteriore, lobulare, con zona corticale e zona midollare- è occupato dalle cellule staminali di tipo linfoide derivate dal midollo osseo che differenziano in linfociti T.
- è il sito di maturazione delle cellule T, con un gradiente maturativo dalla corticale alla midollare.
- induce e sviluppa la tolleranza immunitaria verso il self.
LINFONODO
- follicoli con linfociti B (stimolati dall’antigene, proliferano e maturano producendo anticorpi).
- paracorticale con linfociti T (rispondono agli antigeni della via linfatica).
- nei manicotti peri-arteriolari avviene l’interazione tra linfociti B e linfociti T.
MILZA
- nel quadrante superiore sinistro dell’addome; il parenchima è avvolto dalla capsula
- funzione simile a quella linfonodale (linfonodo: antigeni della linfa; milza: antigeni del sangue)
ALTRI ORGANI LINFOIDI
- MALT (tessuto linfoide associato alle mucose): placche delPeyer, anello di Waldeyer, appendice.
- SALT (tessuto linfoide associato alla cute): linfociti in epidermide e derma.
Immunologia
Antonio Nenna
CINETICA DELLA RISPOSTA UMORALE
IgA: immunità delle mucose
IgD: recettore per l’antigene dei linfociti B naive
IgE: difesa dai parassiti, ipersensibilità immediata
IgG: opsonizzazione, attivazione del complemento, citotossicità cellulare mediata dagli anticorpi (ADCC),
immunità neonatale, inibizione a feedback dei linfociti B
IgM: recettore per l’antigene dei linfociti B naive, attivazione del complemento.
La risposta anticorpale contro antigeni proteici richiede T-helper che attivano B (le proteine sono antigeni
timo-dipendenti). La risposta anticorpale contro antigeni multivalenti (polisaccaridi, lipidi, ac. nucleici)
non richiede la cooperazione dei linfociti T (polisaccaridi sono antigeni timo-indipendenti).
RISPOSTA PRIMARIA: ad opera delle cellule B naive. Le IgM sono predominanti.
- fase di latenza: tra la somministrazione dell’antigene e la comparsa delle Ig nel siero.
- fase di incremento: Ig incrementano in maniera esponenziale.
- fase stazionaria: la degradazione delle Ig è uguale alla loro sintesi.
- fase di declino: Ig diminuiscono fino a livello pre-immunizzazione.
RISPOSTA SECONDARIA: ad opera delle cellule B memory, le IgG sono predominanti, ha fase di latenza breve, fase di incremento pià rapida, fase stazionaria più lunga, fase di declino più lenta. Serve quantità minore
di anticorpo rispetto alla risposta primaria.
RISPOSTA PRIMARIA: TUTTI GLI IMMUNOGENI (timo-dipendenti e timo-indipendenti)
RISPOSTA SECONDARIA: SOLO GLI ANTIGENI PROTEICI (timo-dipendenti)
RISPOSTA ANTICORPALE TIMO-DIPENDENTE
- avviene a livello dei linfonodi, per antigeni peptidici
- antigene è preso dalle c. dendritiche e presentato ai linfociti T-helper
- T-helper attivati sono indotti a esprimere CD40L e citochine
- T-helper attivati migrano verso il follicolo seguendo il gradiente di chemochine
- attivazione di linfociti B da antigene solubile o da antigene legato alle c. dendritiche
- B processa e presenta l’antigene, alterando le chemochine superficiali, e migra verso T
- T e B interagiscono: B sono attivati da CD40L e chemochine prodotte dai T
- B proliferano e si differenziano (aumento dell’espressione di MHC-2, molecole costimolatorie B27, Ig)
Nella risposta secondaria, i cloni espansi di linfociti B-memory specifici per un antigene funzionano come
APC (presentano l’antigene ai linfociti T specifici per quell’antigene).
Interazione linfociti T / linfociti B: contatto fisico, citochine di linfociti T
MATURAZIONE DEI LINFOCITI
- switch isotipico, per ricombinazione dovuta allo scambio genico
- maturazione di affinità
- diminuzione di specificità
- memoria immunologica (rapida risposta in occasione di una nuova esposizione)
Immunologia
Antonio Nenna
CITOCHINE
- condizionano il tipo di anticorpo prodotto (favoriscono lo switch isotipico selettivo; le citochine possono
promuovere il passaggio verso IgG o IgE, ma non entrambi)
- amplificano la proliferazione e la differenziazione dei linfociti B
- più citochine agiscono in modo sinergico o antagonista su B
citochine di proliferazione: IL-2, IL-4, IL-5
citochine di switch isotipico:
- verso IgG => IL-2, INF-γ
- verso IgM => IL-2, IL-4, IL-5
- verso IgE => IL-4
- verso IgA => IL-5
RISPOSTA ANTICORPALE TIMO-INDIPENDENTE
Avviene per polisaccaridi, glicolipidi, acidi nucleici. Non c’è maturazione poichè non si ha la risposta secondaria. Ciò causa l’impossibilità di ipersensibilità ritardata.
La risposta umorale timo-indipendente è l’unico meccanismo di difesa contro molte infezioni batteriche.
Immunologia
Antonio Nenna
COMPLESSO MAGGIORE DI ISTOCOMPATIBILITA’ (MHC)
- È una regione costituita da geni polimorfi, i cui prodotti sono espressi sulla superficie di molti tipi cellulari.
- Le proteine codificate dai geni MHC sono dette antigeni MHC e sono responsabili del rigetto del trapianto
e della risposta immune specifica ad antigeni proteici. Subiscono una intensa glicosilazione.
- Ricevono ed espongono sia antigeni self che antigeni non self.
- I linfociti T riconoscono l’antigene solo se nella tasca di MHC.
- I geni MHC sono codominanti (vengono espressi entrambi gli alleli).
- Linkage disequilibrium: certi alleli MHC in loci differenti vengono ereditati insieme (come DB27 per la
spondilite anchilosante).
Esistono due classi MHC:
- i T-helper (CD4+) con il loro TCR riconoscono il complesso MHC-2/antigene, sulle APC
- i T-citotossici (CD8+) con il loro TCR riconoscono il complesso MHC-1/antigene, su c. infettate
MHC-1
Eterodimero formato da due catene polipeptidiche (α pesante, β leggera “β2-microglobulina”).
Β2-MICROGLOBULINA: extracitoplasmatica, si lega in modo non covalente alla catena α.
CATENA α: transmembrana, con N-term extracitoplasmatico e C-term intracitoplasmatico.
La catena α possiede quattro regioni:
- regione di legame con il peptide. Le subunità α1 e α2 formano le pareti e il pavimento della tasca, che è
piccola a causa delle estremità chiuse, riuscendo e legare peptidi di 9-11 aa. Nelle pareti e nel pavimento
della tasca sono presenti residui polimorfici. Il polimorfismo genera enorme variabilità, e così MHC è in grado di legare praticamente infiniti antigeni estranei. Altri residui polimorfici interagiscono con il TCR (polimorfico). Quindi il linfocita T interagisce sia con l’antigene associato a MHC, sia direttamente con MHC. SI
viene quindi ad avere una triplice interazione: peptide/tasca, peptide/TCR, tasca/TCR.
- regione di tipo immunoglobulinico. Le subunità α3 e β2-microglobulina formano questa regione, formata
da sequenze altamente conservate (non polimorfiche). Possiede il sito di legame per CD8+, espresso dai linfociti T-citotossici. Il recettore di CD8+ si trova nella subunità α3. Quest’interazione, oltre a stabilizzare il legame TCR-MHC-peptide causa la restrizione per MHC-1. In assenza di recettore per CD8+, i linfociti Tcitotossici potrebbero interagire anche con MHC-2, distruggendo le APC. Analogamente, CD4+ è importante
per la restrizione per MHC-2. Quindi, oltre alla triplice interazione TCR-MHC-peptide, si ha un ponte tra linfocita e regione immunoglobulinica (porzione α3) del complesso MHC (CD8+ => α3)
- regione transmembrana. Possiede, subito esternamente alla membrana citoplasmatica, dei gruppi sulfidrilici che permettono la mobilità. Nella regione transmembrana è formata da 25 aa. idrofobici. E’ una regione altamente conservata.
- regoine intracitoplasmatica. C-term, altamente conservata. Contiene i siti di consensus che verranno fosforilati dalla tirosin-chinasi per iniziare il processo di trasduzione del segnale, dopo l’interazione con T-cit.
MHC-2
Eterodimero formato da due catene polipeptidiche (α e β) unite da legami deboli. In ognuna si hanno:
- regione di legame con il peptide. (MHC-1: α1 e α2) (MHC-2: α1 e β1). La tasca di legame è aperta, e il
peptide può essere lungo 10-30 aa. Si hanno residui polimorfici in tasca e pavimento (analogo a MHC-1) e si
ha il fenomeno della triplice interazione.
- regione di tipo immunoglobulinico. Formata da α2 e β2, è una regione non polimorfica. Possiede il sito di
legame per CD4+, espresso dai T-helper. Il recettore di CD4+ si trova nella subunità β2. (CD4+ => β2).
Quest’interazione causa la restrizione per MHC-2.
- regione transmembrana. Analoga a quella di MHC-1.
- regione intracitoplasmatica. Analoga a quella di MHC-1.
Immunologia
Antonio Nenna
Legami effettuati dal complesso MHC:
- tripla interazione (TCR dei linfociti T – MHC1/2 – peptide)
- restrizione per MHC (CD con regione immunoglobulinica)
Espressione di MHC:
- MHC-1 si trova su tutte le cellule nucleate (quindi, non si trova sugli eritrociti)
- MHC-2 si trova sulle APC (macrofagi (c. di Kupffer), linfociti B, c. dendritiche (c. di Langerhans), c. endoteliali)
L’espressione è altamente modulata sulla base delle differenti citochine.
Organizzazione genomica della regione MHC
MHC si trova sul braccio corto del cromosoma 6. β2-microglobulina si trova sul cromosoma 15 (COSTANTE).
Per quanto riguarda MHC, la regione MHC-1 ha tre loci (A, B, C) e la regione MHC-2 ha tre loci (DP, DQ, DR).
Ogni locus contiene un numero variabile di geni, ma non vengono espressi tutti.
MHC-1
Per ogni cellula, ogni locus (A, B, C) ha un solo gene funzionale per la catena α (la β2-microglobulina è costante e non dà queste differenze). Quindi un omozigote sintetizza tre tipi di catene alfa, mentre un eterozigote (codominanza!) sintetizza sei tipi di catena alfa (per ogni singola cellula), cioè fino a 6 tipi di MHC-1.
MHC-2
Per ogni cellula, ogni locus (DP, DQ, DR) ha più geni funzionali (soprattutto DR). Si possono avere fino a tre
geni funzionali per β, e un gene funzionale per α. Quindi, nell’omozigote, ci saranno tre catene beta e una
catena alfa. Nell’eterozigote, ci saranno sei catene beta e due catene alfa. Visto che ci sono tre locus che
possono avere questo comportamento, ogni individuo può produrre fino a 30 tipi di MHC-2 per ogni cellula.
Esiste un TCR differente per ogni antigene estraneo.
Se il linfocita T non incontra l’antigene, il linfocita T è detto vergine e ricircola tra sangue-milza-linfonodi.
All’ingresso di un patogeno o all’infezione di una cellula ad opera di un virus o un tumore, il PMAP viene riconosciuto dal PRR dei macrofagi e delle APC residenti, che si attivano, fagocitano (il microbo o la cellula) e
processano l’antigene. Le APC si staccano dal tessuto e tramite la via linfatica arrivano al linfonodo, stabilendosi nella paracortex. Il linfocita T-helper con il TCR specifico incontra il macrofago. Ciò è favorito dal rilascio, ad opera del macrofago, di citochine infiammatorie che modificano le venule ad endotelio alto del
linfonodo, permettendo un ingresso facilitato al linfocita T-helper. T-helper viene attivato dalle APC e produce citochine per attivare i linfociti B a produrre Ig; inoltre attiva i linfociti T-citotossici.
L’incontro T-helper/APC avviene nel linfonodo. L’incontro T-citotossico/c.target avviene nei tessuti infettati.
T-helper: CD3+, CD4+, CD8T-citotossici: CD3+, CD4-, CD8+
Immunologia
Antonio Nenna
T-CELLS RECEPTOR (TCR)
Nei linfociti B, il frammento Fab delle Ig di membrana lega direttamente i determinanti antigenici (può così
legare antigeni solubili, non legati a MHC).
Nei linfociti T, invece, si viene a formare una sinapsi immunologica tra MHC-peptide delle APC e TCR dei linfociti T, insieme a altre molecole. TCR ha la capacità di riconoscere il complesso MHC/peptide.
La sinapsi immunologica è formata tra complesso TCR e molecole accessorie del linfocita T e i rispettivi ligandi presenti sulle APC o cellule target (infettate o tumorali). Serve al riconoscimento e alla trasduzione.
Si distinguono:
- complesso MHC, formato da TCR+CD3+zeta, favorisce l’interazione TCR/MHC/peptide, trasduzione
- molecole accessorie, non riconoscono l’antigene ma partecipano alla risposta, non polimorfiche, stabilità
COMPLESSO TCR
TCR αβ
- membro della superfamiglia delle Ig
- eterodimero, con α e β unite da ponti disolfuro
- regione variabile, N-term, sito del legame TCR/MHC/peptide. Formata da brevi tratti CDR ipervariabili che
determinano la complementarità (per ogni α e β, CDR1-2-3). Per ogni antigene esistente in natura, esiste un
clone di TCR che lo riconosce; ciò è dovuto all’enorme variabilità dei CDR (per maturazione timica).
- regione costante, residui non polimorfici
- regione cerniera, residui di cisteina per formare ponti disolfuro
- regione transmembrana, residui carichi positivamente, formano legami ionici con i residui carichi negativamente delle molecole accessorie
- regione intracitoplasmatica, corta, formata da 5-12 aa, non può effettuare trasduzione del segnale
CD3
- membro della superfamiglia delle Ig
- formato da tre catene omologhe ma differenti (γ, δ, ε)
- legame ionico con TCR nella regione transmembrana, poichè possiedono aa con cariche negative
- non hanno la funzione di legare l’antigene, quindi N-term è non polimorfico
- catena intracitoplasmatica molto lunga, contenente una sequenza ITAM
ZETA (ζ)
- omodimero zeta-zeta
- struttura analoga a CD3
- regione intracitoplasmatica molto lunga, con tre sequenze ITAM
CD3 e ZETA trasducono il segnale derivato dall’interazione TCR/MHC/peptide.
MECCANISMO DI TRASDUZIONE DEL SEGNALE
1) interazione TCRH-T/MHC2-1/peptide
2) sequenza ITAM fosforilata su residui di tirosina
3) la fosfotirosina di ITAM è il sito di aggancio della tirosin-chinasi (dei linf. T)
4) attivazione via RAS-RAF-ERC-MAPchinasi o NFkB
5) attivazione genica dei linfociti T
T-helper: produzione di citochine
T-citotossici: modifiche al citoscheletro per polimerizzare la perforina
E’ necessaria la sintesi di tutti i componenti del complesso TCR affinchè venga espresso.
Immunologia
Antonio Nenna
MOLECOLE ACCESSORIE
Si legano a ligandi di altre cellule o alla matrice extracellulare. Sono proteine non polimorfiche.
Le molecole accessorie servono generalmente a:
- localizzare i linfociti T
- trasmettere segnali intracellulari originati dalla sinapsi immunologica
- stabilizzare il legame APC/linfocita T
CD4 – CD8
Sono glicoproteine di membrana, appartenenti alla superfamiglia delle Ig.
Servono alla trasduzione del segnale. Sono responsabili della restrizione per MHC.
CD4/MHC2(β2) => T-helper riconoscono antigene su APC
CD8/MHC1(α3) => T-citotossici riconoscono antigene su cellula bersaglio
Lo stesso peptide viene riconosciuto da ligandi differenti in differenti tipi di linfociti.
CD28
Fornisce il secondo segnale necessario per l’attivazione dei linfociti T vergini.
1° segnale: sinapsi immunologica (interazione TCR/MHC/peptide)
2° segnale: interazione CD28 (linf. T) con B7-1 o B7-2 (APC o c. target)
Senza il CD28, la trasduzione è molto rallentata.
CD2
Nel 90% dei linfociti T maturi; nel 50-70% dei linfociti T immaturi (timociti) e NK.
Il ligando è LFA3, e permette adesione e localizzazione dei linfociti T nei tessuti.
INTEGRINE
Proteine di membrana per la localizzazione cellulare. L’aumento delle integrine aumenta la sedentarietà
della cellula (vengono utilizzate per descrivere la malignità di un tumore).
TCR γδ
- nel 10% dei linfT residenti, nel 5% dei linfT circolanti. E’ un eterodimero simile per struttura a TCR αβ.
- non esprimono CD4/CD8 => NO RESTRIZIONE PER MHC, NO MEDIAZIONE DELLE APC
- RICONOSCONO MOLECOLE NON PROTEICHE (lipidi, lipopolisaccaridi, fosfoantigeni). Queste sostanze ricche di fosforo provengono da micobatteri, funghi e protozoi. Includono il lipopolisaccaride (LPS) della parete batterica, l’acido zoledronico e i bifosfonati (che stimolano TCRγδ, con azione antitumorale)
- i linfociti con TCRγδ sono molto presenti nelle mucose, e hanno capacità fagocitica; rappresentano quindi
la prima linea di difesa contro i microrganismi estranei
- recettori per le chemochine (IL2, TNFα, IFNγ); ciò permette di loro di controllare le altre cellule, come i
macrofagi, che vengono richiamati nel sito infiammatorio anche dall’azione di TCRγδ
- analogia funzionale con NK (perforina)
- TCRαβ e TCRγδ (linfociti T-αβ e linfociti T-γδ) sono linee differenziative diverse di un unico precursore
- i linfociti TCRγδ hanno funzione anti-infettiva, anti-tumorale e autoimmunitaria
- si distinguono in quattro classi:
central memory, alta proliferazione, immaturi
naive, alta proliferazione, maturi ma non hanno incontrato l’antigene
effector memory, bassa proliferazione, maturi, secernono IFNγ (stimolo paracrino)
late effector, bassa proliferazione, maturi, sintetizzano perforina (come le NK). La perforina uccide la
cellula bersaglio mediante la formazione di un canale che mette in comunicazione il citoplasma con lo spazio extracellulare. Questo ha due importanti effetti: causa la lisi osmotica per ingresso di sodio e acqua dovuto al gradiente osmotico; causa apoptosi per attivazione delle caspasi, dovuta all’azione del gramzyme.
Immunologia
Antonio Nenna
MATURAZIONE DEI LINFOCITI T
I progenitori midollari migrano nel timo, formando linfociti T, o restano nel midollo, formando i linfociti B.
Questi linfociti maturi e vergini ricircolano, e si attivano quando incontrano l’antigene.
Ig e TCR formano il repertorio immunologico dell’organismo, che matura durante l’embriogenesi.
Il timo è la sede di maturazione dei linfociti T. Nella sindrome di DeGeorge c’è assenza del timo, e si
ha una immunodeficienza grave T-mediata; rimane conservata solo l’immunità innata (i linf. B non
producono Ig, poichè per la loro attivazione sono
necessarie le citochine prodotte da TH).
Nella maturazione dei linfociti T si distinguono:
1) MIGRAZIONE e PROLIFERAZIONE
2) DIFFERENZIAZIONE (fenotipo di superficie TCR che riconosce self e non-self)
3) SELEZIONE POSITIVA e SELEZIONE NEGATIVA (TCR sensibili sono a complesso MHCself/peptidenon-self) (elimino i linfociti T che esprimono il TCR che riconosce MHCnon-self o il peptideself)
Questi passaggi sono contemporanei: il timocita matura nel progredire dalla corticale alla midollare.
MIGRAZIONE e PROLIFERAZIONE
I precursori (CLP) migrano dal midollo osseo al timo.
I timociti (linfociti T immaturi) non esprimono né TCR né molecole accessorie => CD3-, CD4-, CD8-
DIFFERENZIAZIONE
1) Nella corticale arrivano linfociti doppio-meno (CD4-, CD8-) (oltre al CD3-).
C’è uno stadio veloce con espressione o di CD4 o CD8. Successivamente si ha la trasformazione in linfociti
doppio-più (CD3-, CD4+, CD8+). Un piccolo numero rimane doppio-meno: quel clone darà origine ai linfociti
TCRγδ (CD4-, CD8-) *che quindi appartengono ad una linea differenziativa differente da TCRαβ+
2) Le cellule doppio-più (CD3-, CD4+, CD8+) esprimono come CD3 il TCRαβ in maniera debole, diventando linfociti CD3low (TCRαβ), CD4+, CD8+ (espressione del TCR nelle cellule doppio-più). In questo passaggio si ha la
generazione delle diversità: i geni delle regioni ipervariabili di TCR si riarrangiano e generano infiniti TCR
che possono riconoscere praticamente tutti gli antigeni esistenti (riarrangiamento e diversità dei TCR).
3) I linfociti CD3low (TCRαβ), CD4+, CD8+ vanno incontro ai processi di selezione positiva e negativa, durante il
movimento dalla corticale alla midollare. Più del 95% dei timociti immaturi muore nella corticale. Vengono
selezionati solo linfociti che esprimono TCR CD3+ (TCRαβ), CD4+, CD8+ che riconoscono solo il complesso
MHCself/peptidenon-self.
4) Le cellule doppio-più CD3+ (TCRαβ), CD4+, CD8+ che riconoscono solo il complesso MHCself/peptidenon-self
vengono convertite in singole-più e si formano due linee distinte: T-helper (CD3+ (TCRαβ), CD4+, CD8-) e
T-citotossici (CD3+ (TCRαβ), CD4-, CD8+). Questi linfociti sono maturi e vergini, e passano nel circolo sanguigno.
Le cellule che inizialmente rimangono doppio-meno danno origine ai linfociti Tγδ (CD3+ (TCRγδ), CD4-, CD8-),
che non sono causa di malattie autoimmunitarie. Il loro TCR è non polimorfico, e riconoscono antigeni lipidici; svolgono una funzione paragonabile alle cellule NK.
Immunologia
Antonio Nenna
SELEZIONE POSITIVA e SELEZIONE NEGATIVA
La selezione serve a indurre la tolleranza verso il self, e permette la sopravvivenza solo ai linfociti T con
TCR utili per il sistema immunitario (con TCR che riconoscono solo il complesso MHCself/peptidenon-self).
La selezione positiva serve a far riconoscere solo il MHC-self.
La selezione negativa serve a far riconoscere solo i peptidi-nonself.
SELEZIONE POSITIVA.
In origine si hanno TCR che riconoscono quattro tipologie di antirecettori:
MHC-self/peptide-self, MHC-self/peptide-nonself, MHC-nonself/peptide-self, MHC-nonself/peptide-nonself
I timociti che riconoscono MHC-self (sia MHC-self/peptide-self che MHC-self/peptide-nonself) vivono.
I timociti che riconoscono MHC-nonself (non riconoscono MHC-self) muoiono.
La selezione positiva elimina i linfociti T non ristretti a MHC (elimino i linfociti T con TCR che riconosce MHCnonself, e ovviamente non riconosce MHC-self). Sopravvivono i linfociti T con TCR che riconosce MHC-self.
Dopo la selezione positiva, quindi, ho linfociti T che riconoscono due tipologie di antirecettori:
MHC-self/peptide-self, MHC-self/peptide-nonself.
L’eliminazione è permessa dalle cellule nutrici del timo (famiglia dei monociti-macrofagi), che presentano
MHC-self. I linfociti con TCR che legano MHC-self delle cellule nutrici vivono (tramite IL-2); i linfociti con TCR
che non legano MHC-self delle cellule nutrici muoiono (non hanno lo stimolo per il ciclo cellulare).
SELEZIONE NEGATIVA.
All’inizio della selezione negativa ho linfociti T che riconoscono due tipologie di antirecettori:
MHC-self/peptide-self, MHC-self/peptide-nonself.
Le cellule nutrici esprimono MHC-self/peptide-self (perchè non hanno mai incontrato i peptidi-nonself).
I TCR che riconoscono MHC-self/peptide-self vengono eliminati (selezione clonale) o inattivati (anergia
clonale, che può portare a malattie autoimmunitarie).
I TCR che riconoscono MHC-self/peptide-nonself sopravvivono.
La selezione negativa, quindi, elimina linfociti T potenzialmente autoreattivi, inducendo tolleranza al self.
MHC-self/peptide-self
MHC-self/peptide-nonself
MHC-nonself/peptide-self
MHC-nonself/peptide-nonself
TCR non funzionanti
selezione negativa
selezione positiva
RIARRANGIAMENTO E DIVERSITA’ DEI TCR
Avviene durante la fase di differenziazione, nella tappa 2. Si esplica tramite tre modalità:
- riarrangiamento di regioni ipervariabili (V), segmenti diversità (D) e segmenti giunzioni (J). Per ogni TCR
vengono presi, tramite splicing alternativo, un gene da ogni porzione, che ne contiene migliaia. Vengono
così a formarsi milioni di combinazioni. Queste verranno aumentate esponenzialmente dagli altri meccanismi, contribuendo a generare una diversità tale da permette ai TCR di riconoscere tutti gli antigeni esistenti
- flessibilità del punto di giunzione. Tra V/D e D/J avvengono delle piccole delezioni di nucleotidi dovute alla formazione di domini ad ansa; ciò causa mutazioni frameshift e cambia totalmente le proteine
- desossinucleotidil-trasferasi terminale. Questo enzima taglia alcune basi (agisce come una esonucleasi) ai
punti di giunzione, causando mutazioni frameshift
Immunologia
Antonio Nenna
IPERSENSIBILITA’ di TIPO 1
Tipo 1: ipersensibilità immediata (IgE) (anafilassi)
Tipo 2: ipersensibilità da anticorpi citotossici (trasfusione, malattie emolitiche)
Tipo 3: ipersensibilità da immunocomplessi (Lupus Eritematoso Sistemico, eritema nodoso)
Tipo 4: ipersensibilità ritardata (cellulo-mediata) (granuloma da corpo estraneo)
IPERSENSIBILITA’ DI TIPO 1
IgE MEDIATA – ALLERGICA
Le citochine di T-h2 (linfociti T helper di tipo 2) stimolano i linfociti B a differenziare verso plasmacellule e
promuovono lo switch isotipico verso IgE. IgE si legano:
- tramite il frammento Fab, su allergeni (antigeni)
- tramite il frammento Fc, su recettore FCεR1 di mastociti e basofili [analogo a FCγR1 di macrofagi]
Il legame allergene/Fab-IgE-Fc/FCεR1/mastocita-basofilo stimola:
- rilascio di granuli preformati proteici (istamina, eparina, enzimi)
- sintesi di lipidi (prostaglandine, leucotrieni) e la loro liberazione
=> contrazione della muscolatura liscia delle pareti bronchiali e delle cellule endoteliali, stimolando la reazione infiammatoria
Patologie da ipersensibilità di tipo 1:
- allergie: asma bronchiale, rinopatie allergiche, congiuntiviti, allergie alimentari
- anafilassi: effetti sistemici
patologie
Anafilassi
allergene
Farmaci, serpenti
entrata
Ev
Orticaria
Rinite
allergica
Asma
Alimentare
Peli di animali, puntura di insetto, test allergico
Polvere
Pelle
Inalazione
risposta
Edema polmonare, occlusione tracheale,
collasso circolatorio
Reazione locale
Edema mucosa nasale, irritazione
Polline
Cibo
Inalazione
GI
Costrizione bronchiale, muco
Vomito, diarrea, prurito, anafilassi
Caratteristiche degli allergeni:
- proteine (T-mediato)
- enzimaticamente attivi (proteasi)
- bassa dose per reazione
- PM basso
- solubili (anche soluzioni diluite)
- stabili (anche in parti essiccate)
- legabili a MHC2
Risposta all’allergene = risposta immunitaria primaria + risposta secondaria umorale
1) introduzione per inalazione, linfociti B della mucosa bronchiale eseguono endocitosi e processamento,
presentando l’allergene con MHC2 => linfociti B attivati
2) APC professionali della mucosa bronchiale riconoscono il PMAP, fagocitano e processano con MHC2 =>
APC presentano l’allergene ai linfociti T vergini => linfociti T-h2 attivati
3) interazione linfociti B attivati / linfociti T-h2 attivati (analoga alla relazione APC/T-h1)
4) liberazione di citochine delle T-h2 (diverse dalle citochine di T-h1)
IL4 => switch verso IgE, richiamo eosinofili
IL5 => crescita e differenziamento degli eosinofili
IL10 => switch verso IgG4 (le uniche IgG delle allergie)
Immunologia
Antonio Nenna
Al 1° contatto con l’allergene, IgE sono molto basse e non si ha una reazione allergica.
Al 2° contatto con l’allergene, IgE sono alte e causano la reazione allergica, perchè al primo contatto di formano i linfociti T-h2 e B memoria, che ricircolano. Sono già specifici, e al secondo contatto sono già specifici
(non c’è bisogno di APC). Al secondo contatto: latenza breve, crescita rapida.
=> iperattivazione T-h2 => aumento della produzione di IL => aumento della proliferazione dei linfociti B e
della differenziazione => aumento delle IgE
L’allergene è un antigene multivalente: contiene più determinanti antigenici che si legano a frammenti Fab
di IgE differenti (cross linking tra le IgE di superficie).
NO antigeni: le IgE sono disposte in modo uniforme su mastociti e basofili
SI antigeni: richiamo di IgE (polarizzazione) verso la zona dell’antigene
Il legame Fc-IgE/FCεR1 causa attivazione a cascata delle protein chinasi tramite fosforilazioni successive che
portano ad alterazioni del citoscheletro per:
- esocitosi dei granuli proteici preformati (istamina, eparina, fattore chemiotattico per eosinofili ECF, fattore chemiotattico per neutrofili NCF) [via PIPK]
- neosintesi lipidica dai fosfolipidi di membrana (leucotrieni, prostaglandine PGD2, fattore attivante piastrinico PAF) *via dell’acido arachidonico con lipo-ossigenasi]
- neosintesi di citochine [via RAS/RAF/ERC/MAPchinasi]
La liberazione di queste sostanze causa:
- reazione immediata (IgE) [istamina, eparina]
o vasodilatazione, aumento della permeabilità vascolare, passaggio di acqua e proteine in sede extravascolare, edema, congestione della mucosa (ispessimento), riduzione del lume
o contrazione della muscolatura liscia (broncocostrizione)
o ipersecrezione ghiandolare (muco, ostruzione dei bronchioli, asma bronchiale, con difficoltà in espirazione per l’aumento della pressione toracica che occlude il lume già piccolo)
- reazione tardiva (flogosi allergica) [PG, LKT, NCF, ECF]
o richiamo eosinofili e neutrofili con attivazione piastrinica, attivazione dei mediatori secondari
dell’infiammazione (citochine, enzimi lisosomiali) (infiammazione cronica) (mucosa iper-reattiva: si
ha crisi asmatica anche in assenza di allergene, poiché bastano fumo, stress o freddo)
L’incremento epidemiologico delle allergie è dovuto a:
- background genetico (polimorfismi che causano una maggiore predisposizione)
- aumento degli antigeni ambientali (alimentari o respiratori)
- diminuzione dei parassiti (che utilizzano IgE, come la risposta allergica, ma si legano sul recettore FCεR3
degli eosinofili tramite Fc, e sul parassita tramite Fab) (con il miglioramento delle condizioni igieniche, la
diminuzione dei parassiti ha portato a molte IgE che non sono impegnate con i parassiti, e quindi possono
causare allergie)
I test per la rilevazione delle allergie sono:
- test della sospensione (aggiungo un alimento alla volta e vedo quale causa allergia)
- test epicutanei (scratch test)
- analisi delle IgE specifiche
- somministrazione nasale dell’allergene (reazione locale)
Immunologia
Antonio Nenna
IPERSENSIBILITA’ di TIPO 2
Reazione citotossica contro le cellule ematiche (eritrociti, leucociti, piastrine, cellule endoteliali). Si tratta di
ipersensibilità poiché la variabilità individuale (dovuta ai polimorfismi) causa una diversa gravità dei sintomi
nella popolazione.
L’ipersensibilità di tipo 2 causa anemia emolitica, leucopenia e trombocitopenia per la produzione di Ig
che legano la cellula target e la distruggono. L’emolisi è extravascolare (nel sistema emocateretico).
Nella risposta immunitaria contro i farmaci si distinguono due reazioni:
- Ipersensibilità di tipo 1, allergia, mediata da IgE
- Ipersensibilità di tipo 2, intolleranza, mediata da IgM
Il farmaco si lega a recettori cellulari, e funge da aptene, rendendo immunogeno un self
Nelle reazioni trasfusionali ABO4 e Rh, le agglutinine del sangue del donatore non causano danno al ricevente per il fenomeno della diluizione:
1) gli anticorpi del donatore sono pochi (basso titolo) [poiché il siero viene tolto prima della trasfusione]
2) gli anticorpi del donatore vengono immessi nella grande volemia del ricevente
3) gli antigeni A e B sono ubiquitari (non solo negli eritrociti); gli anticorpi antiA e antiB del donatore si legano anche alle altre cellule
CROSS-MATCHING
E’ preferibile la trasfusione con identità di gruppo, a causa dell’esistenza di:
- sottogruppi (A1, A2, A3,…)
- “donatori pericolosi” che producono un alto titolo di agglutinine antiA o antiB
In vitro, combino eritrociti del donatore/siero del ricevente e siero del donatore/eritrociti del ricevente. Se
non ho alcuna reazione, la trasfusione è compatibile.
SISTEMA ABO
“Soggetto di gruppo A”. Nell’embriogenesi, il feto ha tolleranza verso il proprio gruppo (l’antigene non
produce reazione). Alla nascita, le agglutinine antiA e antiB sono assenti. La flora batterica produce antigeni A e B. A viene riconosciuto come self, B viene riconosciuto come non-self, e vengono prodotti antigeni (agglutinine) antiB.
SISTEMA RH
Il sistema Rh è formato da sei antigeni codominanti: C, D, E, c, d, e; tutti immunogeni tranne d.
La presenza di D causa la positività all’Rh. Rh+: DD, Dd. Rh-: dd.
Gli anticorpi antiRh non sono presenti normalmente (NO IgM per Rh).
La produzione avviene in soggetti Rh- che vengono a contatto con Rh+, producendo IgG verso D.
L’intolleranza Rh è dovuta a:
- reazioni trasfusionali Rh-incompatibili
- incompatibilità materno/fetale (=> malattia emolitica del neonato)
MALATTIA EMOLITICA DEL NEONATO
Da madre Rh- e figlio Rh+ (per padre Rh+). Tre processi:
- sensibilizzazione (1^ trasfusione Rh-incompatibile, 1^ gravidanza Rh-incompatibile)
- emolisi (2^ gravidanza Rh-incompatibile)
- fase clinica della malattia
4
gruppo O, senza antigeni di superficie, con agglutinine antiA e antiB nel plasma [donatore]
gruppo A, con antigene A di superficie, con agglutinine antiB nel plasma [ricevente]
=> le agglutinine antiA del donatore non attaccano gli antigeni A eritrocitari del ricevente
Immunologia
Antonio Nenna
1) SENSIBILIZZAZIONE
Gli eritrociti Rh+ del feto passano nel sangue materno tramite discontinuità della barriera ematoplacentare. L’antigene D viene riconosciuto dalla madre, e presentato ai T-helper (risposta primaria), che
causano la produzione di IgM. Le IgM, siccome formano grandi immunocomplessi, non passano attraverso
la barriera emato-placentare => NO contatto IgM/sangue fetale, ma ho produzione di IgM anti-Rh e linfociti memoria.
2) EMOLISI
Al secondo contatto, le emazie Rh+ del figlio causano una risposta immunitaria secondaria, con la produzione di IgG anti Rh, che siccome sono piccoli monomeri, attraversano la placenta e arrivano al feto. Il
frammento Fab riconosce l’antigene D del feto, e le emazie opsonizzate vengono catturate dai macrofagi
(FCγR1), e ciò causa emolisi (nel sistema emocateretico).
3) FASE CLINICA
- tra la 25^ e la 35^ settimana => morte intrauterina
- dopo la 35^ settimana => idrope fetale
neonati prematuri, pallidi, edematosi per ipoalbuminemia, epatosplenomegalia, decesso entro il primo
anno di vita. L’ipoalbuminemia è indice del danno epatico, che avviene poiché:
il fegato deve eliminare più bilirubina (per massiva distruzione)
emopoiesi extramidollare (per maggiore produzione di eritrociti)
emolisi nelle cellule di Kupffer
- ittero neonatale grave “immunologico”
la bilirubina dell’emolisi è troppa per il fegato immaturo
la γGT è poco espressa alla nascita
=> danno neurologico nei gangli della base, sordità, ritardo, paraplegia
DONNE A RISCHIO: Rh- con figlio Rh+, ABO compatibile
Quando gli eritrociti del feto passano nel sangue della madre (ma non il contrario). Nel caso di incompatibilità ABO, le agglutinine materne trovano gli antigeni fetali prima che ci sia la sensibilizzazione dell’Rh. Inoltre, le agglutinine materne, essendo IgM, formano polimeri che non passano la barriera placentare. Quindi,
in gravidanza ABO incompatibile, si ha distruzione eritrocitaria ma non si avrà sensibilizzazione all’Rh (ABO
incompatibile => NO sensibilizzazione Rh)
DIAGNOSI
TEST DI COOMBS INDIRETTO
Il test si effettua nella madre; dopo che è avvenuta l’immunizzazione trovo IgG anti-Rh. Tratto il siero materno in vitro con emazie O-Rh+ e aggiungo il siero di Coombs (IgG anti IgG).
Le IgG del siero di Coombs si legano alle IgG del sangue materno, che si legano alle emazie del feto, causando agglutinazione.
TEST DI COOMBS DIRETTO
Il test si effettua nel feto. L’antigene D degli eritrociti fetali è attaccato dalle IgG della madre. Tratto le emazie del feto con il siero di Coombs e trovo l’agglutinazione.
TERAPIA
- trasfusione intrauterina con emazie Rh- anticorpi anti-D a madri Rh- dopo il 1° parto Rh-incompatibile (gli anticorpi si legano a Rh del feto, nascondono D al sistema immunitario materno: la formazione dell’immunocomplesso inibisce la sensibilizzazione)
Immunologia
Antonio Nenna
IPERSENSIBILITA’ di TIPO 3
Ipersensibilità di tipo 1: IgE
Ipersensibilità di tipo 2: IgM (sistema ABO), IgG (sistema Rh)
Ipersensibilità di tipo 3: formazione di immunocomplessi (IC) di IgG, che attivano il complemento, richiamando le cellule infiammatorie, che causano danno nel tessuto dove si depositano.
REAZIONE FISIOLOGICA
L’antigene (Ag) viene riconosciuto dal macrofago, che causa il rilascio di IgM e IgG e provoca la formazione
di immunocomplessi circolanti (Ab/Ag). Si distinguono tre fasi:
1) IC CON ECCESSO DI ANTIGENE: Ab < Ag, IC solubili che non precipitano; attivazione del complemento
con formazione di fattori chemiotattici e anafilotossici (C3a, C5a).
2) IC ALL’EQUIVALENZA: Ab = Ag, per sintesi di Ab e catabolismo di Ag, IC non solubili che precipitano sulle
pareti vasali e vengono riconosciuti (FCγR, ComplementRec) ed eliminati dai macrofagi.
3) IC CON ECCESSO DI ANTICORPI: Ab > Ag, IC non solubili che precipitano, meno potenti nell’attivare la risposta; eliminati dai macrofagi.
Fattori che influenzano la deposizione di immunocomplessi:
dimensioni dell’IC
piccoli => eliminati dal rene
medi => si depositano facilmente, non vengono eliminati facilmente
grandi => si depositano facilmente, vengono eliminati facilmente
quantità di Ig (proporzionale alla quantità di IC)
capacità di eliminare IC (proporzionale alla integrità funzionale del sistema emocateretico (macrofagi)
e del complemento). Un deficit (FCγR, attività lisosomiale, ROS) causa malattie da immunocomplessi
caratteristiche di Ag e Ab (carica elettrica, valenza, avidità, isotipo di Ig)
fattori anatomici ed emodinamici dell’organismo
lento flusso + capillari fenestrati + alta pressione (turbolenza) => aumento della % di IC
=> capillari glomerulari, sinoviali, cutanei, peritoneo, pleura, pericardio
citochine e mediatori vasoattivi (TNF, IL1, PAF)
+ adesione dei linfociti, + permeabilità vasale => + % precipitazione di IC
REAZIONE PATOLOGICA
1) IC CON ECCESSO DI ANTIGENE: IC solubili
attivazione del complemento mediante la via classica
liberazione di C3a e C3b (fattori chemiotattici e anafilotossici)
richiamo delle c. infiammatorie (neutrofili, magrofagi) sui vasi
degranulazione di mastociti e basofili (aumento della permeabilità vascolare)
contrazione della muscolatura liscia (favorisce il ristagno di sangue)
2) IC ALL’EQUIVALENZA: IC precipitano, e la precipitazione è favorita dai forti eventi della fase 1
IC nella membrana basale degli endoteli
3) FASE DEL DANNO TISSUTALE: gli IC nella membrana basale vengono opsonizzati e fagocitati dai macrofagi che erano stati richiamati dall’infiammazione, nella fase 1. L’opsonizzazione avviene tramite:
FCγR1 che lega il frammento Fc delle IgG che aderiscono all’IC
CR1, CR4 che legano i frammenti C1 e C4 del complemento che aderisce all’IC
se la fagocitosi fosse efficace, gli IC sarebbero distrutti
ma la fagocitosi è “ingolfata” per la presenza di eccessivi IC, e quindi non si eliminano tutti perchè ce ne sono troppi. I macrofagi non riescono a digerire tutti questi IC e si lisano, rilasciando gli enzimi lisosomiali
(proteasi, collagenasi, elastasi,...) nella matrice extracellulare
=> distruzione della matrice extracellulare ad opera degli enzimi lisosomiali
Immunologia
Antonio Nenna
inoltre, le piastrine attivate dal legame con il frammento Fc e dal PAF (secreto da neutrofili e basofili) secernono sostanze vasoattive e ROS, che aumentano il danno vascolare
A differenza della risposta fisiologica, in quella patologica l’intensità della prima fase è molto maggiore.
Meccanismi di danno tissutale:
- lisi cellulare mediata dal complemento (per la formazione del complesso MAC, simile alla perforina; inoltre si rilasciano citochine proinfiammatorie che aumentano il danno tissutale)
- fagocitosi delle cellule opsonizzate da IC
- reclutamento linfocitario complemento-dipendente (C3a, C3b, C5a)
- reclutamento linfocitario FCγR1-dipendente (legame con IgG dell’IC)
- reclutamento linfocitario citochine-dipendente (IL1 e TNF di mastociti, neutrofili e macrofagi)
- danno provocato da Ab (al di fuori dell’IC, si legano a molecole self e ne alterano la funzione; ciò è dovuto
al mimetismo molecolare, che fa confondere antigeni non-self con antigeni self, e quindi gli Ab prodotti per
il non-self attaccano anche il self)
MALATTIE DA IMMUNOCOMPLESSI
LUPUS ERITEMATOSO SISTEMICO
Il LES è una malattia autoimmunitaria dovuta alla formazione di autoanticorpi verso le proteine self, con
formazione di immunocomplessi che causano risposte infiammatorie sistemiche.
Molecole self interessate:
- DNA (formazione di dimeri DNA-antiDNA, rilevabili tramite anticorpi ANA nel plasma per la diagnosi)
- proteine plasmatiche (fattori di coagulazione, complemento)
- antigeni di superficie (eritrociti => anemia; piastrine => trombocitopenia; neutrofili => neutropenia)
- RNA, ribosomi, microfilamenti
Risposte infiammatorie sistemiche:
- glomerulonefrite
- artrite
- vasculite
- rash malare (esantema “a farfalla” sul volto)
- fotosensibilità (danno a congiuntiva e retina)
- convulsioni
POLIARTERITE NODOSA
La poliarterite nodosa è una sequela dell’infezione da HBV. Si depositano IC nelle arterie di medio calibro
(a. temporale), formando noduli. E’ dovuta al legame HBV-antiHBV.
GLOMERULONEFRITE POST-STREPTOCOCCICA
Rara complicanza dell’infezione da streptococco beta-emolitico di gruppo A, si verifica 1/3 settimane dopo
l’infezione faringea (richiesta della coltura del tampone per pz pediatrici). Deposito di IC sui capillari glomerulari, sia Ag-streptococco/Ab-streptococco che Ag-self/Ab-streptococco, a causa del mimetismo molecolare con proteine strutturali self. Il pz presenta dolore, febbre, ematuria, proteinuria, leucocituria (cilindri).
Immunologia
Antonio Nenna
IMMUNOLOGIA DEI TUMORI
tumori monoclonali (un solo antigene viene espresso): linfomi, carcinomi del testicolo
tumori policlonali (vengono espressi più antigeni): quasi tutti gli altri
Il danno che porta la cellula a essere cancerogena è:
- letale, morte per apoptosi
- non letale, riparata dai sistemi di riparazione del DNA o eliminata dal sistema immunitario
le mutazioni possono essere:
- stocastiche (casuali)
- indotte (radiazioni UV per melanomi, benzopirene, HPV, EBV, mezzi di contrasto)
Il ruolo del sistema immunitario nel controllo delle neoplasie è documentato da:
- regressione spontanea
- regressione di metastasi dopo asportazione del tumore (rene, melanoma)
- regressione dopo chemioterapia
- proliferazione di linfociti nei linfonodi drenanti
- maggiore incidenza di tumori in pz non immunocompetenti (AIDS, neonati, anziani, trapiantati)
- infiltrazione di linfociti e macrofagi nei tumori
Antigeni espressi dalle cellule tumorali:
TSTA (tumor-specific transplantation antigen), espressi solo dalle cellule tumorali
TATA (tumor-associated transplantation antigen), espressi da cellule normali e da cellule tumorali
o TADA, “dello sviluppo”, non sono presenti negli adulti normali ma solo in cellule tumorali e cellule del
feto, dovute alla proliferazione delle cellule dei foglietti embrionali (non scatenano quindi immunità
antitumorale poichè sono normalmente prodotte durante lo sviluppo)
alfa1-fetoproteina (AFP) => cancro del fegato
antigene carcinoembrionario (CEA) => cancro del colon-retto, cancro del polmone
o TAVA, “associati a virus”
o altri, come HER2nev per il tumore della mammella o aumento di Ig per il mieloma multiplo
Meccanismi che permettono al tumore di evadere la risposta immunitaria:
- produzione di cellule T regolatorie (CD4+ CD25+) che sopprimono la risposta immunitaria
- produzione di molecole immunosoppressive (PG, TGFβ, IL10)
- mancata espressione di molecole costimolatorie per il TCR (blocca la sintesi di B7-1, per CD28)
- espressione di FasL nelle cellule tumorali, che causano apoptosi nei linfociti T che esprimono Fas (nelle
normali risposte, il linfocita T usa FasL per mandare in apoptosi le cellule bersaglio; comunque, come tutte
le cellule self, contiene anche Fas che viene utilizzato normalmente per uccidere linfociti senescenti)
Immunoterapia:
- prevenzione (vaccino antivirale per HBV [carcinoma epatico] e HPV [carcinoma della cervice uterina])
- immissione del Bacillo Calmette-Guerin (forma inattivata di B. avium, che causa la TBC negli animali); ciò
attiva i macrofagi e potenzia la risposta immunitaria aspecifica
- anticorpi anti-IL2R (inibisce la crescita linfocitaria, nei linfomi indotti da HTLV1)
- estraggo cellule del sistema immunitario del pz, le espongo a IL2, maturano il LAK e le re-inietto
- estraggo cellule tumorali policlonali, le espongo a linfociti T e IL2, creo linfociti specifici, e re-inietto
- inserisco gene di IL2 in un fago e lo inietto nelle APC, maggiore espressione costitutiva di IL2
- iniezione ev di IL2 (per numero selezionato di pazienti, data l’elevata tossicità)
Immunologia
Antonio Nenna
IPERSENSIBILITA’ di TIPO 4
L’ipersensibilità di tipo 4 (ritardata cellulo-mediata) è scatenata da linfociti Th1 sensibilizzati verso un antigene. Alla seconda somministrazione, si hanno:
- citochine (INF-γ) nella sede di reazione
- reclutamento e attivazione dei macrofagi e cellule infiammatorie (neutrofili, monociti => macrofagi)
L’ipersensibilità di tipo 4 può essere provocata da: M. tuberculosis, S. tiphi, B. canis, virus (paramixovirus),
funghi (aspergillus), punture di insetto, sostanze chimiche ad inoculazione sottocutanea.
TINE TEST (reazione della tubercolina): somministrazione sottocutanea di PPD (derivato proteico purificato) del Mycobacterium tuberculosis.
Si verifica una reazione di ipersensibilità ritardata (test positivo) in caso di:
- soggetti vaccinati (sensibilizzati)
- soggetti che hanno avuto la tubercolosi (tbc primaria: asintomatica, a prognosi fausta. RX torace mostra il
“complesso primario”, un addensamento polmonare calcificato, il granuloma, nei campi polmonari superiori con linfoadenomegalia nei linfonodi ilari) (sintomatica: rifampicina + isoniazide)
Non si verifica una reazione di ipersensibilità ritardata (test negativo) in caso di:
- soggetti che non sono mai venuti a contatto con la tbc, e non sono vaccinati
- soggetti immunodepressi (infezioni croniche o tumori => anergia immunitaria, senza risposta cellulomediata all’antigene estraneo)
Reazioni tempo-dipendenti dell’ipersensibilità ritardata del tine test:
4h: accumulo neutrofili in venule post-capillari, regredisce spontaneamente
12h: accumulo linfociti T e monociti (che diventeranno macrofagi) intorno alle venule post-capillari
18h: aumento della permeabilità, fuoriuscita macromolecole (linfociti T, macrofagi, fibrinogeno) (formazione del pomfo, indurimento dei tessuti nel sito di inoculazione, indica positività al test)
24-48h: massimo picco di indurimento
Nell’ipersensibilità di tipo 4 si identificano tre fasi:
1) riconoscimento del PMAP e attivazione dei linfociti T (con produzione di cellule memoria)
2) infiammazione (neutrofili, linfociti T, macrofagi; importanza delle cellule endoteliali)
3) risoluzione (macrofagi, fibroblasti per fibrina e sostituzione del tessuto necrotico)
Alla seconda presentazione dell’antigene, lo stimolo dei linfociti T memoria. Le APC attivi sono:
- macrofagi residenti (fagocitano e producono INF-γ)
- cellule endoteliali (attivati da citochine prodotte dai macrofagi INF-γ)
Th1-memoria riconoscono le APC => citochine (IL2, TNF, linfotossina, INF-γ) => ulteriore attivazione delle
cellule endoteliali => ulteriore amplificazione dei processi infiammatori
FUNZIONI DELLE CELLULE ENDOTELIALI
- VASODILATAZIONE: tramite prostaglandine e ossido nitrico, aumenta il ristagno di sangue e la fuoriuscita
di linfociti)
- ADESIONE LINFOCITARIA: selectina per neutrofili, VCAM per linfociti T, ICAM per monociti macrofagi
- EXTRAVASIONE LEUCOCITARIA: i linfociti T agiscono sulle cellule endoteliali mediante IL8, favorendo
l’angiogenesi e la fuoriuscita dei linfociti (azione proinfiammatoria)
- ESSUDAZIONE: modifica della forma delle cellule endoteliali dovuta al rimodellamento della membrana
basale (rottura delle gap junction), permette la fuoriuscita di fibrinogeno (che diviene fibrina), causando
l’indurimento dei tessuti.
=> passaggio di cellule (neutrofili, linfociti T, macrofagi) e macromolecole (fibrinogeno)
Immunologia
Antonio Nenna
FUNZIONI DELL’INF-γ
- espressione di MHC2 e molecole costimolatorie (aumento delle capacità delle APC)
- stimola i macrofagi a produrre IL12 (che aumenta la produzione di INF-γ, PAF, PG e LT)
- funzioni effettrici dei macrofagi (fagocitosi, presentazione,...)
=> infiammazione cellulo-mediata immunologica(dovuta ad una citochine, INF-γ, prodotte da cellule del
sistema immunitario specifico, cioè i linfociti Th1) *l’infiammazione non-immunologica è dovuta a citochine prodotte da cellule del sistema immunitario aspecifico, come i macrofagi]
FASE DELLA RISOLUZIONE
Normalmente, i monociti maturano in macrofagi per i segnali dati da INF-γ, e i macrofagi riescono ad eliminare il batterio; successivamente, il tessuto torna allo stato fisiologico.
In caso di persistenza cronica dell’antigene, si ha una reazione cellulo-mediata cronica.
I macrofagi, che producono PAF e TGFβ, attivano i fibroblasti per la produzione di fibrina, che causa la sostituzione dei tessuti danneggiati in tessuti fibrotici (FIBROSI).
La fibrosi è quindi:
- l’esito di una ipersensibilità cellulo mediata cronica (non è possibile la risoluzione acuta)
- una barriera per l’ambiente esterno, poichè l’interno contiene batteri che non possono essere uccisi, ma
solo ostacolati
=> formazione del GRANULOMA
Il granuloma è formato (dall’esterno all’interno) da:
- linfociti Th attivati
- cellule epitelioidi (macrofagi attivati) e cellule giganti polinucleate (macrofagi fusi)
- microrganismo vivo circondato da tessuto necrotico e fibrotico (necrosi caseosa di M. tuberculosis)
In caso di immunodepressione, si ha quindi anergia dei linfociti T, e non si produce INF-γ. Quindi i macrofagi
non sono attivati, e il granuloma si riattiva, formando la “caverna”, con riacutizzazione dell’infezione.